1.1Allgemein 5 1.2 Die tumorspezifische Zelloberfläche im Blickpunkt für einen therapeutischen Ansatz 5
1.2.1 Kohlenhydrate 5
1.2.2 Lectine 8
1.2.3 Kohlenhydrat-Lectin-Interaktion 11
1.2.4 Die Bedeutung der Kohlenhydrat-Lectin Interaktion in der Tumorbiologie 14
1.3 Glycomimetika 25
1.4 Rationales Design mittels Molecular Modeling 29
1.4.1 Einleitung 29
1.4.2 Molecular Modeling 30
1.5 Drug Targeting- Konzept 33 1.5.1 Definition Drug Targeting 33
1.5.2 Definition Glycotargeting 34
1.5.3 Endogene Lectine als Drug Target 34
1.6 Anticancer Vakzine 35
2 ARBEITSHINTERGRUND UND ZIELSETZUNG 40
3 ERGEBNISSE 42
3.1 Synthese 42
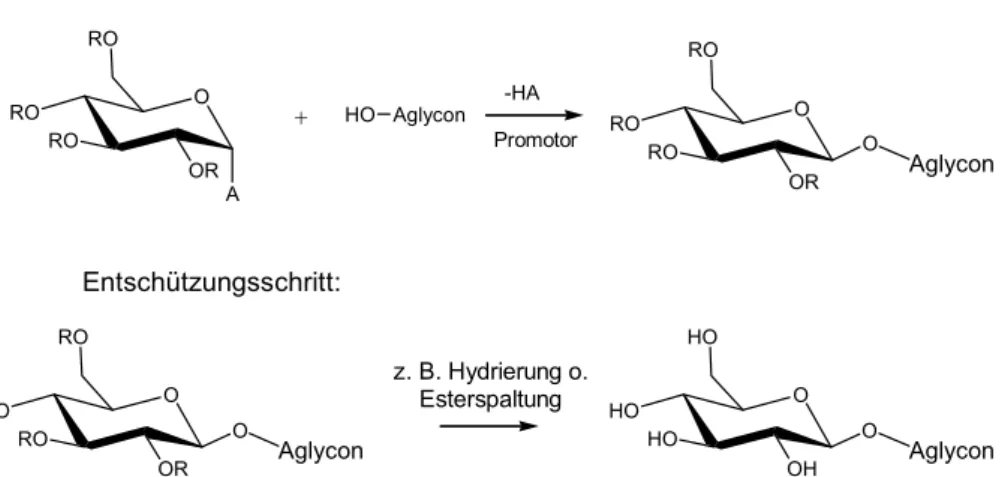
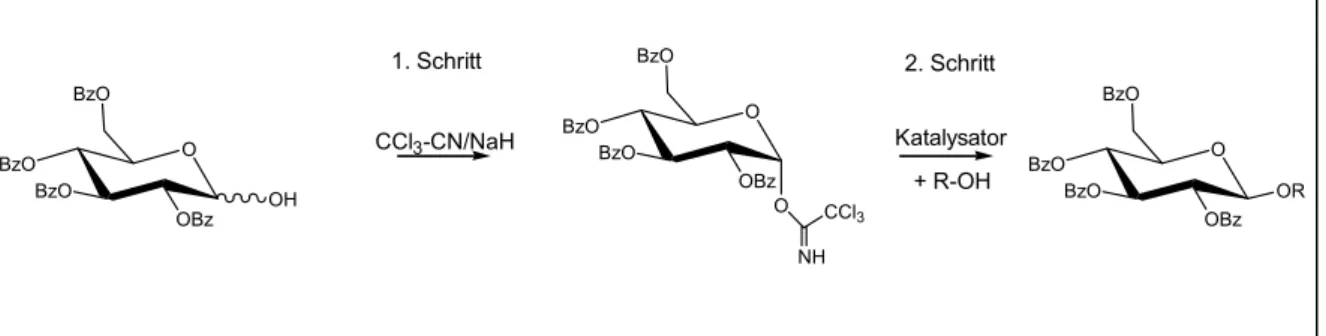
3.1.1Chemische Methoden der O-Glycosidierung 42
3.1.2 Diels-Alder (DA) Reaktion 44
3.1.3 Biotinylierte DA-Mimetika 46
3.1.3.1 Glycosidierung der Furan-Bausteine 46
3.1.3.2 Darstellung von biotinylierten DA-Mimetika 47
3.1.4 Synthese von 1, 3, 5 Trishydroxymethylcyclohexan- Mimetika (TMC) 49
3.2 Biologische Untersuchungen 51
3.2.1 Biotinylierte Oligsaccharidmimetika als diagnostische Werkzeuge 51
3.2.1.1 Einleitung 51
3.2.1.2 Evaluierung des diagnostischen Potentials der Kohlenhydratmimtika über die
Fluoreszenzfärbung 52
an B16F1 und B16F10Zellen 61
3.2.4 Invasionsassay in Boydens Invasionskammern 66
3.2.5 MMP Aktivitätsmessung über Zymogramm 68
3.2.6Untersuchung auf Tyrosin-Phosphat 69
3.3 Molecular Modeling: 2-D Struktur-Aktivität-Studie 71
4 DISKUSSION UND AUSBLICK 81
5 ZUSAMMENFASSUNG 98
6 EXPERIMENTELLER TEIL 101
6.1 Materialien und Methoden 101
6.1.1 Materialien zur chemische Synthese und Analytik 101
6.1.2 Materialien und Methoden für die Zellkultur 103
6.1.2.1 Routine-Zellkultur 103
6.1.2.2 Fluoreszenzfärbung von adhärent wachsenden Zellen 105 6.1.2.3 Fluoreszenzfärbung von Schnitten aus Colontumor und Normalgewebe 106 6.1.2.4 Adhäsionsassay an extrazellulärem Matrix-Protein Fibronectin 106 6.1.2.5 Invasion-Assay in der Boyden-Kammer (semi-in vivo-Assay) 107 6.1.2.6 MMP-2 Protease Aktivitätsmessung am Zymogramm 108 6.1.2.7 Messung der Tyrosin-Phosphatase Aktivität von SKOV-3 Zellen 109
a. Proteinbestimmung nach Lowry im Mikromaßstab 109
b. SDS-Polyacrylamid-Gelektrophorese nach Laemmli (1970) 109
c. Färbung mit Coomassie 111
d. Western-(Protein-) Blotting 111
e. Immundetektion auf Proteinblots-Untersuchung auf Tyrosin-Phosphat 112
6.2Synthesevorschriften 113
7 LITERATURVERZEICHNIS 124
8 VERÖFFENTLICHUNGEN 137
ABKÜRZUNGSVERZEICHNIS
ad Auffüllen auf
ABA Acrylamid-Bisacrylamid
°C Grad Celsius
δ Chemische Verschiebung in ppm (parts per million) BSA Bovine serum albumin
Bz Benzoyl-
CRD Carbohydrate Recognition Domain Cy Cyclohexan
DAPI 4´, 6-Diamidino-2-Phenylindol DA Diels-Alder
DC Dünnschichtchromatographie DMEM Dulbecco´s Modified Eagle´s Medium DMF Dimethylforamid
DMSO Dimethylsulfoxid
EDTA Ethylendiamintetraessigsäure
EE Essigsäureethylester (Ethylacetat) ESI Electrospray Ionisation
FCS Fötales Kälberserum
FITC Fluorescein Isothiocyanat Fuc Fucose
Gal Galactose
GalNAc N-Acetylgalactosamin GlcNAc N-Acetylglucosamin GSL Glycosphingolipid
Hepes N-[2-Hydroxyethyl]piperazin-N´-[2-ethansulfonsäure]
HPLC High performance liquid chromatography J Kopplungskonstante in Hz
KDa KiloDalton KG Kieselgel
M Molar (mol/L)
mAb monoclonal Antibody
m/z Masse-Ladungs-Verhältnis Me Methanol
mg Milligramm (10-3 g) ml Milliliter (10-3 l) mmol Millimol (10-3 mol)
mM Masse/Volumenprozent MS Massenspektrometrie µmol Mikroliter (10-6 mol)
µl Microliter (10-6 l)
NHS N-Hydroxysuccinimid NMR Nuclear Magnetic Resonance
p.a. Pro analysi
PBS Phosphate buffered saline, isotinoscher Phosphatpuffer PE Petrolether
Rf Related to front
RT Raumtemperatur
SC Säulenchromatographie
SDS-Page Sodium Dodecyl Sulfate Poyacrylamid Gelelelectrophoresis TMC Trishydroxymethylcyclohexan
TMS Trimethylsilyl
Triflat Trifluormethansulfonat
Tris Tris-(hydroxymethyl)-aminomethan Triton X-100 t-Octylphenoxypolyethoxyethanol
UV Ultraviolett
1 Einleitung
1.1 Allgemein
Jedes Jahr erkranken weltweit mehr als zehn Millionen Menschen an Krebs- mehr als sechs Millionen sterben daran. Allein in der Bundesrepublik liegt die Zahl der Neuerkrankungen laut deutschem Krebsregister bei jährlich etwas 340 000 Männer und Frauen an Krebs, mehr als 210 000 sterben davon. Damit zählt Krebs, trotz der Fortschritte, die in der medizinischen Diagnostik und Behandlung in den vergangenen Jahrzehnten erzielt worden, sind mit den Herz-Kreislauf- Erkrankungen zu den häufigsten Todesursachen [Krebsatlas].
Die herkömmlichen Behandlungsmethoden wie chirurgische Eingriffe, Chemotherapie und Bestrahlung haben sich nicht in allen Fällen als ausreichend erwiesen, um die heterogene Krankheit Krebs zu heilen. Eine große Bandbreite von Tumortypen können aufgrund ihrer Histologie unterschieden werden, aber auch im Tumor selbst herrscht keine Uniformität der Zellen vor. Bei der Entwicklung von therapeutischen Ansätzen gewinnen zellbiologische Targets immer mehr an Bedeutung in den essentiellen Forschungsgebieten wie die Untersuchung der Invasion, Metastasierung und der Zellmembran [Davis D, Tanneberger S, 1983].
1.2 Die tumorspezifische Zelloberfläche im Blickpunkt für einen therapeutischen Ansatz
1.2.1 Kohlenhydrate
Kohlenhydrate gehören neben den Lipiden, Proteinen und Nukleinsäuren zu den vier großen Naturstoffklassen. Die klassischen Funktionen der Kohlenhydrate wurden als Energiequelle (Glukose, Glykogen) oder als biologisches Baumaterial (Cellulose, Chitin) verstanden, und erst in den letzten 30 Jahren konnte durch die fortschreitende Entwicklung analytischer und synthetischer Techniken die Funktion der Oligsaccharidstrukturen von eukaryontischen Zellen verstanden
werden. Oligosaccharidstrukturen liegen in der Natur meistens kovalent an Lipide oder Proteine gebunden vor. Die entsprechenden Moleküle werden Glykolipide und Glycoproteine genannt und unter dem Begriff Glycokonjugate zusammengefasst.
Abb.1.2-1 Metabolische Umwandlung von Monosacchariden in der ER und im Golgi-Apparat.
Präsentation von Oligosaccharidstrukturen auf Proteinen (und Lipiden), die in der Membran eingebettet sind [Bertozzi CR, 2001].
Abb. 1.2-2 (links) Vereinfachte schematische Darstellung der Lipid-Doppelschicht der Zellmembran einer eukaryontischen Zelle. Oligsaccharidstrukturen sind kovalent an Lipide und an Proteine gebunden. Glycolipide und Glycoproteine exponieren ihre Zuckeranteile auf der extrazellulären Seite der Plasmamembran. Der Oligosaccharidmantel einer Zelle wird als
„Glycocalix“ bezeichnet. [Lindhorst TK, 2000]
Oligosaccharidstrukturen können mit einem Protein auf zwei verschiedene Weisen verknüpft werden: a) durch die C-1 Bindung des N-Acetylgalactosamin mit
der Hydroxyl-Gruppe des Threonins oder Serins über eine O-glycosidische Bindung oder b) durch die Verknüpfung von N-Acetylglucosamin am C-1 N- glycosidisch an Asparagin gebunden. Kohlenhydratedomänen von Glycoproteinen und –lipiden werden von einer Serie von Glycosyltransferasen im endoplasmatischen Retikulum und Golgi-Apparat synthetisiert. Des weiteren können Glycosidasen Kohlenhydratbausteine entfernen und damit die Oligosaccharidstruktur der Glycokonjugate modifizieren (s. Abb. 1.2-2).
Kohlenhydrate besitzen ein enormes Potential biologische Informationen zu codieren, wie der Vergleich zu Peptiden verdeutlichen lässt. Während Nukleinsäuren und Proteine aus bifunktionellen Monomeren aufgebaut sind, werden Oligo- und Polysaccharide aus oligofunktionellen Molekülen zusammengesetzt. Diese können auf viele unterschiedliche Arten miteinander verknüpft werden. Führt die chemische Verknüpfung zweier bifunktioneller Peptidbausteine zu zwei mögliche Peptidstrukturen, können aus zwei Monosacchariden sogenannte lineare, als auch vielfach verzweigte Oligosaccharide entstehen. Eine Hexopyranose kann an fünf verschiedenen Hydroxygruppen mit einem anderen Zuckermolekül glycosidisch verknüpft werden, wobei dieser Glycosylierungsschritt zwei verschiedene stereochemische Resultate haben kann: die Ausbildung einer α- oder einer β-glycosidischen Bindung. So lässt sich danach errechnen, dass bei der glycosidischen Verknüpfung zwei verschiedener Hexapyranosen schon 20 mögliche Disaccharide gebildet werden. Durch die Variation der Verknüpfungsart in Oligosacchariden verfügt die Natur also über ein enormes Potential an struktureller Variabilität, so dass Zucker für die molekulare Codierung biologischer Informationen geradezu geeignet erscheint.
Die so präsentierten Glycokonjugate spielen eine wichtige Rolle in der Zell-Zell- Kommunikation und Zell-Matrix-Interaktionen (auch Strukturproteine wie das Kollagen und Fibronectin sind glycosyliert). Die Glycocalix gibt jedem Zelltyp ein spezifisches Aussehen. Das Oligosaccharidmuster einer Zelle ist auch typisch für ihr Entwicklungsstadium und ihre Zelldifferenzierung. Auch pathologische Veränderungen und maligne Transformationen der Zellen gehen mit oft charakteristischen Veränderungen des Oligosaccharidmusters einher [Kobata A, 1998], so dass tumorassoziierte Oligosaccharide (Tumor-Antigene) auch
diagnostisch für die Testung auf Krebszellen anwendbar sind. Auch die Blutgruppenzugehörigkeit wird von unterschiedlichen Oligosaccharidmustern auf den Erythrozytenoberflächen eines Individuums bestimmt. Die Blutgruppen A und B unterscheiden sich in den zugrundeliegenden Saccharidstrukturen. Es gibt noch zahlreiche Beispiele, die die bedeutende Rolle von Oligosaccharidstrukturen von Glycokonjugaten als Markermoleküle bei Zell-Zell- und Zell-Matrix- Erkennungsprozessen unterstreichen:
Biologisches Ereignis Kohlenhydrat-Liganden
auf Lectin-Rezeptoren auf
Infektion Gastzelle Mikroorganismen
Fertilisation Eier Spermien
Entzündung (Leuko- zyten Rekrutierung)
Leukozyten, Endothelzellen Endothelzellen, Leukozyten
Metastasierung Zielorganen, maligne Zellen Maligne Zellen, Zielorgan (wahrscheinlich)
Tab. 1 Wichtige biologische Erkennungsprozesse werden über Kohlenhydrat-Lectin-Interaktionen vermittelt
1.2.2 Lectine
Proteine, die selektiv und spezifisch an Zuckerstrukturen binden, um die in ihnen gespeicherte Information zu decodieren, nennt man Lectine (Lateinisch: legere=
wählen). Diese heterogene Proteinklasse [Gabius HJ, 1997] besitzt keine enzymatische Aktivität und unterscheidet sich von Immunglobulinen (Antikörper), die auch Zuckerstrukturen binden können. Die Fähigkeit von pflanzlichen Lectinen an Zucker zu binden und Aggregation zu induzieren ist schon seit Jahrhunderten bekannt. Jedoch erst 1960 als Peter Nowel ein Lectin mit dem Namen PHA (Phytohaemagglutinin) aus der Red Kidney-Bohne isolierte, die die Proliferation von peripheren Lymphozyten induzierte, begann eine intensive Forschung auf diesem Gebiet, der viele Aspekte der Zellbiologie eröffnete. Ursprünglich kannte man Lectine nur aus dem Pflanzenreich, später entdeckte man auch tierische - endogene- Lectine (bei Mikroorganismen, Insekten und Menschen). Die Menge an Daten über endogene Lectine wächst von Jahr zu Jahr. Die wichtige Entdeckung des ersten Säugerlectins und seiner Interaktion mit Oligosaccharidstrukturen von Glycokonjugaten stammt aus den Siebziger Jahren. Endogene Lectine zeigen
keine Homologien zu pflanzlichen Lectinen. Damals zeigten Ashwell und Morell, dass Sialoglycoproteine des Blutplasmas nach enzymatischer Desialylierung mit Neuraminidase terminale Galactose präsentierte, die dann vom Asialoglycoprotein-Rezeptor der Leberzellen erkannt wurde [Ashwell G, Harford J 1982]. Dieser Prozess erklärt den Mechanismus der Eliminierung alter Glycoproteine aus dem Blutkreislauf. Allgemein sind Lectine oligomere Proteine, die ein bis mehrere Kohlenhydrat erkennende Domänen oder CRDs (Carbohydrate Recognition Domaine) in ihrem Molekül aufweisen. Aufgrund von Gemeinsamkeiten ihrer CRD Primärstruktur werden sie in C-, S-, P- und I-Typ- Lectine kategorisiert. Lectine eines Typs zeigen in der kohlenhydratbindenden Domäne (CRD) eine hohe Homologie der Aminosäuresequenz. Die CRD umfasst im Falle von C-Typ Lectinen etwa 135 Aminosäuren, beim S-Typ ist sie etwa 130 Aminosäuren lang. Die Gesamtstruktur der Lectine ist andererseits oft recht unterschiedlich und eher spezifisch für bestimmte Organe, Gewebe oder Spezies.
C-Typ-Lectine
Die Klasse der C-Typ-Lectine sind Ca2+ abhängig. Die C-Typ Lectine liegen entweder membrangebunden oder sezerniert vor. C-Typ Lectine haben eine oder mehrere CRDs und man hat nach heutigem Stand um die 50 endogene C-Typ- Lectine identifiziert. Alle besitzen eine Ca2+ abhängige Bindungsdomäne und ein hydrophobes Zentrum.
• Collectin –Familie: Mannose bindende Proteine (MBP)
• Mannose-Rezeptor (MR): Phospholipase A2 (PLA2), Dendritischer Zellrezeptor (DEC-205), MP-multi -Lectin Rezeptor
• L-, E-, P-Selectine
Galectine
Diese Lectin-Klasse ist Ca2+ unabhängig und gehört zu der Klasse der S-Typ- Lectine. Bis dato sind 10 Galectine identifiziert worden. Sie haben gemein, dass sie N-Acetylactosamine (Galβ1-nGlcNAc-R) primär über die Erkennung der β-Gal Einheit, binden. Die CRDs der Galectine sind hauptsächlich von drei Exons
codiert, die ~20 - 40% Homologie aufweisen. Basierend auf ihrer CRD-Struktur unterteilt man Galectine in drei Gruppen:
Galectin-1, -2, -5, -7,-10 besitzen nur eine CRD. Galectin-4, -6, -8, -9 bestehen aus sich zwei tandem-wiederholenden CRD Typen. Galectin-3 ist ein
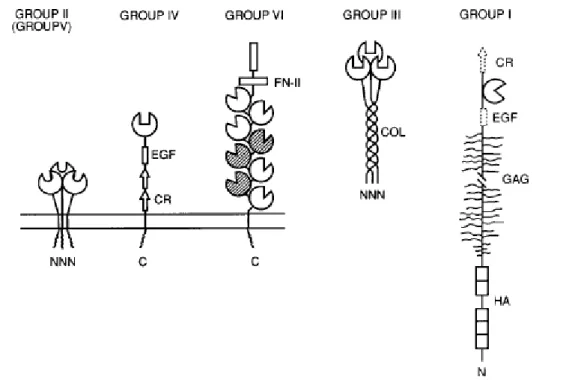
Abb. 1.2-3 Darstellung von C-Typ Säugerzelllectine. Repräsentative Strukturen von drei Gruppen von Membran-assoziierten Lectinen: Gruppe II, das Hühnerleber Lectin (homolog zum Mammalian Asialoglycoprotein Rezeptor); Gruppe IV, Selectin Zelladhäsion Molekül; und Gruppe VI, Makrophage Mannose Rezeptor. Group III Lectine (Collectine), wie Mannose-bindende Proteine, die in extrazellulärer Flüssigkeit zu finden sind. Group I CRD-besitzende Proteine wie Proteoglycane der extrazellulären Matrix. Andere Domäne dieser Moleküle schließen den EGF, epidermal growth factor-like repeats; CR, complement regulatory domains; FN-II, fibronectin type II repeats; COL, collagen-like sequences, GAG, glycosamino-glycan attachment sites; and HA, hyaluronic acid-binding domains mit ein [Weis, WI et al., 1992].
chimärer Typ und besitzt die terminale COOH-Gruppe am CRD, ein Amino Ende mit 12 asscelatorischen Resten und eine kollagenartige Domäne bestehend aus sich wiederholenden Sequenzen von Pro-Gly-Tyr. Galectine existieren sowohl intra- als auch extrazellulär und werden von der Zelle auch in löslicher Form sezerniert. Galectine sind involviert in verschiedenen Prozessen wie Zelladhäsion, Zellwachstumsregulation, Apoptose, Entzündung, Immunreaktion, Embryogenese, Angiogenese und Metastasierung [Perillo NL et al., 1998, Barondes SH et al., 1994, Rabinovich GA 1999, Cooper DN und Barondes SH, 1999, Nangia-Makker P, 2000].
P-Typ Lectine
Lectine des T-Typs binden hauptsächlich an Monnose-6-Phosphate. Zu dieser Gruppe gehören die beiden transmembranen Mannose-6-phosphat Rezeptoren.
Der 300 kDa Rezeptoren, der kationenunabhängig bindet, kommt als Monomer im Trans-Golgi-Netzwerk und an der Plasmamembran vor. Der 45 kDa Rezeptor bindet kationenabhängig und befindet sich lediglich im Trans-Golgi-Netzwerk.
I-Typ Lectine
Lectine des I-Typs zeichnen sich durch eine variable Anzahl extrazellulärer Domänen aus, die Immunglobulinen sehr ähnlich sind. Sie sind an Adhäsionsprozessen beteiligt und binden an saure Oligosaccharide. Bedeutende Vertreter dieser Klasse sind die ICAM (intracellular adhesion molecules). Zu den I- Typ Lectinen zählt auch die Gruppe der Sialinsäure bindenden Siglecs. Als Vertreter dieser Gruppe wäre das Myelin-assoziierte Glycoprotein (MAG) zu nennen [Powell LD und Varki A, 1995].
1.2.3 Kohlenhydrat-Lectin-Interaktion
Der Informationstransfer in zellulären Systemen erfolgt auf molekularer Ebene vielfach über Oligosaccharid – Protein- Wechselwirkungen. Oligosaccharide besitzen wie schon in Abschnitt „Kohlenhydrate“ erwähnt aufgrund ihrer strukturellen Besonderheiten eine den Proteinen und Nucleinsäuren überlegene Speicherkapazität für biologische Informationen [Rüdiger H et al., 2000]. Als Rezeptoren stehen den Oligosacchariden die Lectine gegenüber. Die Kohlenhydrat-Lectin Wechselwirkungen bilden die molekularbiologische Grundlage für zahlreiche normale und pathologische Erkennungsprozesse wie zum Beispiel bei Zelladhäsionsvorgängen [Varki A, 1993]. So bindet der Influenza- Virus über viruseigene Lectine, die Hämagglutinine, an terminale Sialinsäureeinheiten von Memranglycoproteinen und ermöglicht so die Invasion in die Wirtszellen [Colman PM et al., 1983; Burmeister WP et al., 1992].
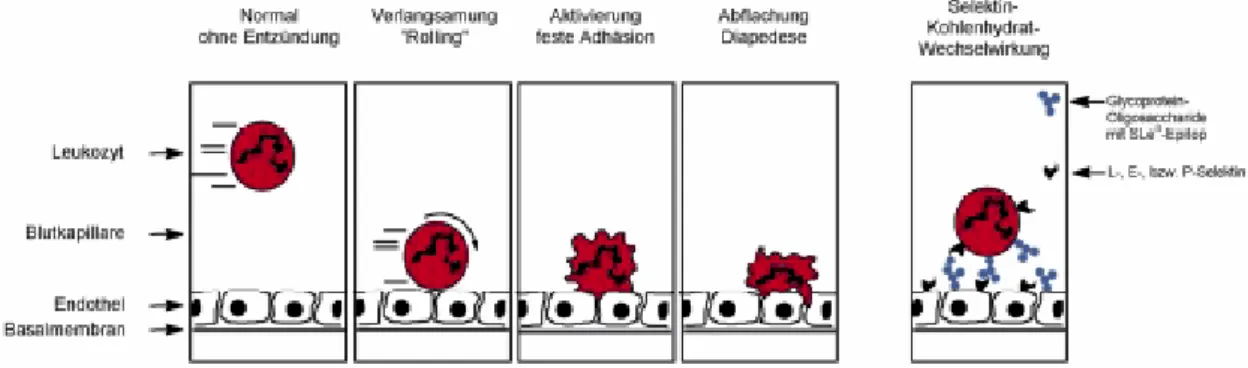
Die Interaktionen zwischen Kohlenhydraten und Lectinen sind sehr spezifisch, jedoch binden die meisten Kohlenhydrate den Proteinrezeptor sehr schwach und die Assoziationskonstanten sind selten größer als 106 M-1. Aber gerade diese schwachen, nicht-kovalenten und doch sehr spezifischen Bindungen ermöglichen erst das sogenannte Rolling von Leukozyten entlang der Endothelzellwand bei Entzündungsprozessen. In der Initialphase verlangsamen sich die Leukozyten durch die Kohlenhydat - Protein (E-, P- und L-Selectine) -Interaktion. Die zweite Phase, die in der festen Adhäsion und Ausschleusung der Leukozyten resultiert, wird von Protein-Protein (Integrine)- Wechselwirkungen gesteuert (s Abb. 1.2-8).
Man nimmt an, dass Sialyl –Lewis-X (sLex) als Ligand für die Selectine dient. In der Forschung dient das sLex deshalb als Referenzligand und Leitstruktur für die Synthese von Selectinblockern, die als Entzündungshemmer dienen sollen.
Abb.1.2-4 Oberflächen Oligosaccharidstrukturen sind als Erkennungsstrukturen an vielen biologischen Prozessen beteiligt.
Die Wechselwirkungen zwi- schen Oligosacchariden und Lectinen sind sehr spezifisch und stellen meistens Initialschritte für weitere Signalübertragungen dar, die im nächsten Schritt in eine stärkere Protein-Protein- Bindung übergehen.
[Wong CH, Homepage]
Im Zusammenhang der schon oben erwähnten Interaktion zwischen Influenza- Virus und Wirtszelle, die sehr spezifisch über die Kohlenhydrat – Lectin – Wechselwirkung stattfindet, ist die Bindungskonstante deutlich höher als 106 M-1 Bereich. Diese Beobachtung ist zurückzuführen auf multivalente Wechselwirkungen zwischen Lectinen und Oligosaccharidstrukturen. Liegen Saccharide des richtigen Typs in der richtigen Orientierung in multivalenter oder geclusterter Form vor, stellt man eine Erhöhung in Affinität und Spezifität zum korrespondierenden Proteinrezeptor fest. Diese Erhöhung ist unerwartet größer als das, was man durch lokale Konzentrationserhöhung (statistischer Effekt) erklären könnte. Dieses Phänomen wird als Cluster- oder Multivalenter Effekt bezeichnet. Lee et al., 1983 zeigte das beispielhaft an den Messungen der Bindungsaffinitäten zwischen dem Asialoglycoprotein-Lectin und synthetischen Galactosiden. Er demonstrierte, dass ein tetraantennäres Undecasaccharid eine 106 M-1 größere Avidität aufwies als die korrespondierende monoantennäre Struktur [Lee YC et al., 1983].
Abb.1.2-5
-links: Beispiele für sLex –Antagonisten. 6 hat 50 x höhere Aktivität zu E-Selectin und 7 zeigt 103 x höhere Aktivität zu P-Selectin als sLex. -rechts:
Multivalente Liganden binden A an oligomere Rezeptoren (Chelat Effekt); B durch Bindung am primären und sekundären Bindungsstellen vom Rezeptor; C durch resultierendes Clustern der Rezeptor an der Membran. [Bertozzi CR, Kiessling LL, 2001]
1.2.4 Die Bedeutung der Kohlenhydrat-Lectin Interaktion in der Tumorbiologie
Allgemein
Ein Tumor entsteht durch eine Mutation, die nach mindestens einer Zellteilung als irreversibler Schaden erhalten bleibt, wenn sie vorher nicht repariert wurde (Initiation). Die Promotion bewirkt eine Selektion und klonale Expansion präneoplastischer Zellpopulationen, d.h. der Nachkommen initiierter Zellen. Die Umwandlung präneoplastischer Zellen und benigner Neoplasien in maligne Tumore, die invasive Eigenschaften aufweisen, wird als Progression bezeichnet.
Die invasive Eigenschaft ermöglicht der Zelle die Intra- und Extravasation, um sich auf einem entfernten Organ anzusiedeln. Diesen Prozess bezeichnet man als Metastasierung.
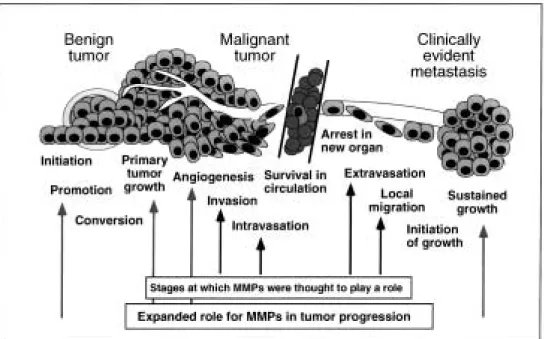
Abbildung 1.2-6 zeigt die relevanten Schritte in der Entwicklung von der Entartung eines benignen Tumors zum malignen Tumors. Dabei sind neben der Initiation, Promotion die Angiogenese, Invasion und Migration wichtige Schritte der Metastasierung und Focus für Grundlagenforschung und klinischen Anwendungen. MMP= Matrix Metalloprotease [Coussens LM, 2002]
Den Tumor in seiner malignen Form zu bekämpfen ist immer noch eine große Herausforderung. Die großen Schwierigkeiten liegen darin, dass die Progression einen dynamischen Prozess darstellt bei der die Tumorzelle durch Selektion ihre Eigenschaften kontinuierlich ändert. Krebs ist keine uniforme Erscheinung und damit schwer therapierbar.
Kohlenhydratstrukturen und Metastasierung
Eine Vielzahl von Untersuchungen zeigten, dass der Metastasierungsprozess mit der Veränderung von Glycosylierungsprozessen einhergeht. Diese Veränderungen während der Progression können dann die Selektion zu mehr invasiven und metastasierenden Zellen steuern. Das Schema von S. Hakomori [1996] zeigt, dass das Stadium der Invasion und Metastasierung von Cell-Social Functions ausgeübt werden. Diese Funktionen umfassen die Zell-Zell- und Zell- ECM –Interaktionen (Extracellular Matrix) und werden von Zelloberflächen- Rezeptoren der Adhäsion/Erkennung, Hydrolasen und zum Teil von Rezeptoren der Wachstumsfaktoren und Hormonen reguliert. Die Rezeptor Expression und das Glycosylierungsmuster der BM (Basalmembrane) und EC (endothelial cell) verändern sich während der Metastasierung, so dass das Durchlaufen der verschiedenen Stadien der Metastasierung wie Adhäsion und Invasion ermöglicht werden kann. Das Schema von Hakomori S. (Abbildung 1.1-5) zeigt, dass die Cell-Social-Functions hauptsächlich durch Glycosylierung bestimmter Rezeptoren kontrolliert werden. Die Glycosylierung dient als Schalter für die Aktivierung und Deaktivierung eines Rezeptors bzw. sie ist maßgeblich an der korrekten Faltung bzw. Struktur des Rezeptorproteins beteiligt. Wird das Glycosylierungsmuster der Zellmembran, BM und EC verändert, können cell social functions aufgehoben werden und zur Autonomie der Zelle führen.
Housekeeping Functions (controlled mainly by
phosphorylation) Cell Social Functions (controlled mainly by glycosylation)
Adhesion and motility receptors, hydrolasis Receptors controlling Transmembrane signaling
Invasion
Tumor growth
Metabolism, respiration Translation,Transcription motility, cell cycle, etc.
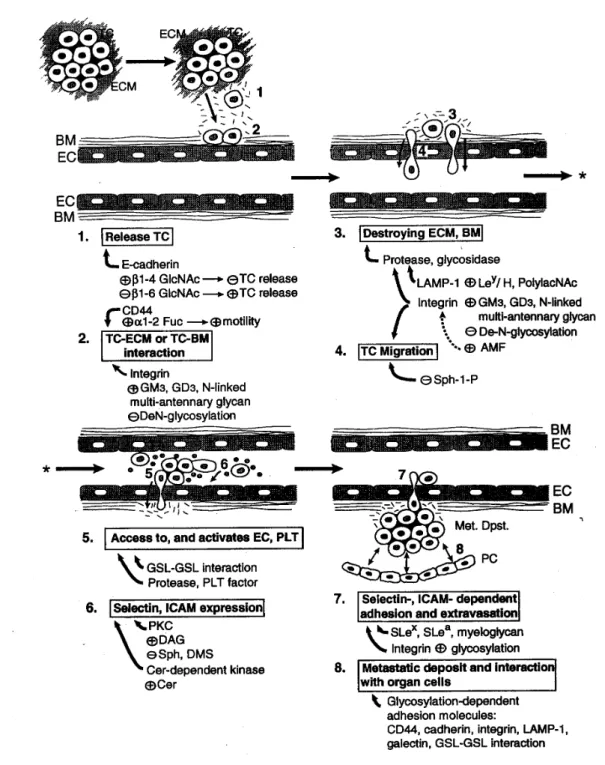
Abb. 1.2-7 Schematische Darstellung der Involvierung der Glycosylierung beim Metastasierungsprozess; BM, Basalmembran; DAG, Diacylglycerol; EC, Endothelial cells; ECM, extracellular matrix; PC, parenchymatous cells of organs; PLT, Platelet; TC, tumor cells;GSL,Glycosphingolipid; LAMP, Lysosme associated membrane protein
1. Tumorzelle verlässt Tumorverband abhängig von der E-Cadherin-Aktivität, die wiederum abhängig ist von der An-/Abwesenheit der ß1-6GlcNAc-Antenne. 2.TC-ECM/TC-BM-Interaktion hängt vom zwei TC-Membran-Rezeptoren ab: Integrin, CD44. Ihre Aktivität ist abhängig vom Glycosylierungsgrad. 3.LAMP-1-Aktivität wird von Poly-LacNAc + H /Ley Glycosylierung gesteuert.
4. Migration und Invasion geschieht auch im Zusammenhang der Integrin-Glycosylierung. 6.
Expression von Selectin, ICAM und anderen Adhäsionsmolekülen. 7.Selectin und ICAM abhängige Adhäsion und Extravasation von TCs werden von Slex, SLea gesteuert. 8. Kontakt mit Zielorgan:
dieser Schritt ist abhängig von der Glycosylierung verschiedener Adhäsionsmoleküle und Kohlenhydrat-bindenden Molekülen wie CD44, Cadherin, Integrin, Galectin und GSL [Hakomori S, 1996].
Verdeutlichen lässt sich das am Beispiel der N-Glykosilierung von Integrinen. Dort sorgt die N-Glycosylierung für die korrekte Zusammensetzung der α und β Untereinheiten der Integrine [Chammas R und Brentani R, 1991]. Die Überexpression von N-verknüpften multiantennären Glycanen verursachte eine permanente Aktivität der Integrine, wodurch die Interaktionen zwischen Tumorzelle und EC oder Tumorzelle und BM unterstützt und folglich die Intravasation in die Blutbahn erleichtert wird. Oligosaccharidstrukturen sind somit beteiligt an Zell-Zell und Zell-ECM-Interaktionen [Opdenakker G et al., 1993;
Sharon N, 1980]. Die Zell-Glycosylierung hängt von der Expression und Funktion verschiedener Glycosyltransferasen und Glycosidasen ab. Transfektionsversuche mit Genen, die verschiedene Glycosyltransferasen codieren, zeigten in der Sense- und Antisense Orientierung, dass eine Veränderung in der Oligosaccharidstruktur auf Zelloberflächen das Metastasierungspotential der Tumorzelle beeinflusst.
Diesen Untersuchungen gingen Beobachtungen voraus, dass der Zuckeranteil der Glycokonjugate (Glycolipide und Glycosphingolipide oder Glycoproteine) von Tumorzellen Veränderungen im Muster aufwiesen. Es gibt zwei Hauptursachen für das veränderte Oligsaccharidmuster: Inhibierung der Kohlenhydratsynthese oder die De Novo Synthese. In Tumoren neuroectodermalen oder epithelialen Ursprungs wie Glioma, Melanoma und Brustkrebs hat man zum Beispiel eine Überexpression von GD3 Gangliosiden beobachtet [Hakomori S, 1985, Zeng G et al. 2000, Manfredi MG et al., 1999]. Ganglioside sind Sialinsäure-haltige Glycosphingolipide, die primär auf der Plasmamembran exprimiert sind und eine wichtige Rolle in Zellwachstum und Differenzierung spielen. Die neuesten Untersuchungen ergaben, das GD3 Ganglioside die Produktion von VEGF (vascular endothelial growth factor) stimulieren und somit an der Angiogenese beteiligt sind [Koochekpour S et al., 1996].
Weitere Analysen von membranverankerten Oligosaccharidstrukturen bei Tumorzellen zeigten, dass vielfach eine Überexpression von großen N- verzweigten Oligosaccharidstrukturen [Dennis JW et al., 1992; Fernandes B et al., 1991] in Brust- und Coloncarcinomen auftreten, die meistens β-1-6GlcNAc - verzweigte N-Glycane darstellen (tri- oder tetra- antennäre Oligosaccharide).
Verantwortlich für die Überexpression von β-1-6 verzweigten N-verknüpften Oligosacchariden ist die erhöhte Aktivität von N-acetylglucosamyltransferase V
(GlcNAc-TV). β-1-6GlcNAc- verzweigte N-Glycane stellen auch zusätzliche Lactosamin-Antennen dar, die eine terminale Verknüpfung mit Sialinsäure, die durch die erhöhte Aktivität der Sialyltransferase promoviert wird, ermöglichen.
Folglich lässt sich so der erhöhter Gehalt an Sialinsäure auf der Zelloberfläche beim Coloncarzinom strukturell erklären. Die Sialinsäure als Indikator für die Bestimmung des Metastasierungspotentials von humanen Coloncarzinomzellen ist seit langem bekannt [Morgenthaler J et al. 1990, Harvey BE und Thomas P, 1993, Kijima-Suda I et al., 1986]. Einige Sialoglycokonjugate haben das Konzept der Carzinom assoziierten Sialin-Expression am Beispiel vom α2,6GalNAc Dissaccharid, auch bekannt als sialyl-Tn Antigen, verifiziert. Dieses Antigen kann als Prognose- Indikator durch immunhistochemische Methoden mit dem monoklonalen Antikörper TKH2 genutzt werden. Es ist dabei wichtig zu erwähnen, dass sialyl-Tn Antigen auch auf Normal- Colon Epithelium exprimiert ist, aber hierbei ist die Sialinsäure O-acetyliert und kann somit nicht vom monoklonalem Antikörper TKH2 detektiert werden. Auch die Veränderung in der Expression von Antigenen der Histo-Blutgruppe ABO und Lewis-Gruppen ist ein häufig beobachtetes Phänomen bei verschiedenen malignen Tumoren [Hakomori S, 1989]. Eine Reduktion oder ein komplettes Fehlen von A- und B-Antigenen der Histo-Blutgruppe wurden bei einigen humanen malignen Carcinomen wie Lunge und Blasenkarzinomen beobachtet [Mandel U et al. 1992; Orntoft TF, 1992; Lee JS et al., 1991; Yuan M et al., 1985]. Des weiteren zeigten Matsumoto, dass der Verlust von A und B Kohlenhydratstrukturen mit einer schlechten Prognose für Lungenkrebspatienten korrelierte [Matsumoto H et al. 1993]. Man nimmt an, dass eine reduzierte Expression von A und B-Kohlenhydratstrukturen mit höherem Invasions-und Metastasierungspotential der Tumorzellen einhergeht. Für eine Erklärung auf molekularer Ebene sorgte Ishikawa [Ishikawa D et al. 1998]. Er transfizierte Colonkarzinomzellen mit cDNAs der Transferasen der Blutgruppe A oder B und stellte eine stark reduzierte Motilität im Matrigel-Invasionsassay fest.
Die Motilität wird größtenteils kontrolliert durch α3, α6, und β1 Integrine. Er vermutet daher, dass der Status der A und B Glycosylierung der Integrine Einfluss auf das Invasionspotential hat. Auch Chammas R et al., 1991 zeigten, dass die korrekte Ausübung der Integrin-Funktion nur durch N-Glycosylierung der Integrine
stattfinden kann, denn die Glycosylierung gewährleistet die korrekte Faltung der α- und β- Untereinheiten der Integrine [Hakomori S, 1996].
Auch die Antigene Lex, Ley (Lewis-Blutgruppe) sialyliert oder nicht, stehen im Blickpunkt der Krebsforschung . Man nimmt an, dass sie die Liganden für endogene C-Typ Lectine (Selectine) sind [Oriol R et al., 1986]. Diese Interaktionen spielen bei Entzündungsprozessen eine wichtige Rolle.
Abb. 1.2-8 Schematische Darstellung des Entzündungsprozesses. Normalerweise bewegen sich die Leukozyten schnell im vaskularen Strom der Blutgefäße, ohne dass eine Wechselwirkung mit dem Endothel stattfindet. Durch Wechselwirkungen von Kohlenhydratabschnitten in Glycokonjugaten mit Selectinen kommt es zur Verlangsamung, dem sogenannten „Rolling“ von Leukozyten. Danach wird die feste Anheftung der Leukozyten durch Protein-Protein Wechselwirkungen möglicht, die durch die Interaktion aktivierter Leukozyten-Integrine mit dem Counter-Rezeptor ICAM-1 auf dem Endothel zustande kommt. Es kommt zum Stop und zur Durchtritt der Leukozyten in die Blutbahn [Lindhorst, 2000].
Leukozyten, die auf ihrer Zelloberfläche sLex exprimiert haben treten in Wechselwirkung mit den Selectinen der Endothelzellwand und die anschließende Extravasation wird durch Protein-Protein-Wechselwirkung vermittelt. Integrine auf den Leukozyten binden dabei an ICAM (intercellular adhesion molecules) auf den Endothelzellen. Man nimmt an, dass diese entzündungssteuernden Moleküle auch beim Metastasierungsprozess eine Rolle spielen, um die Intra- und Extravasation von Tumorzellen zu ermöglichen. So stellte sich heraus, dass Patienten mit Colonkarzinom und gleichzeitig hohem sLex (sialyl Lewisx) Expressionslevel eine schlechte Prognose hatten. Zusammengefasst deuten die Daten darauf hin, dass maligne Transformation oft mit Veränderungen der Zelloberflächen Oligosaccharidstrukturen korreliert. Die vielfach beobachtete Assoziation mit der Veränderung des Glycosylierungsmusters auf Tumorzellen (schon im frühem Stadium) und der Überlebensrate der Patienten zeigt, dass das Glycosylierungsmuster eine wichtige Rolle in der Tumorprogression einnimmt und die Richtung in mehr maligne Phänotypen dirigiert.
Lectine und Metastasierung
Zunehmend gibt es Hinweise darauf, dass Lectine eine Rolle in verschiedenen biologischen Prozessen spielen, wie bei der Zellproliferation, Apoptose, Zelladhäsion, im Immunsystem, beim Tumorwachstum und bei Metastasierungsprozessen.
Die Überexpression von sLex, sLea und Ley in der Mehrheit der humanen Carcinomen von Colon, Blase, Brust und Lunge, veranlassten Untersuchungen zu ihren korrespondierenden Rezeptoren. Da sLex und sLea Selectin-Liganden (P-, E-, L-Selectin) sind, die bei Entzündungsprozessen miteinander in Wechselwirkung treten, sind viele Untersuchungen zum Expressionsmuster von P-, E- und L-Selectinen bei der Metastasierung gemacht worden. So zeigten metastasierende Zellen des Lungen-Adenocarcinoms HAL-8Luc und die Zelllinie H-59, die sLex und sLea überexprimieren, auch gleichzeitig eine hohe Adhäsion an E-Selectin [Brodt P et al., 1997]. Diese Adhäsion konnte sowohl mit anti-E- Selectin mAb (monoclonal Antibody) als auch mit mAb gegen sLex blockiert werden [Martin- Satue M et al., 1998]. Normale Endothelzellen exprimieren einen sehr geringen oder keinen detektierbaren Level an E- und P-Selectin. Diese Beobachtungen weisen darauf hin, dass nur bei Inokulation mit HAL-8Luc und H- 59 Zellen die E-Selectin Expression am Endothelium induziert wird und somit zur Erhöhung des Metastasierungspotentials beiträgt [Brodt P et al., 1997]. Die Begründung liegt vielleicht darin, dass die Produktion von IL-1 (Interleukin-1) und/oder TNF (Tumor Nekrose Faktor), die fähig sind, P- und E-Selectin auf Endothelzellen hochzuregulieren, durch die Tumorzellen angeregt wird.
Tatsächlich hat man bei der Inokulation (in die Milz / portal) von H-59- und B16F1 Zellen, die in die Leber metastasieren eine höhere Konzentration von IL-1 und TNF in der Leber gemessen [Khatib AM et al., 1999]. Diese Studien unterstreichen, dass Tumorzellen den E-Selectin-Level auf Endothelzellen erhöhen können und dass diese Fähigkeit mit dem Metastasierungspotential korreliert. Des weiteren wirkte lösliches E-Selectin als Inhibitor für die Kolonisation der Lunge durch HT-29-Zellen (Colonkarzinomzellen). Interessanterweise besaß nur lösliches E-Selectin Anti-Metastasierungseffekte , aber nicht lösliches L- Selectin, für das HT-29-Zellen auch Liganden besitzt. P-Selectin ist auf Blutplättchen und Endothelzellen [Varki A, 1994] und auf verschiedenen humanen
Tumoren exprimiert [Stone JP et al., 1993]. Die Möglichkeit, dass P-Selectin eine Rolle im Metastasierungsprozess spielen könnte zeigte Kim [Kim YJ et al., 1998].
RAG Mäuse mit T- und B-Lymphozyten- Defizienz, aber NK Zell (natural killer cell) -Aktivität können normalerweise transplantierte Tumorzellen nicht abstoßen und entwickeln progressiv wachsenden Tumor. Handelt es sich bei den RAG-/- Mäusen jedoch um P-Selectin knock-out Mäuse, entwickelten nur noch 2 von 9 dieser Mäuse (RAG - /-, P-Selectin -/-) einen Tumor. Diese Ergebnisse implizieren, dass P-Selectin die Metastasierung fördert. Bei RAG-/-, P-Selectin +/+
Mäusen hat man des weiteren beobachten können, dass die Tumorzellen mit den durch Thrombin aktivierten Blutplättchen aggregierten, jedoch die P-Selectin defizienten Mäuse keine rosettenförmige Aggregation der Tumorzellen zeigten.
Die immunohistochemische Analyse von Lungengewebeschnitten nach Inokulation von LS180 Zellen ergab, dass der größte Teil der Tumorzellen komplett mit Blutplättchen bedeckt waren. Tumorzellen, die in den Blutstrom gelangen reagieren mit verschiedenen zell- und nicht-zell-Bestandteilen des Blutes und können dabei das Koagulationssystem aktivieren. Dies könnte dann zu Tumor Mikroembolien führen, die eine Disposition in entfernte Organe und die Formierung von Metastasen erleichtern [Gasic GJ et al., 1986]. Außerdem vermutet man, dass die Blutplättchen durch die Interaktion ihres P-Selectins mit den Liganden auf der Tumorzelle eine schützende Hülle um die Tumorzelle bilden und diese somit von NK-Zellen nicht erkannt werden. Mit dieser Taktik entkommen Tumorzellen dem Immunsystem. Auf diese Vermutungen basierend werden schon viele Anti-koagulierende Substanzen wie Heparin oder Warfarin eingesetzt, die die Metastasierung erkennbar inhibieren [Gorelik E et al., 1984;
1987].
Auch die Funktion von Galectinen bei Zell-Zell, Zell-ECM-Interaktionen und Zellmigration gewinnt mehr und mehr an zentraler Bedeutung bei Metastasierungsprozessen. Galectin-3 bindet Laminin, carcinoembryonale Antigene und Fc Rezeptoren für IgE. [Perillo NL et al., 1997; Ohannesian DW et al., 1995; Zhou Q und Cummmings RD, 1993]. Galectine sind auf normalen Zellen und auf der ECM zu finden. Auch maligne Zellen exprimieren Galectine. Des weiteren sind sie auch in löslicher Form bekannt. Maligne Zellen sind wie schon erwähnt gekennzeichnet durch die veränderte Oligosaccharidstruktur auf der
Zellmembran, aber auch in der veränderten Expression von Galectinen [Raz A und Lotan R, 1987]. Erhöhte Expression von Galectin-3 korreliert mit neoplastischer Progression bei einigen Krebsarten in Kopf, Nacken und ZNS (Zentrales Nervensystem) [Schoeppner HL et al., 1995, Gillenwater A et al., 1996, Bresalier RS et al., 1997]. Die Veränderung in der Galectin-3 Expression hat einen Effekt auf die Interaktion zwischen korrespondierenden Liganden der normalen Zellen und Tumorzellen und auf die Fähigkeit der Tumorzelle, lokal zu wachsen und in verschiedene Organen zu metastasieren. Diese Vermutung wurde unterstützt durch Gen-Transfektionsexperimente. Gering metastasierende Colon Krebszellen (LS174T) wurden mit Galectin-3 cDNA transfiziert. Bei Inokulation dieser Zellen in Nacktmäuse beobachtete man ein höheres Metastasierungspotential dieser Zellen [Bresalier RS et al., 1998]. Eine andere Untersuchung zeigte, dass drei von fünf humanen Brustkrebs Zelllinien, die in Nacktmäusen wachsen konnten, auch Galectin-3 exprimierten, wohingegen die zwei Zelllinien, die nicht in Nacktmäusen wuchsen, kein Galectin-3 exprimierten.
Als Kontrolle transfizierte man diese zwei Zelllinien mit Galectin-3 cDNA, die dann proliferierten. Ein Klon besaß sogar das Potential, in Nacktmäusen nicht nur zu wachsen, sondern auch in deren Lymphknoten zu metastasieren. [Nangia-Makker P et al., 1997]. Diese Ergebnisse lieferten somit weitere Beweise für die wichtige Rolle von Galectin-3 bei der Metastasierung. Weitere Untersuchungen bestätigten den Zusammenhang zwischen Überexpression von Galectin-3 und erhöhtem Metastasierungspotential, das gleichzeitig die Bildung von heterotypischen und homotypischen Zellaggregaten und erhöhtem Invasionspotential einschließt [Raz A und Lotan R, 1987, Raz A et al., 1989, Raz et al., 1990, Meromsky L et al.
1986]. Man vermutet, dass transfiziertes Galectin-3 anti-apoptotische Effekte induziert. In Experimenten wurde demonstriert, dass die Expression von Galectin- 3 bei Brustcarcinomzellen BT549, die, durch Cisplatin induzierte Apoptose inhibierte, ohne dabei den Expressionslevel der Pro-apoptotischen Familie der BCL2 Proteine (BAX, BCL-X) zu verändern. Dadurch werden optimale Bedingungen für das Überleben von Tumorzellen, Proliferation und Metastasierung geschaffen [Akahani S et al., 1997]. Des weiteren zeigten Galectin-3 transfizierte Zellen eine verstärkte Adhäsion an Laminin und Kollagen Typ IV mit einem gleichzeitig höheren Invasionspotential durch Matrigel
(synthetische ECM) [Warfield PR et al., 1997, Le Marer N und Hughes RC, 1996, Cooper DN und Barondes SH, 1999, Barondes SH et al., 1994]. Die Ursache liegt wahrscheinlich in der erhöhten Interaktion zwischen Galectin-3 mit seinem natürlichen Liganden.
Galectin-1 kann Laminin, Fibronectin, CD43, CD45 an T Lymphozyten und β- Lactosamin enthaltenden Glycolipiden binden, jedoch wurde bis dato keine Korrelation zwischen Galectin-1 und Kanzerogenität gefunden.
Abb.1.2-9 Schematische Darstellung zeigt die möglichen Interaktionen zwischen (Tumor-) Zellen, Zelle und ECM via Proteinen/Lectinen und
Oligosacchariden. [Kaltner H,1998]
wechselwirken. Einfache Zucker wie D-Galactose und Arabinogalactan konnten signifikant die Bildung von experimentellen Lebermetastasen durch L-1 Sarkomzellen blockieren. Ähnliches beobachtete man bei B16 Melanomzellen, die mit Methyl- α-D-Lactose und Lacto-N-tetrose behandelt wurden [Beuth J et al., 1987, Oguchi H et al. 1990]. Eine andere Studie zeigte, dass homotypische Aggregationen von Zellen die Metastasierung fördern: Citrus-Pectin präsentiert im natürlichen Zustand eine verzweigte Kette aus komplexen Kohlenhydraten (50%
Anhydrogalacturonsäure, 20% Galactose, 15% Arabinose) und im modifizierten Zustand eine lineare hauptsächlich aus Galacturonsäure bestehende Kette. Die Behandlung der B16F1 Melanomzellen mit natürlichem Citrus-Pectin führte zu einer 3-fach höhere Anzahl an Metastasen als die Behandlung mit modifiziertem Citrus-Pectin [Platt D und Raz A, 1992]. Die Behandlung mit modifiziertem Citrus- Pectin inhibierte sowohl die Adhäsion an Laminin als auch die homotypische Zellaggregation. Fazit ist, dass eine positive Korrelation zwischen homotypischer
Die Interaktionen zwischen Lectinen und Zuckern bei der Metastasierung können von zwei Seiten beleuchtet werden. Zum einen können tumorassoziierte Lectine mit dem Kohlenhydrat- Anteil der Glycokonjugate, die auf normalen Zellen und auf der ECM exprimiert sind, wechselwirken oder ähnlich können Lectine der normalen Zelle mit tumorassoziierten
Zelle
Zellaggregation und Metastasierungpotential in vitro existiert [Raz A et al., 1980].
Die Erklärung klingt plausibel, denn die Tumorzellaggregationen erhöht die Embolisierung in der pulmonären Vaskulatur. Homotypische Aggregationen könnten zum einen via Integrin-Ligand erfolgen [Qian F et al., 1994], zum anderen über die Lectin-Kohlenhydrat-Interaktion von Tumorzellen oder durch Brückenbildung zwischen Tumorzellen durch Serumglycoproteine [Inohara H und Raz A, 1995]. Darüber hinaus zeigte Galectin-3 noch einen anderen Effekt in in vitro Experimenten, nämlich die Anregung zur Blutkapillarbildung und chemotaktischer Reaktion der Endothelzellen. Ebenso konnte eine in vivo Vaskularisierung beobachtet werden. Galectin-3 wirkt also als Angiogenese- Stimulator [Nangia-Makker P et al., 2000]. Diese Stimulierung konnte kompetitiv mit Lactose und mit modifiziertem Citrus Pectin inhibiert werden. Diese Versuche legen nahe, dass Galectin-3 an der Angiogenese beteiligt ist und damit das Tumorwachstum und die Metastasierung fördert.
MBP (Mannose bindendes Protein) und MR (Mannose Rezeptor) und Metastasierung
Eines der prominentesten C-Typ-Lectine ist das MBP. MBP spielt eine wichtige Rolle bei der frühen Immunabwehr, in der MBP mit fremden Oligosacchariden auf pathogenen Organismen wechselwirkt und so zur Aktivierung der Komplementkaskade beiträgt, die letzlich zur Opsonisierung führt. MBP gehört zu der bisher relativ begrenzten Anzahl von Lectinen, die kristallisiert und deren Röntgenstruktur aufgeklärt werden konnte.
Abb. 1.2-9 Die CRDs (Carbohydrate Recognition Domain) des MBP (Mannose Binding Receptor) sind identisch. Die Abstände der Kohlenhydrat Bindungsstellen (gezeigt in der Vergrößerung) von MBP liegen zwischen 4.5 and 5.3 nm. [Dwek RA, 1996]
Einige experimentelle Daten zeigten, dass der rekombinante Vaccini Virus mit humanem MBP Gen signifikant das Tumorwachstum bei Mäusen inhibieren konnte, die zuvor mit SW1116 Coloncarzinomzellen inokuliert wurden, [Ma Y et al., 1999]. Dies unterstreicht den unabhängigen Mechanismus des Anti-Tumor- Effekts von MBP.
MR ist ein 175 kDa Transmembranglycoprotein, das auf Makrophagen und dendritischen Zellen vorkommt. MR besitzt acht tandemartig angeordnete CRDs (Carbohydrate Recognition Domain), die Mannose, Fucose und GlcNac binden können. MR ist auch auf bestimmten Zelltypen der Endothelzellen exprimiert und könnte die Organ- oder Gewebsspezifität bestimmter metastasierender Zellen erklären. Werden B16 Zellen mit 1-DMM (1-deoximannojirimycin) behandelt, exprimieren sie verstärkt High mannose type Oligosaccharide auf ihrer Zelloberfläche. Das führt zu einer erhöhten Adhäsion an HSE-Zellen (Endothelzelltyp) im Vergleich zu den parentalen Zellen. Diese Adhäsion konnte mit anti -VCAM-1 und mit IL-1 Antagonisten inhibiert werden. VCAM-1 ist der Ligand für das VLA-4 Integrin, das von B16-Zellen exprimiert wird. Für die erhöhte Adhäsion der B16-Zellen an Endothelzellen macht Mendoza die Bindung der Tumorzellen an MR verantwortlich, wodurch die Produktion von IL-1 anregt wird.
IL-1 wiederum induziert die VCAM-1 Expression auf Endothelzellen. VCAM-1 bindet dann an das Integrin VLA-4 der B16-Zelle und trägt zum Tumorarrest, zur Extravasation und letzten Endes zur Metastasierung bei [Mendoza L et al., 1998].
1.3 Glycomimetika
Chemische Synthesen ermöglichen die Vereinfachung und Variation natürlicher Vorbildstrukturen, die dann besser und billiger zugänglich werden. Dabei gelingt es häufig, gleichzeitig neben der strukturellen Vereinfachung wichtiger Moleküle, auch deren biologische Wirksamkeit und Spezifität zu erhöhen. Nach dem Vorbild natürlich vorkommender Verbindungen abgewandelte synthetische Kohlenhydratanaloga werden als Glycomimetika bezeichnet. Sie können strukturell oft recht weit von den natürlichen Vorbildern entfernt sein (s. Abb. 1.2- 5). Mit der bedeutenden Rolle von Kohlenhydraten in vielen biologischen
Prozessen, insbesondere die kohlenhydratvermittelten Erkennungsfunktionen- ergaben sich eine Vielzahl an Möglichkeiten zur therapeutischen Intervention in pathogenen Prozessen, aber die Entwicklung von Pharmaka auf Kohlenhydratbasis verlief bisher deutlich langsamer als vorhergesagt. Zum einen bereitet die Analytik von komplexen Oligosaccharidstrukturen, die durch die Mikroheterogenität der Glycostrukturen in vivo zusätzlich erschwert wird, große Probleme, zum anderen ist die chemische Synthese komplexer Kohlenhydrate aufgrund der Polyfunktionalität äußerst anspruchsvoll und lässt eine Vermeidung von Schutzgruppen-Techniken meistens nicht zu. Darüber hinaus besitzen Kohlenhydrate prinzipiell ungünstige pharmakologische Eigenschaften [Toone EJ, 1994; St Hilaire PM et al., 1994]. Diese Eigenschaften beinhalten die geringe Affinität zu ihren Proteinrezeptoren, die Inaktivität bei oraler Aufnahme und die geringen Halbwertzeiten in vivo durch den enzymatischen Abbau durch Glycosidasen. Es gelten daher folgende Anforderungen an Glycomimetika, die die Funktionen natürlicher Glycostrukturen imitieren, ohne die oben genannten Nachteile zu besitzen.
• Verbesserte biologische Aktivität; in der Regel durch Erhöhung der Affinität zu Proteinen bzw. Proteinrezeptoren.
• Erhöhte in vivo Stabilität, z. B. gegenüber enzymatischem Abbau
• Vereinfachte Strukturen durch vereinfachte Synthesestrategien, die eine schnelle und billige Zugänglichkeit.
• Verbesserte pharmakologische Eigenschaften, um z. B. die Verfügbarkeit am Wirkort zu verbessern oder die Applikationsform zu vereinfachen.
Geeignete Mimetika eröffnen somit neue Ansätze für eine erfolgreiche und gezielte Bekämpfung von bisher nur schlecht therapierbaren Krankheiten. Darüber hinaus können sie durch Modulation oder Inhibition spezifischer biologischer Vorgänge dazu beitragen, die oftmals unbekannten molekularbiologischen Grundlagen vieler Oligosaccharid- vermittelten Prozesse aufzuklären.
Die Struktur des Mimetikums ist von entscheidender Bedeutung für seine Funktion. Zwischen der als Vorbild dienenden Verbindung und dem entsprechenden Mimetikum muss hierbei nicht notwendigerweise eine große strukturelle Ähnlichkeit bestehen, entscheidend ist vielmehr eine enge
Funktionsverwandtschaft [Gruner SAW et al., 2002]. Als bevorzugter Ansatz hat sich bisher das rationale Design, wie das Molecular Modeling von Mimetika bewährt. Ausgehend von einer natürlichen Vorbildstruktur werden durch gezielte Modifikationen und Vereinfachungen neue Strukturen erhalten und durch geeignete Assays auf ihre biologische Wirkung untersucht. Die so erhaltenen Daten können dann bei einer weiteren Strukturoptimierung berücksichtigt werden.
Als Alternative haben sich auch bei der Entwicklung von Glycomimetika kombinatorische Ansätze als sinnvoll erwiesen. Vor allem in Fällen, in denen Kohlenhydrat-Rezeptorwechselwirkungen unklar sind und ein rationales Design folglich schwierig, konnten biologisch aktive Glycomimetika durch Entwicklung von Substanzbibliotheken erhalten werden [Martens CL et al., 1995]. Glycomimetika lassen sich, entsprechend ihres Funktionskonzepts in zwei Gruppen unterteilen [Sears P und Wong CHJ, 1998], obwohl eine strenge Zuordnung nicht immer möglich ist:
• Mimetika, die Lectin- bzw. Selectin-spezifische Oligosaccharidepitope nachahmen und somit eine direkte Intervention in biologische Prozesse durch kompetitive Bindung an spezifischen Rezeptoren ermöglichen.
• Mimetika, die durch Modulation bzw. Inhibition von Enzymen, die an der Biosynthese von Oligosaccharidstrukturen beteiligt sind, eine Intervention in biologische Prozesse ermöglichen.
Die Synthese von Gycomimetika ist ein wesentlicher Schritt auf dem Weg zu Wirkstoffen auf Kohlenhydratbasis, die sich prinzipiell als Therapeutika für Krankheiten eignen, die mit der Funktion von Kohlenhydraten kausal zusammenhängen. Eines der derzeit am intensivsten bearbeiteten Gebiete der Glycomimetika-Forschung ist die Synthese und Untersuchung von E-, P- und L- Selectinen-bindenden Strukturen auf Kohlenhydratbasis [Simanek EE et al., 1998], um Erkrankungen zu bekämpfen, die mit akuten und chronisch entzündliche Prozessen einhergehen, wie Rheumatismus, Psoriasis, oder Dermatitis.
Die natürliche Oligosacchariddeterminante, die von diesen Membranproteinen erkannt wird, ist das Sialyl-Lex-Tetrasaccharid (s. Abb. 1.2-2) [Kiefel MJ und von Itzstein M, 2002]. Es gibt eine Reihe von Ansätzen, die die Inhibierung des
initialen kohlenhydrateabhängigen Adhäsionsschritts am Endothel durch hochaffine sLex-Mimetika anstreben soll, jedoch ist bis heute der große Duchbruch nicht gelungen. Es gibt schon eine Reihe von Mono- und Disaccharid Mimetika, die virale und bakterielle Infektionen bekämpfen. Zum Beispiel die Neuraminidase-Hemmer Zanamivir® (4) und Oseltamivir ® (5) [von Itzstein M et al., 1993, Kim CU et al., 1997]. (s. Abb.1.3-1). Sie imitieren das Glycosyl- Kation- Intermediat 2, das während der Hydrolyse der terminalen Sialinsäure entsteht und hemmen die Enzymfunktion und damit die Anbindung des Virus an die Wirtszelle.
Abb. 1.3-1 Die Neuraminidase des Influenza Virus katalysiert die Hydrolyse der terminalen Sialinsäure und ermöglicht somit den Transport des Virus in den Mucus des Atemtraktes [Vogel P 2001].
Multivalente Glycomimetika
Unter Berücksichtigung der Multivalenz von Kohlenhydrat-Protein-Wechselwirkung wurden zahlreiche Glycomimetika als multivalente Glycokonjugatstrukturen synthetisiert, welche möglichst die natürlichen, mutivalenten Glycokonjugatmoleküle der Glycocalix imitieren und einen Multivalenzeffekt
hervorrufen sollen. Dabei ist es ohne Kenntnis der genauen Rezeptorstruktur schwierig, die Stereochemie der multivalenten Liganden genau vorherzusagen und die einzelnen Liganden in einem Ligand-Cluster strukturell optimal zu organisieren. Meistens verlässt man sich auf die Variation der Cluster-Strukturen, z. B. bezüglich der Länge verwendeter Spacer oder der Zahl der Zuckerbausteine, um zu möglichst potenten Verbindungen zu gelangen. Ein höherer Multivalenzgrad ist aber nicht unbedingt mit höherer „Wirkung“ oder mit höherer Affinität gleichzusetzen [Lundquist JJ und Toone EJ, 2002]. Der Cluster-oder Multivalenz Effekt setzt sich aus vielen anderen Mechanismen zusammen wie die intramolekulare oder Chelat-Bindung, die intermolekulare aggregative Bindung und die sterische Stabilisierung. Die Wahl der richtigen Kohlenhydratbausteine, in der richtigen räumlichen Orientierung, erhöht die Bindungsaffinität zum Rezeptor.
Kleinere aber strukturell wohldefinierte Glycocluster besitzen den Vorteil, dass sich ihre biologische Aktivität auf ihre strukturelle Basis zurückführen lassen (s.
Abb. 1.2-5).
1.4 Rationales Design mittels Molecular Modeling
1.4.1 Einleitung
Günstige Vorraussetzungen für ein rationales Drug Design ist die Kenntnis der tertiären Struktur des Proteins und idealerweise die Kristallstruktur mit komplex gebundenem Liganden, um die wesentlichen Wechselwirkungen auf atomarer Ebene zu identifizieren und zu optimieren. Die Suche nach einem potenten
„Hemagglutinin-Inhibitor“ mittels Informationen aus der Kristallstrukturanalyse ergab bis dato nicht den gewünschten Erfolg. Mittlerweile ist es jedoch, u.a. durch Einsatz von Computermethoden gelungen, einen Wirkstoff auf Kohlenhydratbasis zu entwickeln, der selektiv die Bindungstaschen der Neuraminidase blockiert [von Itzstein M et al., 1993; Taylor NR und von Itzstein M, 1996] (s. S.24, Abb. 1.3-1).
Ausgangsbasis für ein rationales Drug Design war auch hier die Aufklärung der dreidimensionalen Struktur der Neuraminidase und die Entschlüsselung der Wechselwirkung durch Molecular Modeling Methoden [Colman PM et al., 1987].
Auch im Bereich der Krebsentstehung spielen die Wechselwirkungen zwischen
Kohlenhydraten und Proteinen eine wichtige Rolle, daher ist die Aufklärung der Erkennungsprozesse zwischen Oligosacchariden und Lectinen einerseits, Antikörpern oder Enzymen andererseits von zentraler Bedeutung auf diesem aktuellen Forschungsgebiet [Sharon N, 1998, Gabius HJ, 1997, Dwek RA, 1996].
Leider sind nur wenige Kristallstrukturen zuckerkennender Proteine bekannt, weil die Bindungsaffinität zwischen Oligosacchariden und Proteinen sehr schwach ist und folglich die Proteine mit LIgand für eine Kristallstrukturanalyse schwer zugänglich sind.
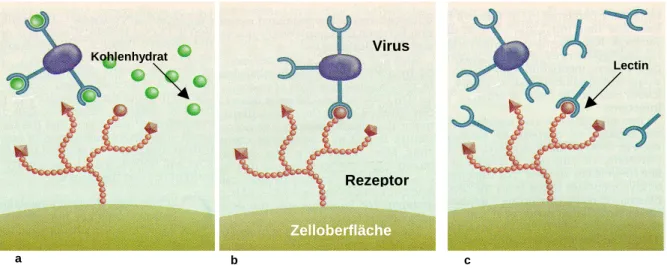
Abb. 1.4.-1 a. Virus blockiert durch hochaffine Kohlenhydrate, b. Virus-Zellrezeptor-Bindung c. Virus-Bindung blockiert durch hochaffine Lectine
Außerdem liefern Kristallstrukturanalysen nur ein statisches Bild der Moleküle, die das dynamische Verhalten (Konformationsänderungen, intermolekulare Stöße) vieler biologischer Funktionen nicht widerspiegeln. Diese Informationen lassen sich durch NMR-Methoden oder Molecular Dynamics (MD)-Simulations erhalten.
MD-Simulationen finden daher zur Simulation von Biomolekülen eine breite Anwendung [van Gunsteren WF und Berendsen HJC, 1990; Levitt M und Sharon R, 1988; Siebert HC et al., 1996; Böhm HJ et al.,1996].
1.4.2 Molecular Modeling
Die Simulation molekularer Strukturen vom Pharmakon, Rezeptor und ihrer Komplexe ist ein beliebtes Feld in Drug Design. Diese Vorgehensweise zielt darauf ab Struktur-Aktivitätsbeziehungen auf dem atomaren Level aufzuklären.
Zelloberfläche Virus
Rezeptor
Lectin Kohlenhydrat
a b c
Ein verbessertes Verständnis dieser Beziehungen kann dann als Leitfaden für neue Moleküle mit spezifischen pharmakologischen Eigenschaften dienen. Die oftmals unbekannte Rezeptorstruktur führte dazu, große Substanzbibliotheken mit multivalenten Strukturen aufzubauen, in der Hoffnung hochaffine Liganden zu generieren.
Molecular Dynamics Simulation (MD)
Bei der Protein-Ligand-Wechselwirkung spielt die Flexibilität beider Partner eine wichtige Rolle. Vorraussetzung für die Bindung des Liganden ist, dass er eine Konformation einnehmen kann, die der Gestalt der Proteinbindetasche entspricht.
Umgekehrt sind auch Proteine in gewissem Umfang flexibel. Zum Beispiel können die an der Oberfläche befindliche Seitenketten unterschiedliche Konformationen einnehmen oder ganze Domänen können sich relativ zueinander bewegen.
Die MD ist ein theoretisches Verfahren zur Beschreibung dieser Effekte. Das Prinzip der MD besteht darin, die Bewegung einer endlichen Zahl von Atomen bzw. Molekülen (10-105) unter der Einwirkung des gewählten Kraftfelds zu verfolgen. Bei der Rechnung wird angenommen, dass die Wechselwirkung zwischen den Teilchen den Gesetzen der klassischen Mechanik folgt. Die Newtonschen Bewegungsgleichungen werden hierbei mit einem numerischen Verfahren schrittweise für alle Teilchen gleichzeitig gelöst. Meist wird angenommen, dass die zwischen zwei Teilchen wirkende Kraft nicht von weiteren Teilchen beeinflusst wird.
Logische Operationen mit Molekülvolumina
Welche Hinweise sind aus solchen Berechnungen zu entnehmen? Als Arbeitshypothese ist anzunehmen, dass ein Molekül nur dann an einen Rezeptor gebunden wird, wenn seine Größe den dort maximal verfügbaren Platz nicht überschreitet. Um sich ein Bild darüber zu verschaffen, betrachtet man das gemeinsame Volumen aller Derivate. Eine mögliche Erklärung für die fehlende Aktivität eines Moleküls kann sein, dass es Bereiche in der Bindetasche besetzten müsste, die bereits vom Protein eingenommen werden. Volumenvergleiche zwischen aktiven und inaktiven Derivaten liefern Hinweise auf die mögliche Gestalt der Rezeptortasche. Man muss also herausfinden, welche Gruppen vom
Ligand und Rezeptor einander entsprechen und so den Pharmacophor definieren.
Es wird zudem ein Verfahren benötigt, das die Moleküle in Konformationen bringt, in denen äquivalente Gruppen des Pharmacophors im Raum analog orientiert werden.
Pharmacophorvergleiche
Active Analog Approach ist ein Verfahren, dass eine Konformationsanalyse mit der Suche nach dem Pharmacophor verbindet.
Wirkstoffe wechselwirken, wie oben schon erwähnt, mit Rezeptoren auf sehr spezifische Art und Weise. Deshalb ist es durchaus möglich, dass nur Teilstrukturen der Leitverbindung an relevanten Wechselwirkungen beteiligt sind.
Die relevanten Gruppen eines Moleküls, die mit einem Rezeptor wechselwirken und für die Aktivität verantwortlich sind, werden als Pharmacophor bezeichnet.
Das Pharmacophor ist damit für die Initiierung des biologischen Effekts verantwortlich. In Kombination mit einem molekülgraphischen Vorgehen, wie dem Molecular Modeling können Pharmacophor-Modelle gezeichnet werden, die die charakteristischen Eigenschaften des Moleküls (Winkel und Abstände der Erkennungseinheiten) geometrisch darstellen. Dieser Schritt basiert auf 2D- Struktur-Aktivitätsstudien, in der Atome und/oder funktionelle Gruppen der Leitstruktur schrittweise verändert und dann diese Veränderungen in einer biologischen Antwort gemessen werden. Diese Daten lassen nicht nur Rückschlüsse auf die Rezeptorstruktur zu, sondern dienen auch als Plattform für die Entwicklung von maßgeschneiderten Mimetika.
Als erstes muss man allen Molekülen eines Datensatzes einen Pharmacophor zuweisen. Es ist zu definieren, welche Gruppen zueinander äquivalent sein sollen.
Dann führt man für das erste Moleküls des Datensatzes eine systematische Konformationssuche durch. Während der Suche bestimmt man in jeder eingestellten Geometrie die Abstände zwischen den funktionellen Gruppen des Pharmacophors. Diese Abstände werden gespeichert. Aus den Datensätzen ergeben sich die möglichen Bindungsgeometrien der pharmacophoren Gruppen in den Liganden [Marshall GR et al., 1979].
1.5 Drug Targeting- Konzept
1.5.1 Definition Drug Targeting
Drug Targeting Strategien können in zwei Kategorien eingeteilt werden: „Pro Drug-Targeting“ und „Carrier vermitteltes Targeting“. Der Pro Drug wird erst am Wirkort in die aktive Form umgewandelt. Beim Carrier vermitteltem Targeting unterscheidet man zwischen „aktivem“ „und passivem“ Targeting. Wird der Ligand am Wirkort vom Rezeptor erkannt bezeichnet man diesen Mechanismus als
„aktiv“, während beim passivem Targeting die physikochemischen Eigenschaften des Drug (Wirkstoff)/Carrier-Komplexes zu einer Internalisierung und folglich einer selektiven Akkumulation in den Zielzellen führt und dabei die anderen Zellen, die durch eine andere Beschaffenheit der Zellmembran den Komplex nicht aufnehmen können, ausschließt [Wadhwa MS und Rice KG, 1995]. Für eine erfolgreiche in vivo Therapie muss die Identifizierung des Wirkortes, die Endozytose und die Internalisierung des Wirkstoffes in die Zielzelle gewährleistet sein [Ghose TI und Blair AH, 1987; Pimm MV 1988, Koppel GA 1990; Vaickus L und Foon KA, 1991; Kosmas C et al., 1993; Weigand M et al., 2001].
Gezielte Abgabe des Wirkstoffes beinhaltet zudem auch Design und Synthese von Carriern mit Liganden, die als Drug/Carrier-Komplex vom Rezeptor erkannt und internalisiert werden. Monoklonale Antikörper (mAb), Albumin, Transferrin, Insulin, epidermale Wachstumsfaktoren und Biotin sind Beispiele für Biomoleküle, die einem solchen Drug Targeting Konzept Verwendung finden. Die Erwartungen, dass mAb diese Parameter besitzen würden und als programmierbare „magic bullets“ (Ehrlich P, 1906) dienen könnten, blieben unerfüllt. Beim Einsatz von mAbs wurde die heterogene Expression von Tumorantigenen auf den Zelloberflächen der Tumorzellen nicht berücksichtigt (Hoch-und /oder Runterregulierung), die zur Selektion bestimmter Tumorzellen führt.
1.5.2 Definition Glycotargeting
Das Targeting Potential mit Kohlenhydraten gewinnt immer mehr an Bedeutung.
Kohlenhydrate sind wegen ihres geringen Molekulargewichts attraktive Drug Targeting Kandidaten. Ihre strukturelle Diversität kombiniert mit dem Potential eine große Anzahl von Zielrezeptoren zu adressieren und ihre Möglichkeit der Internalisierung über rezeptorvermittelter Endocytose befürworten das Glycotargeting Konzept [Shen TY 1987; Monsigny M et al., 1988a; Karlsson KA, 1991; Lerchen HG et al., 2000]. Kohlenhydrate werden an Zellen gebunden und über membrangebundene Lectine internalisiert. Die Kohlenhydrat-Lectin- Interaktion ist beschrieben unter 1.2.3. Biologisch aktive Oligosaccharide sind meistens Glycokonjugate (Glykolipide, -proteine), die die Bioverfügbarkeit und die Serum-Halbwertszeit kontrollieren und Zell-Zell-/Zell-ECM-Interaktionen vermitteln. Es sind schon eine Reihe von zellmembrangebundenen Lectinen bekannt, die zusammen mit ihren Liganden endozytiert werden und die Kohlenhydratliganden den Lysosomen zuführen [Ashwell G und Harford J, 1982;
Wileman T et al., 1985]. Da Lectine terminale Kohlenhydrate erkennen und binden können, läuft die Endozytose relativ unbeeinflusst von der Größe und Komposition der Aglykone ab. Folglich können Kohlenhydratliganden an Wirkstoffe gekoppelt werden, um sie als trojanische Pferde in die Zielzelle einzuschleusen.
1.5.3 Endogene Lectine als Drug Target
Ashwell und seine Mitarbeiter haben das erste endogene Lectin entdeckt, als sie die Clearance von alten Plasmaglycoproteinen untersuchten. Ausgediente Plasmaglycoproteine werden von Exoglycosidasen durch die Entfernung des terminalen Sialinsäurerests gekennzeichnet. Dadurch tragen sie Galactosereste, die durch die Bindung an Galactose-spezifischen Rezeptoren der Leber- Hepatozyten eliminiert werden. Dieses Leberlectin ist heute als Ashwell-Rezeptor bzw. Asialoglycoproteinrezeptor (ASGP-R) (s.Abb. 1.2-3 Gr.II) bekannt.
ASGP-R bindet und internalisiert die meisten Galactose tragenden Liganden, doch konnte Lee zeigen, dass die Bindungsaffinität stark von der Struktur der Galactose-Liganden abhängt [Lee YC et al., 1983]. Mono- und divalente
Galactoside hatten Dissoziationskonstanten im millimolarem Bereich und sind somit irrelevant für ein Drug Targeting Konzept, wohingegen Liganden, die einen Cluster von drei Galactose-Resten tragen, die Dissoziationskonstante iin den nanomolaren Bereich erhöhen konnten. Diese Ergebnisse korrelierten gut mit der Struktur des ASGP-R, denn der Rezeptor besitzt drei Untereinheiten mit jeweils einer Galactose-Bindungsstelle [Rice KG et al., 1990]. Andere membranständige Lectine aus der Familie der Galectine repräsentieren weitere potentielle Kandidaten für ein Drug-Targeting-Konzept. Sie erkennen hauptsächlich N- acetyllactosamin tragende Oligosaccharide und spielen wie schon in Kapitel 1.2.4 erwähnt eine wichtige Rolle in Zell-Zell und Zell-ECM-Interaktionen. Außerdem werden individuelle Mitglieder der Galectin-Familie gewebsspezifisch exprimiert und eröffnen damit die Möglichkeit einer Entwicklung von selektiv bindenden Kohlenhydrat-Liganden zur Erhöhung der Drug Targeting Effizienz [Barondes SH et al., 1994]. Die oben beschriebenen Fakten und Überlegungen zum Glycotargeting führten zur Entwicklung von spezifischen Markern für Lectine, wie zum Beispiel Neoglycoproteine, Neoglycopeptide und glycosylierte Polymere.
Neoglycoproteine sind synthetische Konstrukte aus Mono-, Di- oder Oligosacchariden und kovalent gebundenen Proteinen, wie BSA (Bovine Serum Albumine) [Stowell CP und Lee YC, 1980; Lee YC und Lee RT, 1994]. Die Marker können aufgrund ihrer hohen Bindungsspezifität gegen tumorspezifische Glycokonjugate oder Lectinrezeptoren eingesetzt werden. Sie dienen als Träger für Cytotoxine, Chemotherapeutika und können durch Bindung von Radioisotopen oder Fluoreszenzfarbstoffen zum (Radio-) Imaging verwendet werden.
1.6 Anticancer Vakzine
Kohlenhydrat-Antigene, die den größten Teil der Zelloberflächen Antigene ausmachen, sind prominente Kandidaten für die Krebsimmuntherapie, denn sie werden von Antikörpern erkannt und die Immunantwort gegen Kohlenhydrate ist hauptsächlich auf eine Antikörper-Reaktion zurückzuführen. Sie bietet die Möglichkeit, den Fokus auf die Induktion einer Antikörper-Antwort zu legen, um so den komplexen Vorgang einer T-Zellen Immunität zu umgehen. Tumorzellen haben wie schon in Kapitel 1.2.4 erwähnt häufig veränderte
![Abb. 1.3-1 Die Neuraminidase des Influenza Virus katalysiert die Hydrolyse der terminalen Sialinsäure und ermöglicht somit den Transport des Virus in den Mucus des Atemtraktes [Vogel P 2001]](https://thumb-eu.123doks.com/thumbv2/1library_info/5471785.1684150/28.892.171.684.417.921/neuraminidase-influenza-katalysiert-hydrolyse-terminalen-sialinsäure-ermöglicht-atemtraktes.webp)