NEUROCHIRURGIE
Direktor: Prof. Dr. med. Alexander Brawanski
DER MEDIZINISCHEN FAKULTÄT DER UNIVERSITÄT REGENSBURG
Mögliche Gründe für eine Unterauslastung der Tiefen Hirnstimulation (THS) als Therapieoption
bei Morbus Parkinson:
eine repräsentative Umfrage
Inaugural - Dissertation
zur Erlangung des Doktorgrades der Medizin
der
Fakultät für Medizin der Universität Regensburg
vorgelegt von Josef Mauerer
2013
NEUROCHIRURGIE
Direktor: Prof. Dr. med. Alexander Brawanski
DER MEDIZINISCHEN FAKULTÄT DER UNIVERSITÄT REGENSBURG
Mögliche Gründe für eine Unterauslastung der Tiefen Hirnstimulation (THS) als Therapieoption
bei Morbus Parkinson:
eine repräsentative Umfrage
Inaugural - Dissertation
zur Erlangung des Doktorgrades der Medizin
der
Fakultät für Medizin der Universität Regensburg
vorgelegt von Josef Mauerer
2013
Dekan: Prof. Dr. Dr. Torsten E. Reichert 1. Berichterstatter: PD Dr. Jürgen Schlaier
2. Berichterstatter: Prof. Dr. Ulrich Bogdahn Tag der mündlichen Prüfung: 20.05.2014
Inhaltsverzeichnis
Inhaltsverzeichnis ... 1
1. Einführung ... 3
1.1 Morbus Parkinson ... 3
1.1.1 Epidemiologie ... 3
1.1.2 Pathogenese ... 3
1.1.3 Klinik ... 4
1.1.4 Diagnostik ... 5
1.1.5 Therapie ... 6
1.2 Tiefe Hirnstimulation bei Morbus Parkinson ... 8
1.2.1 Indikation ... 8
1.2.2 Operative Vorgehensweise ... 9
1.2.3 Komplikationen ... 10
1.2.4 Effekte der tiefen Hirnstimulation ... 11
1.3 Zielsetzung ... 11
2. Methodik ... 12
2.1 Ärztefragebogen ... 12
2.1.1 Zahl der pro Praxis behandelten Patienten ... 12
2.1.2 Kenntnis der THS als Therapieoption bei Morbus Parkinson ... 12
2.1.3 Kenntnis der Auswahlkriterien ... 15
2.1.4 Bedenken gegenüber der THS ... 15
2.1.5 Erfahrung mit Patienten mit THS ... 15
2.1.6 Schätzung von Komplikationsraten ... 16
2.2 Patientenfragebogen ... 16
2.2.1 Epidemiologische Daten ... 16
2.2.2 Kenntnis der THS ... 16
2.2.3 THS als persönliche Therapieoption ... 19
2.2.4 Bedenken gegenüber der THS ... 19
2.2.5 Einschätzung von Komplikation mit bleibenden Schäden ... 19
2.2.6 Zufriedenheit mit der aktuellen Therapie ... 19
2.2.7 Fluktuationen der Medikation... 19
3. Ergebnisse... 19
3.1 Auswertung der Ärztefragebögen... 20
3.1.1 Zahl der pro Praxis behandelten Patienten ... 20
3.1.2 Kenntnis der THS als Therapieoption bei Morbus Parkinson ... 20
3.1.3 Kenntnis der Auswahlkriterien ... 20
3.1.4 Bedenken gegenüber der THS ... 22
3.1.5 Erfahrung mit Patienten mit THS ... 22
3.1.6 Schätzung von Komplikationsraten ... 23
3.2 Auswertung der Patientenfragebögen ... 24
3.2.1 Epidemiologische Daten ... 24
3.2.2 Kenntnis der THS ... 24
3.2.3 THS als persönliche Therapieoption ... 25
3.2.4 Bedenken gegenüber der THS ... 25
3.2.5 Einschätzung von Komplikation mit bleibenden Schäden ... 26
3.2.6 Zufriedenheit mit der aktuellen Therapie ... 26
3.2.7 Fluktuationen der Medikation... 26
4. Diskussion ... 27
Inhaltsverzeichnis
5. Zusammenfassung ... 31
6. Schlussfolgerungen ... 32
7. Literaturverzeichnis ... 34
8. Anhang ... 39
9. Lebenslauf ... 40
10. Danksagung ... 41
1. Einführung
1.1 Morbus Parkinson
Das Krankheitsbild des Morbus Parkinson wurde erstmals 1817 von James Parkinson in der Monographie „An Essay on the Shaking Palsy“
beschrieben1. Darin werden sechs Fälle dargestellt, die die folgenden pathognomischen Symptome aufweisen:
„Involuntary tremulous motion, with lessened muscular power, in parts not in action and even when supported; with a propensity to bend the trunk forward, and to pass from a walking to a running pace: the senses and intellects being uninjured.“1
Als Anerkennung sprach Jean Martin Charcot 1872 erstmals von der Parkinson-Krankheit (maladie de Parkinson)2.
1.1.1 Epidemiologie
Die Prävalenz wird europaweit auf 108-257/100.000 Einwohner und die Inzidenz auf 11-19/100.000 geschätzt3. In Deutschland stellt der idiopathische Morbus Parkinson mit einer Prävalenz von 100-200/100.000 Einwohner eine der häufigsten neurologischen Krankheiten dar4. Im Bereich der über 65-jährigen steigt die Anzahl der Betroffenen auf 1.800/100.000 Einwohner.4 Durch die demographische Entwicklung in Deutschland ist in Zukunft deshalb von einer weiter steigenden Prävalenz auszugehen4.
1.1.2 Pathogenese
Die meisten Parkinson-Syndrome treten sporadisch auf. Bisher konnte man nur wenige Einflussfaktoren nachweisen, sodass als Hauptrisikofaktor weiterhin das Alter gilt5. Zahlreiche genetische Komponenten spielen für die familiär gehäufte Parkinson-Syndrome eine wichtige Rolle, unter anderem Mutationen der leucine rich repeat kinase 2 (LRRK-2), α-Synuclein, sowie die heterozygote loss-of-function-Mutation der Glucocerebrosidase (GBA)6. Beim Morbus Parkinson gehen typischerweise melaninhaltige Neurone der Substantia nigra zugrunde, was zu einem Dopaminmangel und einer
Einführung
Dysbalance der Transmitter führt7. Heute geht man jedoch von einer Multisystemdegeneration aus, die zahlreiche weitere Strukturen des Gehirns betrifft8. Mikroskopisch lassen sich in den degenerierten Nervenzellen kugelförmige Lewy-Körperchen nachweisen. Diese sind charakteristisch für den idiopathischen Morbus Parkinson, treten aber auch bei Gesunden auf und könnten somit ein Frühzeichen der Krankheit darstellen9. Als Hauptbestandteile enthalten sie die Proteine Ubiquitin und α-Synuclein9. Letzteres wird mit der Entstehung einer familiären Form des Parkinsons in Verbindung gebracht9.
Nach einem Untergang von etwa 60% der dopaminergen Neuronen treten erste klinische Zeichen eines Parkinson-Syndroms auf7. Obwohl es beim physiologischen Altern ebenfalls zu einem Abfall des Dopaminspiegels durch Zellverlust kommt, wird die kritische Schwelle bei der aktuellen Lebenserwartung jedoch nicht unterschritten7.
1.1.3 Klinik
An idiopathischen Morbus Parkinson erkrankte Patienten zeigen in der Initialphase eine schleichende Verschlechterung ihrer motorischen Fähigkeiten6. Erste Symptome können eine einseitige Anwinkelung eines Arms mit verminderten Pendelbewegungen beim Gehen, Verschlechterung der Geschicklichkeit, Müdigkeit oder monotone, ausdruckslose Gesichtszüge sein6. Diese Anzeichen werden nur selten vom Patienten wahrgenommen6. So vergehen nicht selten mehrere Jahre vom Beginn der ersten Symptome bis zur Diagnosefindung6.
Nach einseitigem Beginn dehnt sich die Erkrankung weiter auf die Gegenseite aus9. Zu den Kardinalssymptomen des Morbus Parkinson zählen schließlich: Ruhetremor, Rigor, Akinese und posturale Instabilität4.
In ca. 70% der Fälle tritt der Ruhetremor bereits in der initialen Phase auf, zumeist asymmetrisch an einer Hand und erst im weiteren Verlauf an Füßen, Kinn und Kopf9. Bei willkürlichen Bewegungen nimmt der Tremor hingegen ab oder bleibt gänzlich aus9.
Rigor beschreibt eine Tonuserhöhung der Muskulatur, die bei jeder Bewegung und auch in Ruhe vorhanden ist9. Bei der passiven Bewegung der
Gelenke findet sich wachsartiger Widerstand und das sog.
Zahnradphänomen – ein durch Ruhetremor verursachtes, ruckartiges Nachlassen des Muskelwiderstandes9.
Den vollständigen Bewegungsverlust bezeichnet man als Akinese. Dieser tritt normalerweise erst in der Spätphase der Erkrankung auf7. Zunächst kommt es jedoch zu verlangsamten, bradykinetischen Bewegungsabläufen, und zu hypokinetisch reduzierten Bewegungsamplituden7. In der Praxis werden die drei Begriffe jedoch häufig synonym verwendet7.
Die posturale Instabilität tritt meist später auf und geht mit dem Verlust das Gleichgewicht zu halten und vermehrter Fallneigung einher9. Dies wird wahrscheinlich als Folge von Akinese und Rigor sowie verminderter Stellreflexe verursacht9.
Beim idiopathischen Morbus Parkinson lässt sich außerdem bei 70%-100%
der Betroffenen eine Einschränkung der Riechfunktion feststellen10. Dies könnte in Zukunft vermutlich bei der Frühdiagnostik und zur Differentialdiagnose beitragen10.
Als weitere Symptome können unter anderem Demenz, Depression und Störungen des vegetativen Nervensystems auftreten6.
1.1.4 Diagnostik
Das idiopathische Parkinson Syndrom wird durch Anamneseerhebung und Klinik diagnostiziert. Der Patient muss eine Bradykinese und mindestens eines der anderen Kardinalssymptome aufweisen4. Bestimmte Ereignisse in der Anamnese können ein symptomatisches Parkinson Syndrom von der idiopathischen Form abgrenzen. Die Einnahme von Neuroleptika während der Erstmanifestation, gehäufte Schädel-Hirn-Traumata, zerebrale Tumore oder seltene Intoxikationen wie beispielsweise Kohlenmonoxid- oder Manganvergiftungen können die Symptome eines Morbus Parkinson vortäuschen4.
Um ein atypisches Parkinson Syndrom ausschließen zu können, sollten Warnsymptome wie unter anderem ein schnelles Fortschreiten der Krankheit, frühzeitiges Auftreten einer posturalen Instabilität, fehlendes
Einführung
Ansprechen auf hohe Dosen L-Dopa, Störungen der Okulomotorik oder zerebelläre Störungen berücksichtigt werden4.
Für die Diagnosesicherung eines idiopathischen Morbus Parkinsons gibt es supportive Kriterien: Ein asymmetrischer Beginn, Ruhetremor, Ansprechen auf L-Dopa und ein Fehlen von zusätzlichen Symptomen mit schwierigem Verlauf für mindestens zehn Jahre4. Treffen mindestens drei der Kriterien zu, kann von einem klinisch sicheren idiopathischen Parkinson Syndrom ausgegangen werden4.
Ein familiärer Morbus Parkinson kann neben der Familienanamnese mittels Gentests nachgewiesen werden4.
Zusätzlich zur Klinik stehen pharmakologische Tests, beispielsweise der L- Dopa-Test, und nuklearmedizinische Verfahren zur Verfügung4. Eine klinische Stadieneinteilung ist nach Hoehn und Yahr11 etabliert (Tab. 1). Der UPDRS (Unified Parkinson Disease Rating Scale)4 (Kap. 8) misst das Ausmaß der Behinderung.
Stadium Beschreibung
I Einseitige Symptomatik mit geringer oder keiner funktionellen Beeinträchtigung
II Beidseitige Symptomatik ohne Beeinträchtigung des Gleichgewichts III Posturale Instabilität
IV Vollbild, Patient braucht Unterstützung im Alltag V Beschränkung auf Bett oder Rollstuhl
Tab. 1: Stadieneinteilung des Morbus Parkinson nach Hoehn und Yahr11
1.1.5 Therapie
Obwohl der Morbus Parkinson noch zu den unheilbaren Krankheiten zählt, lässt sich durch eine suffiziente Therapie die Lebensqualität deutlich steigern6. Therapeutische Basis bilden vor allem medikamentöse Präparate und ergänzende nicht-medikamentöse symptomatische Maßnahmen einschließlich Hilfsgeräten und Physiotherapie4,12. Im weiteren Verlauf steht mit der tiefen Hirnstimulation (Kap. 1.2) außerdem ein chirurgisches Verfahren zur Verfügung4.
Die wirksamste medikamentöse Therapieoption stellt L-Dopa, oder auch als Levodopa bezeichnet, in Verbindung mit einem peripheren Dopa Decarboxylase-Inhibitor dar6. Im Gegensatz zu Dopamin, kann diese Vorstufe im Stoffwechsel die Blut-Hirn-Schranke durchdringen und dem Dopaminmangel im Striatum entgegenwirken12. So verbessern sich Bradykinese, Rigor und Gangbild meist in den ersten drei Monaten13, der Tremor hingegen persistiert oft länger6. L-Dopa ist die Initialtherapie vor allem für Patienten über dem 70. (biologischen) Lebensjahr bzw. für multimorbide Patienten.4
Die Initialtherapie für jüngere Patienten (unter 70. Jahren) ohne erhebliche Komorbidität bilden die Dopaminagonisten4. Sie können als Monotherapie oder in Kombination mit L-Dopa verabreicht werden. Eine Monotherapie führt seltener zu Dyskinesien und wearing-off-Effekten, in Kombination lässt sich L-Dopa einsparen und eine Verminderung der L-Dopa bedingten Motorfluktuationen beobachten14.
MAO-B (Monoamino-Oxidase-B)-Hemmer inhibieren den Abbau von Dopamin und steigern dadurch die Konzentration im synaptischen Spalt12. Des Weiteren wird seit längerem eine neuroprotektive Wirkung diskutiert, beweisende Studien stehen jedoch noch aus12.
COMT (Catechol-O-Methyltransferase)-Hemmer verhindern den Abbau von L-Dopa in der Peripherie und erhöhen dadurch die Bioverfügbarkeit12. Sie sind zur Behandlung von Motorfluktuationen beim fortgeschrittenen Parkinson-Syndrom zugelassen4.
NMDA (N-Methyl-D-Asparat)-Antagonisten, wie z.B. Amantadin, sind Glutamat-Antagonisten und können L-Dopa induzierte Dyskinesien reduzieren15. Amantadine können in jeder Phase eingesetzt werden, da sie L-Dopa einsparen können und kein wearing-off-Effekt zeigen, d. h. kein Wirkungsverlust eintritt und somit keine Dosissteigerung nötig ist12.
Anticholinergika bilden die älteste Form der Medikation. Sie gleichen einen durch Dopaminmangel bedingten cholinergen Überschuss im Striatum aus12. Der Einsatz ist auf Grund von zahlreichen Nebenwirkungen beschränkt und wird daher nur selten beim L-Dopa-resistenten Ruhetremor angewandt4. Ergänzend zur medikamentösen Therapie sollte eine Ernährungsanpassung erfolgen. Diese ist vor allem bei L-Dopa-Therapie wichtig, da L-Dopa nicht
Einführung
unmittelbar vor oder nach dem Essen eingenommen werden sollte um die enterale Resorption nicht zu stören12. Insbesondere behindert eine proteinreiche Nahrung die L-Dopa-Aufnahme. Jedoch sollte im Allgemeinen vor einer proteinarmen Diät abgeraten werden und stattdessen die Medikamenteneinnahme eine halbe Stunde vor bzw. eineinhalb Stunden nach dem Essen erfolgen12.
1.2 Tiefe Hirnstimulation bei Morbus Parkinson
1.2.1 Indikation
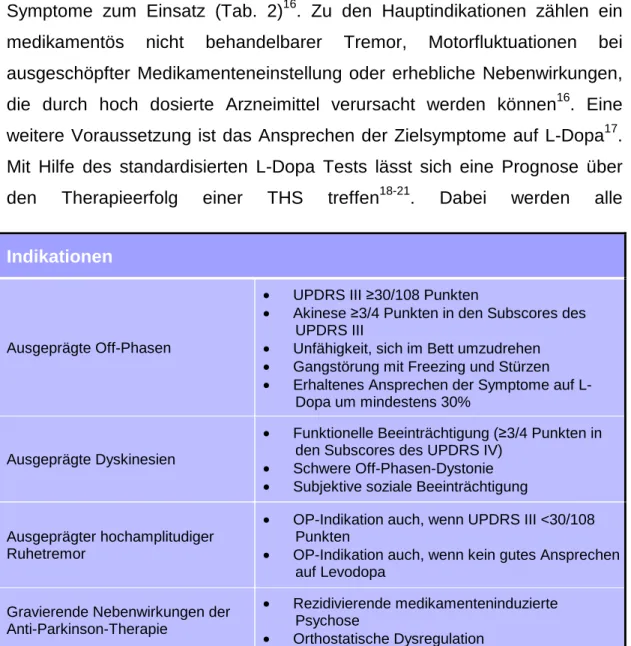
Die THS kommt beim Morbus Parkinson v. a. zur Therapie der motorischen Symptome zum Einsatz (Tab. 2)16. Zu den Hauptindikationen zählen ein medikamentös nicht behandelbarer Tremor, Motorfluktuationen bei ausgeschöpfter Medikamenteneinstellung oder erhebliche Nebenwirkungen, die durch hoch dosierte Arzneimittel verursacht werden können16. Eine weitere Voraussetzung ist das Ansprechen der Zielsymptome auf L-Dopa17. Mit Hilfe des standardisierten L-Dopa Tests lässt sich eine Prognose über den Therapieerfolg einer THS treffen18-21. Dabei werden alle
Tab. 2: Indikationen der THS nach Herzog und Deuschl16
Indikationen
Ausgeprägte Off-Phasen
• UPDRS III ≥30/108 Punkten
• Akinese ≥3/4 Punkten in den Subscores des UPDRS III
• Unfähigkeit, sich im Bett umzudrehen
• Gangstörung mit Freezing und Stürzen
• Erhaltenes Ansprechen der Symptome auf L- Dopa um mindestens 30%
Ausgeprägte Dyskinesien
• Funktionelle Beeinträchtigung (≥3/4 Punkten in den Subscores des UPDRS IV)
• Schwere Off-Phasen-Dystonie
• Subjektive soziale Beeinträchtigung
Ausgeprägter hochamplitudiger Ruhetremor
• OP-Indikation auch, wenn UPDRS III <30/108 Punkten
• OP-Indikation auch, wenn kein gutes Ansprechen auf Levodopa
Gravierende Nebenwirkungen der Anti-Parkinson-Therapie
• Rezidivierende medikamenteninduzierte Psychose
• Orthostatische Dysregulation
Parkinsonmedikamente vorübergehend abgesetzt, was eine vollständige Demaskierung der Symptomatik provoziert18,19. Das Ansprechen auf eine erneute Gabe einer schnellwirksamen L-Dopa-Dosis korreliert gut mit der Wirkung der THS18. Eine Ausnahme bildet in der Regel der Tremor, der sich trotz medikamentöser Resistenz in den meisten Fällen bessert17.
Zu den Kontraindikationen zählen Demenz, psychiatrische oder schwerwiegende internistische Erkrankungen sowie chirurgisch problematische Faktoren wie eine ausgeprägte Hirnatrophie oder eine Blutungsneigung (Tab. 3)16.
Kontraindikationen
Allgemeine Kontraindikationen
• Schwere Hirnatrophie im MRT
• Schwere zerebrale Makroangiopathie (nicht behandelbar)
• Schwere internistische Allgemeinerkrankungen
• Dauerhafte Immunsuppression
• Biologisches Alter über 75 Jahre
Neuropsychologische/
psychiatrische Kontraindikationen
• Demenz
• Schwere frontale exekutive Funktionsstörung
• Akute paranoide oder halluzinatorische Psychose
• Akute schwere Depression
• Schwere Persönlichkeitsstörung
• Schwere Impulskontrollstörung Tab. 3: Kontraindikationen der THS Herzog und Deuschl16
1.2.2 Operative Vorgehensweise
Für die tiefe Hirnstimulation (THS) werden zwei Elektroden im Zielgebiet, beim Morbus Parkinson meist im Nucleus subthalamicus (STN), implantiert22. Um intraoperativ den Zielpunkt zu treffen, ist vorab eine stereotaktische Planung notwendig. Dazu erfolgt meist eine MRT (Magnetresonanztomographie) Bildgebung23. Um störungsfreie Aufnahmen zu gewährleisten, kann der Patient narkotisiert werden23.
Für die weitere CT-Bildgebung wird ein Stereotaxiering an der Schädelkalotte fixiert23,24. Zur Reduktion von Abbildungsfehlern werden die MRT-Bilder mit den stereotaktischen CT-Aufnahmen fusioniert24. So entsteht auf dem Ring basierend ein dreidimensionales Koordinatensystem mit Hilfe dessen sich die Zielführung planen lässt23. Um die geplante Navigation intraoperativ auf den Patienten übertragen zu können, wird das Zielgerät mittels eines stereotaktischen Phantoms eingestellt und anschließend auf
Einführung
dem Stereotaxiering aufgesetzt23. Zur optimalen störungsfreien Lagerung wird der Patient mit dem Ring in liegender oder halb sitzender Position am OP-Tisch fixiert25. Nach Anlage der Bohrlochtrepanation werden dem wachen Patienten bis zu fünf Mikroelektroden zur Ableitung von Einzelzellpotentialen zur Überprüfung des Zielpunkts eingeführt23. Nach ausgiebiger klinischer Testung der erwünschten und unerwünschten Stimulationswirkungen an den einzelnen Elektrodenpositionen, wird die permanente Elektrode röntgenkontrolliert an der Position mit dem besten therapeutischen Fenster (frühes klinisches Ansprechen, hohe Nebenwirkungsschwelle) platziert23,24,26,27
. Alle anderen Messelektroden werden wieder entfernt23.
Die Implantation des subklavikulär oder in der Abdominalwand liegenden Stimulators und der verbindenden Kabeln erfolgt in einer weiteren OP24,26. Durch die postoperative Testung können die Stimulationsparameter dem jeweiligen Patienten individuell angepasst werden und meist eine Medikamentenreduktion erfolgen26,27.
1.2.3 Komplikationen
Chirurgische Komplikationen sind Infektionen, die eine Entfernung der Elektroden zur Folge haben können oder intrazerebrale Blutungen22. Damit verbunden sind hämorrhagische Hirninfarkte mit konsekutiv bleibenden neurologischen Ausfällen22,28. Perioperativ können zu dem vorübergehende Verwirrtheitszustände auftreten29.
Des Weiteren kommen systembedingte Komplikationen vor. Dazu gehört eine mögliche Dislokation der Elektroden und damit ein Verlust der optimalen Stimulationswirkung30. Außerdem können technische Probleme wie Defekte der Elektroden, Kabel oder des Impulsgebers zu weiteren Eingriffen führen29,30.
Zu den häufigsten stimulationsbedingten Komplikationen zählen Dysarthrie, Gewichtszunahme und Depression29.
1.2.4 Effekte der tiefen Hirnstimulation
Mit Hilfe der THS verbessern sich oft die motorischen Symptome der Krankheit, so nehmen Off-Phasen und Dyskinesien deutlich ab22,28,29,31
. Ein bisher therapieresistenter Ruhetremor spricht häufig gut auf die THS an17. Außerdem lässt sich die dopaminerge Medikation um durchschnittlich 50%
verringern29. Dies wirkt sich auch positiv auf die Lebensqualität der Patienten aus16,28.
Jedoch sollte postoperativ auf die Entwicklung einer Depression oder Apathie geachtet werden32. Auch Suizidalität wird in manchen Fällen beschrieben33. Weitere mögliche negative Effekte bilden Dysarthrie, Parästhesien, tonische Muskelkontraktionen oder Apraxie der Augenlidöffnung17,34. In der Regel können diese durch eine Veränderung der Stimulationsparameter verbessert werden30. Zudem kann es zu einer deutlichen Gewichtszunahme kommen35.
1.3 Zielsetzung
Die THS (mit anschließend reduzierter Medikation) ist der alleinigen medikamentösen Behandlung beim fortgeschrittenen Parkinsonsyndrom überlegen28,31. Jedoch wird diese Option nur von wenigen Patienten in Anspruch genommen.
Im Raum Oberpfalz (1.082.516 Einwohner36) und Niederbayern (1.192.543 Einwohner37) erkranken bei einer mittleren Inzidenz von 15/100.000 pro Jahr3 in etwa 341 Patienten am Morbus Parkinson. Bis zu 10% sind dabei jünger als 40 Jahre38-41 und dürften im OP-fähigen Alter Dyskinesien entwickeln42 und sich somit für eine THS eignen. Statt der geschätzten 34 Patienten pro Jahr wurden in den vergangenen 2 Jahren aber nur insgesamt 7 Patienten (2 in 2011 und 5 in 2012) aus Niederbayern und der Oberpfalz mit der Indikation Parkinson im Regensburger Zentrum operiert.
Was diese Diskrepanz bedingt und warum so viele Patienten nicht einmal die Möglichkeit nutzen sich danach zu erkundigen, ist bisher nicht verstanden. Ziel dieser Arbeit ist, mögliche Gründe für die zurückhaltende Inanspruchnahme dieser Therapieform zu finden und abzuklären, inwieweit mangelnde Aufklärungsarbeit und Patientenängste eine Rolle spielen.
Methodik
2. Methodik
Im Rahmen dieser deskriptiven Studie wurden in Kooperation mit dem Zentrum für klinische Studien Regensburg Fragebögen für Parkinsonpatienten sowie betreuende Ärzte erstellt und im Zeitraum von August bis Dezember 2010 an diese versendet.
Es wurden 87 niedergelassene Neurologen und Nervenärzte im Raum der Oberpfalz und Niederbayern, dem unmittelbaren Einzugsgebiet der Universitätsklinik Regensburg, angeschrieben. Die Adressen wurden der Internetdatenbank der KVB (Kassenärztliche Vereinigung Bayerns) entnommen.
Die Fragebögen für die Parkinsonpatienten wurden an die Selbsthilfegruppen der dPV (deutsche Parkinson Vereinigung e.V.) im Raum der Oberpfalz und Niederbayern gesendet.
2.1 Ärztefragebogen
Der Fragebogen (Abb. 1, Abb. 2) wurde, um eine möglichst hohe Beteiligung zu erreichen, relativ kurz und in Multiple-Choice-Form mit zusätzlich frei formulierbaren Anteilen gehalten.
2.1.1 Zahl der pro Praxis behandelten Patienten
Um einen groben Überblick über die Erfahrung der Ärzte mit Parkinsonpatienten zu erhalten, wurde diese Frage als Einstiegsfrage gewählt. Die Ärzte sollten dabei eine ungefähre Anzahl der von ihnen behandelten Parkinsonpatienten nennen. Hierbei könnten sich eventuelle Zusammenhänge mit Erfahrung und Kenntnis der THS zeigen.
2.1.2 Kenntnis der THS als Therapieoption bei Morbus Parkinson Diese Frage sollte die bloße Kenntnis der THS als Therapieoption bei Morbus Parkinson prüfen. Um eine klare Aussage zu erhalten wurde diese als „ja/nein“-Frage formuliert.
Abb. 1: Ärztefragebogen Seite 1
Methodik
Abb. 2: Ärztefragebogen Seite 2
2.1.3 Kenntnis der Auswahlkriterien
Für diese Kernfrage wurde eine zweiteilige Form gewählt. Zunächst wird durch eine „ja/nein“-Frage die eigene Einschätzung der Ärzte zur Kenntnis der Auswahlkriterien ermittelt. Anschließend, sofern erstere mit „ja“
beantwortet wurde, sollte mit Hilfe einer offenen Frage die aktive Wiedergabe der wichtigsten Auswahlkriterien (1. Dyskinesien/Fluktuationen, 2. therapieresistenter Tremor, 3. beeinträchtigende Nebenwirkungen durch medikamentöse Therapie) erfolgen. Hier wurde bewusst die schwieriger auszuwertende offene Frageform gewählt um keine Antwortmöglichkeiten vorzugeben und damit aktiv Wissen zu prüfen sowie ein Raten zu verhindern. Es wurde ebenso auf die Formulierung geachtet, um den Eindruck eines Wissenstests zu vermeiden. Die Validierung der Antworten könnte Auskunft über die Informationstiefe der Ärzte liefern.
2.1.4 Bedenken gegenüber der THS
Ziel dieser Frage war die Ermittlung möglicher Bedenken gegenüber der THS. Dazu wurde eine Multiple-Choice-Frage mit drei vorgegebenen Bedenken formuliert (Mehrfachnennungen möglich). Zusätzlich wurde eine vierte offene Antwortoption angefügt um eine weitere freiformulierbare Nennungen zu ermöglichen. Diese Frage könnte die zurückhaltende Zuweisung der Patienten zur THS miterklären.
2.1.5 Erfahrung mit Patienten mit THS
Um noch mehr über die Einstellung der Ärzte gegenüber der THS zu erfahren wurde nach den bisherigen Erfahrungen gefragt. Durch eine
„ja/nein“-Frage soll zuerst angegeben werden, ob Erfahrungen zur THS vorliegen. Anschließend konnten durch eine offene Frage positive und negative Erlebnisse genannt werden. Daraus könnten eventuell Zusammenhänge zum Wissensstand über die THS gezogen werden.
Methodik
2.1.6 Schätzung von Komplikationsraten
Zuletzt sollten anhand dreier Komplikationen die Häufigkeiten geschätzt werden. Zu jeder Komplikation sollte ein Prozentwert angegeben werden.
Durch einen Vergleich mit den tatsächlichen Risikoraten lässt sich ermitteln, wie realistisch die Ärzte das Eingriffsrisiko einschätzen. Bei Nennungen von Spannweiten, wie beispielsweise 2-3%, wurde die jeweils höhere Zahl gewertet.
2.2 Patientenfragebogen
Um eine hohe Beteiligung zu erreichen, wurde der Fragebogen (Abb. 3, Abb.
4) möglichst kurz (2 Seiten) und weitestgehend in Multiple-Choice-Form gehalten.
2.2.1 Epidemiologische Daten
Zur epidemiologischen Datenerhebung wurde nach Alter, Geschlecht und Erkrankungsdauer gefragt.
2.2.2 Kenntnis der THS
Die Frage zur Kenntnis der THS wurde zweiteilig gestaltet. Zunächst sollte mittels einer „ja/nein“-Frage die bloße Kenntnis der THS bei Morbus Parkinson angegeben werden. Sofern erstere Frage bejaht wurde, sollte durch eine anschließende Multiple-Choice-Frage (Mehrfachnennungen möglich) noch die Informationsquellen ermittelt werden. Dazu wurden vier denkbare Quellen angegeben sowie eine offen Zeile für weitere Nennungen angefügt. Wurde erstere Frage verneint, fielen als logische Konsequenz die folgenden drei Fragen weg. Ziel der Frage war die Ermittlung des Informationsstandes der Patienten sowie deren Bezugsquellen.
Abb. 3: Patientenfragebogen Seite 1
Methodik
Abb. 4: Patientenfragebogen Seite 2
2.2.3 THS als persönliche Therapieoption
Diese „ja/nein“-Frage sollte zeigen, welcher Anteil der Patienten die THS für sich als Therapieoption in Betracht zieht. Zudem sollte sie mit dazu beitragen, die Einstellung gegenüber der THS zu ermitteln.
2.2.4 Bedenken gegenüber der THS
Eine Multiple-Choice-Frage (Mehrfachantworten möglich) mit vier vorgegebenen Antwortmöglichkeiten sollte die Bedenken und Ängste der Patienten offen legen. Zudem wurde durch eine weitere leere Zeile Raum für freie Nennungen geschaffen.
2.2.5 Einschätzung von Komplikation mit bleibenden Schäden Hier sollte mittels einer Multiple-Choice-Frage die Einschätzung des Komplikationsrisikos überprüft werden um in Kombination mit den beiden vorherigen Fragen Rückschlüsse auf die Informationsqualität ziehen zu können.
2.2.6 Zufriedenheit mit der aktuellen Therapie
Eine „ja/nein“-Frage sollte zunächst die Therapiezufriedenheit wiedergeben.
Anschließend bot eine offene Frage Raum um die Antwort zu erläutern.
2.2.7 Fluktuationen der Medikation
In einer „ja/nein“-Frage wurde das Auftreten von Fluktuationen erfragt. Die beiden letzten Fragen könnten so mögliche Kandidaten zur THS identifizieren.
3. Ergebnisse
Alle Fragebögen wurden mittels SPSS (IBM SPSS Statistics 19) digitalisiert und ausgewertet. Die statistische Analyse erfolgte in Kooperation mit dem Zentrum für klinische Studien Regensburg.
Ergebnisse
3.1 Auswertung der Ärztefragebögen
Von 87 angeschriebenen Ärzten, erhielten wir 49 Antworten, was einer Beteiligung von 56,3% entsprach.
3.1.1 Zahl der pro Praxis behandelten Patienten
Diese Frage konnte aufgrund vieler zusätzlicher Angaben seitens der Ärzte statistisch nicht ausgewertet werden. So wurde beispielsweise die Patientenanzahl mit „pro Jahr“ oder „pro Quartal“ ergänzt.
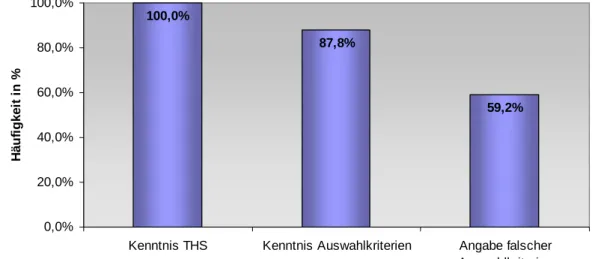
3.1.2 Kenntnis der THS als Therapieoption bei Morbus Parkinson Unter allen 49 Rücksendern war die THS als Therapieoption bei Morbus Parkinson bekannt (Abb. 5).
3.1.3 Kenntnis der Auswahlkriterien
87,8% gaben an, die Auswahlkriterien zu kennen (Abb. 5).
100,0%
87,8%
59,2%
0,0%
20,0%
40,0%
60,0%
80,0%
100,0%
Kenntnis THS Kenntnis Auswahlkriterien Angabe falscher Auswahlkriterien
Häufigkeit in %
Abb. 5: Angaben zur Kenntnis der THS und deren Auswahlkriterien
In der freiformulierbaren Zusatzfrage zur Kenntnis der Auswahlkriterien sollten die Ärzte die wichtigsten angeben. Die drei etabliertesten Hauptindikationen sind16:
1) Dyskinesien/Fluktuationen 2) therapieresistenter Tremor
3) beeinträchtigende Nebenwirkungen durch die medikamentöse Therapie (Kap. 1.2.1).
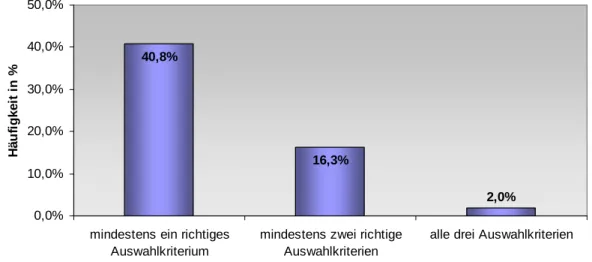
Jedoch zeigte sich bei der objektiven Überprüfung der aufgeführten Kriterien anhand der dargestellten Indikationen, dass 59,2% als falsch bzw. derzeit nicht aktuell anzusehen sind (Abb. 5). Somit konnten nur 40,8% des Gesamtkollektivs wenigstens ein richtiges Kriterium aktiv wiedergeben (Abb.
6). Mindestens zwei richtige Kriterien konnten 16,3% und alle drei konnten 2,0% angeben. D.h. nur einer der 49 Ärzte konnte alle richtigen Auswahlkriterien aktiv benennen.
40,8%
16,3%
2,0%
0,0%
10,0%
20,0%
30,0%
40,0%
50,0%
mindestens ein richtiges Auswahlkriterium
mindestens zwei richtige Auswahlkriterien
alle drei Auswahlkriterien
Häufigkeit in %
Abb. 6: Auswertung der angegebenen Auswahlkriterien
Lediglich 28,6% gaben Motorfluktuationen oder Dyskinesien an und 24,5%
listeten einen therapieresistenten Tremor des Morbus Parkinsons auf (Tab.
4). Für je 20,4% stellte das Alter oder ein Ansprechen auf L-Dopa ein
Von Ärzten angegebene Auswahlkriterien Absolute Häufigkeit
Relative Häufigkeit
Fluktuationen, Dyskinesien, On/Off-Phasen 14 28,6%
Therapieresistenter Tremor 12 24,5%
Beeinträchtigungen durch medikamentöse.
Nebenwirkungen (ohne Fluktuationen) 3 6,1%
Alter 10 20,4%
Wirksamkeit, Ansprechen auf L-Dopa 10 20,4%
Mangelnde Medikamentenwirkung, Pharmakoresistenz,
(ohne Tremorresistenz) 7 14,3%
Keine Demenz 7 14,3%
Keine Angaben 8 16,3%
Tab. 4: Von Ärzten angegebene Auswahlkriterien
Ergebnisse
entscheidendes Kriterium dar. 6,1% sahen Beeinträchtigungen durch medikamenteninduzierte Nebenwirkungen als wichtig an und 14,3% nannten einen Demenzausschluss als Voraussetzung. Ebenfalls 14,3% gaben eine mangelnde Medikamentenwirkung oder Pharmakoresistenzen an. 16,3%
konnten keine Kriterien auflisten.
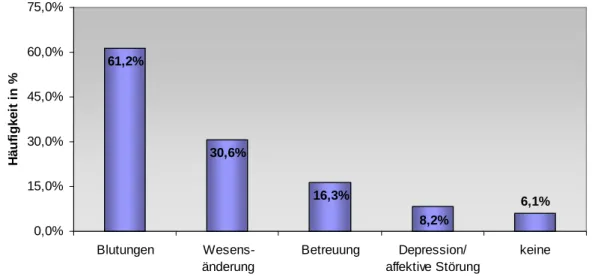
3.1.4 Bedenken gegenüber der THS
Bedenken (Abb. 7) in Hinsicht auf Blutungen oder daraus folgende bleibende neurologische Ausfälle äußerten 61,2% der Neurologen und Nervenärzte.
30,6% sorgten sich um eine mögliche Wesensänderung des Patienten und 16,3% kreuzten an, Probleme bei der weiterführenden postoperativen Betreuung zu haben. Im freiformulierbaren Antwortteil zogen 8,2%
Depressionen oder affektive Störungen in Erwägung. 6,1% gaben keine Bedenken an.
61,2%
30,6%
16,3%
8,2%
6,1%
0,0%
15,0%
30,0%
45,0%
60,0%
75,0%
Blutungen Wesens- änderung
Betreuung Depression/
affektive Störung
keine
Häufigkeit in %
Abb. 7: Bedenken der Ärzte gegenüber der THS
3.1.5 Erfahrung mit Patienten mit THS
61,2% der Ärzte erwähnten, bereits Erfahrungen mit der THS gesammelt zu haben. Hierbei zeigt sich ein signifikanter Unterschied (p=0,025) zwischen Ärzten mit und ohne Erfahrung bezüglich der Kenntnis der Kriterien.
In der offenen Frage nach positiven und/oder negativen Erfahrungen (Mehrfachnennungen möglich) führten 90% (27 der 30 Ärzte mit Erfahrung)
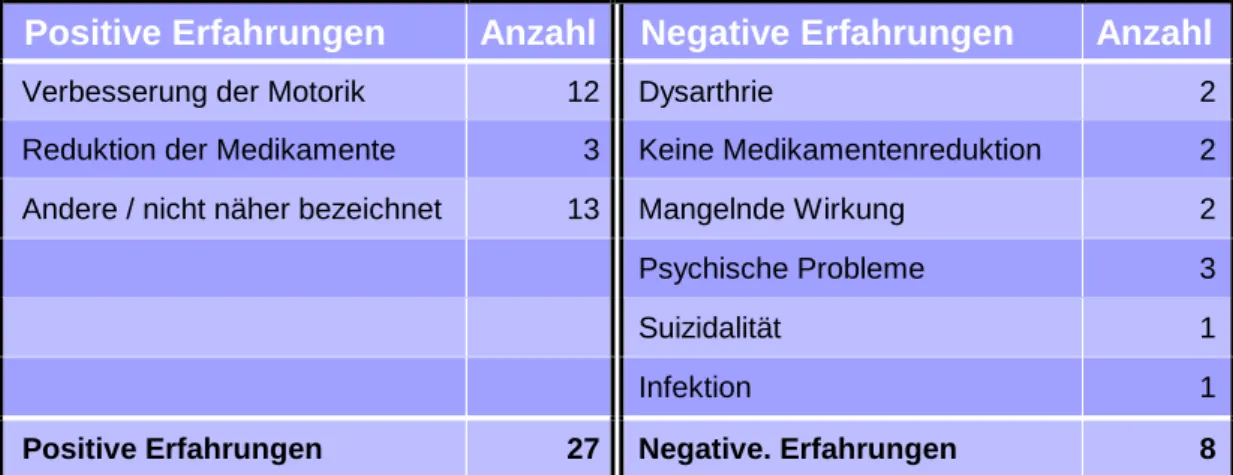
gute Ergebnisse an (Tab. 5). Hierbei nannten 44,4% (12 Ärzte) eine Verbesserung der Motorik und 11,1% (3 Ärzte) eine deutliche Reduktion der Medikamente. Von schlechten Resultaten berichten 8 Ärzte (26,7%). Dabei handelte es sich um einen Suizidversuch, dreimal um psychische Probleme (Depression, Hypomanie) und zweimal um eine Dysarthrie. Eine mangelnde Wirkung oder einen weiterhin hohen Medikamentenbedarf beschrieben je zwei Ärzte.
Positive Erfahrungen Anzahl Negative Erfahrungen Anzahl
Verbesserung der Motorik 12 Dysarthrie 2
Reduktion der Medikamente 3 Keine Medikamentenreduktion 2 Andere / nicht näher bezeichnet 13 Mangelnde Wirkung 2
Psychische Probleme 3
Suizidalität 1
Infektion 1
Positive Erfahrungen 27 Negative. Erfahrungen 8
Tab. 5: Angaben der Ärzte von positiven und negativen Erfahrungen mit der THS (Mehrfachnennungen möglich)
3.1.6 Schätzung von Komplikationsraten
In der letzten Frage sollten Ärzte die Häufigkeit vorgegebener Komplikationen einschätzen (Abb. 8). Es folgte für Dysarthrien eine durchschnittliche Wahrscheinlichkeit von 7,0% (SD 5,3%, Median 5,0%).
Blutungen oder bleibende neurologische Schäden wurden im Mittel mit 4,4%
(SD 4,7%, Median 3,0%) angegeben. Hinsichtlich einer deutlichen postoperativen Gewichtszunahme gingen die Meinungen weiter auseinander, sodass Werte im Bereich zwischen 0% und 80% angegeben wurden, der Durchschnitt jedoch lag bei 5,9% (SD 13,8%, Median 2,0%).
Ergebnisse
7,0%
4,3%
5,9%
0,0%
5,0%
10,0%
15,0%
20,0%
25,0%
Mittelwert in %
Blutungen Gewichts-
zunahme Dysarthrie
SD 5,3
SD 4,7
SD 13,8
Abb. 8: Mittelwerte der geschätzten Häufigkeiten
3.2 Auswertung der Patientenfragebögen
Von sieben angeschriebenen Selbsthilfegruppen bekamen wir 46 Fragebögen zurück.
3.2.1 Epidemiologische Daten
35% der Patienten waren weiblich, 65% männlich. Der Altersdurchschnitt lag bei 68,9 Jahren und einer Spannweite von 48 bis 86 Jahren. Die durchschnittliche Erkrankungsdauer betrug 11,4 Jahre mit Werten zwischen 2 und 34 Jahren.
3.2.2 Kenntnis der THS
91,3% gaben an, die THS als Therapieoption bei Morbus Parkinson zu kennen. Als Informationsquelle (Abb. 9) standen mit 88,1% die Selbsthilfegruppen an erster Stelle der Patienten. Vom Arzt wurden 54,8%
informiert. Die Medien wurden von 21,4% und Angehörige von 4,8%
angegeben. Bei den freiformulierbaren Quellen ergaben sich zwei weitere Antworten. Zum einen gaben 4,8% das Internet an und zum anderen besuchten 14,3% verschiedene Vorträge an Kliniken.
88,1%
54,8%
21,4%
4,8%
4,8% 14,3%
0,0%
20,0%
40,0%
60,0%
80,0%
100,0%
Selbsthilfe- gruppe
Arzt Medien Angehörige Internet Vorträge an Kliniken
Häufigkeit in %
Abb. 9: Informationsquellen der Parkinsonpatienten über die THS
3.2.3 THS als persönliche Therapieoption
43,9% der Patienten würden die THS als mögliche Therapieoption in Betracht ziehen.
3.2.4 Bedenken gegenüber der THS
Bedenken (Abb. 10) wurden v. a. (56,1%) gegenüber einer Verschlechterung des Sprechens angegeben. Blutungen oder bleibende neurologische Ausfälle kreuzten 46,3% an und eine mögliche Wesensänderung wurde von 41,5% angeführt. Eine fehlende Wirkung hingegen befürchten 24,4%.
46,3%
41,5%
24,4%
56,1%
0,0%
10,0%
20,0%
30,0%
40,0%
50,0%
60,0%
Blutungen Wesensänderung fehlende Wirkung Verschlechterung des Sprechens
Häufiigkeit in %
Abb. 10: Bedenken der Parkinsonpatienten gegenüber der THS
Ergebnisse
3.2.5 Einschätzung von Komplikation mit bleibenden Schäden 15,8% der Patienten ordneten Komplikationen mit bleibenden Schäden (Abb. 11) einer Wahrscheinlichkeit von weniger als in 1% der Fälle zu. 39,5%
schätzten das Risiko auf 1% bis 5% und 34,2% zwischen 5% und 15%.
Komplikationsraten von mehr als 15% gaben immerhin noch 10,5% an.
15,8%
34,2%
10,5%
39,5%
0,0%
10,0%
20,0%
30,0%
40,0%
50,0%
< 1% 1 - 5% 5 - 15% > 15%
Komplikationsrate
Häufigkeit in%
Abb. 11: Einschätzung der Komplikationsrate mit bleibenden Schäden
3.2.6 Zufriedenheit mit der aktuellen Therapie
83,3% der Patienten gaben an, mit ihrer aktuellen Therapie zufrieden zu sein. 3 Patienten antworteten auf die Frage nicht adäquat und wurden daher zensiert.
3.2.7 Fluktuationen der Medikation
Bei 57,8% der Patienten traten On/Off-Phasen auf. Trotzdem gaben 83,3%
an, mit ihrer aktuellen medikamentösen Therapie zufrieden zu sein. Von den unzufriedenen Patienten (16,7%) sahen 71,4% (5 von 7 Patienten, p=0,095) die THS als Therapieoption.
4. Diskussion
In unserer Befragung gaben alle Ärzte an, die THS als Therapieoption bei Morbus Parkinson zu kennen und 87,8% glaubten die Auswahlkriterien zu kennen. In der einzigen uns nun bekannten ähnlichen Studie43 an 325 US- amerikanischen Ärzten von 2011, die in unserer Konzeptionsphase (2010) noch nicht zur Verfügung stand, waren 92% der Spezialisten für Bewegungsstörungen und 87% der Nichtspezialisten vertraut mit der THS bei Morbus Parkinson. 16% der Spezialisten und erstaunliche 71% der Nichtspezialisten würden Patienten mit geringem oder gar fehlendem medikamentösem Ansprechen zur THS überweisen. In unserer Studie nannten 14,3% Auswahlkriterien, die Patienten mit mangelnder medikamentöser Wirkung und Pharmakoresistenzen (ohne therapieresistenter Tremor) einschließen. Jedoch belegen Studien29,44, dass das motorische Ansprechen auf die THS mit dem motorischen Ansprechen auf L-Dopa korreliert. Daraus folgt, dass Patienten, die motorisch nur gering von der dopaminergen Medikation profitieren auch nicht auf eine THS ansprechen. Deswegen gilt unzureichendes Ansprechen auf Anti- Parkinsonmittel im UPDRS III als Kontraindikation für die THS. Mit über 80%
herrschte weitgehende Einigkeit beider Gruppen zur Einweisung von Patienten mit Motorfluktuationen, medikamentös nicht beherrschbaren Dyskinesien und Nebenwirkungen sowie therapieresistenten Tremor43. Unsere Daten sagen, dass 28,6% der Ärzte Patienten mit Motorfluktuationen/Dyskinesien bzw. On/Off-Phasen und 24,5% Patienten mit therapieresistentem Tremor auswählen würden. Weitere 6,1% gaben Beeinträchtigungen durch Medikamentennebenwirkungen an. Zieht man die 40,8% der Ärzte, die wenigstens eines oder mehrere der genannten Kriterien angaben heran, so bleibt trotzdem eine deutliche Diskrepanz zur amerikanischen Studie. Diese könnte zum Teil mit dem Fragemodus erklärt werden. Im Gegensatz zu unserer offenen Fragestellung, bei der Auswahlkriterien frei aufzuführen waren, verwendete Shih43 eine Likert Skala (“strongly disagree,” “disagree,” “neither agree nor disagree,” “agree,” and
“strongly agree”). So sind diese Zahlen vermutlich nur bedingt vergleichbar.
Diskussion
Weiter gaben in der US-Studie 79% der Spezialisten und 77% der Nichtspezialisten einen Bedarf für Informationen zur Indikationsstellung einer THS an43. Bedenkt man, dass nur 40,8% der von den hiesigen Neurologen aufgelisteten Auswahlkriterien als richtig anzusehen sind und dass nur 2%
alle drei Indikationen vollständig wiedergeben konnten, wird deutlich, dass dieser Informationsbedarf auch für unser Kollektiv besteht. So besteht ein signifikanter Unterschied (p=0,025) zwischen Ärzten mit und ohne Erfahrung mit THS-Patienten bezüglich der Kenntnis der Kriterien. Dies könnte auf eine gezielte Auseinandersetzung der Ärzte mit der THS hinweisen, die Kontakt mit THS-Patienten haben. Andererseits wäre denkbar, dass geschulte Neurologen eher Patienten der THS zuführen und dadurch Erfahrungen sammeln. Des Weiteren erscheint anhand der Angabe der Auswahlkriterien, dass für viele Ärzte die THS als letzte Therapieoption gilt, d. h. wenn alle anderen Möglichkeiten erschöpft sind. Zu diesem Ergebnis kamen auch die Nichtspezialisten für Bewegungsstörungen in der amerikanischen Studie43. Jedoch konnte Deuschl et al.28 zeigen, dass die THS in Kombination mit Medikamenten beim fortgeschrittenen idiopathischen Parkinson Syndrom sowohl motorisch als auch in Bezug auf die Lebensqualität der medikamentösen Therapie überlegen ist. Des Weiteren konnte gezeigt werden, dass auch Patienten im früheren Krankheitsverlauf (durchschnittliche Erkrankungsdauer 7,5 Jahre) profitieren.45 Dies gilt insbesondere für Lebensqualität, Motorik und Dyskinesien.45
Hinsichtlich der Bedenken gegenüber der THS bei Morbus Parkinson äußerten 39% der Spezialisten und 36% der Nichtspezialisten Sorgen über operationsbedingte Komplikationen43. Außerdem gaben die amerikanischen Ärzte einen Informationsmangel zu Komplikationen des Eingriffs (72%) und zur postoperativen Programmierung der Stimulation (Spezialisten 65%, Nichtspezialisten 73%) an. In unserer Studie gaben 16,3% an, Bedenken bei der postoperativen Betreuung zu haben und 61,2% befürchteten Blutungen mit nachfolgenden bleibenden neurologischen Defiziten.
Um herauszufinden, wie realistisch betreuende Ärzte die Risiken der THS betrachten, ließen wir sie Komplikationsraten schätzen (Ergebnisse 2.1.6).
So wurde die Häufigkeit von Blutungen im Mittel auf 4,4% (SD 4,7%) geschätzt. Publizierte Daten reichen zentrumsabhängig von 0,4% bis
3,9%29,46-50. Jedoch stellt aufgrund der hohen Patientenzahl (262) bei Voges et al.50 die niedrige Risikorate von 0,4% den Standard dar. Verglichen hierzu, wurde diese Komplikation doch um ein vielfaches überschätzt. Die Häufigkeit der Gewichtszunahme wurde hingegen mit im Mittel 5,9% (SD 13,8) deutlich unterschätzt. Hier streuen jedoch die Werte von 8,4% bis 78,7%29,51,52. Die Komplikation Dysarthrie wurde mit durchschnittlich 7,0% (SD 5,3%) gut eingeschätzt. Publizierte Häufigkeiten liegen zwischen 3,9% und 12,8%29,46,51. Bei diesen Einschätzungen gab es keine signifikanten Unterschiede zwischen Ärzten, die richtige oder falsche Indikationskriterien für die THS anführten (Blutungen p=0,181, Gewichtszunahme p=0,480, Dysarthrie p=0,336). Dies lässt eine oberflächliche Auseinandersetzung mit den Komplikationen vermuten oder ähnlich wie bei den amerikanischen Ärzten43 einen entsprechenden Informationsmangel aufdecken.
Im Mittelpunkt der Patientenbefragung standen Kenntnis der THS und Bedenken gegenüber dem Eingriff und dessen Wirkung. 91,3% der Patienten kannten die THS als Therapieoption bei Morbus Parkinson. Damit lag der Bekanntheitsgrad in der Region Oberpfalz und Niederbayern auf deutschlandweitem Niveau (96%)53. Ähnlich unserer Datenrekrutierung durch Anschrift der dPV-Selbsthilfegruppen erfolgte auch in der Studie von Südmeyer et al.53 durch Anschrift der Patienten mittels der Parkinson- Nachrichten (monatliche Zeitung der dPV) eine Präselektion des Kollektivs.
So sollte man annehmen, dass überwiegend engagierte und gut informierte Patienten an der Befragung teilnahmen. Demzufolge könnte auch der hohe Anteil der Selbsthilfegruppen als Informationsquelle (88,1% der Patienten) erklärt werden. In der deutschlandweiten Befragung durch Südmeyer et al.53 von 2011, die uns ebenfalls während unserer Studienkonzeption noch nicht vorlag, gaben 74,9% der Patienten Parkinson-Verbände oder andere Patienten als Quellen an. In unserer Studie folgten an zweiter Informationsstelle mit 54,8% die Ärzte und an dritter mit 21,4% die Medien, wohingegen bei Südmeyer et al.53 58,5% der Patienten von den Medien und 40,4% von Ärzten oder Kliniken ihre Informationen bezogen. Angehörige spielten bei uns mit 4,8% eine untergeordnete Rolle. Anders gaben bei Südmeyer et al.53 immerhin 16,4% ihre Familien und Freunde als Quellen
Diskussion
an. Zusätzlich fügten 14,3% unserer befragten Patienten als Ergänzung Vorträge an verschiedenen Kliniken an, die von Ärzten mit veranstaltet wurden. Somit ergäbe sich eine vergleichsweise hohe Informationsrate durch Ärzte von 69%.
Neben der bloßen Kenntnis der THS wollten wir von den Patienten auch deren Bedenken erfragen. So erwies sich eine mögliche Verschlechterung des Sprechens als häufigster genannter Einwand gegenüber der THS (56,1%). Da Dysarthrien bei bis zu 12,8%51 der Fälle auftreten können, sind diese Befürchtungen durchaus gerechtfertigt. In der Befragung von Südmeyer et al.53 äußern diese Bedenken nur rund 8% der Patienten. Hier stehen mit 31% Operationskomplikationen und eine operationsinduzierte Symptomverschlechterung (21%) im Vordergrund. In unserer Befragung gaben 46,3% Bedenken gegenüber Blutungen mit konsekutiv möglichen bleibenden Schäden an. 24,4% befürchten eine unzureichende Wirkung der Stimulation. Des Weiteren sorgten sich 41,5% bezüglich einer postoperativen Wesensänderung. Bei Südmeyer et al.53 gaben nur rund 8%
Bedenken hinsichtlich Persönlichkeitsveränderungen an. Diese können jedoch in Form einer Depression oder Apathie je nach Studie in 1,5% bis 25%32 der Fälle auftreten. Die Suizidalität steigt im ersten Jahr auf das 12,6 bis 15,6-fache gegenüber nicht mit THS versorgten Parkinson Patienten, sinkt jedoch nach vier Jahren wieder auf den 1,8 bis 2,3-fachen Wert33. Andererseits stellt die Apathie, auch ohne THS, ein häufiges Symptom des Morbus Parkinson dar und kann in etwa 16,5% bis 42% der Patienten betreffen54. Verglichen mit der Befragung von Südmeyer et al.53, bei der lediglich 65% der Patienten Bedenken angaben, waren es bei uns verhältnismäßig viele Patienten (87,8%). Eine mögliche Erklärung könnte der Fragemodus darstellen. In unserem Fall gab es eine Multiple-Choice-Frage mit vorgegebenen Komplikationen, wohingegen bei Südmeyer et al.53 eine ja/nein Frage mit freiformulierbar zu ergänzenden Bedenken gestellt wurde.
In einer weiteren Multiple-Choice-Frage ließen wir die Patienten die Häufigkeit von Komplikationen mit bleibenden Schäden einschätzen. Dabei kreuzten 55,3% ein Risiko von weniger als 5% an. Laut Voges et al.50 kommt es zentrumsabhängig in 0,4% der Fälle zu bleibenden Schäden. Jedoch schätzten insgesamt 84,2% der Patienten das Risiko mit über 1% als zu
hoch ein. Dabei schätzten 34,2% das Risiko mit 5 bis 15% deutlich zu hoch und 10,5% schätzten das Blutungsrisiko erheblich zu hoch auf über 15%.
Dabei besteht kein signifikanter Unterschied (p=0,757) bei der Risikoeinschätzung zwischen Patienten, die als Informationsquelle ihren Arzt nannten und solchen, die ihre Informationen überwiegend aus den Selbsthilfegruppen oder Medien bezogen. Somit besteht hinsichtlich einer adäquaten Risikoeinschätzung seitens der Patienten noch ein deutlicher Aufklärungsbedarf.
Trotz aller Bedenken sahen 43,9% der Patienten die THS für sich als Therapieoption, genauer gaben 71,4% der Therapie-Unzufriedenen Patienten (5 von 7 Patienten, p=0,095) die THS als Therapieoption an. Diese Patienten würden potentiell für eine THS in Frage kommen. Im Verhältnis zu unserem Gesamtkollektiv, entspricht dies einem Anteil von 10,9%. Trotz fehlender Signifikanz, die möglicherweise durch eine zu geringe Power der Studie nicht erreicht wurde, ist eine klare Tendenz zu erkennen.
5. Zusammenfassung
Das Ziel dieser Studie lag darin zu verstehen warum im Einzugsgebiet der Universitätsklinik Regensburg sich weniger als die zu erwartende Zahl von Parkinsonpatienten nach einer tiefen Hirnstimulation erkundigen bzw. sich einer solchen unterziehen. Anhand dieser Erkenntnisse könnte dann gezielt die Patientenaufklärung und die fachliche Information der zuweisenden Kollegen verbessert werden, um mehr geeigneten Patienten diese lebensqualitätsverbessernde Therapie zu ermöglichen. Daher wurden für Patienten und Ärzte unterschiedliche Fragebögen erstellt und an die dPV- Selbsthilfegruppen bzw. den niedergelassenen Ärzten in der Region zugeschickt. Die ausgefüllten Fragebögen wurden schließlich mittels SPSS digitalisiert und ausgewertet.
56,3% der kontaktierten Neurologen und Nervenärzte beteiligten sich an der Befragung. 87,8% gaben an, die Auswahlkriterien der THS zu kennen, jedoch konnten nur 40,8% wenigsten ein richtiges Kriterium wiedergeben, nur 2% konnten alle drei Indikationskriterien aktiv benennen. Bedenken gegenüber der THS wurden vor allem hinsichtlich intracerebraler Blutungen
Schlussfolgerungen
(61,2% der Befragten) geäußert. Weitere Sorgen galten Wesensänderungen und der Entwicklung einer affektiven Störung (30,6% respektive 8,2% der Befragten). Bei der Einschätzung der Komplikationsraten wurden intracerebrale Blutungen im Mittel mit 4,4%, Dysarthrien mit 7,0% und Gewichtszunahmen mit 5,9% angegeben. Tatsächlich hatten jedoch 90%
der niedergelassenen Fachärzte, die THS-Patienten betreuen, positive Erfahrungen mit dieser Therapie gemacht (gegenüber 26,7% mit negativen Erfahrungen).
Von den Parkinson Patienten erhielten wir 46 ausgefüllte Fragebögen zurück. 91,3% kannten die THS als Therapieoption. Die Selbsthilfegruppen stellten mit 88,1% die wichtigste Informationsquelle dar, gefolgt von den Ärzten mit 54,8%. Bedenken wurden in erster Linie gegenüber einer Verschlechterung des Sprechens (56,1% der Befragten) angegeben.
Blutungen befürchteten 46,3% und eine Wesensänderung 41,6%. An einer fehlenden Wirkung zweifelten hingegen nur 24,4%. 16,7% der Patienten waren mit ihrer aktuellen Therapie unzufrieden, von diesen würden 71,4%
die THS für sich als Therapieoption in Betracht ziehen. Über 80% der Patienten schätzten allerdings das Risiko für Komplikationen mit bleibenden Schäden zu hoch ein.
Letztendlich ergab sich zum Einen, dass die niedergelassenen Fachärzte auch über 10 Jahre nach Zulassung der Therapie die Indikationskriterien nicht ausreichend kennen. Zum anderen zeigte sich eine deutliche Diskrepanz zwischen den ganz überwiegend positiven Erfahrungen, die die befragten Neurologen bereits gemacht hatten und einer insgesamt doch zu hohen Einschätzung des Komplikationsrisikos. Die zurückhaltende Einstellung der Parkinsonpatienten gegenüber der THS lässt sich am ehesten auch durch eine unrealistisch hohe Beurteilung von Komplikationsrisiken erklären.
6. Schlussfolgerungen
Bei Fortbildungsveranstaltungen für niedergelassene Zuweiser sollten daher die Indikationskriterien besser herausgearbeitet werden mit einer
anschaulichen Darstellung wie und warum Patienten konkret in den 3 genannten Bereichen von der Behandlung profitieren. Darüber hinaus müssen die möglichen Komplikationen, ihre tatsächlichen Folgen und ihre Häufigkeiten besser dargestellt werden.
Bei der Aufklärungsarbeit für die Patienten muss ebenfalls auf eine realistischere Risikoeinschätzung hingearbeitet werden. Dabei sollten solche Informationsveranstaltungen primär vor Ort in den Selbsthilfegruppen erfolgen, da die Patienten hier den Hauptteil ihrer Therapieinformationen beziehen.
Literaturverzeichnis
7. Literaturverzeichnis
1. Parkinson J. An Essay on the Shaking Palsy. London: Sherwood, Neely and Jones; 1817.
2. Charcot JM, Bourneville. Leçons sur les maladies du système nerveux faites à la salpêtrière. Paris: A. Delahaye; 1872.
3. von Campenhausen S, Bornschein B, Wick R, et al. Prevalence and incidence of Parkinson's disease in Europe. European neuropsychopharmacology : the journal of the European College of Neuropsychopharmacology. Aug 2005;15(4):473-490.
4. Neurologie DGf. Leitlinien Extrapyramidalmotorische Störungen 2008.
5. Dick FD, De Palma G, Ahmadi A, et al. Environmental risk factors for Parkinson's disease and parkinsonism: the Geoparkinson study.
Occupational and environmental medicine. Oct 2007;64(10):666-672.
6. Andrew J Lees JH, Tamas Revesz. Parkinson's disease. Lancet.
2009.
7. Thümler R. Morbus Parkinson. Berlin: Springer; 2002.
8. Braak H, Del Tredici K, Bratzke H, Hamm-Clement J, Sandmann-Keil D, Rub U. Staging of the intracerebral inclusion body pathology associated with idiopathic Parkinson's disease (preclinical and clinical stages). Journal of neurology. Oct 2002;249 Suppl 3:III/1-5.
9. Kunze K. Praxis der Neurologie1999.
10. Herting B, Bietenbeck S, Scholz K, Hahner A, Hummel T, Reichmann H. [Olfactory dysfunction in Parkinson's disease: its role as a new cardinal sign in early and differential diagnosis]. Der Nervenarzt. Feb 2008;79(2):175-184.
11. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality.
Neurology. May 1967;17(5):427-442.
12. Jost W. Therapie des idiopathischen Parkinson-Syndroms. Bremen:
UNI-MED Verlag; 2008.
13. Fahn S, Oakes D, Shoulson I, et al. Levodopa and the progression of Parkinson's disease. The New England journal of medicine. Dec 9 2004;351(24):2498-2508.
14. The Parkinson Study Group. Pramipexole vs Levodopa as Initial Treatment for Parkinson Disease: A 4-Year Randomized Controlled Trial. Arch Neurol. July 1, 2004 2004;61(7):1044-1053.
15. Del Dotto P PN, Gambaccini G, Bernardini S, Metman LV, Chase TN, Bonuccelli U. Intravenous amantadine improves levadopa-induced dyskinesias: an acute double-blind placebo-controlled study. Mov Disord. 2001.
16. Herzog J, Deuschl G. [Deep brain stimulation for Parkinson's disease].
Der Nervenarzt. Jun 2010;81(6):669-679.
17. Jost W. Therapie des fortgeschrittenen Parkinson-Syndroms. Bremen:
UNI-MED-Verlag; 2007.
18. Charles PD, Van Blercom N, Krack P, et al. Predictors of effective bilateral subthalamic nucleus stimulation for PD. Neurology. Sep 24 2002;59(6):932-934.
19. Welter ML, Houeto JL, Tezenas du Montcel S, et al. Clinical predictive factors of subthalamic stimulation in Parkinson's disease. Brain : a journal of neurology. Mar 2002;125(Pt 3):575-583.
20. Kleiner-Fisman G, Fisman DN, Sime E, Saint-Cyr JA, Lozano AM, Lang AE. Long-term follow up of bilateral deep brain stimulation of the subthalamic nucleus in patients with advanced Parkinson disease.
Journal of neurosurgery. Sep 2003;99(3):489-495.
21. Deuschl G, Fogel W, Hahne M, et al. Deep-brain stimulation for Parkinson's disease. Journal of neurology. Oct 2002;249 Suppl 3:III/36-39.
22. Group TD-BSfPsDS. Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in Parkinson's disease. The New England journal of medicine. Sep 27 2001;345(13):956-963.
23. Schirmer M. Neurochirurgie. München: Elsevier, Urban & Fischer 2005.
24. Voges J, Kiening K, Krauss JK, Nikkhah G, Vesper J. [Neurosurgical standards in deep brain stimulation : consensus recommendations of the German Deep Brain Stimulation Association]. Der Nervenarzt. Jun 2009;80(6):666-672.