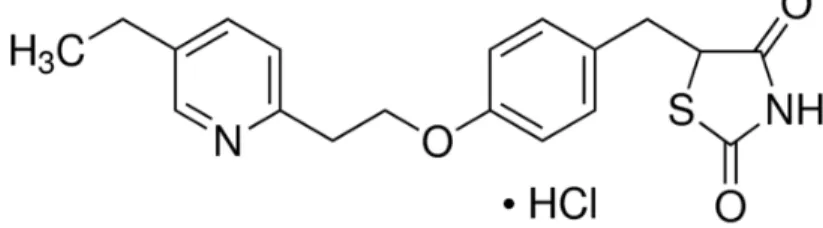
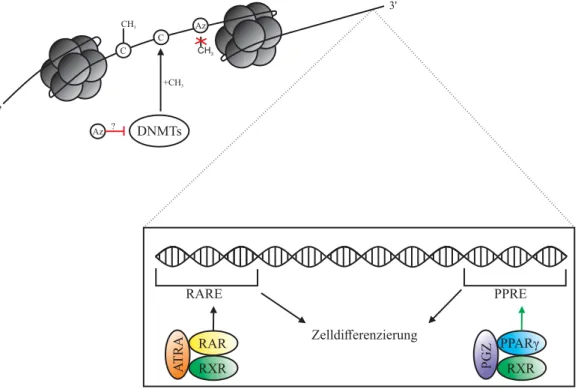
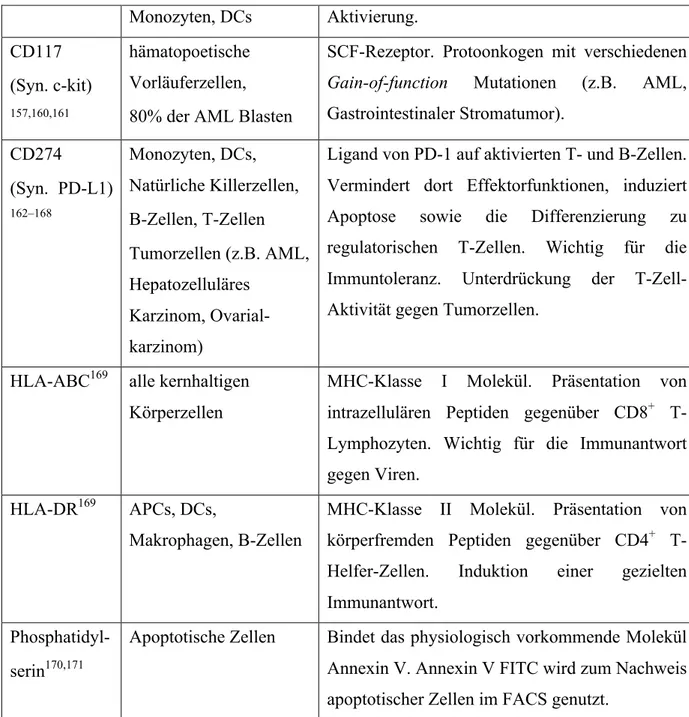
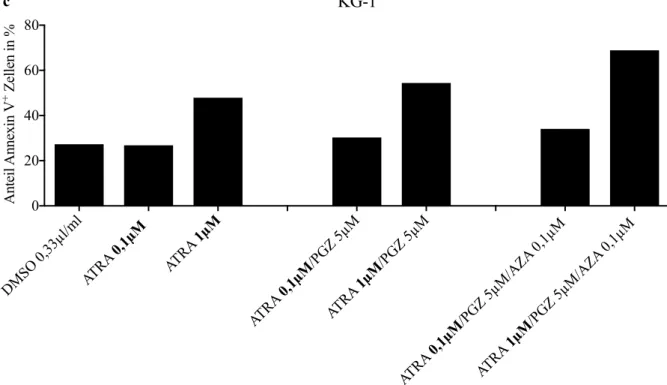
AUS DEM LEHRSTUHL FÜR INNERE MEDIZIN III DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG
Volltext
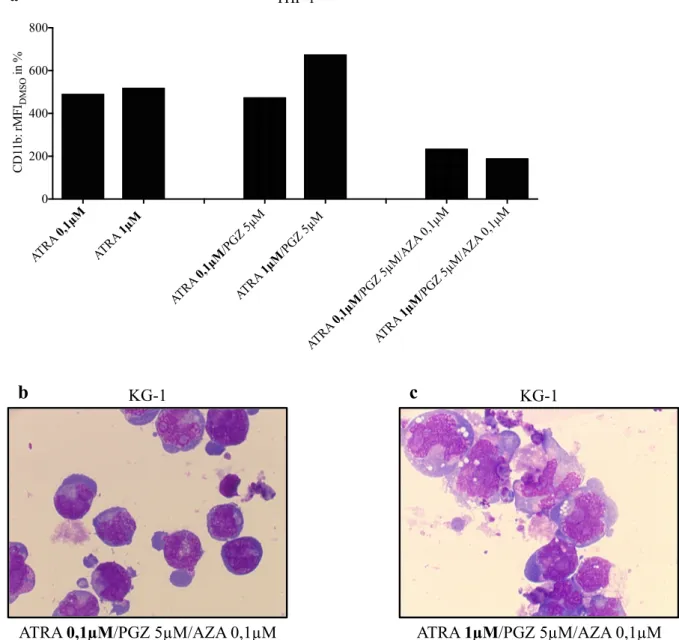
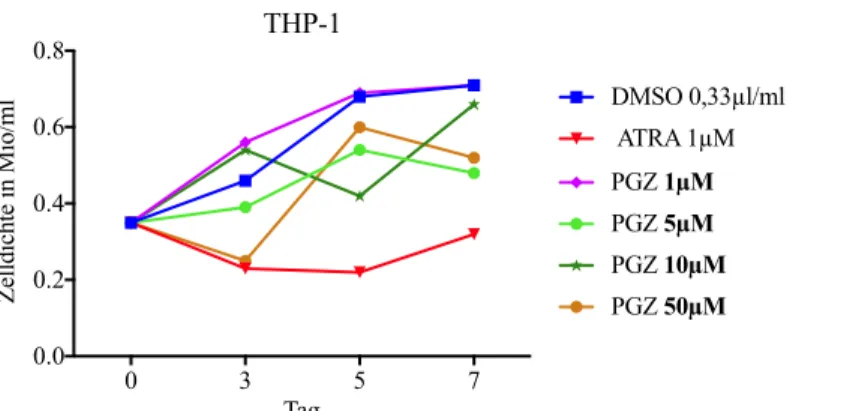
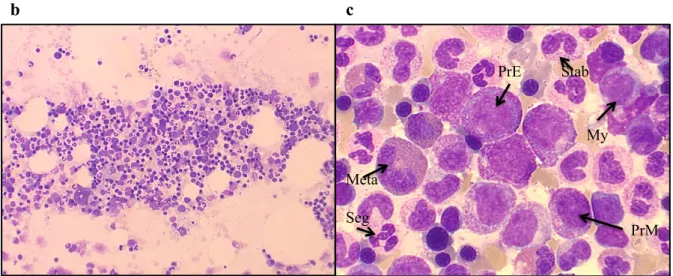
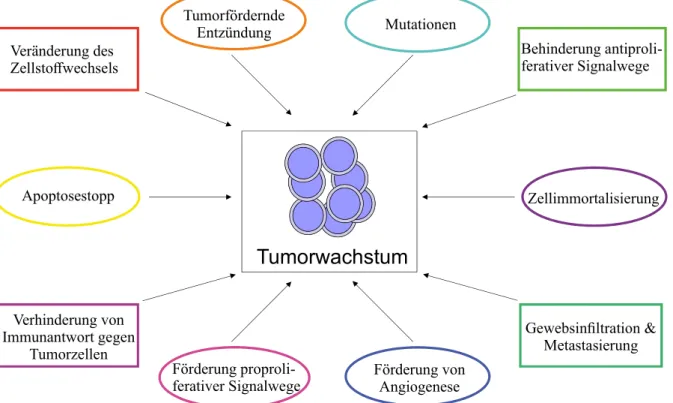
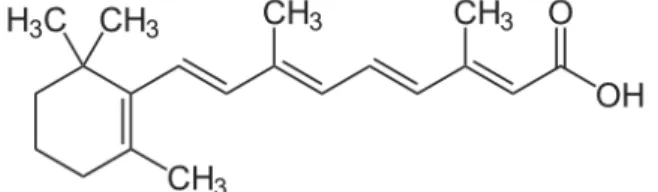
Abbildung

ÄHNLICHE DOKUMENTE
Bei den Ergebnissen für NGAL zeigte sich bei der mit Omapatrilat behandelten herzinsuffizienten Gruppe eine leicht, aber nicht signifikant höhere NGAL-Expression als bei
Weiterhin lieferte diese Methode deutliche Hinweise darauf, dass die mit ATG stimulierten DCs in der Lage sind, die Proliferation von T-Zellen, welche durch reife DCs induziert
Nach dem Aushärten ist es nicht mehr möglich, Objekte nachträglich zu platzieren; dabei bricht die feste Gelatine oder das Agar Agar auf, schließt sich nicht mehr über
In the isolated rat mesenteric bed, electric sympathetic nerve stimulation mimics extensive and/or prolonged SNS activity. This procedure has been examined previously in healthy
Differenziert man in der Gruppe der Patienten aus der rheumatologischen Ambulanz nach der immunsuppressiven Medikation, so zeigen die Patienten unter Methotrexat gegenüber
Eldar Khan, the usurper Shamkhal, the Usmi and Sorkhey of the Qazi-Qomuq gathered in Qazanesh with the intention to attack Khass Bulat Khan, the Shamkhal, 106 but they were
Bei der COPD (chronic obstructive pulmonary disease) handelt es sich nach der Definition der Global Initiative for Chronic Lung Disease (GOLD) um eine häufige
Die fixierten Zellen wurden zweimal mit Permeabilisierungspuffer (PermBuffer, eBioscience, San Diego) gewaschen und danach in 100µl eBioscience PermBuffer aufgenommen und mit