Kapitel 3
Populationsgenetik: Gene und ihre Frequenzen
3.1 Populationsgenetik
Mikroevolutive Prozesse bilden die Grundlage allen Evolutionsgeschehens. Dabei spielt die Dynamik der zugrundeliegenden Gene eine zentrale Rolle. Diese genetische Information (die “Gene”) ist in der Regel die einzige Information, welche an die Nachkommen über die Generationen weitergegeben (vererbt) wird.
Deshalb ist Evolution im wesentlichen eine Änderung der genetischen Information (im Sinne der eigentlichen Mikroevolution, eine Änderung von Genfrequenzen). Diese geschieht auf dem Hintergrund vorhandener Variation und unter dem Einfluss von Evolutionsfaktoren (Selektion, Drift, Mutation, usw.).
Die Populationsgenetik untersucht die natürlicherweise vorkommenden genetischen Unterschiede zwischen Individuen. Diese Unterschiede bilden in ihrer Gesamtheit die genetische Variation. Die Populationsgenetik interessiert sich für die Gründe des Vorkommens und der Veränderung der genetischen Variation über die Generationen. Die genetische Variation ist dabei auf drei hierarchischen Stufen vorhanden: innerhalb Populationen, zwischen Populationen der gleichen Art, zwischen Populationen verschiedener Arten. Die Populationsgenetik befasst sich aber meist mit Variation innerhalb und zwischen Populationen derselben Art. Falls es sich um die Untersuchung genetischer Variation handelt, welche ökologisch wichtige Merkmale (d.h. mit starkem Einfluss auf die Fitness) betrifft, spricht man auch von Oekologischer Genetik. Dieses Gebiet umfasst typischerweise nebst der Populationsgenetik auch die Quantitative Genetik (eine Erweiterung der Populationsgenetik auf die gleichzeitige Betrachtung vieler Gene).
Merkmale sind phänotypische Eigenschaften von Individuen, welche von Interesse für die untersuchte Fragestellung sind (z.B. Körpergösse, Färbung, Verhalten, Stärke der Immunantwort, etc.). Solche Merkmale unterscheiden sich zwischen Individuen; man spricht von phänotypischer Variation. Ein Teil dieser Unterschiede beruht auf entsprechenden genetischen Unterschieden (andere Unterschiede entstehen durch unterschiedliche Umwelten, etc). Phänotypischer Variation beruht damit z.T. auf genotypischer Variation. Wird diese an die Nachkommen weitergegeben, sind Merkmale erblich.
Oekologische Faktoren (z.B. Räuber, Trockenheit, Konkurrenten) verursachen Selektion auf die untersuchten Merkmale (spezialiserte Räuber fressen z.B. vor allem grosse Individuen). Haben diese Merkmale eine erbliche Komponente, verändern sich die Merkmale in einer Population im Laufe eines Evolutionsprozesses. Es entstehen Anpassungen (Adaptation) der Lebewesen an ihre Umwelt (DARWIN’s klassische Lehre der Evolution durch natürliche Selektion). Gleichzeitig ändert sich aber auch die genetische Variation, welche den entsprechenden Merkmalen zugrunde liegt. Die Populationsgenetik ist damit auch eng verknüpft mit Fragen der Selektion, Anpassung und Evolution. Sie beschäftigt sich mit der evolutiven Dynamik von Genen in Populationen, deren Ursachen und Konsequenzen. Populationsgenetik ist damit nicht nur zentral für das Verständnis von Evolutionsprozessen per se, sondern auch von hoher Relevanz für die Umweltwissenschaften (Naturschutzbiologie, Folgen der Klimaveränderung etc.), die Biologie (Populationsbiologie, Oekologie), oder auch die Landwirtschaft (Züchtungen).
Variation
Variation ist eine essentielle Eigenschaft von Lebewesen in Populationen. Praktisch kein Individuum gleicht einem anderen perfekt. Die Unterschiede beruhen auf Unterschieden in den Genen, in der Umwelt, in weiteren Faktoren, und in deren gegenseitigen Interaktionen. Ohne entsprechende Variation wäre Evolution nicht möglich, da Selektion aus verschiedenen Varianten “auswählen” muss.
September 2004
Für eine Verteilung eines Merkmals X in einer Population (mit den Messwerten xi; z.B für Körpergrösse des Individuums i) gelten folgende einfache Definitionen:
n = Anzahl Messwerte
xi = Messwert i (z.B. Körpergösse von Individuum i, bzw. der Klasse i von Individuen) pi = (relative) Häufigkeit des Messwerts i in der Population
- Mittelwert: x=1 n xi
i
! - Varianz: V(x)=1
n (xi!x)
i
" 2; oft wird bei gemessenen Werten 1/n durch 1/(n-1) ersetzt.
Variation ist auch ein wichtiger Begriff in der Statistik und Wahrscheinlichkeitsrechnung. Tatsächlich ist die Mikroevolution auch ein statistischer Prozess. Die statistischen Werkzeuge können deshalb in der Populations- und Evolutionsbiologie sinnvoll genutzt werden. Ein wichtiges Werkzeug ist insbesondere die Zerlegung der Varianzen mithilfe der Varianzanalyse (ANOVA: Analysis of variance), vor allem in der Quantitativen Genetik (s. Kap. 5). Eine Zerlegung ist möglich aufgrund der Additivität von Varianzen (siehe Statistik-Vorlesungen).
3.2 Das Messen der genetischen Variation
Das Standardwerkzeug zum Studium der genetischen Variation ist der genetische Marker. Im Idealfall macht er einzelne Allele (= Varianten eines Gens) sichtbar. Folgende Verfahren stehen zur Verfügung:
a) Sichtbarer Polymorphismus
Das zu untersuchende Merkmal ist polymorph, d.h. es weist verschiedene (meist 2 - 3) Zustände auf (z.B.
Farbvarianten). Im einfachsten Fall entsprechen diese Morphen der Präsenz verschiedener Allele an einem (evtl. zwei oder mehr) Locus. Die Erbsen von GREGOR MENDEL (grün, gelb) sind ein gutes Beispiel für einen einfachen Farbpolymorphismus (mit je einem Allel für die grüne bzw. gelbe Farbe). In diesen einfachen Fällen ist die Präsenz von Allelen daher von aussen direkt sichtbar.
b) Molekulare Marker
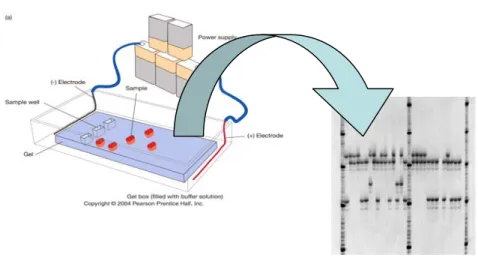
In modernen Untersuchungen werden in der Regel molekulare Marker verwendet. Sie basieren alle auf irgendeiner Anwendung der Elektrophorese (Fig. 3.1). Mit dieser Technik lassen sich verschiedene Varianten von Molekülen auf einem Gel auftrennen.
Die häufigsten Anwendungen der Technik der Elektrophorese sind:
i. Protein (Enzym-) Elektrophorese: Die Produkte der Gene werden direkt analysiert. Allele entsprechen dabei den Allozymen (auch Isozyme genannt). Die Variation in den sichtbar gemachten Proteinen beruht auf Unterschieden in den codierenden Sequenzen. Mit Enzymelektrophorese kann sehr viel mehr genetische Variation sichtbar gemacht werden als dies
mit sichtbaren Polymorphismen möglich ist. Diese Methode wird heute (zu Unrecht) als veraltet angesehen. Sie kann jedoch in vielen Fällen hervorragende Dienste leisten, auch wenn die damit erkannte Variation notwendigerweise kleiner ist als mit direkten DNA-Markern.
ii. RFLP’s (Restriction Fragment Length Polymorphism): Dabei wird eine DNA-Probe mit Restriktionsenzymen vermischt. Die Enzyme zerschneiden die DNA an bestimmten Stellen (abhängig vom verwendeten Restriktionsenzym) in unterschiedlich lange Fragmente. Je nach der zugrundeliegenden DNA Sequenz entstehen dabei auf dem Gel unterschiedliche Muster an dunklen Banden (entsprechend den Fragmenten). Diese Muster können als genetischer Fingerabdruck interpretiert und verwendet werden.
Fig. 3.1 Das Prinzip der Elektrophorese. Links: die Proben werden einzeln an einem Ende eines Gels aufgetragen (sample well). Nach Anlegen einer elektrischen Spannung (Elektroden + und -) wandern die Moleküle der Probe - je nach ihrer Grösse, Struktur, Ladung - entlang des Gels, solange die Spannung aufrechterhalten wird. Rechts: Das elektrische Feld wird ausgeschaltet und das Gel wird der Einrichtung entnommen. Gleiche Moleküle sind an die gleiche Stelle gewandert und können durch Färbung als Banden sichtbar gemacht werden. Kleine Moleküle wandern weiter als grosse. Die entsprechenden Molekul-Grössen können durch kalibrierte “Leitern” abgelesen werden (im Gel rechts als 3 lange Bahnen sichtbar). Diese Elektrophoresemethode wird heute auch mit automatischen DNA-Analyse Geräten durchgeführt (“DNA sequencer”).
Alle folgenden Methoden beruhen auf der PCR-Reaktion (Polymerase Chain Reaction). Diese benützt sog.
Primers, welche bestimmte Sequenzen auf der DNA erkennen und zur Darstellung eines bestimmten, gezielten Abschnitts aus der gesamten DNA-Sequenz benutzt werden. Die PCR-Reaktion kann eine ausgewählte DNA-Sequenz aus wenigen Kopien zu sehr grosser Zahl vervielfältigen (Amplifikation).
Folgende Anwendung der PCR-Reakion werden in der Populations- und Evolutionsbiologie vorzugsweise verwendet:
iii. RAPD (Randomly Amplified Polymorphic DNA): Mit dieser Methode werden Primers benutzt, die eine zufällige Sequenz aufweisen. Die somit amplifizierten DNA-Abschnitte sind zufällig im gesamten Genom verteilt.
iv. AFLP’s (Amplified Fragment Length Polymorphism): Bei dieser Methode wird ähnlich wie bei RFLP’s die DNA mithilfe von Restriktionsenzymen geschnitten. Dabei werden jedoch gleichzeitig an den aufgeschnittenen Enden definierte Sequenzen angehängt. Diese werden dann im nächsten Schritt von den entsprechenden Primers erkannt (wie bei RAPD’s) und die Bruchstücke so gezielter als mit den anderen Methoden amplifiziert.
v. Microsatelliten: Diese werden manchmal auch als VNTRs (Variable Number of Tandem Repeats) bezeichnet. Dabei handelt es sich um Abschnitte der DNA-Sequenz, die sich durch eine
September 2004
Anzahl Wiederholungen des gleichen Motivs kennzeichnen (z.B. Tandems oder Triplets). Diese Wiederholungen können durch geeignete Primers amplifiziert werden. Beispiele sind:
...GCGCGCGCGCGC... 6 Wiederholungen des Tandems (GC) ...AGTAGTAGTAGTAGT... 5 Wiederholungen des Triplets (AGT)
Die Anzahl der Wiederholungen dieser Motive variiert zwischen Individuen. Unterschiedliche Längen von Fragmenten werden als Banden auf dem Gel sichtbar. Microsatelliten dienen als sehr nützliche Marker für verschiedene Allele.
• DNA-Sequenzierung. Die vollständige Sequenzierung eines Abschnitts enthält naturgemäss sehr viel Information. Die Methode ist aber viel aufwendiger, zudem gibt es Komplikationen mit diploiden Genomen.
In der Ökologie und Populationsbiologie sind heute AFLPs und vor allem Mikrosatelliten die am häufigsten benutzten Methoden.
c) Gene, Allele, Frequenzen
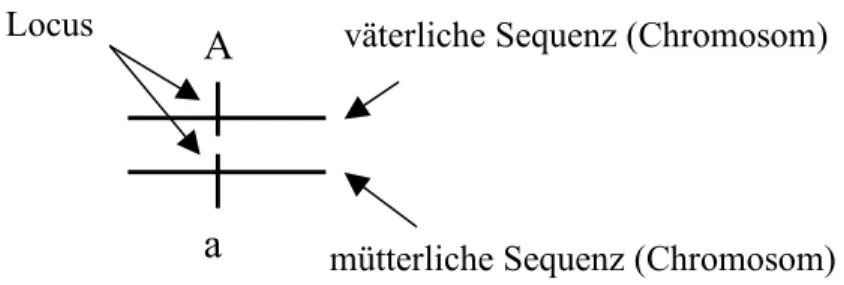
In der Populationsgenetik betrachtet man Allele, d.h. alternative Gene an einem Locus (Fig. 3.2). In einem diploiden Organismus hat ein Locus zwei “Plätze” auf denen je ein Allel vorhanden ist. Die Kombination der beiden Allele ist der Genotyp an diesem Locus. Die Gene (Allele) an einem Locus sind verantwortlich für die Ausprägung eines bestimmten Merkmals, dem entstprechenden Phänotyp. Ein Individuum hat viele solcher Loci in seinem Genom, und entsprechend werden Multi-Locus Genotypen definiert.
Fig 3.2 Ein einfacher Genotyp in der Populationsgenetik - zwei Allele (A, a) an einem Locus. In diesem Beispiel stamme das Allele A vom Vater, das Allel a von der Mutter. Beide Alternativen besetzen einen Locus in diesem diploiden Genom. Der zugehörige Phänotyp (d.h. das Merkmal, das von diesem Locus geprägt wird) variert je nach der Präsenz der Allele A und a (oder allenfalls weiterer Allele B, b, c, usw.).
Der Standardfall in der Populationsgenetik besteht aus einer Population mit diploiden Individuen, die sich sexuell fortpflanzen. Betrachtet man alle N Individuen einer Population so steuert jedes davon 2 Allel für jeden Locus bei, d.h. es sind total 2N Allele pro Locus im Genpool der Population zu finden. Diese werden im Laufe der sexuellen Reproduktion an die Nachkommen weitergegeben. Evolutionsfaktoren bewirken, dass verschiedene Allele unterschiedlich gut in der Nachkommenschaft repräsentiert sind. Die Gesamtheit der Allele und ihre Verteilung auf die Individuen repräsentiert die genetische Variation in der Population.
Eine beobachtete genetische Variation kann durch eine Reihe einfacher Masse (statistisch) charakterisiert werden:
A
a
väterliche Sequenz (Chromosom)
mütterliche Sequenz (Chromosom) Locus
1. Allelfrequenzen: Eine Frequenz ist die relative Häufigkeit (“Prozentsatz”) eines Allels unter den N Individuen bzw. 2N Allelen im Genpool und an einem bestimmten Locus. Die übliche Schreibweise ist:
A, a = Allele an einem Locus. (In der Regel bezeichnet ein grossgeschriebenes A das dominante Allel, das kleingeschriebene a das rezessive Allel).
p = Frequenz des Allels A (0 ≤ p ≤ 1) q = Frequenz des Allels a (0 ≤ q ≤ 1)
Falls nur A und a als Alternativen vorhanden sind, gilt: p + q = 1
2. Genotypfrequenz: Der Genotyp entspricht der Kombination der Allele am betrachteten Locus (bzw. an mehreren Loci). Im einfachsten Falle der Betrachtung eines einzelnen Locus mit 2 Allelen sind folgende drei Genotypen mit den entsprechenden Frequenzen möglich (grossgeschrieben für die Genotypen):
P = Frequenz des Genotyps AA (homozygoter Genotyp) Q = Frequenz des Genotyps aa (homozygoter Genotyp) H = Frequenz des Genotyps Aa (heteorzygoter Genotyp) Und: P + Q + H = 1
Berechnungen: In einer ausgezählten Stichprobe von N Genotypen (N Individuen, welche an einem Locus untersucht wurden) seien folgende Anzahlen gefunden worden:
nAA = Anzahl Genotypen AA nAa = Anzahl Genotypen Aa naa = Anzahl Genotypen aa wobei nAA + nAa + naa = N.
Daraus:
p= 2nAA+nAa 2N q= 2naa+nAa
2N
3.3 Das Hardy-Weinberg Gleichgewicht
a) Frequenzen unter Hardy-Weinberg Bedingungen
Das Hardy-Weinberg Gleichgewicht ist das “Null”-Modell der Populationsgenetik. Es entsteht falls:
• Organismen sind diploid, sexuell und haben diskrete Generationen
• Zufällige Paarungen
• Unendlich (bzw. sehr) grosse Population
• Keine geschlechtsspezifische Unterschiede in den Genfrequenzen
• Allele segregieren nach den Mendel’schen Gesetzen
• Es wirken keine evolutiven Kräfte, d.h. keine Selektion, Genfluss, Drift, Mutation, etc.
September 2004
Berechung: Die Allelfrequenzen in der Eltern- und Nachkommengenerationen können unter diesen Annahmen wie folgt berechnet werden.
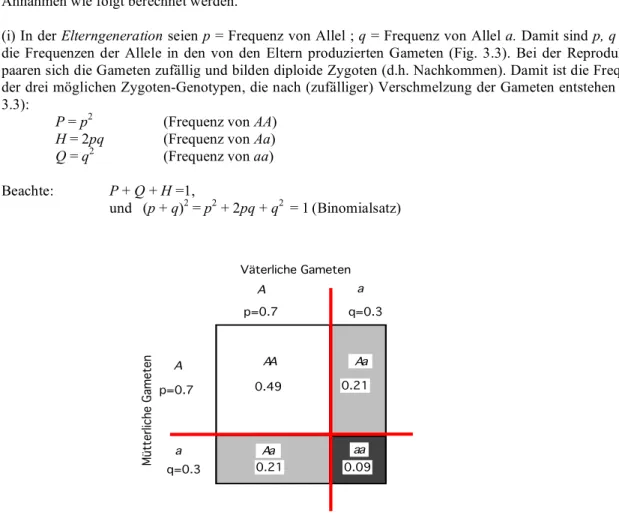
(i) In der Elterngeneration seien p = Frequenz von Allel ; q = Frequenz von Allel a. Damit sind p, q auch die Frequenzen der Allele in den von den Eltern produzierten Gameten (Fig. 3.3). Bei der Reproduktion paaren sich die Gameten zufällig und bilden diploide Zygoten (d.h. Nachkommen). Damit ist die Frequenz der drei möglichen Zygoten-Genotypen, die nach (zufälliger) Verschmelzung der Gameten entstehen (Fig.
3.3):
P = p2 (Frequenz von AA) H = 2pq (Frequenz von Aa) Q = q2 (Frequenz von aa) Beachte: P + Q + H =1,
und (p + q)2 = p2 + 2pq + q2 = 1(Binomialsatz)
Fig 3.3 Das Hardy-Weinberg-Prinzip. Aus den Frequenzen der (haploiden) Gameten (p, q) lassen sich auf einfache Weise die Frequenzen der drei möglichen Genotypen (AA, Aa, aa) in den entstehenden Zygoten (d.h. den Nachkommen) berechnen. In diesem Beispiel p = 0.7, q = 0.3.
(ii) Frequenzen in den Nachkommen. Mit den Frequenzen P, Q, H lassen sich wiederum die Allelfrequenzen für A, a in dieser Nachkommenschaft bestimmen (d.h. die Frequenzen p’ und q’ in der nachfolgenden Generation):
Frequenz von A: p'=P'+H'
2 =p2+2pq 2 =p Frequenz von a: q'=Q'+H'
2 =q2+2pq 2 =q
Das heisst unter den Annahmen von Hardy-Weinberg verändern sich die Allelfrequenzen von einer Generation zur anderen nicht (p’ = p und q’ = q; und damit auch keine Veränderung der Genotypfrequenzen). Die Frequenzen sind im sog. Hardy-Weinberg Gleichgewicht. Es findet keine Evolution statt. (Dieses Gleichgewicht wird schon nach einer Generation erreicht, egal welche Anfangsfrequenzen in der Population vorliegen.) Im Hardy-Weinberg-Gleichgewicht sind die Frequenzen der drei Genotpyen stets eine einfache Funktion der Frequenzen der Allele A und a (Fig.3.4).
A
A
a
a
AA p=0.7
p=0.7
q=0.3
q=0.3
0.49
Aa 0.21
Aa 0.21
aa 0.09 Väterliche Gameten
Mütterliche Gameten
Fig3.4 Das Hardy-Weinberg-Gleichgewicht. Die Frequenzen der Genotypen AA, Aa, aa sind als Funktion der Frequenzen des Allels A (p) bzw. Allel a (q) gegeben.
b) Sind natürliche Population im Hardy-Weinberg-Gleichgewicht?
Einer der hauptsächlichen Nutzen des Konzepts des Hardy-Weinberg-Gleichgewichts besteht darin, reale Populationen auf Abweichungen zu prüfen. Gibt es Abweichungen ist mindestens eine der Annahmen falsch (die Populationsgrösse steht dabei meist nicht im Mittelpunkt; s. Dikussion der Inzucht).
Beispiel 1: Panaxia diminula (eine Motte).
Eine Stichprobe von N = 1’612 Individuen wurde untersucht und ihre Genotypen mittels Enzym- Elektrophorese bestimmt (Tab. 3.1).
Tab 3.1 Genotypfrequenzen bei Panaxia diminula
Beobachtete Anzahl Individuen Erwartete Anzahl Individuen
Genotyp1 Anzahl Frequenz Anzahl
BB 1469 0.910 1467.1
BD 138 0.002 141.5
DD 5 0.088 3.4
Total N = 1612 1.000 N = 1612
1 Das untersuchte Enzym ist die Alkohol-Dehydrogenase (ADH), welche einen Polymorphismus mit zwei Enzymvarianten (B und D) aufweist
Frage: Entsprechen die beobachteten Zahlenverhältnisse einem Hardy-Weinberg-Gleichgewicht?
Antwort: Man berechnet die unter dem Hardy-Weinberg-Gleichgewicht zu erwartenden Frequenzen und vergleicht diese mit den Beobachtungen der Tab. 3.1 mittels des X2 -Tests.
Berechnung der Frequenzen p, q aus Tab. 3.1:
- Frequenz des Allels B: p = (1469 + 69) / 1612 = 0.954 - Frequenz des Allels D: q = (5 + 69) / 1612 = 0.046 Daraus: Erwartete Frequenzen unter Hardy-Weinberg :
- Frequenz des Genotyps BB: p2 = 0.9542 = 0.910 - Frequenz des Genotyps DD: q2 = 0.0462 = 0.002 - Frequenz des Genotyps BD: 2pq = 0.954 • 0.046 = 0.088
Die erwartete Anzahl Individuen welche einen bestimmten Genotyp aufweisen sollte, ist demnach für:
September 2004
Anzahl BB = N p2, Anzahl DD = N q2, Anzahl BD = N 2pq
Die erwartete Anzahl wird mit der beobachteten Anzahl mithilfe des X2- Test verglichen. Die Testgrösse, X2, errechnet sich nach:
!2= (beobachtet"erwartet)2
erwartet
#
mit Tab. 3.1: !2=(1469"1467.1)2
1467.1 +(138"141.5)2
141.5 +(5"3.4)2
3.4 =0.842
Ist die Testgrösse X2 = 0.842 signifikant, d.h. zeigt sich eine Abweichung zwischen Beobachtung und Erwartung? Dazu wird der Wert X2 = 0.842 mit dem kritischen Wert für eine Signifikanz von P = 0.05 (die in der Biologie übliche Irrtumswahrscheinlichkeit von 5%) verglichen. Diese kritischen Werte sind in Statistikbüchern tabelliert. Im vorliegenden Fall muss der Wert für einen Freiheitsgrad von df = 1 gesucht werden (für die Diskussion des Freiheitsgrades, siehe Statistikvorlesung). Hier: X2 1, 5% = 3.4.
Der Vergleich zeigt: X2 = 0.842 < X2 1, 5% = 3.4, d.h. der kritische Wert wird durch die gerechnete Testgrösse nicht überschritten. Schluss: die Beobachtungen sind nicht signifikant verschieden von den Erwartungen; die Population ist im Hardy-Weinberg-Gleichgewicht.
Beispiel 2: Coelopa frigida. Stichprobe von N = 111 Individuen (d.. total 222 Allele)
Tab 3.2 Genotypfrequenzen bei Coelopa frigida (vgl. Erklärungen in Tab.3.1).
Beobachtet Erwartet
Genotyp Anzahl Frequenz Anzahl
BB 12 0.157 17.43
BD 64 0.478 53.06
DD 35 0.365 40.51
Total N = 111 1.000 N = 111
Berechnung:
Erwartete Frequenzen nach Hardy-Weinberg (hier mit der Anzahl Allele, 2N = 222, gerechnet):
Allel B: p = (24 + 64) / 222 = 0.396 Allel D: q = (70 + 64)/ 222 = 0.604 Daraus: P = p2; Q = q2; H = 2pq, und X2 = 4.66;
Vergleich mit kritischem Wert (df = 1): X2 = 4.66 > X2 1, 5% = 3.4. Schluss. die Beobachtung ist signifikant verschieden von der Erwartung (genauer Signifikanzwert: P = 0.03). Diese Population weicht von Hardy- Weinberg ab.
B B B DD D
1 2 6 4 3 5 N
= 1 1 1
2 N
= 22
2 Al lel e
3.4 Abweichungen durch Nicht-zufällige Paarung
Abweichungen vom Hardy-Weinberg-Gleichgewicht können aus einer grossen Anzahl von Gründen auftreten. Eine häufige Verletzung der Annahmen beruht auf nicht-zufälligen Paarungen bzw. Inzucht.
Solche Paarungen verteilen die Allele auf die Genotypen in anderer Weise als es nach Zufall zu erwarten wäre.
a) Assortative Paarung
(Positive) assortative Paarung: Oft paaren sich Individuen nach gewissen ähnlichen Eigenschaften (Phänotypen), z.B. nach Körpergrösse, überlappende Blütezeiten bei Pflanzen, ökonomischer Status beim Menschen. Insofern diese Eigenschaften auf genetische Faktoren zurückgehen, erzeugt assortative Paarung einen erhöhten Grad von Homozygotie an den enstprechenden Loci d.h. die Nachkommen dieser Paarungen weisen mehr gleiche Allele (von Vater bzw. Mutter) an den massgebenden Loci auf.
Negative assortative Paarung: In diesem Fall paaren sich Individuen mit gegensätzlichen Eigenschaften (Phänotypen) mit erhöhter Wahrscheinlichkeit. Genetisch führt dies zu erhöhter Heterozygotie an den entsprechenden Loci. Ein gutes Beispiel dafür sind die Phänomene der Selbst-Inkompatibilität bei Pflanzen.
b) Inzucht
Im eigentlichen Sinne bezeichnet Inzucht die Paarung zwischen verwandten Individuen, d.h. Individuen, welche gemeinsame Vorfahren haben. Der Grad der Verwandschaft muss dabei relativ eng sein, damit merkbare genetische Effekte wirklich auftreten.
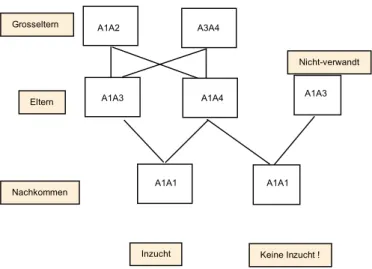
Fig 3.5 Inzucht (Schema): Inzucht entsteht, wenn verwandte Individuen Allele identischer Abstammung zur Nachkkommenschaft beisteuern. Sind Allele “per Zufall” identisch, so liegt keine eigentliche Inzucht vor.
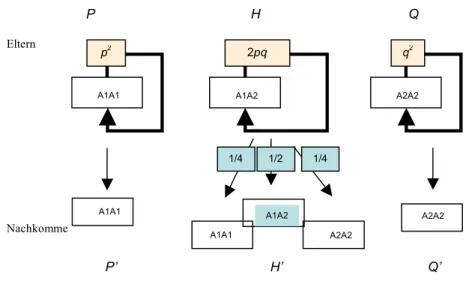
Beispiel: Selbstbefruchutng bei Pflanzen (Fig.3.6) als extremes Beispiel der Inzucht.
Die Elterngeneration ist im Hardy-Weinberg-Gleichgewicht. Was sind die Genotypfrequenzen nach einer Runde von Inzucht?
A1A2 A3A4
A1A3 A1A4
A1A1 Grosseltern
Eltern
Nachkommen
Inzucht Keine Inzucht !
A1A3
A1A1
Nicht-verwandt
September 2004 Berechnung:
- Elterngeneration:
P=p2;H=2pq;Q=q2 - Nachkommen (vgl. Fig.3.6):
P'=p2+1
42pq=p2+ pq 2
!
"#
$
%&
H'=2pq!1
22pq=pq Q'=q2+1
42pq=q2+ pq 2
!
"#
$
%&
d.h. Inzucht führt dazu, dass die Heterozygoten (H’) abnehmen und die Homzygoten (P’,Q’) zunehmen.
Fig 3.6 Inzucht unter Selbstbefruchtung. Für die Berechnung der Frequenzen P’, H’, Q’, siehe Text.
Der F-Wert
Der berechenbare Verlust an Heterzygoten kann durch die Definition des Inzuchts-Koeffizienten vereinfacht werden. Der F-Wert (Inzuchts-Koeffizient) vergleicht den Anteil der Heterozygoten (H) in der Population mit denjenigen, welche unter zufälliger Paarung (H0) zu ewarten wären:
Definition: F=H0!H H0
; Bereich: (-1 ≤ F ≤ +1)
wobei H0 = 2pq (zufällige Paarung, d.h. nach Hardy-Weinberg erwartet), H = beobachtete Heterozygosität.
Im Falle eines Hardy-Weinberg-Gleichgewichts ist H = 2pq, d.h. F = 0. Bei vollständiger Inzucht gilt H = 0 und deshalb F = 1.
A2A2
A1A1 A1A2
A1A1 A2A2
1/4 1/2 1/4
A1A1 p2
P’ H’ Q’
A1A2 A2A2
2pq q2
P H Q
Eltern
Nachkomme n
Der F-Wert beschreibt auch die Abnahme der Heterozygoten pro Generation:
- von Generation 0 zu Generation 1: H1 = H0(1-F).
- nach t Generationen: Ht=H0 1( !F)t
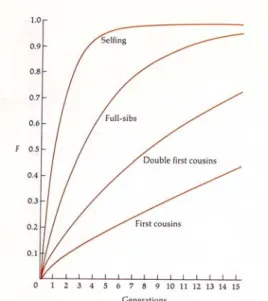
Fig.3.7 Zunahme des Inzuchtwerts (dies charakterisiert den Verlust an Heterozygoten gegenüber dem Hardy-Weinberg- Gleichgewicht) bei fortgesetzter Inzucht unter Verwandten.
Der Verwandtschaftsgrad bestimmt die Wirkung der Inzucht (s. auch Fig.3.8).
Fig 3.8 Berechnen des F-Werts aus bekanntem Stammbaum. Homozygote können in den Nachkommen auf zwei Arten entstehen (links: Entstehung von AA, rechts: BB), entsprechend den ursprünglichen, durch gemeinsame Abstammung vererbte Allele. Für die Berechnung, siehe Text.
Beispiel: Berechnung des F-Wertes aus bekanntem Stammbaum (Fig.3.8):
In der Elterngeneration gibt es den Genotyp AB an einem Locus. Zwei der erzeugten Halbgeschwister paaren sich und haben ihrerseits Nachkommen. In diesen können Homozygote durch Inzucht auf zwei Arten entstehen - Genotyp AA und Genotyp BB. Wie gross ist die Wahrscheinlichkeit (bei Stammbaum der Fig.3.8), dass entweder der eine oder andere dieser Genotypen entsteht?
In den Halbgeschwistern ist die Wahrscheinlichkeit das Allel A bzw B durch Abstammung gemeinsam ist (d.h. in beiden vorkommt) jeweils (1/2)(1/2) = 1/4. Entsprechend ist die Wahrscheinlichkeit, dass in den
1/2 1/2
1/2 1/2
AB AB
A - A - B - B -
AA BB
1/2
1/2 1/2
September 2004
Nachkommen der Halbgeschwister beide dieser Allele (A bzw, B) zusammen vererbt werden: (1/2)(1/2)
=1/4. Daraus berechnen sich die Wahrscheinlichkeiten:
P(AA) = (1/4)(1/4) = 1/16 P(BB) = (1/4)(1/4) = 1/16 und:
P(AA oder BB) = (1/16) + (1/16) = 1/8
d.h. Inzuchtskoeffizient für dieses Paarungsschema: F = 1/8.
Fitness-Effekte von Inzucht
Fitnessverlust bei Inzucht ist eine häufige Erscheinung (Fig.3.9). Dies gilt aber nicht universell. In einigen Fällen sind keine offen-
sichtlichen Nachteile beobachtet worden.
Fig. 3.9 Bei Kohlmeisen (Parus major) hängt die Schlüpfrate der Eier vom Inzuchtskoeffizienten (F) ab. Bei Brutpaaren, die einen hohen Inzuchtsgrad aufweisen, entwickeln sich die meisten Eier schlecht, so dass aus vielen Eiern keine Jungtiere schlüpfen. Die Ursache ist nicht genau bekannt.