Philipps Universität Marburg Fachbereich Chemie Lehramt Wintersemester 2006/2007
Seminar: Übungen im Experimentalvortrag (OC)
Natürliche und synthetische Fasern
Astrid Höhle
Willinger Str. 9
34497 Korbach
Inhaltsverzeichnis:
1. Einleitung...3
2. Definition...3
3. Zur Geschichte der (Textil-)fasern...4
Die ersten natürlichen Fasern...4
Die ersten Chemiefasern...5
3. Fasern- Ein Überblick...7
Demonstration 1: Die Griff- und Knitterprobe...7
Demonstration 2: Die Brennprobe...9
4. Naturfasern...14
Versuch 1: Cellulosenachweis...18
Versuch 2: Was haben Wolle und Seide gemeinsam?...21
5. Abgewandelte Naturfasern...25
Versuch 3: Herstellung von Kupferseide...28
6. Synthesfasern...31
Versuch 4: Nylondarstellung...32
7. Weiterverarbeitung...36
Demonstration 3: Schmelzspinnen von Polyamid...36
8. Textilveredelung...39
Versuch 5: Mercerisieren und Färben von Baumwolle...39
9. Schulrelevanz...42
10. Bildnachweise...43
11. Literaturnachweise...43
1. Einleitung:
Als eigenständiges, abgeschlossenes Thema werden natürliche sowie synthetische Fasern in der Schule nur äußerst selten unterrichtet. Der hessische Lehrplan sieht explizit als Thema in Klasse 12 (für das achtjährige Gymnasium) natürliche Fasern vor. Synthetische Fasern hingegen werden zumeist nur im Zusammenhang mit Kunststoffen und Polymerisationsreaktionen thematisiert. Eine Gegenüberstellung und verknüpfende Betrachtung dieser beiden Fasergruppen ist nicht vorgeschrieben und erfolgt zumeist auch nicht. Trotzdem ist das Thema für die Schule sehr gut geeignet. Gerade im Zusammenhang mit Mode und Kleidung und somit vom Standpunkt der Textilfasern bietet es sich für jeden Chemieunterricht an. Der so oft geforderte Alltagsbezug wird bei diesem Thema mehr als erfüllt: Wir alle sind täglich umgeben von Fasern, sei es, um nur ein paar wenige Beispiele zu erwähnen, in Form von Textilfasern, Papierfasern oder aber auch modernen Glasfasern.
Schon früh lernen die Schüler in ihrem "normalen" Leben die verschiedenen Fasern kennen.
Ein Blick in den Pulli oder die Jacke genügt und auf den eingenähten Schildern werden uns die verschiedenen Fasern aufgezeigt. Da gibt es Baumwolle, Polyester, Viskose, Seide und vieles mehr. Doch was ist das überhaupt? Was unterscheidet diese Fasern oder haben einige von ihnen doch mehr miteinander gemeinsam als man glaubt? Diese Fragestellungen resultieren bereits aus dem Alltag der Schüler und können vom Lehrer im Unterricht leicht aufgegriffen werden. Hierzu eignet sich wohl am besten eine Projektunterrichtseinheit in der die Schüler die Thematik Fasern von verschiedenen Seiten chemisch beleuchten können.
Auch fächerübergreifende Arbeiten z.B. mit der Biologie sind möglich. Da das Thema jedoch sehr weit reichend ist, ist eine alles umfassende Bearbeitung nahezu ausgeschlossen. Daher sollte man je nach Intention, Vorwissen und Interesse der Schüler den Schwerpunkt auf einen Bereich der Fasern legen. Hier bieten sich z.B. die in meinem Vortrag intensiver behandelten Textilfasern an. Man könnte aber auch eine Einheit über Papierfasern oder moderne High- Tech-Fasern gestalten.
2. Definition
Bei Fasern handelt es sich um lang gestreckte Aggregate, deren Moleküle oder Kristalle in der
Moleküllängsrichtung oder einer Gittergeraden überall gleichgerichtet sind. Diese Definition
erscheint jedoch zunächst sehr nüchtern, wird aber im Folgenden an konkreten Beispielen illustriert.
3. Zur Geschichte der (Textil-)fasern
Die ersten natürlichen Fasern:
In der Altsteinzeit vor ca. 125 000 Jahren verließen die Menschen die Warmzonen der Erde.
Daher wurde es sie nötig sich mit Kleidung vor der Witterung zu schützen und die ersten Kleidungsstücke aus Fell entstanden. Noch in der Steinzeit lernten die Menschen Pflanzen zu verflechten und es wurden bereits mit einfachen Hilfsmitteln Tierhaare und Pflanzenfasern (zumeist aus Rohstoffen aus der umgebenden Natur) zu Garnen verarbeitet. Diese wurden nicht nur für Bekleidung genutzt, sondern auch als Schnüre für Netze zum Fischfang usw..
Die Kunst der Textiliengestaltung entwickelte sich vermutlich zeitgleich an verschiedenen Stellen auf der Erde. Daher weiß man auch nicht, wo die Technik des Spinnens zuerst entwickelt wurde, doch es gibt Anhaltspunkte, dass schon in der Steinzeit lange Fäden bzw.
Garne eingesetzt wurden. Auch weiß man, dass schon vor 5 000 Jahren die Sumerer Flachs anbauten und diesen zu Leinen verarbeiteten. Funde belegen, dass auch die Ägypter 3 000 v.
Chr. bereits Kleidung aus Leinen trugen. Aber auch in unseren Breitenkreisen, also bei den Germanen, wurde Leinen hergestellt, später dann die Schafwolle. Man geht sogar davon aus, dass 3 000 v. Chr. in Europa bereits Webstühle zum Einsatz kamen.
Aber nicht nur Leinen war schon früh bekannt, so setzten die Inkas 2 700 v. Chr. Baumwolle ein und in China begann vermutlich die Zucht von Seidenspinnerraupen. Dieser Zeitpunkt ist nicht genau bestimmt, denn die Chinesen bewahrten das Geheimnis der Seidenproduktion über viele Jahrhunderte und hatten somit ein Monopol. Dementsprechend wertvoll war Seide.
Auch Filz gibt es wohl schon seit sehr langer Zeit. So stellten Römer und Griechen aus Tierhaaren unter Einwirkung von Feuchtigkeit, Wärme, Druck und Walkmitteln (Harz, Seife) Stoffe her.
Diese Verfahren überdauerten lange, doch mit steigender Bevölkerungszahl, wurde zum einen
eine größere Menge an Textilien benötigt, vor allem aber auch mehr Nahrung. Daher wurde
auf Feldern zunehmend nicht mehr Flachs angebaut und ebenso ging die Schafszucht zu
Gunsten der Nahrungsmittelproduktion zurück. Viele Gebiete mussten daher Rohstoffe
importieren. So wurde versucht in der Empire- und Biedermeierzeit bei der Textilproduktion möglichst Stoff sparend zu arbeiten.
Ein Umschwung trat im 19. Jahrhundert zu Zeiten Napoleons III ein. Dessen Gemahlin Eugenie entwarf eine Mode für die große Mengen an Stoff von Nöten waren. Aber nicht nur für Kleidung wurde viel Stoff benötigt; die Menschen begannen nun auch ihre Wohnungen mit Dingen wie Gardinen und Bordüren zu schmücken. Durch die Industrialisierung stieg zeitgleich der Wohlstand, sodass ein großer Teil der Bevölkerung nun an der Mode teilhaben konnte. Da nun aber gerade in Europa aus klimatischen und räumlichen Gründen der Anbau von z.B. Baumwolle nicht möglich war, mussten Alternativen gefunden werden. Dies leitete den Beginn der Chemiefaserproduktion ein.
Die ersten Chemiefasern:
Mitte des 19. Jahrhunderts fanden dank einer Entdeckung des Baselers Christian Schönbein
erstmals abgewandelte Polymere auf Basis von Cellulose-Molekülen Verwendung als
Textilfaser. Schönbein fand zufällig heraus, dass Cellulose nitrierbar ist. So konnte aus Holz
z.B. Viskose, eine Faser, die sich zur Herstellung von Textilien hervorragend eignet,
gewonnen werden. Die eigentlichen Chemiefasern wurden jedoch erst etwa 40 Jahre später
entwickelt. Graf Louis Bernigaud St. Hilaire de Chardonnet stellte aus nitrierter Cellulose,
welche in einem Gemisch aus Ethanol und Ether gelöst war, Nitroseide her. Nach ihm ist
daher die Chadonnet-Seide benannt, welche zudem durch Denitrierung schwer entflammbar
gemacht wurde. Etwa 10 Jahre später gelang es dem deutschen Chemiker H. Pauly
Kupferseide herzustellen. Hierzu nutzte er aus, dass Cellulose in einer Tetrammin-Kupfer(II)-
hydroxid-Lösung, dem so genannten Schweizer-Reagenz gelöst werden kann. (s. auch
Versuch Herstellung von Kupferseide). Kurze Zeit später gewannen Cross, Bevan und Beadle
mittels der Xanthogenatbildung Viskose-Seide. Hierzu verwendeten sie eine Cellulose-
Lösung in einem Gemisch von Schwefelkohlenstoff und Natronlauge. Bereits einige Jahre
zuvor hatte in Frankreich P. Schützenberger Acetylcellulose entdeckt. Diese eignete sich
jedoch noch nicht für die Textilverarbeitung. Erst 1899 fand Leonard Lederer eine
Möglichkeit diese Kunstseide verspinnbar zu machen. Hierzu wurde das zunächst entstehende
Cellulosetriacetat teilweise rückverseift. Hierdurch konnte man das erhaltene Produkt in
Aceton lösen und schließlich verspinnen. Durch diese Entwicklungen schnellte die weltweite
Kunstseideproduktion bis 1913 auf die beträchtliche Menge von 11 600 t.
Etwa 20 Jahre später und nach umfassender Forschung auf dem Gebiet der Polymerisationsreaktion synthetisierte 1935 Wallace Rume Carothers bei Du Pont aus Hexamethylendiamin (1,6 Diaminohexan) und Adipinsäure das erste Polyamid. Hierbei erhielt er eine amorphe Schmelze, welche mit Hilfe von Düsen zu Fäden verarbeitet und schließlich verstreckt wurden. Dadurch erhielten die Fäden eine extreme Reißfestigkeit. Noch heute findet dieses Polyamid 6,6 unter der Bezeichnung Nylon (New York und London) Einsatz in vielen Gebieten. In den USA kamen 1940 die ersten Nylonstrümpfe auf den Markt und revolutionierten diesen. Etwa zeitgleich (1938) gelang in Deutschland Paul Schlack die Herstellung von Perlon (bzw. auf dem amerikanischen Markt Nylon 6) aus ε-Caprolactam mit Hilfe eines Katalysators und unter großer Hitze. Carothers hatte ebenfalls an dieser Synthese gearbeitet, diese jedoch nach einiger Zeit als nicht realisierbar verworfen.
Auch hatte Carothers in Zusammenhang mit verschiedensten Polymerisationsreaktionen versucht einen Polyester darzustellen und dies wiederum verworfen. Diese Idee griffen jedoch die beiden Engländer John R. Whinfield und James T. Dickson wieder auf. Im Gegensatz zu Carothers, welcher als Ausgangsstoffe stets geradlinige Kohlenstoffketten, also Aliphaten, verwendet hatte, setzen die beiden Engländer auf den Einbau von Benzolringen. Diese sollten den Faden unempfindlicher gegen Temperatur und allgemein widerstandfähiger machen. Sie setzen also Terephthalsäure und Glykol ein. Polykondensation lieferte ihnen einen Polyglykolterephtalsäureester, aus welchem leicht beständige Fäden für die Textilverarbeitung erhalten werden konnten. Ab 1953 ging diese Faser unter der Bezeichnung Terylen® in Großproduktion. Zwei Jahre später stellte die Hoechst AG die Polyesterfaser Trevira® her.
Ebenfalls bereits 1930 kam Acrylsäurenitril (bzw. Acrylnitril oder Propennitril) bei der
Copolymerisation mit Butadien beim Synthesekautschukprozess zum Einsatz. Dies sollte aber
nicht das einzige Verwendungsgebiet bleiben. Schon bald setzte man es zur Herstellung von
Thermoplasten, Elastomeren und Fasern ein. 1939 glückte Walter Reppe eine einfache und
kosteneffiziente Herstellung von Acrylsäure. Hierzu setzet er Acethylen (bzw. Ethin) mit
Kohlenstoffmonoxid bei Anwesenheit von Wasser oder aber Alkoholen um. Doch es sollte
noch drei Jahre dauern, bis Polyacrylnitril Einsatz als Faser finden konnte, denn zunächst gab
es kein geeignetes Lösemittel. 1942 fand jedoch Herbert Rein heraus, dass sich Polyacrylnitril
in Dimethylformamid, Dimethylacetamid und Dimethylsulfoxid lösen lässt. Wiederum
nahezu zeitgleich wurde jedoch in den USA von R. C. Houtz Polyacrylnitril in Dimethylformamid gelöst und im Nassspinnverfahren weiterverarbeitet. Im Handel findet man die so erhaltenen Fasern unter den Bezeichnungen Orlon® (Du Pont) bzw. in Deutschland als Dolan® oder aber auch Dralon®.
3. Fasern- Ein Überblick
Wie bereits erwähnt ist der Begriff der Fasern weit reichend. Dementsprechend unterschiedlich verhalten sich auch die unterschiedlichen Fasern. Trotzdem gibt es Möglichkeiten die Fasern in Gruppen zusammenzufassen und zu ordnen. Diese Einteilungen können jedoch, ja nachdem auf welche Aspekte das Hauptaugenmerk gelegt wurde, unterschiedlich erfolgen. Unten stehender Grafik stellt eine mögliche Einteilung der Fasern dar, wie sie häufig zu finden ist. Hierbei wird zunächst grob zwischen Natur- und Chemiefasern unterschieden, da sich diese sowohl in Herkunft als auch in ihren Eigenschaften deutlich unterscheiden. Von diesen beiden großen Klassen lassen sich weitere Untergruppierungen bilden, so unterscheidet man bei den Naturfasern solche mit pflanzlicher, tierischer oder aber mineralischer Herkunft. Bei den Chemiefasern betrachtet man abgewandelte Naturstoffe, synthetische Polymere und Fasern aus anorganischen Rohstoffen.
Zur Identifizierung von Naturfasern bieten sich mehrere Verfahren an. Eines der einfachsten Verfahren zu einer ersten Unterscheidung, das wir wohl alle aus dem Alltag kennen, ist die Griff- und Knitterprobe.
Demonstration 1: Die Griff- und Knitterprobe
Chemikalien:
Stoffproben: Leinen, Polyamid, Baumwolle, Viskose, Acetat, Polyester, Schurwolle, Seide
Geräte:
Schere
Tesa-Film
2 Bogen Tonpapier Durchführung:
Vor Beginn des eigentlichen Versuches werden etwa in Größe einer Postkarte acht Probe der oben genannten Stoffe mit der Schere zugeschnitten. Diese befestigt man nun mit Tesafilm auf dem Tonpapier. Unter der Stoffprobe wird verdeckt die jeweilige Bezeichnung dieser notiert, es besteht in der Schule aber auch die Möglichkeit diese erst nach Abschluss des Versuchs bekannt zu geben. Anschließend können die so vorbereiteten Tafeln mit Proben herumgegeben werden. Die Probanden sollen den Stoff zuerst optisch begutachten, dann die Struktur fühlen und diesen schließlich auch knittern. Durch Vergleich sollen Eigenschaften der einzelnen Proben herausgefunden werden. Auch sollen Gemeinsamkeiten und Unterschiede sowohl in Bezug auf die Oberflächenbeschaffenheit als auch auf das Knittervermögen herausgearbeitet werden.
Beobachtung und Erklärung:
Durch die Griffprobe lassen sich im Wesentlichen nur die Naturfasern gut von einander unterscheiden. Auch stellt sich das Problem, dass die Stoffproben, wenn man sie im Geschäft erwirbt, oft bereits mit speziellen Verfahren behandelt wurden, sodass nicht mehr die selben fasertypischen Eigenschaften wie bei den natur belassenen Fasern erfühlt werden können. Im Versuch sollten die Fasern folgende Eigenschaften zeigen:
Baumwolle Warm, fest
Leinen Kühl, steif
Schafwolle Warm, rau, weich
Seide Glatt, weich
Synthetische Fasern Unterscheidung schwer mgl.
Auch das Knitterverhalten eines Gewebes kann bereits erste Anhaltspunkte zur Identifizierung des Faserrohstoffes, aus dem es besteht, bieten. Allerdings muss wie bei der Griffprobe erwähnt werden, dass durch chemische Behandlung das fasertypische Knitterverhalten etwas verändert sein könnte. Nach kurzem Knittern in der der Hand sollte man folgende Unterschiede im Knitterverhalten der einzelnen Proben feststellen können:
Sehr starkes Knittern Leinen (Flachs)
Starkes Knittern Baumwolle, Viskose, Seide Geringes Knittern Wolle, Acetat, Polyamid Sehr geringes Knittern Polyester
Entsorgung:
Bei diesen Demonstrationen bietet es sich an, die einmal vorbereiteten Tafeln mit den Stoffproben für weitere Unterrichtszwecke aufzubewahren.
Diesen noch relativ unspezifischen ersten Proben kann man nun weitere anschließen. So kann man zum Beispiel ausnutzen, dass die verschiedenen chemischen Zusammensetzungen einer Faser unterschiedliche Verhalten bei der Verbrennung in der Hitze der offenen Flamme zeigen. Auch gibt der Verbrennungsrückstand Aufschlüsse über die eingesetzten Fasern.
Demonstration 2: Die Brennprobe
Chemikalien:
Stoffproben: Schurwolle, Polyester, Baumwolle
Geräte:
Feuerzeug
Feuerfeste Unterlage
Tiegelzange
3 kleine Porzellanschalen zum Auffangen des Verbrennungsrückstandes.
Durchführung:
Kleine Proben der drei Stoffe werden vorbereitet. Nun hält man eine der Stoffproben mit der Tiegelzange fest und zündet diese an der unteren Ecke mit dem Feuerzeug an. Die Schüler/Zuschauer sollen nun genau darauf achten, wie die Probe verbrennt. Während der Verbrennung sollte die Probe bereits über die Porzellanschale gehalten werden. Flüssige, sowie feste Verbrennungsprodukte werden in dieser aufgefangen. Anschließend wiederholt man den Vorgang für die beiden anderen Proben und lässt dann die Verbrennungsrückstände in Bezug auf Geruch, Farbe und sonstige Beschaffenheit begutachten.
Beobachtung und Erklärung:
Bei der Verbrennung kann man deutliche Unterschiede in der Entflammbarkeit wahrnehmen.
Auch verläuft die Verbrennung anders. Die Rückstände unterscheiden sich sowohl in Geruch, Farbe als auch Beschaffenheit. Würde man die Probe für eine größere Anzahl an Proben durchführen, könnte man die Proben nach der Brennprobe in drei großen Gruppen klassifizieren: Cellulosefasern, Eiweißfasern und Synthesefasern.
Cellulosefasern:
Als Beispiele lassen sich hier Baumwolle, Flachs und Viskose nennen. Diese Fasern lassen sich leicht entflammen. Sie verbrennen zügig und mit hell leuchtender Flamme. Der hierbei entstehende Geruch erinnert an verbranntes Papier. Der Rückstand ist eine hellgraue, leichte Flugasche.
Eiweißfasern:
Als Beispiel eignet sich besonders gut die Schafwolle bzw. ein Schurwollestück. Im
Vergleich zur Cellulosefaser lässt sich die Wollfaser nur äußerst schlecht entflammen. Nähert
man sich der Probe mit der Flamme des Feuerzeugs, so weicht die Probe zurück. Auch
entflammt verbrennt die Faser sehr langsam. Es entsteht nur eine kleine Flamme, welche leicht erlischt. Hört man genau hin, so kann man ein Zischen hören. Bei der Verbrennung riecht es nach verbrannten Haaren oder verbranntem Horn. Betrachtet man den Rückstand, so erhält man eine poröse schwarze, kohlige Masse.
Synthesefasern:
Hier gilt es zu beachten, dass bei einigen Synthesefasern bei der Verbrennung gesundheitsschädliche Dämpfe entstehen können (Polyacrylnitril=> Blausäure), daher sollte der Versuch gegebenenfalls unter dem Abzug durchgeführt werden. Als gutes Beispiel eignet sich ein Polyester. Die Synthesefaser weicht ebenfalls vor der Flamme zurück, beginnt aber zu schmelzen. Es bilden sich kleine Schmelzperlen, die tropfend in die Porzellanschale fallen.
Einmal entflammt, verbrennt die Faser mit heller Flamme. Es riecht süßlich-aromatisch, aber auch stechend. Als Rückstand erhält man eine glasige Masse, welche schnell beim Abkühlen aushärtet. Dieser lässt sich nicht zerreiben.
Die untenstehende Tabelle fasst noch einmal die charakteristischen Beobachtungen bei dieser Demonstration zusammen.
Einteilung Cellulosefasern (pflanzlich)
Eiweißfasern
(tierisch) Synthesefasern
Faserbeispiel Baumwolle Wolle Polyester
Entflammung Sehr leicht Schwer Schmelzen, dann
Entflammen Verbrennung Sehr schnell - helle,
leuchtende Flamme
Langsam – kleine Flamme
Schnell – Tropfend – helle Flamme
Geruch Verbranntes Papier Verbranntes Horn Süßlich-aromatisch, stechend
Rückstand Hellgraue, leichte Flugasche
Schwarze, kohlige Masse
Helle, glasige, harte Masse
Abschließend sollen exemplarisch zwei Verbrennungsreaktionen chemischen beschrieben
werden. Zunächst die Verbrennung von Baumwolle, einer Cellulose-Faser. Diese besteht aus
verknüpften Zuckermolekülen (der Aufbau wird in späteren Kapiteln detaillierter behandelt),
welche beim Erhitzen zu Kohlenstoffdioxid und Wasser verbrennen. Wie allgemein bekannt besteht Papier ebenfalls zum Hauptteil aus Cellulose. Dies erklärt das sehr ähnliche Verbrennungsverhalten.
Erhitzt man nun hingegen die Schurwolle, welche aus Aminosäuren aufgebaut ist, so erhält man neben Wasser und Kohlenstoffdioxid Ammoniak.
O
O
O
O H H H OH
H OH H OH
O H H H
H OH H OH
OH ...
... + x O
2, n CO
2 (g)+ m H
2O
(g)R2
R1 O
NH HN
O
... ... + x O
2, n CO
2 (g)
+ m H
2O
(g)+ p NH
3 (g)Des Weiteren gibt es noch viele andere Möglichkeiten durch Prüfverfahren Fasern zu identifizieren, diese sollen hier aber nur kurz angesprochen werden.
Anfärbeverfahren:
Da die Fasern unterschiedliche chemische Strukturen aufweisen, reagieren diese unterschiedlich mit Farbstoffen. Daher lässt sich durch Anfärben eine Differenzierung der Fasern erzielen. Hierzu eigenen sich entweder Farbreagenzien, wie sie industriell angeboten werden (Neocarmin W® oder Neocarmin MS®) oder aber man verwendet eine wäßrige Lösung von Chicagoblau 6 B, Palatinscharlach 3 R, Rhodamin B extra, Leonil DB, Magnesiumsulfat und neutralisierter Pikrinsäure. Dies liefert folgende Färbungen:
Polyamidfasern werden gelb-gelbgrün, während Wolle und Seide orange gefärbt werden.
Caseinfasern nehmen einen roten Farbton an. Bei Verwendung von Neocarmin kann die Probe entweder im kalten oder im Kochverfahren gefärbt werden.
Die Säure- und Laugenprüfung:
Auch hier können durch Zugabe von Säuren und Laugen die Fasern wieder in verschiedenen
Gruppen geordnet werden. Diese Probe beruht darauf, dass die zwischenmolekularen Kräfte
der makromolekularen Fasermoleküle durch Zugabe von Säure bzw. Lauge gelockert bzw.
teilweise sogar zerstört werden. Hierfür gibt man zu den einzelnen Stoffproben in Reagenzgläser jeweils 5%ige Natronlauge bzw. 80%ige Schwefelsäure. Die Probe mit der Natronlauge wird nun vorsichtig für etwa fünf Minuten erhitzt, bis sie schwach zu sieden beginnt. Im Gegensatz dazu erhitzt man die Proben mit Schwefelsäure nicht, sondern lässt diese lediglich 15-20 Minuten stehen. Nach dem Einwirken entnimmt man nun vorsichtig mit einer Pinzette die Faserrückstände und spült diese gründlich mit fließendem Wasser ab.
Danach lässt sich folgendes beobachten:
Faser 5%ige Natronlauge 80%ige Schwefelsäure
Baumwolle Kein Abbau Schneller Abbau
Flachs Kein Abbau Langsamer Abbau
Hanf Kein Abbau Schneller Abbau
Viskose Kein Abbau Abbau
Acetat Kein Abbau, wird schleimig Abbau unter gelblicher Färbung
Wolle Abbau Kein Abbau
Seide Abbau Abbau
Polyamid Kein Abbau Abbau
Polyester Kein Abbau Abbau
Polyacrylnitril Kein Abbau Langsamer Abbau
Prüfungen mit Lösemitteln:
Für dieses Experiment sollte man im Abzug arbeiten. Hierbei werden auf die verschiedenen Synthesefasern jeweils Aceton, konzentrierte Ameisensäure, (Dimethylformamid, giftig) und entsprechende andere Lösungsmittel gegeben. Hierbei kann man folgende Resultate beobachten:
Faser Aceton Ameisensäure Dimethylformamid Andere
Lösungsmittel Polyamid Nicht löslich löslich Nicht löslich Konz. Essigsäure Polyester Nicht löslich Nicht löslich Nicht löslich Konz. Salpetersäure
(kochend)
Polyacrylnitril Nicht löslich Nicht löslich heißlöslich Konz. Salpetersäure
PVC löslich Nicht löslich Teilweise löslich Toluol
Acetat löslich löslich löslich Konz. Essigsäure
Des Weiteren gibt es noch einige wichtige Reaktionen die ebenfalls bei der Identifizierung von Fasern helfen können.
Xanthoproteinreaktion: (s. auch Versuch)
Hierbei reagieren Wolle, Seide und Polyamidfasern mit konzentrierter Salpetersäure. Die Lösung färbt sich hierbei intensiv gelb. Gibt man nun Ammoniaklösung im Überschuss hinzu, so vertieft sich dieser Farbton zu orange.
Plumbatreaktion:
Gibt man Wolle in eine heiße, alkoholische Bleiacetatlösung (da diese giftig ist, darf diese Reaktion in der Schule nur als Lehrerversuch durchgeführt werden), so reagiert der in der Wolle enthaltene Schwefel zu schwarzem Bleisulfid.
Reaktion mit York-Lösung: (s. auch Versuch)
Hierbei handelt es sich um eine Iod, Kaliumiodid, Zinkchlorid-Lösung. Mit Hilfe dieser kann festgestellt werden, ob eine Faser hauptsächlich aus Cellulose besteht. Gibt man dise auf Kupferseide, Acetatfasern, Viskosefasern oder aber Baumwolle, so färben sich diese gelb- braun.
Es gibt noch zahlreiche andere Verfahren, um Fasern zu identifizieren. Hier soll jedoch nur ein kurzer Überblick über die für den Schulunterricht geeignetesten Verfahren gegeben werden.
4. Naturfasern
In diesem Abschnitt sollen die wichtigsten Naturfasern, ihre Klassifizierung, ihr Aufbau und ihre Eigenschaften vorgestellt werden. Auf Baumwolle, Wolle und Seide wird hierbei näher eingegangen.
Unter Naturfasern fallen sowohl organische als auch anorganische Naturfasern. Man unterscheidet jedoch bei den organischen Fasern solche tierischen und pflanzlichen
Naturfasern
Tierisch (Eiweiß) Pflanzlich
(Cellulose)
Mineralisch
Ursprungs. Pflanzliche Fasern zeichnen sich dadurch aus, dass sie alle Cellulose enthalten, während tierische jeweils Eiweiß enthalten. Eine der wichtigsten anorganischen Naturfasern ist Asbest. Dieses soll zunächst detaillierter beschrieben werden.
Anorganische Naturfasern:
Asbest:
Wie schon beschrieben, handelt es sich bei Asbest um eine mineralische Naturfaser. In der Natur kommt es als Hornblendenasbest, dem Krokydolith, und als Serpentinasbest, dem Chrysalit, vor.
nasbest Hornblende sbest
Serpentina
OH O Si Mg Fe Ca O
Si OH
Mg
8(
4 10)
2( , )(
8 20)
2In der Natur findet man jedoch zumeist Steine, welche zunächst gespalten werden müssen, um schließlich weiche, glänzende Asbestfasern zu erhalten. Diese Fasern können versponnen werden. Asbest zeichnet sich durch Feuerunempfindlichkeit und schlechte Wärmeleitung aus.
Aus diesem Grund wurde es früher am Bau als Isoliermaterial und Feuerschutzmittel eingesetzt. Da es jedoch cancerogen ist, da kurze Fasern in die Lunge gelangen können, wird es heute nicht mehr verwendet.
Pflanzliche Fasern:
Hierbei handelt es sich um organische Naturfasern, welche aus natürlich entstandenen Makromolekülen aufgebaut sind. Hierbei kann man noch einmal eine Klassifizierung vornehmen, wobei man Pflanzenhaare, wie Baumwolle, Bastfasern, wie Flachs, Hanf, Jute oder aber Ramie und Hartfasern unterscheidet, hierzu zählen beispielsweise Sisal und Kokos.
Alle pflanzlichen Fasern beinhalten Cellulose.
Baumwolle:
Als Baumwolle bezeichnet man die Samenhaare der Pflanze Gossypium herbaceum.
Abbildung 1
Wie alle pflanzlichen Fasern ist auch die Baumwolle zu einem großen Anteil aus Cellulose aufgebaut (dies kann mittels Versuch 1 gezeigt werden), welche ein Makromolekül aus ß-D- Glucose-Molekülen ist. Der Anteil an dieser beträgt ca. 90%. Der Faserstamm besteht hierbei zu über 95% aus Cellulose, während die dünne Außenhaut der Faser gerade einmal einen Celluloseanteil von 10% aufweist. Die Außenhaut setzt sich hingegen hauptsächlich aus Wachsen und Pektin zusammen.
Betrachtet man die einzelnen Fasern nun genauer (dies ist zum Beispiel mit Hilfe eines
Rasterelektronenmikroskops möglich), so stellt man fest, dass die einzelnen Samenhaare
gerade einmal 20µ dick sind. Auch sind die einzelnen Samenhaare wiederum aus noch
kleineren (0,1-0,2 µ) Einheiten aufgebaut, den Cellulose Fibrillen. Diese liegen in Bündeln
vor.
Abbildung 2
Wie man an Hand der unten gezeigten Aufnahme gut erkennen kann, sind die Samenhaare in sich verdreht.
Abbildung 3
Es besteht ein direkter Zusammenhang zwischen Feinheit der Baumwolle und der Länge der einzelnen Fasern. Es gilt: Umso länger die Faser, umso feiner ist diese. Baumwolle ist sehr reißfest, allerdings im Vergleich zu anderen Naturfasern, wie z.B. der Wolle, wenig elastisch.
Für den Einsatz als Textilfaser eignet sie sich besonders gut, da sie hitzebeständig und somit
kochfest ist. Allerdings ist sie auf Grund der mangelnden Elastizität nur schlecht formbar und
nicht pflegeleicht.
Versuch 1: Cellulosenachweis
Chemikalien:
Zinkchlorid-Iodlösung
20 g Zinkchlorid
0,1 g Iod
2,1 g Kaliumiodid
10 mL entionisiertes Wasser
Geräte:
Petrischale
Tropfpipette
Probe Baumwollgewebe
Probe Watte (Baumwolle)
Probe Polyester
Durchführung:
Zunächst wird die Zinkchlorid-Iodlösung hergestellt. Hierzu werden 20 g wasserfreies Zinkchlorid in 10 mL entionisiertem Wasser gelöst. Anschließend mischt man diese Lösung mit einer Lösung aus 2,1 g Kaliumiodid und 0,1 g Iod in 50 mL entionisiertem Wasser.
Nachdem die Lösung einige Zeit stehen gelassen wurde, gießt man diese vom Bodensatz ab und fügt noch ein Iodkristall hinzu. Die auf diese Weise hergestellte Lösung sollte in einer braunen Schliffflasche aufbewahrt werden, da sie lichtempfindlich ist.
Für den eigentlichen Versuch bereitet man in einer Petrischale Proben eines
Baumwollgewebes, eines Polyesters, sowie einer Baumwollwatte vor. Anschließend tropft man mit der Pipette einige Tropfen Zinkchlorid-Iodlösung auf die jeweiligen Proben und wartet einige Minuten.
Beobachtung:
Zunächst sind alle zugegebenen Tropfen noch gelb. Nach kurzer Zeit bereits färben sich diese in Kontakt mit dem Baumwollgewebe bzw. der Watte dunkel blau-braun. Beim Polyester ist keine Farbänderung zu beobachten.
Entsorgung:
Die Proben werden im Feststoffabfall entsorgt.
Erklärung:
Bei diesem Versuch handelt es sich um eine Nachweisreaktion von Cellulose. Da Baumwolle zum größten Teil aus Cellulose besteht, kann diese mittels Zinkchlorid-Iodlösung in den Proben des Baumwollgewebes und der Baumwollwatte nachgewiesen werden.
Der Nachweis beruht hierbei auf folgenden grundlegenden chemischen Prinzipien:
Metallsalze weisen, abhängig vom Ionenradius, eine Quellwirkung auf. Dies ist auch bei dem hier eingesetzten Zinkchlorid der Fall. Das relativ kleine Zink-Kation ist von einer großen Hydrathülle umgeben und stark hygroskopisch . Dadurch kann dieses in die Hohlräume zwischen den Zellen dringen und diese aufweiten. Die Cellulose quillt auf und es bilden sich Hohlräume. Man kann daher hierbei von einer intermicellaren Reaktion. In die Hohlräume zwischen den Zellen können sich nun die in der Zinkchlorid-Iodlösung enthaltenen Polyiodid- Ionen einlagern. Es entsteht, ähnlich wie bei der Iod-Stärke-Reaktion, eine Einschlussverbindung, welche als Charge-Transfer-Komplex für die charakteristische blaue Farbe sorgt.
) 3( 2
/ I
aqZnCl
Einschlussverbindung
Micelle Intermicellarer
Raum
Tierische Fasern:
Auch tierischen Fasern setzen sich aus von der Natur gebildeten, organischen Makromoleküle zusammen. Im Gegensatz zu pflanzlichen Fasern bestehen diese jedoch anstatt aus Cellulose aus Eiweißen (siehe Versuch 2). Auch hier kann man noch einmal eine Untergliederung finden. Im Allgemeinen unterscheidet man Wollen (Wolle, Schurwolle etc.), Haare (Schafkamelwolle, Angora, Kamelhaar, Ziegenhaar oder aber auch Rosshaar) und Seiden (hier sind im Wesentlichen die Maulbeerseide und die wilde Seide zu nennen).
Versuch 2: Was haben Wolle und Seide gemeinsam?
Chemikalien:
Konzentrierte Salpetersäure
Geräte:
3 Demoreagenzgläser
Demoreagenzglasständer
Probe Polyester
Probe Wolle
Probe Seide
Durchführung:
Zu allen drei Proben gibt man eine ausreichende Menge konzentrierte Salpetersäure und wartet einige Minuten.
Beobachtung:
In den Reagenzgläsern, welche Wolle bzw. Seide enthalten, lässt sich schon bald eine intensive Gelbfärbung beobachten. Die Polyesterprobe hingegen weist keine Veränderungen auf.
Entsorgung:
Die Proben werden neutral im anorganischen Abfall entsorgt.
Erklärung:
Sowohl Wolle als auch Seide sind zum größten Teil aus Eiweißen aufgebaut. Diese lassen sich mittels der hier eingesetzten Xanthoproteinreaktion nachweisen. Da die Eiweiße in der Wolle bzw. Seide unterschiedlichst aus Aminosäuren aufgebaut sind, soll der Mechanismus der Xanthoproteinreaktion zur Vereinfachung exemplarisch am Beispiel der Aminosäure L- Phenylalanin dargstellt werden.
Zunächst wird das für den nachfolgenden Mechanismus entscheidende Elektrophil gebildet.
Dies geschieht in dem die Salpetersäure sich selbst protoniert und ein Wassermolekül im Anschluss daran abgespalten wird. Man erhält somit als Elektrophil ein Nitronium-Kation.
Nun erfolgt die eigentliche Nitrierung indem das
elektrophile Nitroniumkation das elektronenreiche aromatische Ringsystem angreift. Hierbei entsteht zunächst der π-Komplex. Durch Ausbildung einer kovalenten Bindung zwischen dem
) 2( ) ( ) 2
3( 2
) 3( ) 2
3( )
(
2
3aq aq aq
aq aq aq
NO O
H NO
H
NO H NO
HNO
Ringkohlenstoffatom in para-Position (Alkylrest wirkt schwach aktivierend, sodass ortho- und para-Position denkbar wären. Die para-Position ist jedoch unter sterischen Aspekten
begünstigt) und dem Elektrophil kommt es zur Bildung eines Carbenium-Ions bzw. des so genannten σ-Komplexes. Anschließend erfolgt rasch durch Abspaltung eines Protons die Rückbildung zu einem aromatischen System und man erhält das nitrierte und gelb gefärbte Endprodukt.
O R
1NH R
2+ NO
2+O R
1NH R
2NO
2+pi-Komplex
(aq)
O R
1NH R
2NO
2+H O R
1NH R
2N
+O
-+ O
Sigma-Komplex
O R
1NH R
2N
+O
-O
+ H
+.. . . ..
.
(aq)
Seide:
Schon bereits im alten China wurde Seide nach einem streng geheim gehaltenen Verfahren aus den Kokons der Seidenspinnerraupe gewonnen. Hierbei produzieren die Raupen des Seidenspinners einen feinen Faden (0,013-0,026 mm), welcher jedoch eine Länge von bis zu 3 km lang aufweisen kann. Abgewickelt werden können jedoch lediglich ca. 300-900 m.
Diesen Vorgang bezeichnet man auch als Abhaspeln.
Abbildung 4
Wie in unten stehender schematischer Darstellung gezeigt, handelt es sich zunächst beim Seidenfaden um einen Doppelfaden aus Seidenfibroin, welcher von einer Sericinschicht umgeben ist. Sericin und Fibroin sind Proteine. Das Sericin wird jedoch innerhalb der Produktion entfernt, da es die Seide glanzlos und rau macht. Nach der Entfernung dieser Schicht, weist die Seide ihre bekannten Eigenschaften auf: Sie ist glänzend, geschmeidig und elastisch. Ähnlich wie bereits bei der Baumwolle geschildert setzt sich ein Fibroineinzelfaden aus Fibrillenbündeln zusammen, welche wiederum aus Mikrofibrillen aufgebaut sind.
Abbildung 5
Chemisch gesehen, setzt sich das Seidenfibroin zu 60% aus den beiden Aminosäuren Glycin und Alanin zusammen. Es handelt sich also um Eiweiße. Im Gegensatz zur weiter unten beschriebenen Wolle ist jedoch die schwefelhaltige Aminosäure Cystein am Aufbau des Seidenfibroins nicht beteiligt.
Ausschnitt aus einem Seidenmolekül
Am Ende des Seidenherstellungsprozesses weist der erhaltene Faden eine hohe Feinheit auf.
Er ist sehr glatt und kaum gekräuselt. Daher ist der Seidenfaden relativ wenig elastisch.
Allerdings weist er eine sehr hohe Festigkeit auf, welche alle anderen Naturfasern übertrifft.
Problematisch bei der Pflege von Seidenfasern sind jedoch die Hitzeempfindlichkeit und die Empfindlichkeit gegenüber Laugen.
Wolle
Unter Schaf- bzw. Schurwolle versteht man die Haare der Schafe. Diese sind elastisch, spinnfähig und geschuppt.
Abbildung 6
Den größten Teil der Faser machen die Cortexzellen aus. Sie bilden eine Schuppenschicht, welche unmittelbar unter der Oberhaut der Faser liegt. Ähnlich wie bei der Seide sind die Cortexzellen aus spindelförmigen Fibrillen zusammengesetzt. Diese werden wiederum durch Cysteinbrücken mit einander verbunden. Wolle ist aus dem Gerüsteiweiß Keratin aufgebaut.
1 Schuppenzellen 2+3 Faserstamm (Spindelzellenschicht) 2 Ortho Cortex
3 Para Cortex
4 Makrofibrille
5 Microfibrille
Dieses enthält eine Vielzahl von Aminosäuren, welche unter anderem auch schwefel- und stickstoffhaltig sind.
Auch bei der Wolle ist die Feinheit ein wichtiger Aspekt. Umso feiner die Faser ist, umso weicher wirkt sie auf uns. Hierbei ist die Feinheit abhängig von der Kräuselung, welche durch Gattung und Herkunft des Wolle liefernden Tieres bestimmt wird. Eine stark gekräuselt Wolle ist zudem ein schlechter Wärmeleiter. Daher empfinden wir im Winter einen Wollpullover als wärmend. Zudem sind Wollfasern hygroskopisch und schwerentflammbar.
5. Abgewandelte Naturfasern:
Bei abgewandelten Naturfasern handelt es sich um Naturfasern, welche chemisch und physikalisch behandelt wurden. Werden diese im Anschluss an diese Behandlungen versponnen, so erhält man eine feinere Faser als das vergleichbare Naturprodukt. Man unterscheidet generell abgewandelte Naturfasern aus pflanzlichen (Latex, Cellulose, Algen) und tierischen natürlichen Polymeren (Caseinfasern). Die bedeutendste Gruppe bilden hier die Cellulosefasern. Als Ausgangssubstanz dient hier stets Zellstoff, welcher aus verschiedenen Rohstoffen gewonnen werden kann.
Cellulosefasern:
Wichtige Vertreter der Cellulosefasern sind Viskose, Acetat und Kupferseide. Hierbei sind
besonders die Viskose- und Acetatfasern für die heutige Textilindustrie von großer
Bedeutung. Kupferseide ist an den Rand verdrängt worden, da die Herstellung dieser vom ökologischen Standpunkt als bedenklich anzusehen ist. Für alle diese Fasern benötigt man Cellulose. Diese lässt sich entweder aus Baumwolle (Entfettung durch Zugabe von Natronlauge) oder aber aus Holz gewinnen.
Acetat:
Bei Acetatfasern handelt es sich um Cellulose, deren freie Hydroxidgruppe mit Essigsäure verestert wurden. Großtechnisch werden Acetatfasern durch Zugabe von einem Gemisch aus Essigsäure und Essigsäureanhydrid zu Zellstoff synthetisiert. Hierbei bildet sich im ersten Schritt das voll veresterte Produkt, das Cellulosetriacetat. Dieses Triacetat wird jedoch unter anderem aus Löslichkeitsgründen wieder teilweise gespalten. Durchschnittlich bleiben hierbei zwei Hydroxidgruppen einer Glucoseeinheit verestert. Man spricht bei diesem Produkt von einem Sekundäracetat. Im Verarbeitungsprozess wird die Cellulose teilweise deprotoniert und somit auch einige der glucosidischen Bindungen gespalten. Dadurch erhält man Ketten mit einer Länge von 100 bis etwa 300 Glucoseeinheiten. Im sich an diesen Prozess anschließenden Spinnverfahren, erhält man aus den Lösungen der Ester einen Faden. Die so gewonnen Acetatfasern zeichnen sich durch feinen Glanz, Weichheit und geringes Knittervermögen aus. Textilien aus Acetatfasern sind daher besonders pflegeleicht.
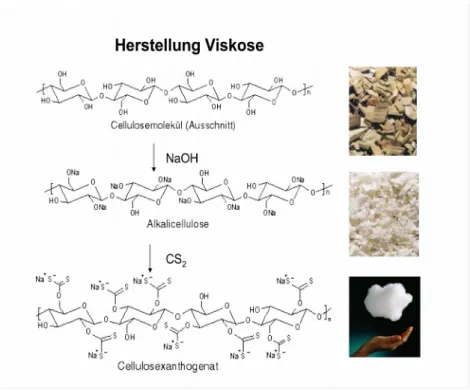
Viskose:
Viskosefasern werden mittels des so genannten Celluloseverfahrens hergestellt. Hierbei geht
man von Holzabfällen aus, welche im ersten Schritt in Natronlauge getaucht werden. Dabei
bildet sich das Salz der Natriumcellulose, die Alkalicellulose. Auf diese lässt man
Schwefelkohlenstoff einwirken. Hierbei entsteht das Natriumxanthogenat. Diese löst man
nach einiger Zeit wieder inb Natronlauge. Um einen Faden zu erhalten, presst man dann die
Spinnlösung in ein Fällbad aus salzhaltiger Schwefelsäure, diese enthält fast bis zur
Sättigungsgrenze Natriumsulfat und zudem ein wenig Zinksulfat. Hierdurch wird die
Zellulose-Ausfällungsreaktion verzögert. In der Spinnlösung bildet sich neben Schwefel,
Schwefelwasserstoff, Schwefelkohlenstoff und Natriumsulfid (diese stellen ein
Umweltproblem dar) ein fester Faden aus Cellulose. Dieser muss anschließend gründlich
gewaschen werden. Die so erhaltenen Viskose-Fasern finden vielfältigen Einsatz in der
Textilverarbeitung, werden aber auch zu Watte, Verband- und Vliesstoffe verarbeitet.
Abbildung 7 Kupferseide:
Kupferseide (im Handel auch unter dem Namen Cupro bekannt) wird auch in der Großindustrie nach dem im Versuch 3 dargestellten Verfahren synthetisiert. Allerdings wird industriell der Faden im Anschluss an die Synthese gedehnt, sodass man einen besonders feinen Faden erhält. Es handelt sich also im Gegensatz zu Baumwolle, welche auch aus Cellulose aufgebaut ist, um eine hochfeine Faser, die ähnliche Eigenschaften aufweist wie Seide. Bei Viskose und Kupferseide handelt es sich also um Fasern welche aus reiner Cellulose bestehen, während es sich bei Acetat um chemisch veränderte Cellulose handelt.
Versuch 3: Herstellung von Kupferseide:
Chemikalien:
Schweizer Reagenz
6 g CuSO
4· 5 H
2O
20 mL entionisiertes Wasser
20 mL Ammoniak-Lösung (w = 25%)
4 mL Natronlauge (w = 32%)
5 g Baumwollwatte
300 mL verdünnte Schwefelsäure c= 2 mol/L
Geräte:
2 100 mL Bechergläser
Magnetrührer mit Heizplatte
Messpipette
Schraubdeckelglas
Edelstahlsieb
20 mL Einwegspritze mit Kanüle
600 mL Becherglas
Durchführung:
Zuerst wird das Schweizer Reagenz hergestellt. Hierzu gibt man in ein 100 mL Becherglas 6 g Kupfersulfat und löst dieses unter ständigem Rühren und leichtem Erwärmen in 20 mL entionisiertem Wasser. Nach dem Abkühlen gibt man 20 mL der Ammoniak-Lösung und anschließend mit Hilfe der Messpipette 4 mL Natronlauge hinzu. Zum Schluss füllt man alles in ein Schraubdeckelglas und fügt dann der Lösung 5 g Watte hinzu. Anschließend muss die Lösung mehrere Tage stehen und wird täglich belüftet und geschüttelt. Die besten Ergebnisse lassen sich nach etwa einer Woche erzielen. Für den eigentlichen Versuch filtriert man einige Milliliter der Lösung durch ein Haushaltsedelstahlsieb, um gröbere Partikel zu entfernen, welche die Kanüle verstopfen könnten. Dann zieht man mit der 20 mL Einwegspritze ca. 10 mL der Lösung auf. Diese spritzt man in verdünnte Schwefelsäure, welche sich in einem 600 mL Becherglas befindet.
Beobachtung:
Beim Einspritzen in die Schwefelsäure bildet sich sogleich ein feiner langer, dünner Faden.
Dieser ist zunächst noch intensiv blau gefärbt, verfärbt sich jedoch bald weiß. Der erhaltene Faden ist nur mäßig reißfest.
Entsorgung:
Die selbst hergestellten Kupferseidefäden werden aus der Lösung entfernt und trocken im Feststoffabfall entsorgt. Sollte noch Schweizer-Reagenz vorhanden sein, welches nicht für weitere Versuche benötigt wird, so neutralisiert man dieses mit der eingesetzten Schwefelsäure und filtriert die erhaltene Lösung durch das bereits erwähnte Edelstahlsieb ab.
Das Filtrat wird neutral im anorganischen Abfall entsorgt und die ausgefallene Baumwolle wird getrocknet. Anschließend kann diese ebenfalls im Feststoffabfall entsorgt werden.
Erklärung:
Zunächst wird das Schweizer Reagenz gebildet. Hierzu reagiert das Kupfersulfat mit der Natronlauge zu Kupferhydroxid und Natriumsulfat. Das auf diese Weise hergestellte Kupferhydroxid bildet mit dem zugesetzten Ammoniak einen Kupfer(II)-Aminkomplex. Man erhält das stark alkalische Schweizer Reagenz.
Was im Folgenden unter Zugabe von Cellulose in Form der Watte mechanistisch exakt abläuft, ist bis lang nicht genau geklärt. Man weiß jedoch, dass im ersten Schritt das Schweizer Reagenz die Hydroxidgruppen der Cellulose deprotoniert und ein Cellulat gebildet wird, welches einen quadratisch-planaren Komplex mit dem Kupferaminkomplex des Schweizer Reagenz bildet.
Schweizer Reagenz
4(aq) 2
2(aq) (aq) (aq)
4
+ 2 NaOH Cu(OH) Na SO
CuSO
2(aq) x
3 3(aq)
2(aq)
+ x NH [Cu(NH ) ](OH)
Cu(OH)
Beim Einspritzen der Lösung in verdünnte Schwefelsäure wird dieser Komplex zerstört und die Cellulose protoniert, sodass man letztendlich wieder ein Cellulose-Molekül erhält. Dieses Cellulose-Molekül ist aber in der verdünnten Schwefelsäure unlöslich und kann somit als Faden zurück gewonnen werden.
2(aq) 4 3) ](OH) [Cu(NH
3 2O,- 8NH 8H
6. Synthesfasern:
Zunächst werden zu Herstellung von Synthesefasern aus synthetischen Monomeren Kunststoff synthetisiert. Diese werden dann mittels Schmelz- bzw. Trockenspinnverfahren zu Fasern weiterverarbeitet. Zwar gibt es auf Basis von verschiedensten Kunststoffen eine Vielzahl an Synthesefasern, doch sollen an dieser Stelle nur die wichtigsten kurz vorgestellt werden: Polyamid, Polyester und Polyacrylnitril. Diese machen zusammen über 90% der Produktion aus.
Die wichtigsten Reaktionsmechanismen zur Herstellung von Kunststoffen, welche als Ausgangsstoffe für die Darstellung von Synthesefasern dienen, sind die Polymerisation und die Polykondensation. Während bei der Polymerisation Bindungen gespalten und neu gebildet werden, wird bei der Polykondensation ein kleines Molekül abgespalten.
Polyamide:
Bei Polyamiden handelt es sich um hochmolekulare Verbindungen, welche mittels Peptidbindungen verknüpft werden. Synthetische Polyamide sind langkettige Moleküle, in deren Hauptkette die Säuramidgruppe wiederkehrend eingebaut ist. Die erwähnte Polyamidgruppe erhält man bei der Kondensation eines Amins und einer Säure. Hierbei läuft schematisch folgende Reaktion ab:
R-COOH + H
2N-R' → R-CO-NH-R' + H
2O
Man unterscheidet zwei Klassen synthetischer Polyamide: Den Aminocarbonsäuretyp, kurz AS und den Diamin-Dicarbonsäuretyp, kurz AA-SS. Das Kürzel A steht in diesem Zusammenhang für eine Aminosäuregruppe, während S eine Carbonsäuregruppe bezeichnet.
Hierbei stellt man Polyamide vom AA-SS-Typ durch Kondensation von einem Diamin und einer Dicarbonsäure her. Den AS-Typ kann man mittels der Kondanstion von Aminosäuremolekülen erhalten. Nachdem die Kondensation erfolgt ist, erhält man beim AS- Typ und beim AA-SS-Typ folgende funktionelle Gruppen:
AS-Typ: -NH-R-CO-
AA-SS-Typ: -NH-R-HN-OC-R'-CO-
Die wohl am weitesten verbreiteten Polyamide sind PA66 und PA6. PA66 ist besser bekannt unter der Bezeichnung Nylon, während PA6 als Perlon im Handel zu finden ist. Beide Polyamide wurden nahezu zeitgleich in den 1930er Jahren in Deutschland und den USA entwickelt. So brachte die amerikanische DuPont-Company 1935 die erste vollsynthetische Textilfaser auf den Markt. Man hatte entdeckt, dass sich aus einer Schmelze von PA66 Fäden ziehen lassen, welche nach dem Verstrecken eine extrem hohe Festigkeit aufweisen. Im gleichen Zeitraum wurde in Deutschland bei der I.G. Farben eine sehr ähnliche Synthese entwickelt. Hier verwendete man eine Schmelze von PA 6. Auch hierbei konnten Fasern mit sehr ähnlichen Eigenschaften wie die des Nylons hergestellt werden. Bedingt durch diese extrem ähnlichen Eigenschaften kamen die beiden großen Polyamide produzierenden Firmen überein, einen vollständigen Patentaustausch und eine Aufteilung der Absatzmärkte zu beschließen. Nylon und Perlon zeichnen sich neben ihrer Reißfestigkeit aus durch gute Färbbarkeit, Elastizität, Leichtigkeit, Mottensicherheit, sowie hohe Knick- und Scheuerfestigkeit. Auf Grund ihrer positiven Eigenschaften finden diese Polyamide vielfältige Anwendungen, so z.B. als Damenstrümpfe, Bekleidung, Taue, Borsten oder aber (nicht als Fasern) als Dübel, als Haushaltsgeräte und in weiteren Bereichen der Bau- und Möbelindustrie.
Der genaue Verlauf einer Polyamidsynthese sei am Beispiel des Versuchs 4 dargestellt:
Versuch 4: Nylondarstellung:
Chemikalien:
4 g 1,6-Dimethylaminohexan
10 mL Sebacinsäuredichlorid
100 mL Petrolether 40-60
5 g Natriumcarbonat
Entionisiertes Wasser
Phenolphthalein w = 0,01 in Ethanol w= 0,96
Geräte:
2 250 mL Bechergläser
100 mL Becherglas
2 Reagenzgläser
Wasserbad (zur Verarbeitung von 1,6-Diaminohexan)
2 20 mL Einwegspritzen ohne Kanüle
Pinzette
Durchführung:
Zuerst werden in je einem 250 mL Becherglas die beiden Ausgangslösungen hergestellt.
Hierzu stellt man, um eine gute Handhabung zu ermöglichen, die 1,6-Diaminohexan Vorratsflasche in ein Wasserbad, sodass ein Teil der Substanz in geschmolzener Form vorliegt. Hiervon gibt man nun 4 g in eines der beiden Bechergläser und fügt eine 5%ige Natriumcarbonatlösung hinzu (hergestellt aus 5 g Natriumcarbonat und 100 mL entionisiertem Wasser). Diese Lösung färbt man anschließend durch Zugabe weniger Tropfen Phenolphthalein an.
In das zweite Reagenzglas füllt man 10 mL Sebacinsäuredichlorid und löst dieses in 100 mL
Petrolether 40-60.
Für den eigentlichen Versuch verwendet man ein 100 mL Becherglas (am besten hohe Form) und gibt mit Hilfe der Einwegspritzen zunächst 20 mL der Diaminohexan-Lösung in dieses.
Anschließend überschichtet man, wiederum mittels einer Einwegspritze, vorsichtig mit 20 mL
Sebacinsäuredichlorid-Lösung.
Beobachtung:
Es bilden sich zwei Phasen. An der Phasengrenze kann sehr schnell die Bildung eines dünnen weißen Häutchens beobachtet werden, welches man nun mit der Pipette aus der Lösung ziehen kann. Man erhält einen Faden, welcher um ein Reagenzglas gewickelt werden kann.
Der Indikator Phenolphthalein zeigt zunehmend eine saure Lösung an.
Entsorgung:
Man vermischt die beiden Lösungen, sodass man einen Feststoff erhält, welcher trocken im Feststoffabfall entsorgt werden kann.
Erklärung:
Bei der hier vorgestellten Polymerisation zu einer synthetischen Faser handelt es sich um eine Grenzflächen-Polykondensation. Hierbei reagieren 1,6-Diaminohexan und Sebacinsäuredichlorid unter Abspaltung von Chlorwasserstoff zu Polyamid 6.10. Dieses Produkt ist auch unter dem Handelsnamen Nylon bekannt. Der erste Schritt erfolgt in Form eines nukleophilen Angriffs eines der freien Stickstoffatom des 1,6-Diaminohexans an das partiell positivierte Kohlenstoffatom der Säurechloridfunktion. Hierbei kommt es zur Ausbildung einer negativen Partialladung am Sauerstoffatom der funktionellen Gruppe, sowie einer positiven am Stickstoffatom.
N
H
2CH
2NH
26 + Cl
O
C CH
2C O 8 Cl
6 Cl 8
N
H
2CH
2NH
2+C CH
2C O
Cl O
--HCl
Die Partialladungen werden allerdings durch Ausbildung einer Sauerstoff-Kohlenstoff-
Doppelbindung unter Abspaltung eines Chloridions, welches mit einem Proton der
Aminogruppe weiter zu Chlorwasserstoff reagiert, aufgehoben.
6 8 N
H 2 CH 2 NH C CH 2 C
O Cl O
...
6 8
O CH 2 NH C CH 2
O N C
H
... ... + n HCl
HCl (aq) + OH - (aq) H 2 O + Cl - (aq)
Da beide eingesetzten Edukte über je zwei funktionelle Gruppen verfügen, welche unter Kondensation miteinander reagieren, kommt es zur wiederholten Kondensation und man erhält ein makromolekulares Produkt. Hierbei handelt es sich um ein Polyamid.
Polyesterfasern:
Polyester können mittels Polykondensation aus Diolen und Dicarbonsäurederivaten
synthetisiert werden. Man kann auch verzweigte und vernetzte Polyesterfasern erhalten, wenn man bei der Polykondensation mehrwertige Alkohole mit polyfunktionellen Carbonsäuren umsetzt. Anwendung finden Polyester vor allen Dinge in der Bekleidungsindustrie und bei der Herstellung von Wohntextilien, wie z.B. Gardinen. Untenstehende Abbildung illustriert exemplarisch die Bildung eines Polyesters.
O
O H
O
OH
Terephthalsäure
n + n
OHO H
CH2 O
O
O O
...
...
Polyethylenterephthalat
+ 2n H
2O
Polyacrylnitril:
Polyacrylnitrilfasern zählen zur Gruppe der Polyethylenfasern. Hierbei handelt es sich bei der
Ausgangssubstanz immer um ein substituiertes Ethlylenmolekül der Form CH
2=CHX. Im Fall
von Polyacrylnitril ist X eine Cyano-Gruppe, welche nach Polymerisation ein Polyacrylnitril
liefert. Polyacrylfasern sind knitterfrei, schnell trocknend und sehr beständig gegenüber
Säuren, Hitze, sowie Lösungsmitteln. Meist werden sie als Mischung mit Wollfasern als
Strickwolle eingesetzt.
7. Weiterverarbeitung:
Spinnverfahren:
Als Spinnen bezeichnet man bei der Chemiefaserproduktion die Erzeugung von Fäden aus gelösten oder geschmolzenen Rohstoffen mit Hilfe von Spinndüsen. Im Wesentlichen gibt es drei Verfahren des Spinnens:
1. das Schmelzspinnverfahren 2. das Trockenspinnverfahren 3. das Nassspinnverfahren
Das Schmelzspinnverfahren:
Abbildung 8
Das Schmelzspinnverfahren wird zumeist für Polyamide, wie Nylon oder Perlon verwendet.
Hierzu schmilzt man das aus der Synthese erhaltene Polymer auf und presst die erhaltene Schmelze mittels einer Spinnpumpe durch die beheizten Spinndüsen. Tritt nun der Faden aus den heißen Spinndüsen aus, wird dieser mit einem Kaltluftstrom abgekühlt und wird dadurch wieder fest. Daran anschließend wird der Faden verstreckt und aufgewickelt. Der Vorgang des Schmelzspinnens kann in der Schule gut durch folgenden Versuch simuliert werden:
Demonstration 3: Schmelzspinnen von Polyamid
Chemikalien:
Feinstrumpfhose aus Polyamid
Geräte:
Schere
Bunsenbrenner
Glasstab
Porzellanschale
Dreibein mit Netz
OVH-Projektor
Durchführung:
Zunächst wird die Feinstrumpfhose in möglichst kleine Stücke geschnitten. Diese gibt man anschließend in eine kleine Porzellanschale, welche man unter ständigem Rühren mit dem Glasstab vorsichtig auf dem Dreibein über der Bunsenbrennerflamme erwärmt. Hierbei ist darauf zu achten, dass die Probe nicht zu stark erhitzt wird und dabei zerstört wird. Hat sich eine homogene Schmelze gebildet, beendet man das Erhitzen und lässt einen kurzen Moment abkühlen. Danach beginnt man sofort mit dem Glasstab Fäden aus der Schmelze zu ziehen, welche man um den Stab wickelt. Diese können zur besseren Demonstration auf den OVH- Projektor gelegt werden.
Beobachtung:
Die Polyamidfasern beginnen zu schmelzen. Zunächst weist die Schmelze einen grünen Farbton auf, der allerdings bald ins bräunliche wechselt. Schließlich erhält man eine homogen zähflüssige Schmelze. Aus dieser lassen sich nun leicht lange, sehr feine Fäden ziehen.
Entsorgung:
Die erhaltenen Fäden können im Feststoffabfall entsorgt werden. Die erkaltete Schmelze lässt
sich am besten mit konzentrierter Salzsäure aus der Porzellanschale lösen. Diese wird
anschließend neutral im anorganischen Abfall entsorgt.
Erklärung:
Zunächst werden die Polyamidstücke lediglich geschmolzen. Dann erfolgt wie oben beschrieben ein Ziehen von Fäden, welche beim Abkühlen an Luft sich verfestigen.
Das Nassspinnverfahren
Abbildung 9
Das Nassspinnverfahren findet Anwendung bei der Herstellung von Fäden aus abgewandelten Naturstoffen, wie z.B. Viskose oder aber der im Versuch hergestellten Kupferseide. Hierbei wird die in einem geeigneten Lösungsmittel gelöste Spinnmasse wie beim Schmelzspinnverfahren durch Spinndüsen gepresst. Diese befinden sich jedoch in einem Chemikalienbad, in dem der erhaltene Faden sofort ausgefällt wird. Dieser wird mit Hilfe einer Abzugsvorrichtung aus dem Fällbad entnommen, verstreckt, gewaschen und schließlich wiederum aufgewickelt.
Das Trockenspinnverfahren:
Abbildung 10
Das Trockenspinnverfahren wird vor allem für Polyacrylnitrilfasern eingesetzt. Hierbei wird die Spinnmasse ebenfalls in einem geeigneten Lösungsmittel gelöst und durch Spinndüsen gepresst. Anschließend gelangt der erhaltene Faden in einen Heißluftstrom. Durch diesen wird das Lösungsmittel verdampft und man erhält einen festen Faden. Das Lösungsmittel wird aufgefangen und kann somit mehrfach verwendet werden. Der hergestellte Faden wird wie in den beiden zuvor vorgestellten Verfahren verstreckt und schließlich aufgewickelt.
Verstrecken:
Bei allen drei Verfahren wird der zunächst erhaltene Faden verstreckt. Unter Verstrecken versteht man eine Neuorientierung der Fasermakromoleküle. Hierbei werden die zunächst ungeordneten und verknäulten Kettenmoleküle in Filamentrichtung orientiert. Man erhält einen feineren und deutlich festeren Faden.
8. Textilveredelung:
Im Anschluss an die Herstellung von Textilfäden schließt sich oft eine Vielzahl an
Veredelungsverfahren an. Aus der Textilverarbeitung kennt man z.B. das Färben von Fasern,
das Bleichen (z.B. für Leinen- oder aber Baumwollfasern) oder aber das Mercerisieren. Des
Weiteren kommen Weichmacher und optische Aufheller zum Einsatz. Neuerdings werden die
Fasern zudem oft mit einer Schutzausrüstung gegen Knittern, Flammen, Schmutz oder Wasser
versehen. Da die Textilveredelung ein sehr weit reichendes Themengebiet ist, soll hier
lediglich exemplarisch das bei Baumwollfasern oft eingesetzte Verfahren der Mercerisierung
vorgestellt werden.
Mercerisieren:
Im Handel findet man oft Baumwolltextilien mit der Eigenschaft „mercersiert“. Diese Fasern gelten als besonders hochwertig, da sie besonders fein und glänzend wirken. Wie dieser Effekt technisch erzielt wird, beschreibt folgender Schulversuch:
Versuch 5: Mercerisieren und Färben von Baumwolle
Chemikalien:
30%ige Natronlauge
Spatelspitze Farbstoff Kongorot
Entionisiertes Wasser
5 g Natriumcarbonat
Geräte:
Größere Probe Baumwolle (ca. 15 cm x 10 cm)
Tropfpipette oder Glasstab
1 L Becherglas
Heizplatte
Tiegelzange
Durchführung:
Auf die Probe des Baumwollgewebes tropft man gut verteilt einige Tropfen der Natronlauge.
Nach einer Wartezeit von ca. fünf Minuten wird die Stoffprobe unter fließendem gründlich ausgewaschen. Anschließend überführt man die Probe in eine siedende Kongorot Färbelösung (eine Spatelspitze Kongorot und ca. 5 g Natriumcarbonat in ca. 500 mL entionisiertem Wasser lösen). Die Stoffprobe verbleibt nun etwa fünf Minuten in der Färbelösung und wird danach mit der Tiegelzange aus der Lösung herausgeholt. Zum Schluss wird die Stoffprobe erneut ausgewaschen und getrocknet.
Beobachtung:
Schon kurze Zeit nach Auftropfen der Natronlauge beginnt das Baumwollgewebe sich an den behandelten Stellen zusammen zu ziehen. Die unbehandelten Bereiche der Probe hingegen beginnen sich zu kräuseln. Nach dem Färben kann man an den betupften Stellen eine deutlich intensiver rote Farbe feststellen als an den unbehandelten.
Entsorgung:
Die Färbelösung wird neutral im anorganischen Abfall entsorgt. die Stoffproben werden entweder zu Demonstrationszwecken aufgehoben oder im unbelasteten Feststoffabfall entsorgt.
Erklärung:
Im Gegensatz zur intermicellaren Reaktion, welche beim Nachweis von Cellulose eintrat (Zelle bleibt als solche erhalten), handelt es sich bei dieser Reaktion um eine intramicellare.
Das heißt die hochkonzentrierte Natronlauge ist in der Lage in das Zellinnere der Faser einzudringen. Hier können nun prinzipiell zwei Vorgänge ablaufen. Einerseits kann die Natronlauge in einer Säure-Base-Reaktion die Hydroxidgruppe der Cellulosemoleküle deprotonieren, diese Reaktion spielt allerdings nur eine untergeordnete Rolle. Vielmehr wird durch elektrostatische Umorientierung das zuvor bestehende Wasserstoffbrückennetz zerstört.
Hierdurch kommt es zu einer Vergrößerung der Abstände zwischen den einzelnen Cellulosemolekülen. Dadurch wird es sowohl Wasser- als auch Farbstoffmolekülen erleichtert in die intermicellaren Zwischenräume zu gelangen und dort mit den Cellulosehydroxidgruppen in Wechselwirkung zu treten. Dadurch können die Farbstoffmoleküle nicht nur mit den Hydroxidgruppen der Cellulose an der Faseroberfläche in Kontakt treten, sondern auch mit den Gruppen im Zelleninneren. So können quantitativ mehr Farbstoffmoleküle gebunden werden und es kommt zu einer Farbvertiefung.
Da sich aber auch
Wassermoleküle besser einlagern können, nimmt das Quellvermögen der Faser zu.
Normalerweise erfolgt das Aufquellen zum größten Teil in die Tiefe. Hierbei versucht sich die Faser diesem Zwang zu entziehen und reagiert mit einer Schrumpfung in die Länge. Daher
) ( )
( )
(
2 ) ( )
( )
(
)
(
aq aq
s
s aq
s
OH Na
H O Cell NaOH
OH Cell
O H Na O Cell NaOH
OH Cell