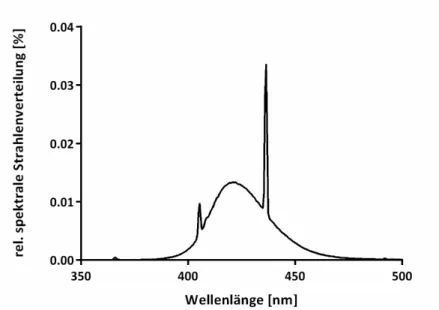
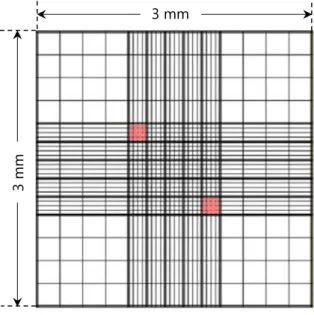
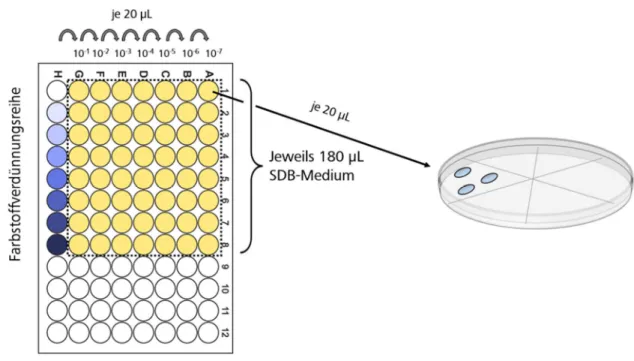
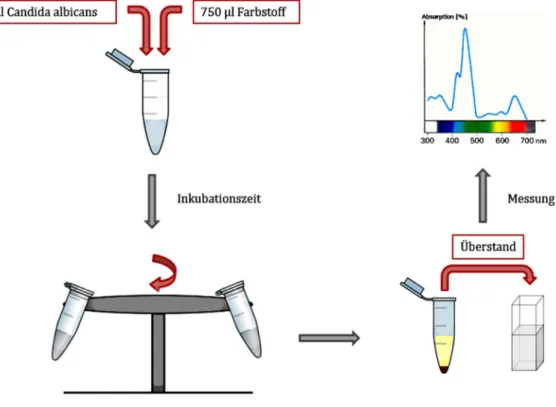
Nachweis und Lokalisation von Photosensibilisatoren bei der photodynamischen Inaktivierung von Candida albicans
Volltext
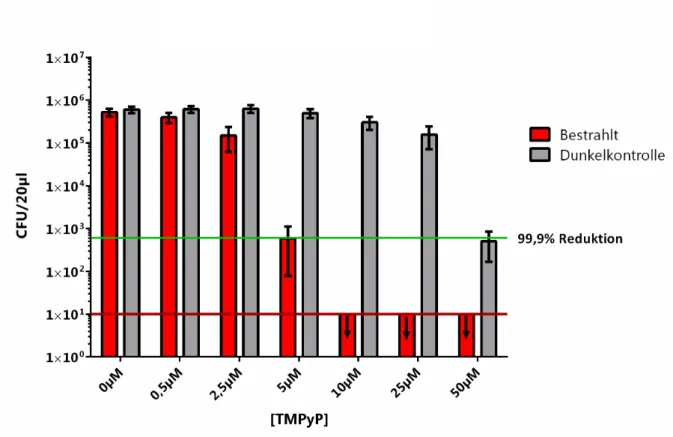
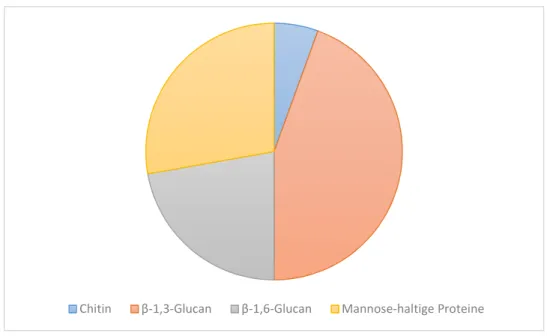
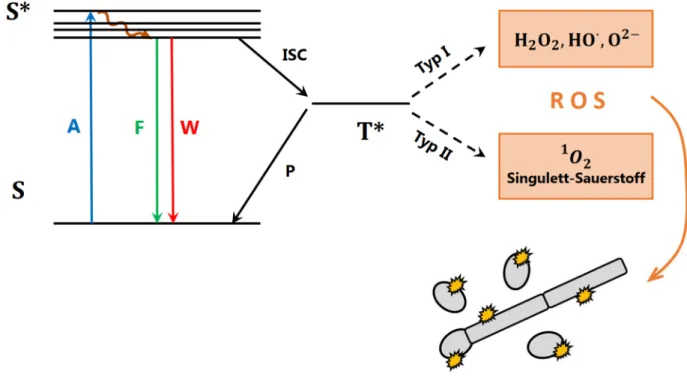
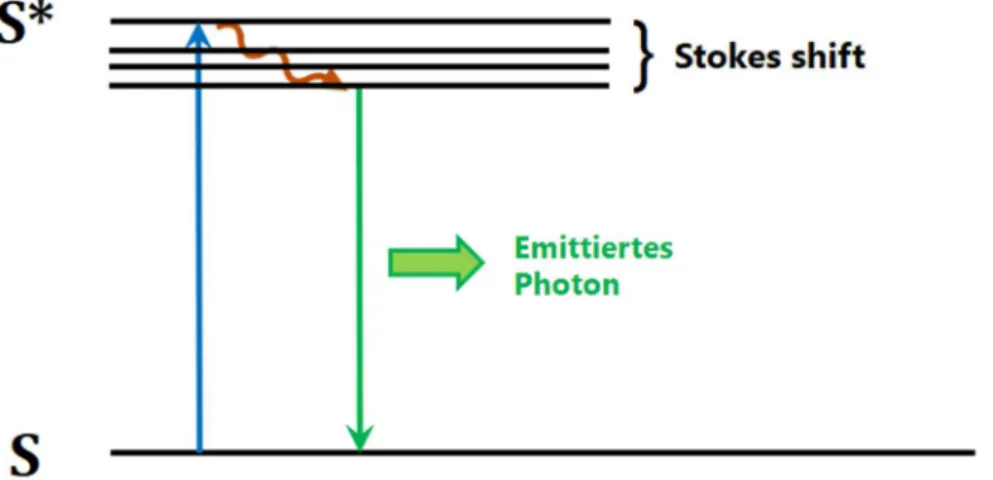
Abbildung

ÄHNLICHE DOKUMENTE
Obwohl Candida albicans bei Gesunden nicht pathogen ist, kann der Pilz bei Personen, die an mehreren Krankheiten leiden, intensiv mit Breitbandantibiotika behandelt
Obwohl Candida albicans bei Gesunden nicht pathogen ist, kann der Pilz bei Personen, die an mehreren Krankheiten leiden, intensiv mit Breitbandantibiotika behandelt werden
Es wurde bereits erwähnt, dass die Expressionsaktivität von ahpC1 unter Normalbedingungen erst nach der exponentiellen Phase erhöht ist (104, 146), jedoch wurde das Gen bei
Die meisten Desinfektionsmittel für schnelle und sichere Inaktivierung von Milzbrandsporen nicht geeignet.. USAMRIID: Dekontaminierung von Sicherheitswerkbänken mit 10% Bleiche
Bei je drei Patienten konnte eine Besiedlung der Gallenblase nachgewiesen werden, ohne dass Anal- oder Oralregion mit Candida besiedelt waren.. Dies führte
6a–c (von oben nach unten): Zusammenfassung der intraoralen Befunde bei dem 4jährigen Kind mit ECC im zeitlichen Verlauf der Karies inaktivierung in frontaler Ansicht sowie
Der Austausch von Tryptophan für Arginin an Position 274 und Austausch eines Glycinrests gegen Alanin an Position 275 führt sowohl zu einem schnelleren Kernimport
Als wichtige Ergänzung hat das neu gegründete Netzwerk nicht nur Daseins-Berechtigung, es bietet vielen selbständig ope- rierenden Alltagsbegleitern eine Grundlage für