AUS DEM LEHRSTUHL FÜR NEUROLOGIE DIREKTOR: PROF. DR. MED. RALF LINKER DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG
Volltext
Abbildung
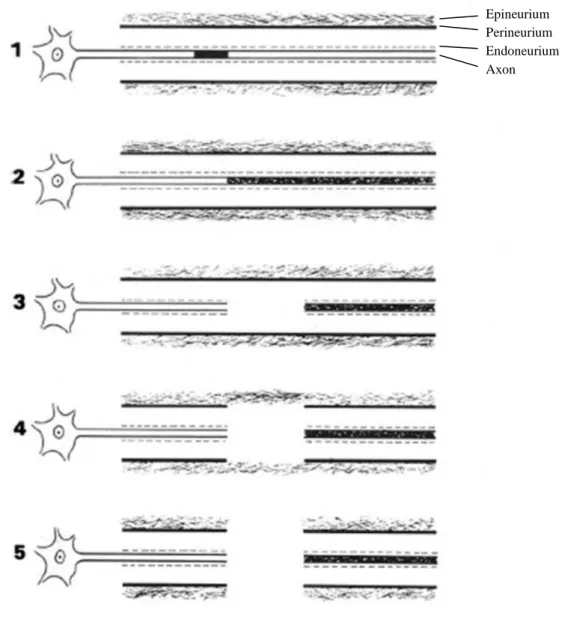
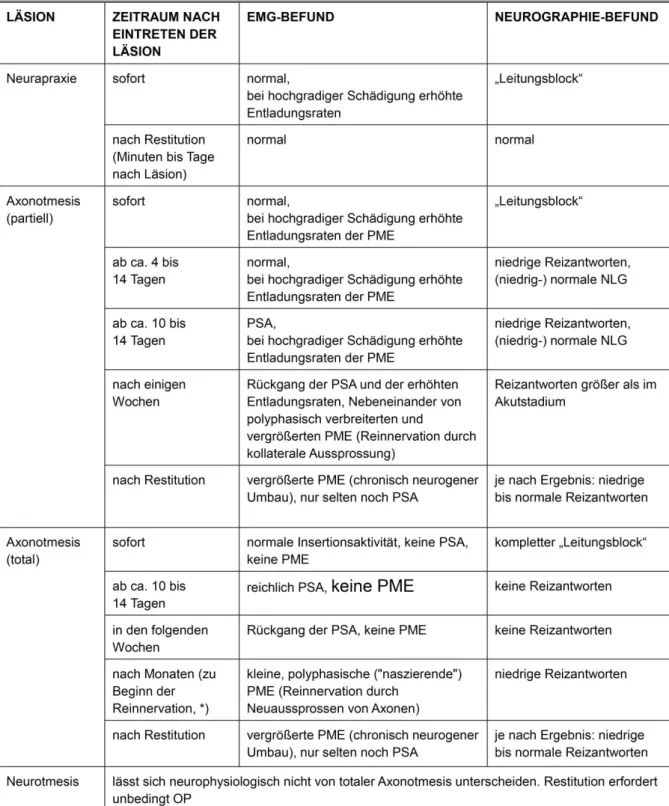
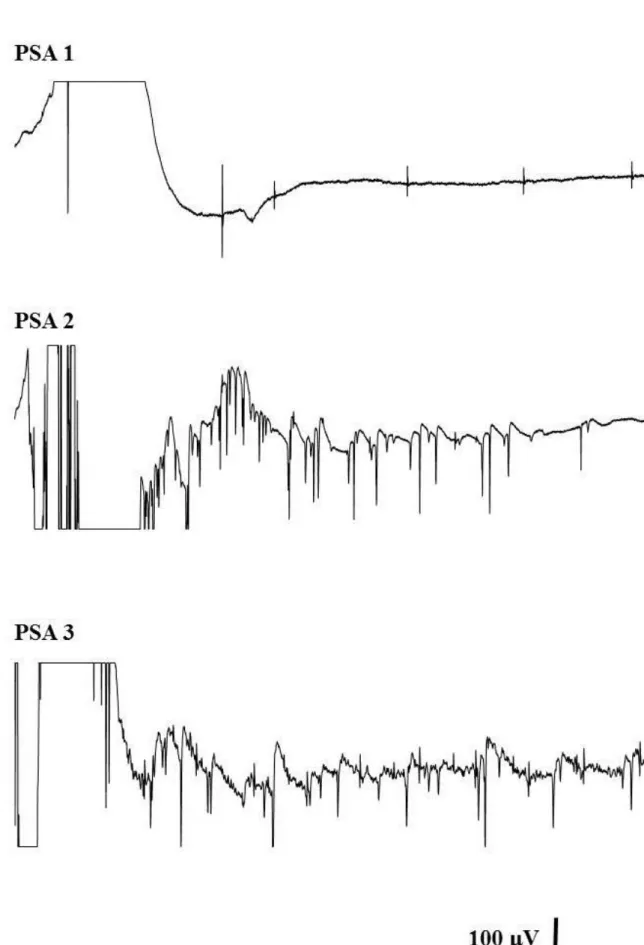
ÄHNLICHE DOKUMENTE
Figure 35: Pre- and postoperative deviation of the patellar shift (absolute values) Figure 36: Pre- and postoperative deviation of the patellar shift in each case Figure 37: Pre-
Ziel der Studie war zu untersuchen, ob sich die Volumina der Hirnstrukturen Thalamus, Nucleus caudatus, Putamen, Pallidum, Nucleus accumbens, Amygdala, Hippocampus und die
Zusammenfassend kann man sagen, dass sich in unserer Studie sowohl deutliche Vorteile für die Patienten nach erfolgreicher Pankreastransplantation im Vergleich zur Einstellung
Inzwischen wurde in einer großen prospektiven Studie gezeigt, dass die Anzahl der Rezidive im weiteren Verlauf deutlich geringer war, wenn man an der Stelle weiter
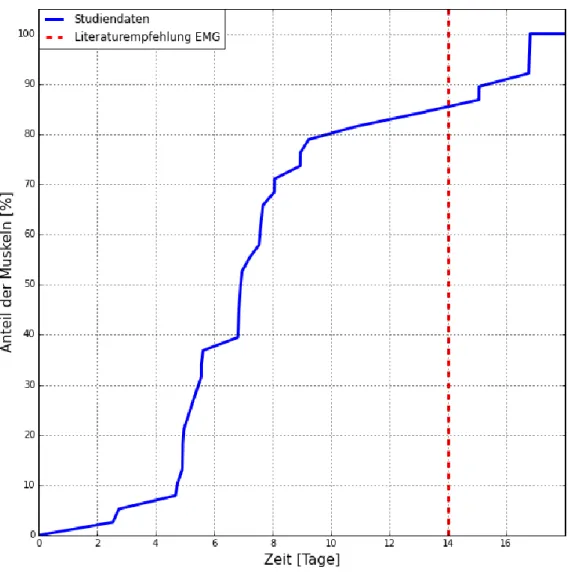
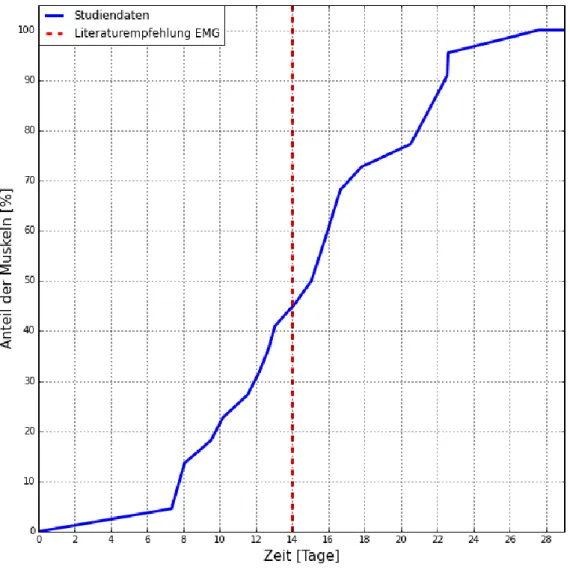
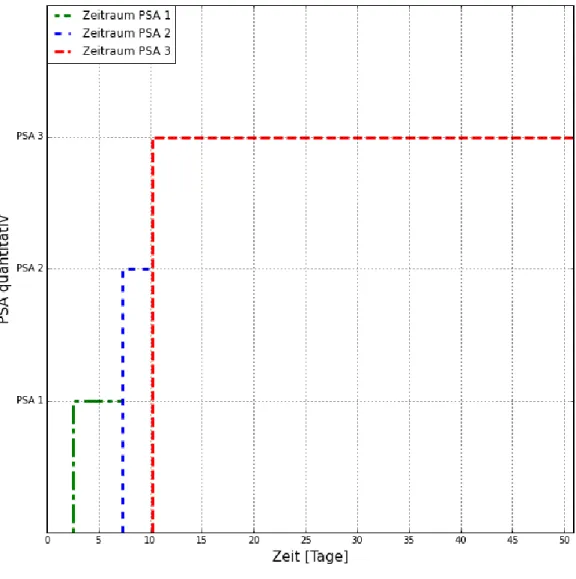
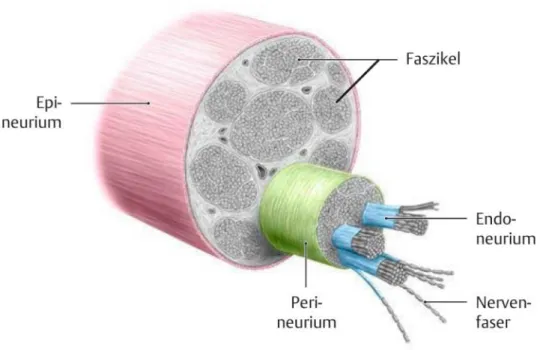
Abbreviations: ADM, abductor digiti minimi muscle; ALS, amyotrophic lateral sclerosis; CMAP, compound muscle action potential; IS-MUNE, incremental stim- ulation motor unit
Da der Vergleich eines Gelenkes zur Gegenseite der anderen Hand beim Torhüter schwierig ist, da zum größten Teil beide Hände von Verletzungen oder Beschwerden
Tatsache ist jedoch, dass die normale Ernährung den Mehrbedarf an Folat/ Folsäure in der Schwangerschaft nicht deckt (BgVV und BZgA 2001) und nur durch zusätzliche Folsäuregabe
172 Unter den 20 häufigsten Medikamenten sind sowohl von 1995 bis 1999 als auch von 2000 bis 2006 jeweils acht Nicht-NL zu finden, wobei jeweils drei Nicht-NL unter den