Aus dem Lehrstuhl für Innere Medizin II Direktor: Prof. Dr. med. L. Maier der Fakultät für Medizin der Universität Regensburg
Volltext
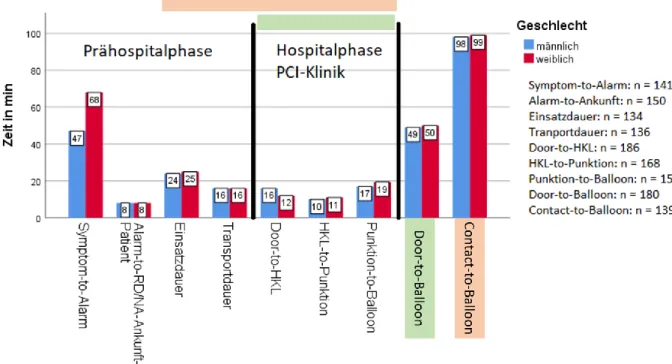
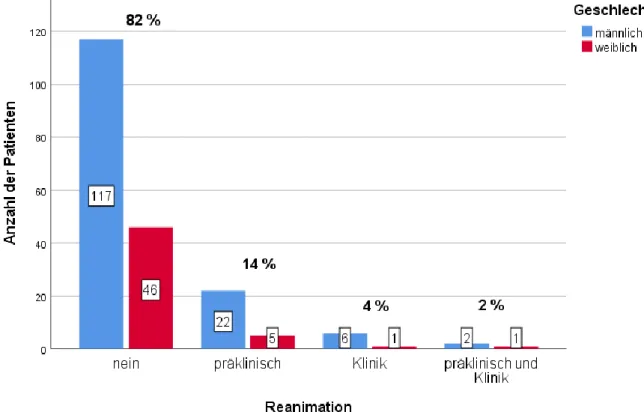
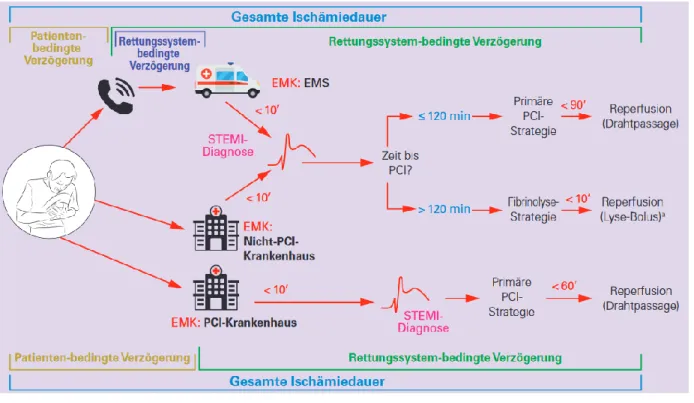
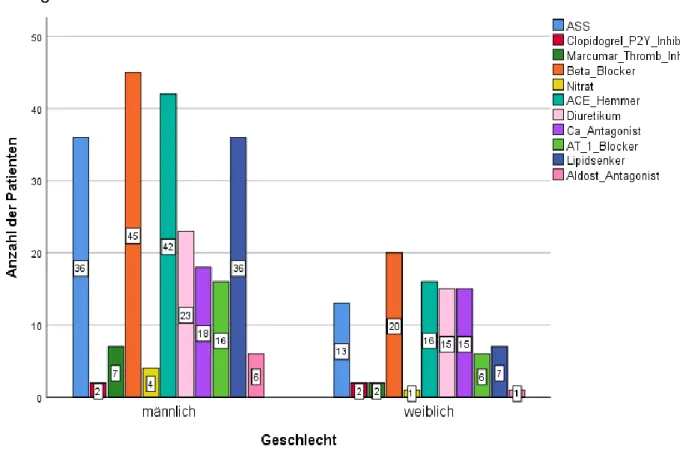
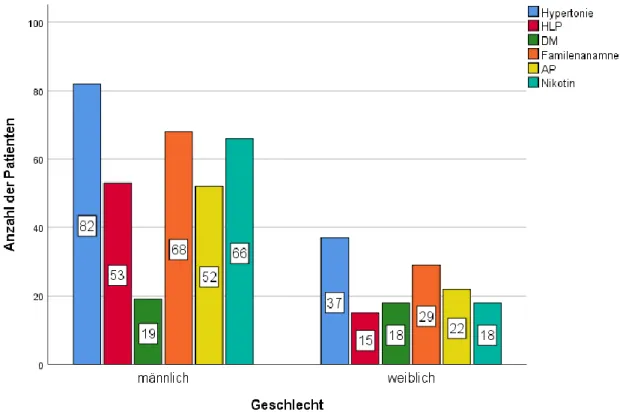
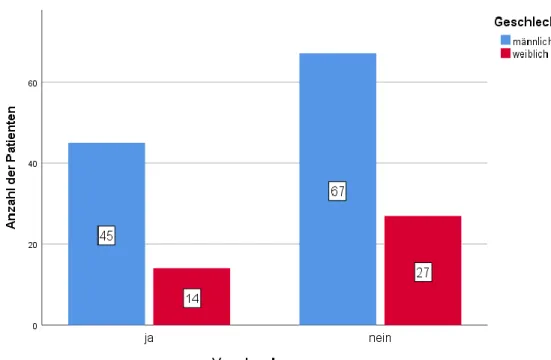
Abbildung
ÄHNLICHE DOKUMENTE
Bei der COPD (chronic obstructive pulmonary disease) handelt es sich nach der Definition der Global Initiative for Chronic Lung Disease (GOLD) um eine häufige
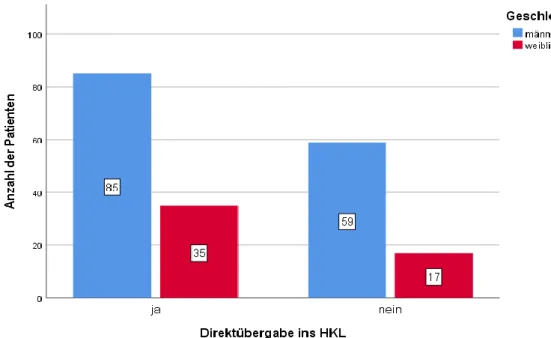
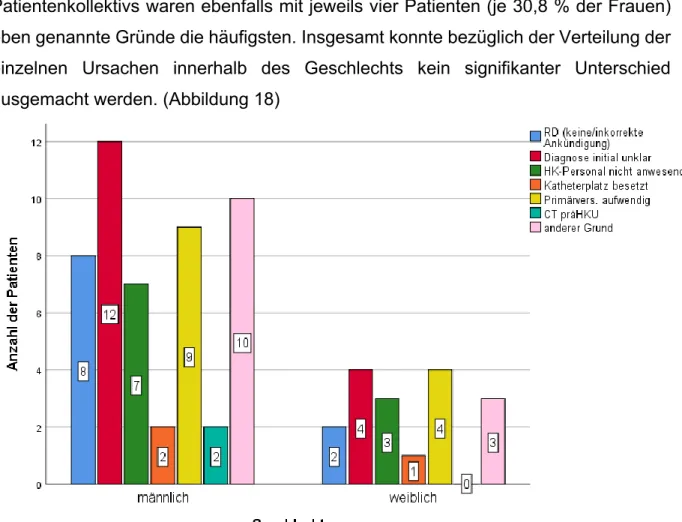
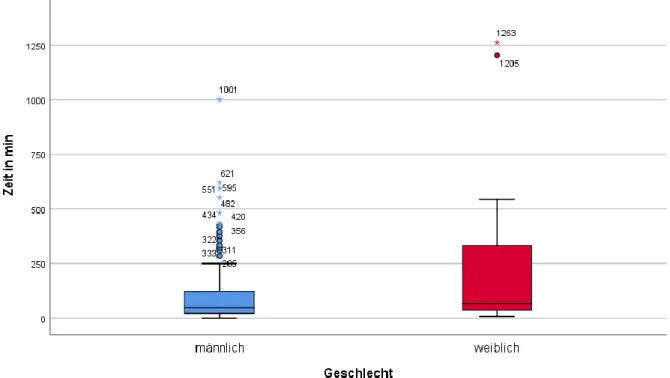
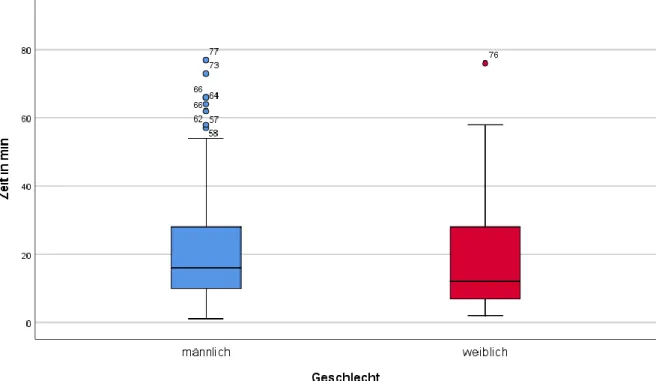
Für die Analyse des Überlebens wurde das Patientenkollektiv unterteilt. Die Gruppe der Überlebenden umfasst alle Patienten, die aus dem UKR entlassen wurden,
Regarding serial testing, excellent predictive values were achieved with a sensitivity of 89% and a specificity of 85% for the diagnosis of Non-STEMI at a 10-fold higher cutpoint
Durch Vergleich der ROC-Kurven von NT-proBNP und dem Lee revise cardiac index ergab sich keine statistisch signifikante Überlegenheit von NT-proBNP für die Endpunkte MACE,
Bei den Ergebnissen für NGAL zeigte sich bei der mit Omapatrilat behandelten herzinsuffizienten Gruppe eine leicht, aber nicht signifikant höhere NGAL-Expression als bei
Weiterhin lieferte diese Methode deutliche Hinweise darauf, dass die mit ATG stimulierten DCs in der Lage sind, die Proliferation von T-Zellen, welche durch reife DCs induziert
Die Unterscheidung zwischen akuter und chronischer GvHD kann nicht alleine anhand der Zeitspanne nach SZT gemacht werden, denn eine akute GvHD kann sich ohne
Inzwischen wurde in einer großen prospektiven Studie gezeigt, dass die Anzahl der Rezidive im weiteren Verlauf deutlich geringer war, wenn man an der Stelle weiter