AUS DEM LEHRSTUHL FÜR INNERE MEDIZIN II PROF. DR. LARS MAIER DER FAKULTÄT FÜR MEDIZIN
Volltext
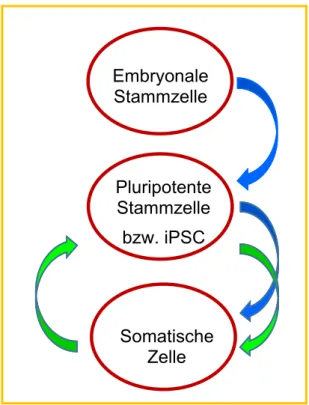
Abbildung
ÄHNLICHE DOKUMENTE
Bei den Ergebnissen für NGAL zeigte sich bei der mit Omapatrilat behandelten herzinsuffizienten Gruppe eine leicht, aber nicht signifikant höhere NGAL-Expression als bei
Dabei konnte man die geschlechtsspezifischen Unterschiede in Bezug auf Nüchternglukose auch bei schlanken Männern feststellen, was insbesondere nach Adjus- tierung für Alter,
EFfects of continuous positive airway pressure treatment and withdrawal in patients with obstructive sleep apnea on arterial stiffness and central bp*. Buchner NJ,
Die Gruppe der ER-positiven adipösen Probanden in unserem Studienkollektiv lässt sich durch einen insgesamt gesünderen Phänotyp im Vergleich zu den ER-negativen
Im Gegensatz zum allosterischen CaMKII-Inhibitor KN-93 (grün) ist AS100105 (rot) aufgrund seiner kompetitiven Wirkung an der ATP-Bindungsstelle in der Lage sowohl die
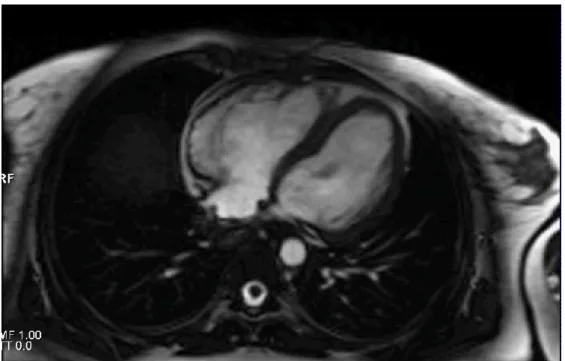
In vorliegender Untersuchung wurde entsprechend den Empfehlungen der Society for Cardiovascular Magnetic Resonance (SCMR) eine Kombination von verschiedenen
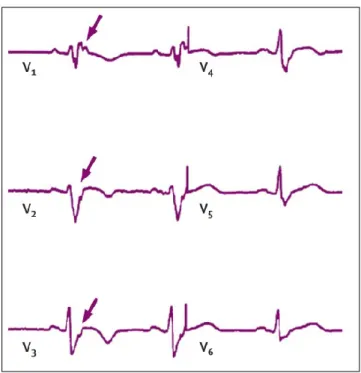
Inzwischen wurde in einer großen prospektiven Studie gezeigt, dass die Anzahl der Rezidive im weiteren Verlauf deutlich geringer war, wenn man an der Stelle weiter
Bei der COPD (chronic obstructive pulmonary disease) handelt es sich nach der Definition der Global Initiative for Chronic Lung Disease (GOLD) um eine häufige