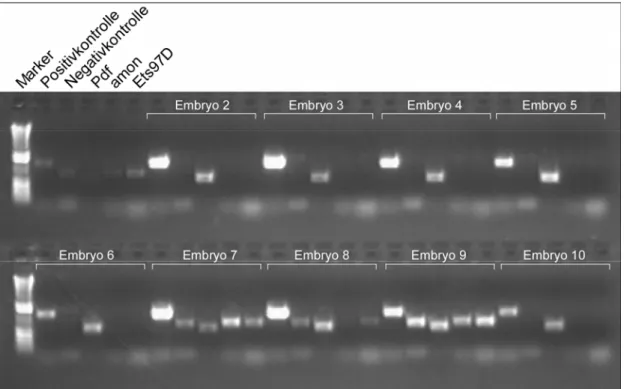
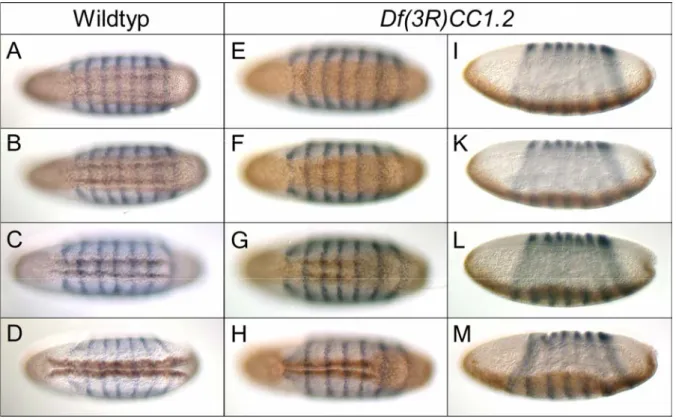
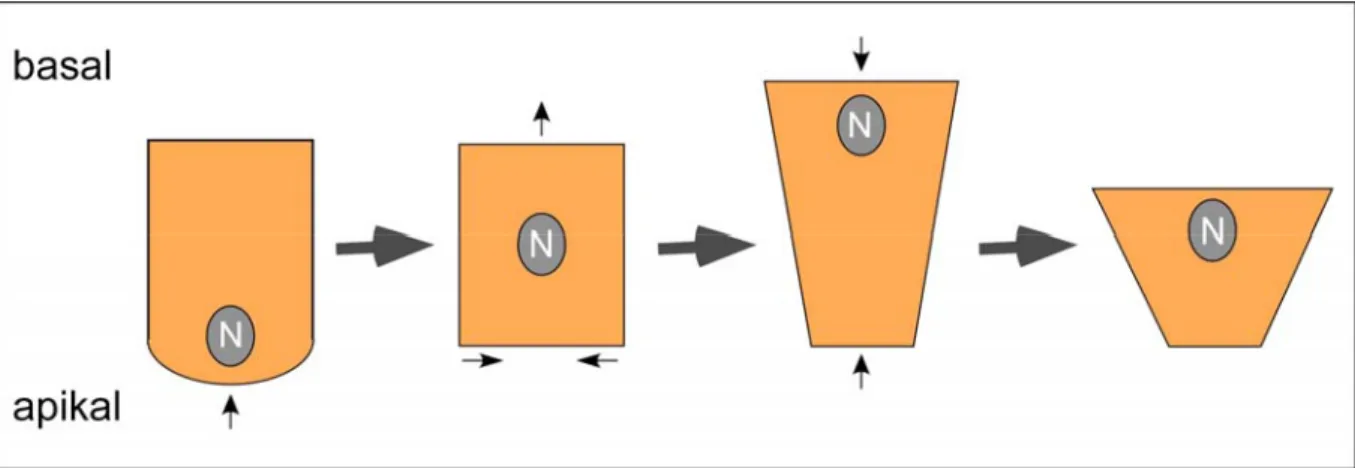
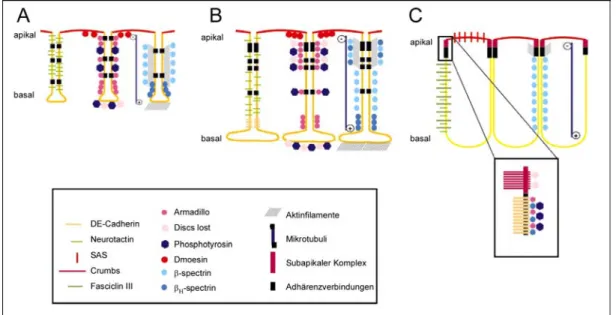
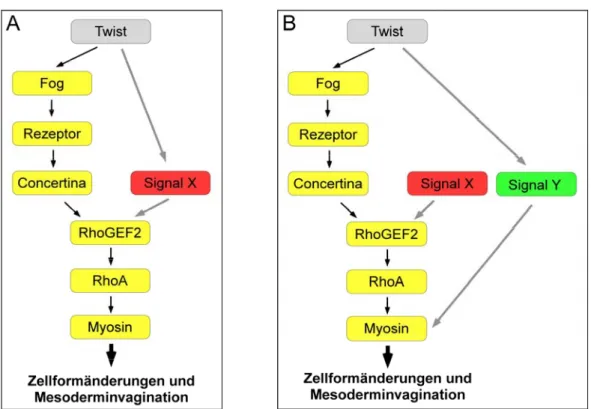
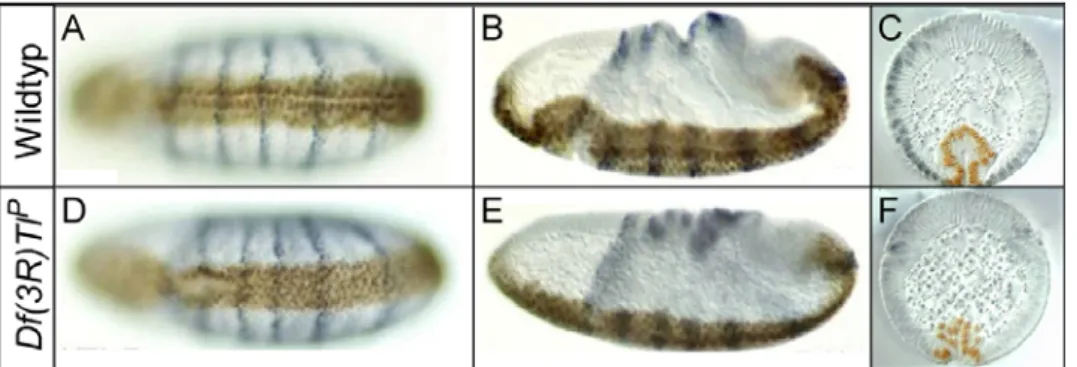
T48 reguliert mit Fog/Concertina die Zellformveränderungen während der Mesoderminvagination in Drosophila melanogaster
Volltext
Abbildung
ÄHNLICHE DOKUMENTE
Mutational analysis of a histone deacetylase in Drosophila melanogaster: missense mutations suppress gene silencing associated with position effect variegation.. Types of
Jedoch konnte spä- ter gezeigt werden, dass sowohl die Serratia-Nuklease, als auch die Anabaena- NucA in der Lage sind die synthetische Verbindung
After the population reproduces the complete Hi-C data, we include the vector E (lamina- DamID), again in stages with decreasing contact probability thresholds (λ).... Snapshot of
Das Controlling des Amtes für Betriebswirtschaft und Aufsicht der Justiz-, Gemeinde- und Kir- chendirektion (JGK) zeigt auf, dass die Budgetkredite auf den Kontengruppen 301 (Löhne des
Die etablierte Funktion von Rca1 als Inhibitor des APC/C wurde vor allem durch Überexpression von Rca1-Derivaten während der Embryogenese ermittelt. Für die konservierte F-box
Während eine Aktivierung der Transkription durch den Kofaktor GCN5 mit einer starken Acetylierung des Chromatins in Bereichen GCN5-abhängiger Promotoren einherging, konnten
Bypassing was first identified in the translation of the gene 60 of bacteriophage T4 (Huang et al., 1988; Weiss et al., 1990), where the ribosome translates the mRNA until it
melanogaster, the uniqueness of the X chromosome is reflected by its sex-biased gene content and its special mechanisms of gene expression regulation, such as dosage