Research Collection
Doctoral Thesis
Versuche zur Bestimmung des Wasserstoffes in Gasgemengen durch Absorption
Author(s):
Fischli, Ernst Publication Date:
1915
Permanent Link:
https://doi.org/10.3929/ethz-a-000089062
Rights / License:
In Copyright - Non-Commercial Use Permitted
This page was generated automatically upon download from the ETH Zurich Research Collection. For more information please consult the Terms of use.
ETH Library
Versuche zur Bestimmung des
Wasserstoffes in Gasgemengen
durch Absorption
Von der
Eidgenössischen Technischen Hochschule
in Zürich
zur Erlangung der
Würde eines Doktors der Technischen Wissenschaften
genehmigte
Promotionsarbeit
vorgelegt von
Ernst
Fischli, dipl. Chemiker,
aus DiessenhofenReferent: Herr Prof Dr. E. BOSSHARD Korreferent: Herr Prof. Dr. F. P TREADWELL
DIESSENHOFEN 1915 Buchdruckerei FRITZ FORRER
Leer Vide Empty
jJleinen fieben Öfh em
Leer Vide Empty
chemischen Laboratorium der Eidgen. Tech¬
nischen Hochschule in Zürich ausgeführt.
Meinem hochverehrten Lehrer,
Herrn Prof. Dr. E. BOSSHARD, spreche ich meinen besten Dank
ausfür
das rege Interesse und die vielen Anre¬
gungen und Ratschläge, die
er mirjeder¬
zeit zuteil werden Hess.
Leer Vide Empty
A. Wasserstoffbestimmung.
Für die
gasvolumetrische Bestimmung
des Wasser¬stoffes kommen zwei Methoden in Betracht: die Bestim¬
mung durch
Verbrennung
und dieBestimmung
durchAbsorption.
I.
Bestimmung
durchVerbrennung.
Die älteste
Gasverbrennungsmethode
zurAnalyse
deran der
Verbrennung
teilnehmendenGaskomponenten
mit¬telst der bei diesem
Vorgang
entstehenden Kontraktion ist dieExplosionsmethode.
Diese Methode hat
allgemeine Verwendung gefunden
zur
Bestimmung
des Wasserstoffes und des viel schwerer verbrennbaren Methans. DieExplosionsmethode
ist nun, trotzdem die Wasserstoff- und dieMethanbestimmung
mit¬einander
gemacht
werdenkönnen,
nicht ohne verschiedeneMängel.
Das
Gasgemisch wird,
wiebekannt,
in derExplosions¬
pipette
überQuecksilber
beigeringem
Vacuum durch elek¬trische Funken entzündet. Das zur
Analyse vorliegende Gas,
dasgewöhnlich
nicht ohne weiteres zurExplosion gebracht
werdenkann,
muß durch Zusatz von Luftexplo¬
dierbar
gemacht
werden. Wir erhalten natürlichje
nachder
Zusammensetzung
der Gase bei derVerbrennung
ver¬schiedene
Kontraktionsgleichungen.
Nehmen wir an, das Gas bestehe nur aus Wasserstoff und
Stickstoff,
danngilt folgende Ueberlegung
:2H2
+
O2 = 2H* 0das heißt:
2 Vol. H2 4- 1 Vol. O2 = 2 Vol. H2 0-
dampf
=0 Vol. Wasser oder: 3 Vol. Gas= 0 Vol. Wasser.
Die Kontraktion C
beträgt
somit:C = 3 Vol.
Die verbrannte
Wasserstoffmenge ist,
da von diesen3 Volumen 2 Vol. als Wasserstoff zugegen waren :
H2 = C .
*/s
Vol.Enthält also das zu verbrennende Gas neben Stick¬
stoff nur
Wasserstoff,
sofügt
man auf 2 Vol. Wasserstoff 1 Vol. Sauerstoff oder 5 Vol. Luft zu.Besteht das
Gasgemisch
aus Methan undStickstoff,
so
gilt
dieGleichung
:Cm
-\-
2O2 = CO2-f
2 Ha 0das heißt:
1 Vol. Cm
+
2 Vol.O2 =1 Vol. CO*+
2 Vol. H2 O-dampf
=0 Vol. Wasser, oder: 3 Vol. Gas = 1 Vol. C02
, Die Kontraktion Ci
beträgt
:Ci = 3— 1 — 2 Vol.
Daraus
ergibt
sich derMethangehalt,
da von diesen2 Volumen 1 Vol. als Methan zugegen war : Cm = Ci .
Va
Vol.Das entstehende
Kohlendioxyd,
dessen Volumengleich
ist dem des zu verbrennenden
Methans,
absorbiert manmit
Kalilauge,
so daß3 Vol. Gas = 0 Vol. Wasser liefern.
Die bei der
Verbrennung
mitnachfolgender Absorp¬
tion entstehende Kontraktion C2
beträgt
daher:& = 3 Vol.
Da von diesen 3 Volumen 1 Vol. als Methan vor¬
handen war, erhält man :
CH4 = C2.
7.«
voi.Man setzt also zu
je
1 Vol.methanhaltigem
Gas vorder
Verbrennung
mindestens 2 Vol. Sauerstoff oder 10 Vol. Luft.Bei
Gasgemischen,
die ausWasserstoff,
Methan undStickstoff
bestehen, gestalten
sich dieVerbrennungsver¬
hältnisse
komplizierter.
Zu einerBestimmung
nimmt man12—15 ccm Gas und
fügt
dazu 100 ccm Luft =20,9
ccm Sauerstoff. Dieses Gemischbringt
man in derExplosions¬
pipette
untergeringem
Vacuum durch elektrische Funkenzur
Explosion.
Die aus Methan entstehende Kohlensäure absorbiert man wie schonangegeben
mitKalilauge,
dannwird die Gesamtkontraktion Vc gemessen. Der nicht ver¬
brauchte Sauerstoff wird mit
Phosphor absorbiert,
die ver¬brauchte
Sauerstoffmenge
V0 ist dann:zugesetzter
Sauer¬stoff
weniger überschüssigen,
mitPhosphor
absorbierten Sauerstoff.Setztman dasWasserstoffvolumen=
X,
und das Me¬thanvolumen —
Y,
so erhalten wirfolgende Gleichungen
: Gesamtkontraktion Vc =7äX-|-3Y
Verbrauchter Sauerstoff V0 =
7a
X-f
2 Y Darausergibt
sich:X=*/„Vc—2Vo= H2 und
Y=V0
—V* Vc
=CIL Diese Werte werden auf dengesamten
Gasrest be¬rechnet,
und man erhält so denProzentgehalt
des betref¬fenden Gases an Wasserstoff und Methan. Den Rest be¬
trachtet man als Stickstoff.
Grosse
Genauigkeit
kann bei dieserMethode,
wieübrigens
bei allenVerbrennungsmethoden,
nicht erwartet werden. Zu demUmstand,
daß Fehler durch die Um¬rechnung
erheblichvergrößert werden,
tritt noch dieSchwierigkeit,
dieVerbrennung richtig
durchzuführen. Ist in derExplosionspipette
ein zu hoherDruck,
so verbrenntauch ein Teil des
Stickstoffes,
und istumgekehrt
ein zuhohes Vacuum
vorhanden,
so ist dieVerbrennung
un¬vollständig.
Dazu kommtnoch,
daß die ganze für dieExplosionsmethode nötige Apparatur
ziemlich viel Platzbeansprucht.
Man hat denn auchversucht,
diese Methode durch eine einfacher durchzuführende zu ersetzen.Verbrennung
ohneExplosion.
Diese
Verbrennung
wird hier unterMitwirkung,
zumTeil
katalytischer Natur,
verschiedener Metalledurchge¬
führt. Als solche kommen in Betracht:
Palladium, Platin,
dannOxyde
von Palladium und vonKupfer.
Mit Hülfeerstgenannter
Metalle kann man Gase mit Sauerstoff beiTemperaturen verbrennen,
die unter den betreffendenEntflammungspunkten liegen.
Je feiner die Metalle verteiltsind,
um so besser findet dieseVerbrennung
statt.Coquillion
hat zuerst brennbare Gase inMischung
mit Sauerstoff beiGegenwart
einerglühenden Platinspirale verbrannt.1)
Er bestimmte damit denMethangehalt
derGrubengase.
Diese Methode wurde von Clemens Winkler und von Dennisverbessert.2)
Während diePlatinspirale
durch den elektrischen Strom zum Glühen
gebracht wird,
leitet man zum
Gasgemisch langsam
Sauerstoff.Drehschmidt verwendet an Stelle der elektrisch er¬
hitzten
Spirale
eine von aussen erhitztePlatinkapillare.3)
Ist nur
methanhaltiges
Gas zuverbrennen,
so kann diese Methodegut
benützt werden. DieHauptschwierigkeit liegt darin,
daß dieTemperatur
nicht leicht auf derrichtigen
Höhe
gehalten
werden kann. Dieser Umstand erschwert dieAnwendung
der Methode für die technischeGasanalyse
außerordentlich.
Die
Verwendung
von Palladium erlaubt durch ge¬eignete Temperaturregulierung
dieVerbrennung
vonWas- ') Hempel, Gasanalytische Methoden.2) do.
3) do.
serstoff neben Methan. Palladium wird entweder als Draht oder als Schwamm verwendet.
Zuerst wurde die fraktionierte
Verbrennung
von W.Henry angewendet.
Er benützte auf 177" erhitzten Palla¬diumschwamm.1)
Bunte führte dieAnwendung
von Palla¬diumdraht
ein.2)
DasVerbrennungsröhrchen,
das denPalladiumdraht
enthält,
wird bis zum Glühenerhitzt,
dannwird das Gas
durchgeleitet.
Wink 1erempfiehlt
an Stelledes Drahtes
Palladiumasbest.3)
Dieser wird in einer Ka¬pillarröhre
schwacherhitzt,
dasGasgemisch (Gasrest -f"
Luft) langsam darübergeleitet,
dann dieeingetretene
Kon¬traktion gemessen. Die
richtige Temperatur
genau ein¬zuhalten ist auch hier
schwierig, gewöhnlich
verbrennt noch etwas Methan.E.
Jäger
führtediefraktionierteVerbrennung
mitKupfer¬
oxyd
indieGasanalyse ein.4)
Schon früherbenützte FreseniusKupferoxyd,
um brennbare Gase zu verbrennen. Das ge¬körnte
Kupferoxyd
wird in einerGlasröhre auf 250°erhitzt,
dann wird dasGasgemisch übergeleitet. Hauptvorteil ist,
daßman dengesamten
Gasrest ohneirgend
welche Sauer¬stoffzufuhr benützen
kann,
daneben ist aber auch wieder derNachteil,
daß die Luft aus demVerbrennungsröhrchen
zuerst mit Stickstoff
verdrängt
werden muß.Außer diesen
Verbrennungsmethoden
kommen zurWasserstoffbestimmung
wieanfangs
erwähnt noch inBetracht :
IL
Bestimmung
durch Occlusion undAbsorption.
Die
Jaquelinsche Methode,
metallisches NatriumundKa¬liumzur
Absorption
zubenützen,
bewährtesichnicht.6)
Was-') Annals of philosophy, 25, 428.
2) Ber 1878 11, 1123.
a) Winkler, Technische Gasanalyse.
4) Zeitschrift für Gasbeleuchtung 1898, 764.
5) Ann- chim- phys. 74, 203
serstoff wird zwar bei 200—300°
energisch absorbiert, dagegen
ist esunmöglich,
die Gase ohne Rest aus demAbsorptionsgefäß
zuverdrängen,
da man bisjetzt
keineSperrflüssigkeit besitzt,
die ihren Dienst vollkommen er¬füllt.
Es ist dann
Hempel gelungen,
dieEigenschaft
derPlatinmetalle,
Wasserstoff zuoccludieren,
für die Gasana¬lyse
zuverwenden.1)
Vor allem besitzt dieseFähigkeit
das
Palladium,
das schon bei 100°große Mengen
Wasser¬stoff aufnimmt.
Hempel
verwendet oberflächlichoxydier¬
ten Palladiumschwamm oder das noch wirksamere Palla¬
diumschwarz. Die
U-röhren,
in denen sich die Palladium¬präparate befinden,
werden wie die bei denVerbrennungs¬
methoden verwendeten
Verbrennungsröhren,
zwischen dieGaspipette
und die Gasbüretteeingeschaltet.
Die U-röhre wird in 90—100° erwärmtes Wassergestellt,
dasGasge¬
misch,
natürlich ohneLuftzusatz, einige
Maledurchge¬
trieben. Nachdem man die
Kohlensäure,
mit der die U- röhre vor der Reaktiongefüllt
war, um Fehler zu ver¬meiden,
mitKalilauge
absorbierthat,
wird der Gasrest ge¬messen. Nachder
Operation regeneriert
man dasPalladiumwieder. Trotz der einfachen
Apparatur
ist auch diese Me¬thode für technische
Betriebsanalysen wenig geeignet,
dadie
Palladiumpräparate
sehr teuer sind und da durch denUmstand,
daßdie imApparat
sichbefindliche Luftzuerstmit Kohlensäureverdrängt
werdenmuß,
dieHandhabung
derMethode umständlich wird. Methan muß hier mit der
Explosionsmethode
bestimmt werden.Eine ganz neue und genaue Methode führten Paal und Hartmann
ein,
indem sie Palladiumsolbenützten,
das vorwegregeneriert wurde,
indem der Wasserstoff an unge¬sättigte Verbindungen angelagert wurde.2)
AlsKataly¬
sator wurde das
colloidale,
mitprotalbinsaurem
Natrium') Hempel, Gasanalytische Methoden.
2) Ber.41, 804.
als Schutzcolloid versetzte Palladium verwendet. Störend wirkt der
Umstand,
daß die zurRegeneration
des Palla¬diumsols verwendete
wässrige Lösung
vonNatriumpikrat
stark
schäumt,
so daß man nach derAbsorption
sehrlange
wartenmuß,
bis der beim Schütteln entstehende Schaum verschwunden ist. Diesen Schaum kann manzerstören,
indem man entwedergeringe Mengen
Alkohol einfließenläßt,
oder indem man den Schaum durch einengmaschiges,
zwischenKugel
undKapillare
derAbsorp¬
tionspipette eingeschmolzenes
Platindrahtnetz treibt. Durch den Alkoholzusatz wird aber dieAbsorptionskraft
der Lö¬sung, oder besser
gesagt
diekatalytische Wirkung
desPalladiumsols so
geschwächt,
daß dieseLösung
nachhernicht mehr
gebraucht
werden kann.Die
guten Resultate,
die mit dem colloidalen Palla¬dium erreicht
wurden,
veranlaßten uns, neben den nach¬stehend beschriebenen
Nickelpräparaten
colloidales Nickel herzustellen zuversuchen. Es ist uns aber bisjetzt
nichtgelungen,
das nach dem Patent von Kallehergestellte,
mit
protalbinsaurem
Natrium als Schutzcolloid versetzteNickeloxydul
ohne Zusatz von Palladium zum Metall zureduzieren.1)
Unsere Versuche
gingen
nundahin,
das verhältnis¬mäßig kostspielige
Paalsche Palladiumverfahren durch einbilligeres,
fürdie technischeAnalyse
inBetracht kommen¬des Verfahren zu ersetzen. Den
Weg
hiefür wies uns die in den letzten Jahren sogewaltig
entwickelt„Oel- härtung".
Bei dieser Industrie werdenungesättigte
Fett¬säuren und deren
Derivate,
wie solche imTran,
Baum¬wollsamen-, Oliven-, Sesam-, Lein-, Kokospalmöl vorliegen,
dann die Oelsäure und deren Derivate selbst durch Was¬
serstoffanlagerung
infeste, gesättigte Verbindungen
über¬geführt.
DieseOelhärtung
fußt auf denepochemachenden
') D.R.P. 180729 und Ber.47, 2203.
Arbeiten von Sabatier und
Senderens.1)
Im Jahre 1897erhielten sie durch
Synthese
ausAethylen
und Wasserstoff unter Zuhülfenahme von Nickel alsKatalysator
Methan.Einige
Zeitspäter gelang
esihnen,
Benzol zumHydroben-
zol zu
hydrieren,
Methan ausKohlenoxyd, Kohlendioxyd
und Wasserstoff herzustellen. Letzteres
Verfahren,
Her¬stellung
vonMethan,
wird in der Gasindustriepraktisch angewendet,
indem man laut Patentschrift Methankataly-
tisch ausHandelsgas,
das vonKohlendioxyd
befreitist, herstellt.2)
In erster Linie interessierten wir uns für die Ge¬
winnung
eines wirksamenKatalysators.
B. Die für die „Oelhärtung" vorgeschlagenen Katalysatoren.
Als
erstes,
für dieOelhärtung
in Betracht kommendesVerfahren,
erschien das Normannsche Patent von der FirmaLeprince
& Sivecke inHerford.3)
Dieses Verfahren wurde von Crosfield inWarrington, England, erworben,
der es zu einem wirklichpraktisch
verwendbaren Ver¬fahren ausarbeitete. Die Lizenz für Deutschland
ging
an die„Germania-Oelwerke"
in Emmerichüber,
derengroße Fetthärtungsanlage
nachdemNormannschenPatent arbeitet ; in Oesterreich arbeitet eine Fabrik inAussig
nach diesem Verfahren. Nach dem Normannschen Patent werden un¬gesättigte
Fettsäuren und derenGlyceride
mit Hülfe vonreduziertem Nickel bei 180—200° in
gesättigte
Verbin¬dungen übergeführt.
Das Nickel wird entweder inloser, pulvriger
Form oder aufgeeigneten Trägern,
z. B. Bims¬stein,
feinverteilt,
verwendet.Die
große Bedeutung,
die diese Industrie errang, rief eine Reihe vonPatenten undPatentanmeldungen
für Ver-') C. r. d.I'accad. 124, 1358-61. 132, 210-12. 134, 689—91.
-) D.R. P. 237499.
3 D. R.P. 141029.
besserung
der Kontaktmassenhervor,
die sich zum Teilin die Praxis
eingeführt
zu habenscheinen,
zum Teil aber auch unverwertetgeblieben sind,
Platin- und Palladium¬präparate
haben sich trotz dergünstigen Wirkungsweise
wegen der
allzugroßen Kostspieligkeit
nichteingeführt.
Eine
Verbesserung
des Normannschen Verfahrens soll nach C. und G. Müller dadurch erreichtwerden,
daß dieMetalle nach der Reduktion noch im
Kohlendioxyd geglüht werden,
wodurch die im Wasserstoffstrom wahrscheinlich entstandenenMetallhydrüre
zersetzt und in reine Metalleumgesetzt
werdensollten.1)
Bedford und Erdmann
schlugen
vor, an Stelle von reduziertem Nickel dasOxyd
oder besseroxydulhaltiges Nickeloxyd
zuverwenden.2)
Ob nun das metallische Nickel oder dasNickeloxyd
alsKatalysator wirke,
darüberherrschen verschiedene Ansichten. Nach Bedford und Erdmann ist nicht das reduzierte
Nickel,
sondern des Nickel¬oxyd
nebstSuboxyd WasserstoffÜberträger. *)
Nach ihrerAnsicht entsteht zunächst aus dem
Oxyd
eineniedrigere Oxydationsstufe,
einSuboxyd,
dem nach Beilud und Co- relli die Formel NÎ2 0 zukomme. Unter besonderen Umständen könnten aber auch nochSuboxyde
andererZusammensetzung
entstehen. AlsZwischenphasen
kämenin Betracht:
1. die
Additionsverbindungen:
! HC —Ni
\
0/
HC —Ni!
y) Franz. Pat 45 070
2) Franz.Pat 436295 und 18122.
3) Journal für prakt Chemie 1913, 425-455 HNi
\
und 0
/
HNiDie letztere soll den Wasserstoff ganz lose
gebunden enthalten.
2. Durch das
Suboxyd
findeeineZerlegung
vonWasserstatt, wodurch
dann der soentstehende,
naszierende Was¬serstoff auf die
ungesättigte Verbindung
einwirke.Ni
\
0
-f
H2 0 > 2NiO-f-
H2/ /
Ni
Durch den
zugeführten
molekularen Wasserstoffwerde dann dasgebildete Oxyd
wieder zumSuboxyd reduziert,
das wieder eineZerlegung
von Wasser bewirke und sofort. Auf alle Fälle entstehe kein metallisches
Nickel,
da derwiedergewonnene,
entfetteteKatalysator
keine elek¬trische
Leitfähigkeit
mehr besitze und mitKohlenoxyd
keinNickelkarbonyl
mehr bilde. Es könnendaher,
sofügen
die Autoren
bei,
zurHärtung
auchHydrate, Karbonate, organische Nickelsalze,
wie zumBeispiel
Formiat undAcetat,
verwendet werden.Zu ganz
entgegengesetzter
Ansicht sindneuerdings
W.Meyer
und G. Bartelsgekommen.1) Metalloxyde
sindnach diesen Forschern nur dann als
Katalysatoren
wirk¬sam bei der Reduktion
ungesättigter Fettsäuren,
wenn sie vorher zum Metall reduziert worden sind. Die Autoren wiesen dieBildung
und das Vorkommen von metallischem Nickel in dem alsKatalysator gebrauchten Nickeloxyd nach,
unterandermauch durchBildung
vonNickelkarbonyl.
Die
Härtung geht
beiAnwendung
von metallischem Nickelvon
Anfang
an viel schneller vorsich,
als beiVerwendung
von
Nickeloxyd.
In der Praxisgenügt
eineTemperatur
von 180° zur
Uebertragung
desWasserstoffes,
bei Nickel¬oxyd
ist eine solche von 250° erforderlich. Es kann nicht ') Journal f. prakt Chemie 1914, 290.anerkannt werden,
daß die nach Erdmann und Bedfordhypothetischen Zwischenprodukte
entstehen.Nun hat auch Normann in einer
längeren Abhandlung nachgewiesen,
daß in allen Fällen bei derHydrierung ungesättigter Verbindungen
mitNickelpräparaten
als Ka¬talysatoren
reduziertes Nickelentstehe,
das dann die An¬lagerung
des Wasserstoffesbewirke.1)
DieBildung
vonmetallischem Nickel wies er nach: 1.
analytisch
durch Be¬stimmung
des mit verd. Schwefelsäure und dem Nickel¬präparat
entwickelten Wasserstoffes und durchelektroly¬
tische
Bestimmung
des Gesamtnickels. Durch einfacheUeberlegung
stellt Normannfest,
daßunbedingt
metallisches Nickel vorhanden sein müsse. 2. DurchBestimmung
derelektrischen
Leitfähigkeit,
und 3. durchBildung
des Nickel-karbonyls.
Zu ähnlichen
Ergebnissen
kamen auch wir imLaufe der
Untersuchungen
betr.Wasserstoffabsorption
; mit metallischem Nickel hatten wir immer bessere Resul¬tate als bei
Anwendung
vonNickeloxyd.
In der Absichtfestzustellen,
waseigentlich
bei derHydrierung
unge¬sättigter Verbindungen
inGegenwart
vonNickelpräparaten
als
Katalysator
dieAnlagerung
des Wasserstoffesbewirke,
führten auch wir mit den
verschiedenen,
zu Wasserstoffab¬sorptionsversuchen
benütztenNickelkatalysatoren
Oelhär-tungen
durch. Dann wurden dieangewandten
Ka¬talysatoren
nach dem Gebrauch auf ihren Gehalt an red.Nickel untersucht. Verwendet wurde
Oelsäure,
deren Jod¬zahl nach Hübl-Waller zu
89,1 gefunden
wurde.Wir härteten in
großen,
miteingeschliffenen Stopfen
versehenen
Reagenzgläsern,
die wir im Luftbad auf diebestimmte
Temperatur
erhitzten. Das Wasserstoffzulei¬tungsrohr
Wurde in der Axe bis dicht auf den Boden ge¬führt,
um eine intensiveBewegung
der zuhydrierenden
') Chem Zeitg 1915, 29.
2
Wasserstoff war
sorgfältig gereinigt
undgetrocknet.
Vordem Gebrauch entwässerten wir die Oelsäure
vollständig,
indem wir sie unter Durchleiten von Wasserstoff zirka 1 Stunde auf 200° erhitzten.
Wir
beobachteten,
um dies voraus zunehmen,
beiallen Versuchen mit
Nickelsalzen,
daß diese Salzezuerst,
bevor eineWasserstoffanlagerung
an die Oelsäure statt¬fand,
zersetztwerdenmußten,
wasgewöhnlich
nicht unter 240°geschah.
Indem fortwährend Wasserstoffdurchge¬
leitet
wurde,
bildete sich reduziertesNickel,
das dann den Wasserstoffübertrug.
Sehr deutlichzeigt
sich diese Zer¬setzung
beiAnwendung
von Nickelborat alsKatalysator.
Die verschiedenen
Hydrierungsversuche
werden im Fol¬genden
näher beschrieben.Hydrierung
der Oelsäure mit Nickelborat nachSchönfeld.1)
Das Nickelborat wurde vor dem Gebrauch nach der Vorschrift von Schönfeld im Wasserstoffstrom
längere
Zeitauf 300°
erhitzt,
um 5 Mol Kristallwasserabzuspalten,
das6. Mol bleibt
hartnäckig
zurück. Nach dem Erkalten im Wasserstoffström wurden 3 gr. des Produktes in 100 gr.Oelsäure
gebracht,
und das Gemisch unter Durchleitenvon Wasserstoff während 3 Stunden auf 250° erhitzt.
Dann filtriertenwir die heiße
Flüssigkeit
durch einen Hei߬wassertrichter,
wuschen denRückstand,
denKatalysator,
mit Benzol aus, lösten ihn in Salzsäure und bestimmten
aus ammoniakalischer
Lösung elektrolytisch
das Gesamt¬nickel.
Von
0,6562
gr. desentfetteten, gebrauchten Kataly¬
sators wurden auf diese Weise
0,5234
gr. als metallisches Nickel bestimmt. Durch Glühen einer Probe dieses ent-') Seifensiederzeitung 1914, 945.
fetteten
Katalysators
im Wasserstoffstrom konntenachge¬
wiesen
werden,
daß der Gewichtsunterschied des elektro¬lytisch gefundenen
Nickelsgegenüber
derabgewogenen Menge
desKatalysators
nur durchgebundenen
Sauerstoffhervorgerufen
wurde =0,1328
gr. Oä. Nimmt man an, der Sauerstoff sei als NiOvorhanden,
so binden diese0,1328
gr. O2 =0,4904
gr.Ni.Der
Katalysator
bestandalso
im Moment der Unter¬suchung
aus25,4 %
red. Nickel und aus74,6 %
NiO. Bor¬säure konnte im
Katalysator
nicht mehrnachgewiesen
werden.
Aus der heißen filtrierten Oelsäure schied beim Stehen ein weißes Pulver aus, das sich nach dem Entfetten und Trocknen als reineBorsäure identifizieren ließ. Aus Wasser kristallisierte sie in
perlmutterglänzenden
kleinen Blätt¬chen aus.
Der
Nickelgehalt
der mit Wasserstoff behandelten Oelsäure wurde nach dervon Schönfeldangewandten
Me¬thode bestimmt. Wir veraschten
je
5—10 gr. derOelsäure,
behandelten den Rückstand mit Salzsäure und bestimmten dannelektrolytisch
aus der ammoniakalischenLösung
das Nickel. Nachdreistündigem
Durchleiten von Wasserstoffbetrug
derNickelgehalt 0,03 %,
die Jodzahl sank nur auf 75. DieHärtung geht
sehrlangsam
vorsich, langsamer
als beiAnwendung
anderer Nickelsalze wie z. B. Nickel-formiat,
da diese sich rascher zersetzen als das Nickel¬borat.
Härtungsversuche
mit reduziertem Nickel nach Normann.1)
Verweüdet wurden 3
%
des zurWasserstoffabsorption angewandten
reduzierten Nickels. Die Resultate sindgut.
Die
Temperatur
wurde während der ganzen Versuchs¬dauer auf 180—190°
gehalten.
Interessant ist das Ver- ') D. R. P. 141029.2*
halten des Nickels als Metall
gegenüber
der Säure. Nach1/i
Stunden besaß die Oelsäure die Jodzahl88,1
und einenNickelgehalt
von0,46 °/«,
nach 3 Stunden die Jodzahl 54 und einenNickelgehalt
von0,02 %,
nach 47*
Stunden die Jodzahl 37 und einenNickelgehalt
von0,005 %• Gegen
das Ende der
Härtung
schied sich das Nickel in Formleichter Flocken aus, die schön
grün gefärbte
Oelsäureverwandelte sich in ein schwach
gelb gefärbtes
festesProdukt.
Benützt man zur
Hydrierung
oberflächlich mit redu¬ziertem Nickel versehenes
Asbestpulver,
sogeht
die Här¬tung infolge
der vonAnfang
an viel feinernVerteilung
des Nickels viel rascher vor sich. Dieses
Nickelpräparat
wurde
hergestellt,
indem manAsbestpulver
mit Nickel¬nitratlösung tränkte,
etwasauspreßte, glühte
und im Was¬serstoffstrom bei 330—340°
sorgfältig
reduzierte.Hydrierung
mitNickeloxyd
alsKatalysator
nach
Erdmann.1)
Ein Versuch wurde bei einer konstant auf 200° ge¬
haltenen
Temperatur
mit 3% Nickeloxyd durchgeführt.
Gegenüber
der Wirksamkeit des reduzierten Nickels tratnun ein bedeutender Unterschied zu
Tage.
Nach 4stün-digem
Durchleiten des Wasserstoffes sank die Jodzahl nurauf
71,85 gegenüber
der Jodzahl 37 beiVerwendung
vonreduziertem
Nickel,
derNickelgehalt
der Oelsäurebetrug 0,03 °/o.
Nach 9 Stunden bestimmten wir die Jodzahl zu36,75, Nickelgehalt 0,005 %.
Bei einem andern Versuch
steigerten
wir dieTempe¬
ratur
gleich anfangs
auf 240°. Schon nach 4 Stundensank die Jodzahl auf
45,
nach einer weitern Stunde auf 40.Nickelgehalt
der Oelsäure0,007 %.
Die
Analyse
desgereinigten gebrauchten Katalysators ergab
anOxyden
einen Gehalt von51,58%
und an re-') Franz. Patent 436295 und 18122.
duziertem Nickel einen solchen von
48,42 °/o,
während bei demungebrauchten Katalysator
der Gehalt anNickeloxyd
rund 97
°/o
und an reduziertem Nickel rund 3°/o betrug.
Versuche mit
Nickelhydroxydul
lieferten ein schlechtesErgebnis.
BeiAnwendung
von 3% Hydroxydul
bei 230°war nämlich nach
27stündigem
Durchleiten von Wasser¬stoff die Jodzahl immer noch 54.
Hydrierung
mit Nickelkarbonat und Nick elformiat.1)
und2)
Bei Gebrauch dieser
grüngefärbten Katalysatoren
be¬merkten wir bei 230°
gleich
zuAnfang
derHydrierung
eine starke
Gasentwicklung,
dieKatalysatoren
färbten sich braun bis schwarz. DieAnalyse
der entfettetenKataly¬
satoren
ergab
die Anwesenheit von reduziertem Nickel nebenOxyd
undSuboxyd,
während Karbonat und Formiatvollständig
fehlten.Zum
qualitativen
Nachweis des reduzierten Nickels führten wir unter allenVorsichtsmaßregeln
dieKarbonyl-
reaktion in der mit Wasserstoff behandelten Masse selbst
durch,
indem wir dasHydrierungsgemisch
unter fort¬währendem Durchleiten von Wasserstoff auf 50° abkühlten.
Dann ersetzten wir den Wasserstoffstrom durch einen
Kohlenoxydstrom.
Nach kurzer Zeit bildete sich Nickel-karbonyl,
das wir in einer erhitzten Glasröhre zur Zer¬setzung brachten,
das Nickel schied sich alsNickelspiegel
aus,
Kohlenoxyd
mit etwasKarbonyl
entwich. Für dieKarbonylreaktion
soll dieTemperatur
desOelsäurege-
misches nicht über 60°
gesteigert werden,
da sonst schonin dem Gemisch das Nickel wieder
abgeschieden
wird.Aus diesen Versuchen
ergibt
sich mit Bestimmtheit dieRichtigkeit
der schon früher erwähntenAnsicht,
daß*) D. Pat.Anmeldg. 8952-
*) Zeitschrift für angewandte Chemie, 1914, 522-
das reduzierte Nickel als
Katalysator
wirke und nicht dasOxyd.
DieAnwendung
von Nickelsalzen alsKatalysatoren
kann der
Oelhärtung
insoferngewisse
Vorteilebieten,
alsdie
Zersetzung
der Salze mitnachfolgender
Reduktion in der zuhydrierenden
Masse selbst eine feinereZerteilung
des Nickels bewirkt und als eine
allfällige Vergiftung
deseben doch ziemlich
empfindlichen
reduzierten Nickels ver¬hindert wird.
Die
Frage
derWirkungsweise
von metallischem Nickel und vonNickeloxyd
ist auch deshalbwichtig,
weil alleOelhärtungsverfahren,
die mit Nickel alsKatalysator
ar¬beiten,
entweder vom Normannschen metallischen Nickel¬oder vom Erdmannschen
Nickeloxydverfahren abhängen.
Der wirksame
Katalysator
ist da überall entweder dasreduzierte metallische Nickel oder das
Nickeloxyd.
Fallses sich als
richtig erweist,
daß das Nickel als solches dieKatalyse verursacht,
so sind alle dem NormannschenVer¬fahren
nachfolgenden
Patente von diesemabhängig
unddaher ohne besondere
Abmachungen ungültig.
Nach einem
englischen
Patentereduziert
man eineMetallverbindung
so, daß eineVerbindung
entsteht mitweniger
Sauerstoff als NiObesitzt.1)
Durch Glühen von NiO erhaltenesNickeloxyd
wird entweder beimög¬
lichst
niedriger Temperatur
reduziert(230—270°), je niedriger
dieTemperatur,
desto mehrSuboxyd entsteht,
oder bei 340°
vollständig
reduziert und bei 3Q0—600° mit Luft oder mitSauerstoff,
mit indifferentem Gase(Stick¬
stoff) verdünnt, sorgfältig oxydiert,
um lokaleErhitzung
zu vermeiden. Diese würde die Wirksamkeit des
Kataly¬
sators
beeinträchtigen.
Ein weiteres
englisches
Patentempfiehlt
alsKataly¬
sator
Schwermetallseifen,
die aus Fetten oder Fettsäurenhergestellt sind,
derenSchmelzpunkt
höherist,
als der->) Engl. Patent 4702.
jenige
der herzustellendenVerbindung.1)
Die Seife wärein Pulverform mit dem Oel zu. vermischen.
Nach einem andern
Vorschlag
wirdempfohlen,
unge¬sättigte
Fettsäuren und deren Ester unterVerwendung
von Metallsalzen
organischer
Säuren mit reduzierenden Gasen zu behandeln. In Brake inOldenburg
soll einegroße Anlage
denBetrieb nach diesem Verfahreneröffnen.2)
Mit Nickelkarbonat als
Katalysator
nach Fuchs und Granichstädt soll in Oesterreich undNorwegen gearbeitet werden.8)
Ein
Patent,
das sich wieder mit metallischem Nickelbefaßt,
ist dadurchgekennzeichnet,
daß das als Kontakt¬substanz benützte Nickel durch
Zersetzung
von Nickel-tetrakarbonyl
gewonnenwird.4) Nickelkarbonyl
oder kar-bonylhaltige
Gase werden in das über denZersetzungs¬
punkt
desKarbonyls erhitzte,
derHydrierung
zu unter¬werfende Material
eingeleitet.
Das auf diese Weise aus¬geschiedene
Nickel ist sofein,
daß essich,
wie wir beiunsern Versuchen selbst
bemerkten,
aus einerSuspension
erst nach
stundenlangem
Stehen absetzt. Ein Teil desNickels wird kolloidal
gelöst.
Soviel wir erfahrenhaben,
hat sich diese Methode nicht bewährt oder wird
wenig¬
stens
nirgends verwendet,
dawahrscheinlich,
wie wir selbstbeobachteten,
das bei derZersetzung
entweichende Kohlen¬oxyd
einen störenden Einfluß auf das Nickelausübt,
denKatalysator vergiftet.
Diese
Zersetzung
derMetallkarbonyle
bei höhererTemperatur
benützteneuerdings
Wa. Ostwald zur Dar¬stellung
verschiedenerMetallsole.5)
J) Engl.Pat.Seifensiederzeitung 1913, 904.
3i D. Pat.Anmeldg. 8952.
:!) Zeitschrift f. angew Chemie 1914, 522.
4) D.R. P. 241823.
») Zeitschrift für Kolloidchemie 1914, 204.
Neuerdings
wurdeempfohlen,
an Stelle vonNickel,
Kobalt etc. das
verhältnismäßig billig
herzustellendeamorphe
Bor zuverwenden,
als wirksamesZwischenpro¬
dukt soll Borwasserstoff
entstehen.1)
Ueber eine Verwen¬dung
dieses Produktes ist uns nichts bekannt.Kurz vor Abschluß
vorliegender
Arbeit ist von H.Schönfeld ein neuer
Katalysator, Nickelborat,
zurHydrie¬
rung
ungesättigter
Fettsäuren und derenGlyceride
em¬pfohlen
worden*) (s.
S.18).
Wir
gingen
nun an dieHerstellung
verschiedenerKatalysatoren,
um den wirksamsten für unsere Zwecke verwenden zu können.') D.Pat.Anmeldg.41408.
-) Seifensiederzeitung 1914, 945.
Experimenteller
A. Darstellung der Katalysatoren.
Reinigung
des verwendeten Wasserstoffes :Der
Wassersoff,
sowohl zur Reduktion desKataly¬
sators wie auch der bei den
Absorptionsversuchen
ge¬brauchte,
wurde immersorgfältig gereinigt.
Der Wasser¬stoffstrom
passierte
zuerst eineLösung
vonKaliumper¬
manganat,
dannNatronlauge,
weiter konzentrierte Schwe¬felsäure,
dann eineglühende Kupferspirale
und zuletzteineWaschflasche mit festem
Natriumhydroxyd,
um Feuch¬tigkeit
zurückzuhalten.Zuerst wurde das Normannsche
Oelhärtungsverfahren
auf seine Verwendbarkeit
geprüft.
ImGegensatz
zu denMengenverhältnissen
bei diesemVerfahren,
woja begreif¬
licherweise Wasserstoff im Ueberschuß in die zu redu¬
zierenden Massen
eingeleitet wird,
mußten wir bei denAbsorptionsversuchen
mit einemabgemessenen
Gasvo¬lumen
arbeiten,
nahmendagegen
einengroßen
Ueber¬schuß an
ungesättigten Verbindungen,
was für die Erzie¬lung
einer raschen undvollständigen Absorption
des Wasserstoffes alsgünstig
erscheint.Der
Nickelkatalysator
wurde gewonnen durch Glühenvon
nickelnitrathaltiger Zuckerlösung (Pat. Erdmann).
Durch
nachfolgende
Reduktion des so erhaltenenOxydes
bei 310—340° wurde dann das Nickelmetall
hergestellt.
In 500 ccm
Nickelnitratlösung
vom spez. Gewicht1,6
wurden 90 gr.
gepulverter
Zuckereingetragen.
DieseLösung
ließen wirlangsam
in einemrotglühenden
Nickel¬tiegel eintropfen,
wobeijeglicher Luftzug sorgfältig
ver¬mieden werden mußte. Es wurde immer so
lange erhitzt,
biskein
Stickstoffdioxyd
mehr entwich. Das sehr lockere Produkt enthielt nun nebenNickeloxyd
auch reduziertes metallischesNickel,
ca.3% (s.
S.20).
ZurReduktion wurde diesesGemiscji
ingereinigtem
Wasserstoff im Verbren¬nungsofen
erhitzt. Da die Reduktion mit kleinen Portionen vorgenommenwurde,
so konnte dieReduktionstemperatur
mit einem
Thermometer,
dessenQuecksilbergefäß
in die zureduzierende Masse
eingebettet
war, genau kontrolliert werden. Die Reduktion wurde mit kleinenMengen
durch¬geführt,
weil das Produkt dergroßen
Selbstentzündbarkeit halber ohne besondereVorsichtsmaßregeln
nichlange
haltbar ist. Einevollständige
Reduktion dauert zirka 3Stunden,
dieTemperatur
darf 340° nichtübersteigen.
Eswurde nämlich die
Beobachtung gemacht,
daß eine nie¬drigere Temperatur
eineVerminderung
derHaltbarkeit,
eine höhereTemperatur
eineVerminderung
der Wirksam¬keit des
Katalysators
zurFolge
hat.Einige
Proben wurden nach C. & G.Meyer
anstatt im Wasserstoffstrom imKohlendioxydstrom abgekühlt.
Um das Verfahren von Wimmer und
Berkeley,
An¬wendung
vonorganischen Nickelsalzen,
zuprüfen,
stellten wir Nickelformiat und Acetat her ausNickelhydroxydul, Nickelkarbonat,
Ameisensäure undEssigsäure.
Das aus¬gefällte
Salz wurdegetrocknet
und dann in kleinen Por¬tionen
verwendet,
zum Teil mit Oelsäure und zum Teil mit Oleat alsAbsorptionsmittel.
EineAbsorptionswirkung
konnte nicht beobachtet
werden,
da wir dieTemperatur
nicht über 100°
steigerten.
Vorteile können wir in diesem Verfahren nichterblicken,
es seidenn,
wie schon auf Seite 22gesagt wurde,
daß durch dieZersetzung
dieserSalze eine feinere
Zerteilung
des Nickels zu Stande kommt.Jedenfalls wirken diese Nickelsalze nicht
unmittelbar,
son¬dern sie müssen eben zuerst zersetzt und zu Nickel redu¬
ziert werden.
Die
gleiche Erfahrung
machten wir beiAnwendung
von Nickelkarbonat als
Katalysator
nach Fuchs und Gra-nichstädt. Auch da tritt erst bei höherer
Temperatur
eineZersetzung
und Reduktion ein.Das Verfahren von A. de
Kadt, Verwendung
vonSchwermetallseifen,
leidet auch an diesem Uebelstand.Wir stellten Niokelstearat
her,
erhielten aber gar keine für unsere Zwecke verwendbare Resultate.Es wurde auch
versucht,
Nickel in Form von Nickel¬oleat zu verwenden. Trotz
langem
Erhitzen mit Natrium-oleatlösung gelang
esnicht,
eineVerteilung
des in Wasserunlöslichen Nickelsalzes zu
bewirken,
sodaß auch keineAbsorptionsversuche
mit solchem Nickelsalz alsKatalysator ausgeführt
werden konnten. Nickeloleat wurdehergestellt,
indem Oelsäure mit
überschüssigem Nickelhydroxyd längere
Zeit erhitzt wurde. Beim Abkühlen erhält man ein
grünes
zähesProdukt,
das nicht verreibbar ist. Das verwendetePräparat
war ein Gemisch von97,6 %
Nickeloleat und2,4 °/o Nickelhydroxyd.
Amorphes
Bor benützten wir inVerbindung
mitOleat,
Oelsäure und
Acrylsäure.
Wir stelltenamorphes
Borher,
indem wir 50 gr. Borsäure mit 30 gr. Natrium in einen
glühenden Tiegel
aus Gußeisenbrachten,
dazufügten
wir30 gr.
getrocknetes
Natriumchlorid. Nach der Reaktion gössen wir denTiegelinhalt
in mit Salzsäureangesäuertes Wasser,
die borsauren Salze werdengelöst,
dasamorphe
Bor wird nicht
angegriffen,
filtrierten ab und trockneten auf einem Tonteller beiZimmertemperatur. Resultate,
die uns zur
Anwendung
diesesKatalysators bewegen
konnten,
erhielten wir nicht.Das Verfahren von
Schönfeld,
Nickelborat als Kata¬lysator
zubenützen, eignet
sich nach unsernErfahrungen
nicht für
Absorptionen
des Wasserstoffes mit Oleat. Ent¬wässern nützt
nichts,
da durch das "Wasser der Oleat-lösung
sofort wieder eineAnlagerung
des Kristallwassers stattfindet. Beim Schütteln entseht ein so zäherSchaum,
daß es
unmöglich ist,
denselben selbst durch Zusatz vongrößern Mengen
Alkohol zu zerstören.B. Apparatur.
Als
Absorptionsgefäß
benützten wir zuerst die ge¬wöhnliche
Hempelsche Gaspipette
mitQuecksilberabschluß, nachher, bei
denAbsorptionsversuchen
mitOleat, gingen
wir zu einer einfachen
Kugelpipette über,
mitQuecksilber
alsSperrflüssigkeit,
die sehrbequem
zu handhaben war.Bei
Anwendung
derOelsäure,
desOliven-,
Sesam-und anderer Oele als
Absorptionsflüssigkeit
wurde der zuabsorbierende Wasserstoff in einer
Quecksilberbürette
ab¬gemessen, wodurch wir dann bei der
Absorptionspipette
auch in der
Kapillare
einenQuecksilberabschluß
erhielten.Die mit einem
abgemessenen
Volumen Wasserstoff be¬schickte
Absorptionspipette
wurde in einemDampfbad
erhitzt,
das auf einerSchüttelmaschinegeschüttelt
wurde.Die durch
Absorption eingetretene Volumverminderung
wurde durch
Quecksilberzugabe ausgeglichen.
C. Absorptionsversuche.
Im
Nachfolgenden
wird über die erreichten Resultate Auskunftgegeben.
I. Oelsäure als
Absorptionsflüssigkeit.
Ci- H».i COOH.o)
AlsKatalysator
:Nickeloxyd
ausnickelnitrathaltiger Zuckerlösung
nach Erdmann.Bei einem Versuche wurden 100ccm Oelsäuremit3° o
Nickeloxyd
aufsinnigste
vermischt in dieGaspipette eingefüllt.
Es wurden10,8
ccm Wasserstoff bei 90"unter 20 cm
Quecksilberhöhe
3 Stundenlang geschüt¬
telt. Die
Volumverminderung betrug
:5,8
ccm =53,7 a/o
Bei einem andern Versuch mit 57» Nickeloxyd
wurden unter
gleichen Bedingungen
wie vorhin von10,8
ccmWasserstoff nur 3 ccm absorbiert ='27,7 °/o
MitNickeloxyd
von Kahlbaum erhielten wir beiTemperaturen
von 98° keinegünstigeren
Resultate.b) Als
Katalysator:
Nickel ausNickeloxyd
im Wasser¬stoffstrom reduziert und darin erkaltet. Die Oelsäure wurde wieder mit dem
Katalysator
vermischt in diePipette eingefüllt.
Die Resultate sind infolgender
Tabelle
zusammengestellt.
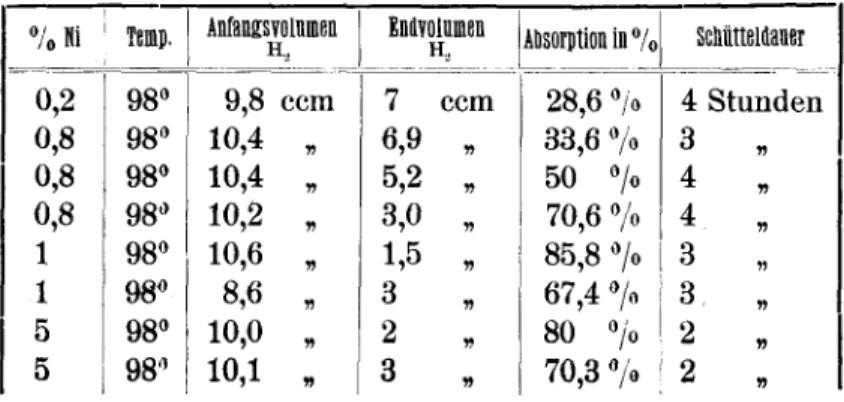
%Ni Temp. Anfanjsvoinmen H,
EMvoinmen
H. Alisorptionin7o ScMtteldanei
0,2
98°9,8
ccm 7 ccm28,6 7o
4 Stunden0,8
98»10,4
„6,9
„33,6 %
3 „0,8
98°10,4
„5,2
„ 50%
4 „0,8
98°10,2
„3,0
„70,6 %
4 „1 98°
10,6
„1,5
„85,8 7o
3 „1 98°
8,6
„ 3 „67,4 >
3 „5 98°
10,0
„ 2 „ 807'o 1
25 98fl
10,1
„ 3 „70,3 >
2 „r) Als
Katalysator
: Nickel ausNickeloxyd
im Wasser¬stoffstrom
reduziert,
imKohlendioxydstrom geglüht
und darin
abgekühlt. (C.
& G.Meyer.)
Zuerst wurde ein Versuch mit 1
%
Nickel und 10ccm Wasserstoff
gemacht.
Nachvierstündigem
Schüt¬teln bei
Zimmertemperatur, 15°,
und bei Druck von20 cm
Quecksilberhöhe
war noch keine Volumver¬minderung
zu konstatieren.Mit 5
%
Nickel wurden durchdreistündiges
Schüt¬teln bei 98° und bei 20 cm
Quecksilberhöhe
von10,4
ccm Wasserstoff nur
3,2
ccm absorbiert =30,7
% Mit 5no Nickel wurden durchvierstündiges
Schüt¬teln unter
gleichen Bedingungen
von10,8
ccm Wasser¬stoff 9 ccm absorbiert =
83,9 %
Mit
Oliven-, Sesam-,
Baumwollsamenöl alsAbsorptions¬
flüssigkeit
erhielten wir noch schlechtere Resultate. Leinöl ist wegen dergroßen
Viscosität gar nicht verwendbar.Die Resultate mit Oelsäure und den verschiedenen Oelen als
Absorptionsmittel
und mit denNickelpräparaten
alsKatalysatoren
waren also ganzunbefriedigend.
Zur un¬genügenden Absorption
des Wasserstoffes kommt noch dasunsaubere, schmierige
Arbeiten. Die Oelsäuregreift
die
Gummiverbindungen
stark an undverunreinigt
dasQuecksilber,
dieAbsorptionsgefäße
sindschwierig
undumständlich zu
reinigen.
Das mitKohlendioxyd
behandelteNickel
amalgamiert
sich stark mit demQuecksilber,
wasmit dem im Wasserstoffstrom
abgekühlten
nicht in demMaße der Fall ist.
Weiter wurde die
Absorptionsfähigkeit folgender
un¬gesättigter Verbindungen geprüft
:II.
Acrylsäure
: CH2 =CHCOOH,
hergestellt
aus Acrolein durchOxydation
mitSilberoxyd
und