AUS DEM LEHRSTUHL
Volltext
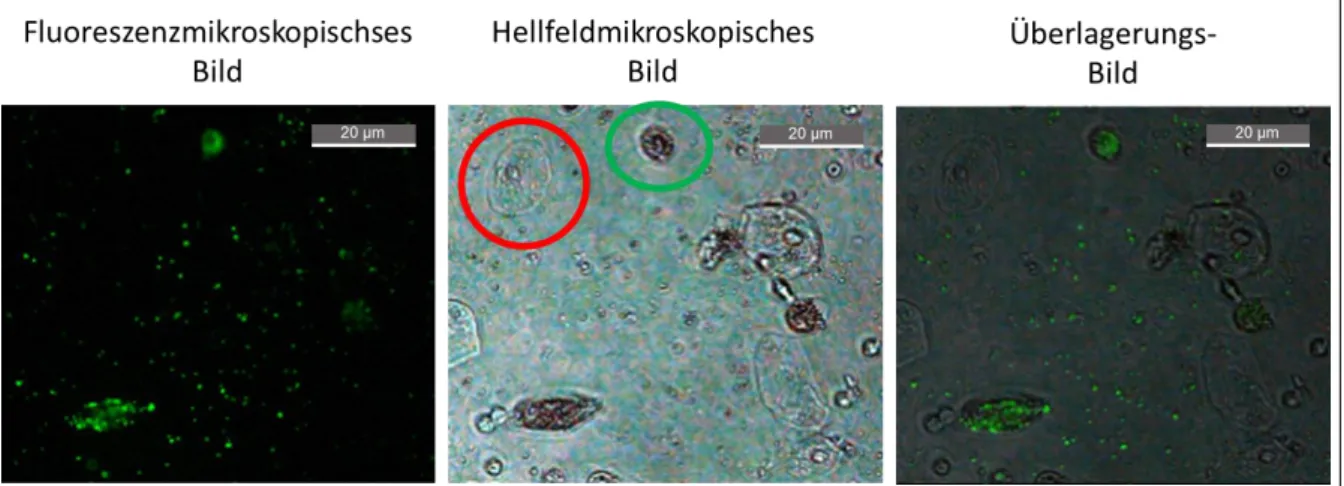
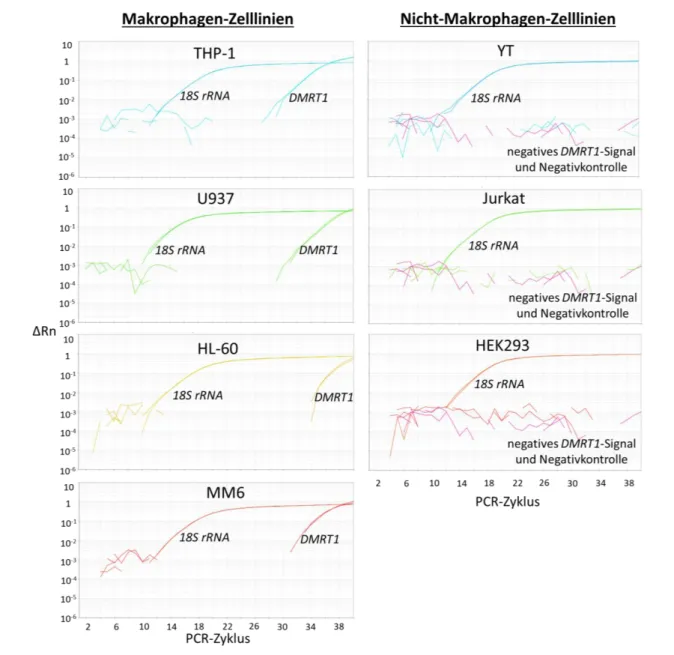
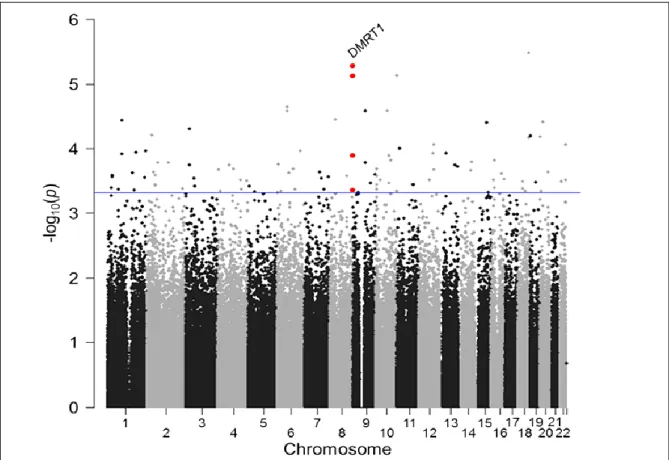
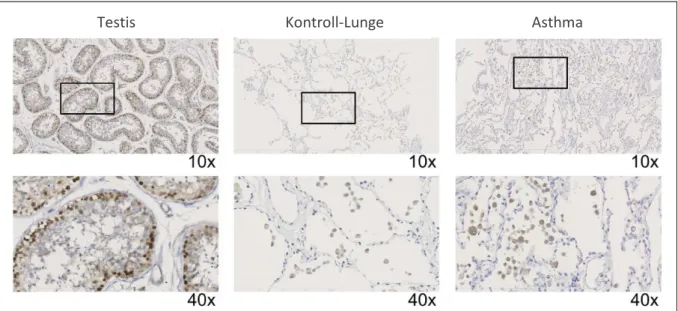
Abbildung
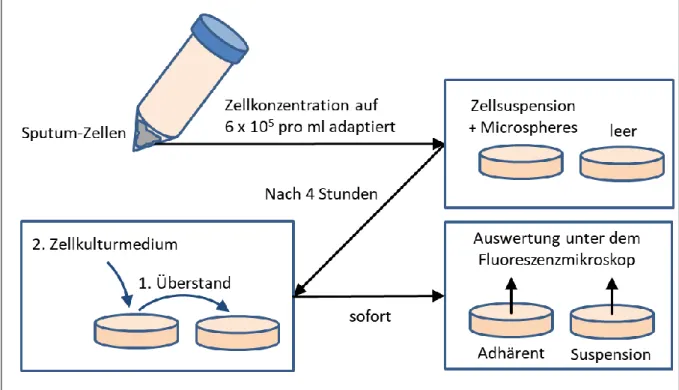
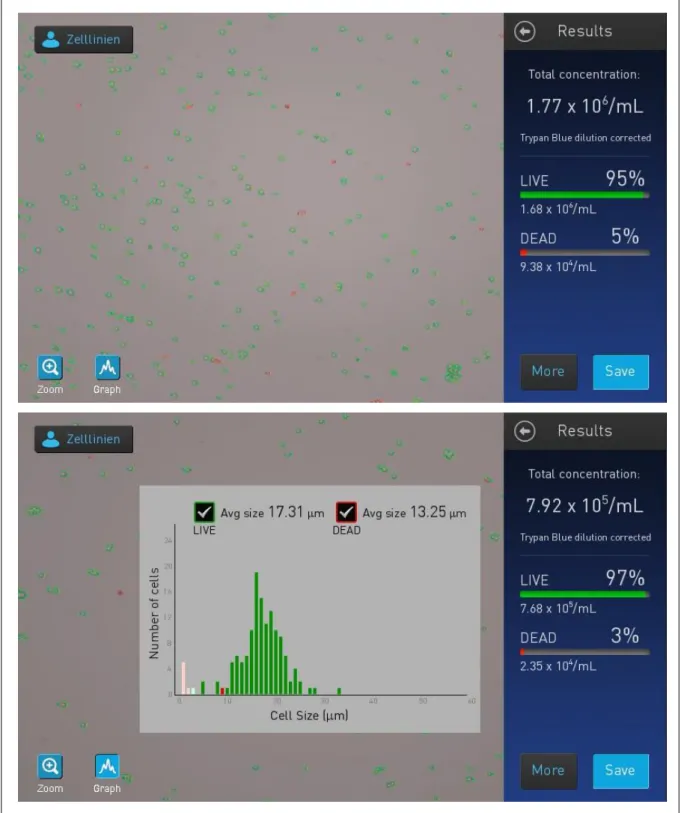
ÄHNLICHE DOKUMENTE
• Hohe Tarifabschlüsse und eine starke Nachfrage nach Tiefbauleistungen (insbesondere auch durch die Förderprogramme) führen zu spürbaren Kostensteigerungen beim Einkauf
Insgesamt zeigt sich sehr positiv, dass Habitatbäume als Träger der Artenviel- falt ab einem Bestandesalter von 180 Jahren in allen untersuchten Beständen vorhanden sind (Abb..
Im Hause werden die quantitativen Verfahren zur Bestimmung der Lymphocytensub- Populationen (single-platform Technik), die Abklärung des Autoimmun Lymphoproliferationssyndrom
Ab etwa 1983 steigen dann die Jahrringbreiten von Tannen wieder deutlich an und zeigen so den Beginn einer Erholung an.. Als Ergebnis
Eine Fabel zu zitieren, die es in Wahrheit nicht gibt, ist zwar Effekthascherei – aber der Verfremdungseffekt zeigt volle Wirkung. |
Unter Verwendung des alkalischen Glycinpufferextraktes CMV-infizierter Fibroblasten nach Krech (7) kann die KBR als sehr geeignet angesehen werden, bei rechtzeiti- ger Blutentnahme
[r]
Auch die Disease-Management- Programme bedeuten ledig- lich erneut eine Umvertei- lung, da in anderen Berei- chen eingespart werden muss, wenn nicht zusätzli- ches Geld zur