Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Übungen im Slf ,
-: Experimentalvortrag
SS 97
Dozenten: Butenuth, Gerstner, Perst
Proteine und Enzme
Referent:
Oliver Wißner
Oliver Wißner Beethovenstr. 11a 35043 Marburg
Inhaltsverzeichnis
Seite
1. Einführung in Funktion und Struktur der Proteine 1.1 Funktion von Proteinen
Versuch 1: Nachweiß von Eiweiß 1.2.] Aufbau der Proteine
1.2.2 Strukturebene des Proteinaufbaus Versuch 2: Vorstellung der Katalase
1.2.3 Denaturierung von Proteinen
Versuch 3: Nachweis von Aminosäuren im Hydrolysat
2 2 3 5 8 11 14 14
2. Enzyme 16
2.1 Einführung 16
Versuch 4: Katalysierte Umsetzung von Hamstotfmit Urease 17
2.2 Das aktive Zentrum 18
Versuch 5: Substratspezifität: Umsatz von Thiohamstoffmit Urease 19 Versuch 6: Umsatz von HarstofI / Thioharristoff mit Urease 19 Versuch 7: Umsatz einer Harnstoff / Bleiacetatlsg. mit Urease 19
2.3 Hemmung / Blockierung von Enzymen 20
2.4 Bindungsarten des aktiven Zentrums 21
2.5Beeinflußung der Enzymaktivität durch ,,äußere" Faktoren 21 Versuch 8: pH-Abhängigkeit der Enzymaktivität 21
3. Beispiele für den Einsatz und Wirkungsweise von Enzymen 3.1 Lysozym (Immunabwehr)
Versuch 9: Zerstörung von Bakterien durch Lysozym 3.2 Enzyme als Bestandteil von Waschmitteln
Versuch 10: Filmtest für Proteasen
23
23 23 25 25
=
~.
EinleitunK
Die hier vorliegende Ausarbeitung beschäftigt sich mit dem Thema ,,Proteine und Enzyme".
Sie besteht aus drei Teilen, in denen auf einzelne Aspekte des Themas näher eingegangen wird.
Der erste Teilnimmt Bezug auf den Aufbau und die Struktur von Proteinen und versucht eine Vorstellung über ihre lebenswichtige Bedeutung zu entwickeln.
Der zweite Teil beschreibt die eine spezielle Gruppe von Proteinen, die Enzyme.
Wirkungsweise, Funktion und Aufgaben der enzymatischen Katalyse werden hier Schwerpunkte sein.
Der dritte Teil versucht an Hand von Beispielen die Inhalte aus den beiden vorangegangen Teilen zu erläutern und zu vertiefen.
1. Einfühnmg in Funktion und Struktur der Proteine
,
Protein - ein Wort von Jöns J. Berzelius im' Jahre 1836 geprägt, um die Wichtigkeit dieser Stoffgruppe zu betonen.
Es stammt vom griechischen Wort proteios und bedeutet soviel wie "an erster Stelle" .
Mit diesen Worten beschrieb J.J. Berzelius den Umstand, daß Proteine eine entscheidende Rolle in praktisch allen biologischen Prozessen spielen.
Die folgende Übersicht soll einen Einblick in ihre komplexen Funktionen und Einsatzgebiete verschaffen. Es sollte deutlich werden, daß das Leben so wie wir es kennen ohne sie nicht möglich wäre.
1.1 Funktion von Proteinen
1. Enzymatische Katalyse
.~_ • Alle bekannten Enzyme sind Proteine. Sie "katalysieren alle chemischen Reaktionen in biologischen Systemen, wobei einige dieser Reaktionen relativ einfach strukturiert sind, andere hingegen hochkompliziert. Sie spielen eine einzigartige Rolle bei der Auswahl der chemischen Umsetzungen.
Der zweite Teil dieser Ausarbeitung wird sich ausfiihrlicher mit dem Thema der Enzyme beschäftigen.
2. Transport und Speicherung
• Viele kleinere Moleküle und Ionen werden durch spezifische Proteine transportiert.
Hämoglobin, Sauerstoffträger im Blut, und Myoglobin, Sauerstoffträger im Muskel sollen an dieser Stelle als Beispiel dienen. '
3. Koordinierte Bewegung
\~ • Kontraktionen des Muskelgewebes werden durch gleitende Bewegung zweier . Arten von Proteinfilamenten (Myosin und Aktinin) ermöglicht, Ihre Auswirkungen sind direkt durch Entstehung von Bewegung durch muskuläre Verkürzung wahrnehmbar. Im mikroskopischen Bereich werden z.B.
Vorgänge wie die Bewegung von Chromosomen während der Mitose ebenfalls durch aus Protein bestehenden kontraktilen Systemen veranIaßt.
4. Mechanische Stützfunktion
• Die hohe Zugfestigkeit von Haut, Bindegewebe und Knochen wird durch das Vorhandensein vonKollagen, einem Faserproteine gewährleistet.
5. Immunschutz
• In. diesem Zusammenhang sind die Antikörper als hochspezifische Proteine, die Fremdsubstanzen wie Viren, Bakterien und Zellen von allderen Organismen erkennen und diese binden können, zu nennen.
Proteine spielen somit eine vitale Rolle bei der Unterscheidung .zwischen
· " d fr d'
"eigen un " em .
6. Erzeugung undÜbertragung vonNervenimpulse
• Die Kommunikation zwischen Nervenzellen unterschiedlicher Art wird durch spezifische Reize an bestimmte Rezeptorproteine vermittelt. Das Acetylcholin stimuliert z.B. RezeptormoJeküle, die verantwortlich sind für die Übertragung vonNervenimpulsen an den Synapsen.
7. Kontrolle des Wachstums und der Differenzierung
• Die kontrollierte Folge der Expression von genetischer Information ist für ordnungsgemäßes Wachstum und die Differenzierung von Zellen unabdingbare Voraussetzung. Beispiele, die an dieser Stelle zu nennen wären, sind die Repressorproteine, welche spezifische Segmenteder DNA einer Zelle
~! stillegen können und der Nervenwachstumsfaktor, der die Kopplung von Nerven zu Verbundsystemen im höheren Organismus steuert.
Der folgende Versuch· 1 soll den Nachweiswon Eiweißen in tierischen Organismen auf einfache Weise demonstrieren. Er dient gleichzeitig der Einführung und der Erläuterung von typischen Eigenschaften der Proteine,
Versuch 1: Nachweis von Eiweiß
Versuchsbeschreibung 1a) EiweißalsBestandteil von Fleisch Chemikalien:
ca. 60g ungewürztes gehacktes Fleisch, 150 ml dest. Wasser.
Geräte
250 ml Becherglas, Glastrichter, Rundfilterpapier, Bunsenbrenner, Demonstrationsreagenzglas, Stativklammer, Stativ.
Durchführung
Das Gehackte wird in das Becherglas gegeben und mit 150 ml dest. Wasser versetzt und vermischt. Der sich so bildende Brei bleibttueca. eine halbe Stunde stehen, anschließend wird das Wasser abfiltriert,
Das so gewonnene Filtrat wird nun in eine Demonstrationsreagensglas überführt und im Bunsenbrenner und Schütteln gelinde erwärmt,
Ergebnis
Unter Einwirkung der Bunsenbrennerflamme beginnt nach kurzer Zeit em weißer Niederschlag auszufallen, Die Proteine koagulieren.
Erklärung
Albumine und Globuline des Fleisches sind wasserlöslich und gerinnen beim
-0 Erhitzen, Die Eiweiße denaturieren. Als Albumine werden Proteine bezeichnet, die in tierischen Flüssigkeiten vorkommen. Protein von kugeliger Gestalt, die Bestandteil des Blutes sind, werden als Globuline angesprochen.
Koagulation: die ursprüngliche hochgeordnete Raumstruktur wird in eine ungeordneten Zustand überführt. Die Peptidkette entfaltet sich, da sich stabilisierende Bindungen lösen. Werden dabei Gruppen reaktiv, welche zuvor in der Faltstruktur neutralisiert oder "maskiert" waren so verliert das Protein seine Löslichkeit, bzw. seine biologische Aktivität.
Versuchsbeschreibung 1b) Die Xanthoproteinreaktion
Bei der Xanthoproteinreaktion wird der Benzolrest dreier Aminosäuren, die Bestandteil eines jeden Eiweißes sind, notriert, Es entsteht ein gelbes bis oranges Reaktionsprodukt, das als qualitativer Nachweis dient.
Chemikalien
150 ml konz. lINO), weiße Schwanenfeder, dest. Wasser. - Geräte
Kristalisierschale, Pipette, Handschuhe, Pinzette, Wasserflasche Durchführung
Die weiße Schwanenfeder wird in die Kristalisierschale gelegt und mit konz.
HN03 beträufelt. Nach einigen Minuten hat sich die Feder deutlich gelb verfärbt.
Sie wird nun vorsichtig mitdest. Wasser gespült und anschießend vorgeführt.
Erklärung Nitrierung:
Herstellung des elektrophilen Teilchens: Autoprotolyse der lIN03 lIN03+HN03 => N02+ + H20 + N03•
Nitroniumion
coo
+ I
3HN-C-H CH2I
COO·
+ I
3HN-C- H
C~2
COO
+3HN-C-HI
CH2I
H
Phenylalanin
OH
Tyrosin Tryptophan
o
Nitrierung des Benzolrings
H 0
I
0
-ooC-C-CH2-~ !I P
NH3+I
1.2.1 Aufbau der Proteine
HI
- ... ·OOC-C-CH2 NHtI
Die Proteine sind aus 20 Arten von Aminosäuren aufgebaut. Aus diesem Grund werden sie auch als die Grundbausteine bezeichnet. Die Aminosäuren stellen das Alphabet des Lebens dar und ist ca. 2 Millionen Jahre alt.
Die einzelnen Aminosäuren unterscheiden sich in: '
• Größe
• Gestalt
• Wasserstoffbindungsfähigkeit
• chemische Reaktivität
Bei pH 7 liegen die Aminosäuren als Zwitterionen vor, das heißt, daß die Aminogruppe protoniert und die Carboxylgruppe der Aminosäure deprotoniert vorliegt.
Der Dissoziationsgrad ändert sich mit dem pH. Dieser Effekt gilt auch für die in den Seitenketten enthaltene funktionellen Gruppen, so daßjede Aminosäure an : bestimmten pH-Werten ihre typische Ladungen ausprägen.
COOH H2N-C-HI
RI allgemeine Schreibweise einerAminosäure
L·llOm .... I 0·110m....,
Absolute Konfiguration der L- und D-Isomeren von Aminosäuren
Überfiihrung in Keilstrich und anschließend in Fischer - Projektion:
coo
. +
R - C -NH3
L -Isomer
COO
Fischerprojektion
I
- - - -...~ R-C-NHt
~
~
+R-C -NH3
C I a
H
S - Konfiguration L - Konfiguration
Aminosäuren Zwischenmolekulare Kräfte
ohne polare Gruppen (aliphatische& aromatische Reste)
Lysin (Lys) Arginin (Arg)
Alanin (Ala) R= -CH3 Valin (Val) R= -CH(CH3) 2
Leuein (Leu) R= -CH2CH(CH3) 2 Isoleuein R= -CHCH2CH3(S)
CHI3
Phenylalanin (Phe) R=.-CH2C6Hs COOH
Prolin fIN +H (Pro)
~H2
mitHydroxylgruppen
Tyrosin (Tyr) R= -CHZC6H.OH
Senn (Ser) R= -CH20 H Threonin (Thr) R--CHOH
-. CH 3 mitweiteren Aminogruppen
o
Asparagin (Asn) R= -CH2CNH2 Glutamin (GIn) R= -CH2CH2CNH2
o
R= -(CH2)4NH2 R= -(CH2)3NHCNH2
o
Van der Waals 'Kräfte
elektrostatische Wechselwirkungen
\ Wasserstoff-Briicken-Bindungen
elektrostatische Wechselwirkungeil Wasserstoff-Brückenbindungen
Tryptophan (Trp) R=
-c~
H Histidin (His) R- -CH2
ljH
mit Mercapto- oder SulfidgruppeIl Cystein (Cys) R= -CH2SH
Methionin (Met) R= CH2CH2SCH3 Aminosäuren mit Carboxygruppen Asparaginsäure(Asp) R= CH2COOH
Glutaminsäure (Glu) R= CH2CH2COOH
elektrostatische Wechselwirkungen Atombindung (Disulfidbtndungen)
elektrostatische Wechselwirkungen
1.2.2 Strukturebene des Proteinaufbaus 1. Primärstruktur
Charakteristische Aminosäuresequenz
Die Aminosäuresequenz ist das Bindeglied zwischen der genetischen Botschaft der DNA und der dreidimensionalen Struktur, welche die Grundlage der biologischen Funktion des Proteins darstellt.
@-@)-C@)-@ -@D
2. Sekundärstruktur
Die Sekundärstruktur bezieht sich auf sterische Wechselwirkungen der Peptidgruppe. Alle CO und NH-Gruppen der Hauptkette sind an Wasserstofibrückenbindungen beteiligt, was zum Auftreten einer periodischen Struktur führt. Die a-Helix und die ß-Faltblattstruktur sind Beispiele für die Sekundärstruktur.
Peptidbindung
H:O H: H:o H 1 ,'11 I: I I. 11 I
NH2-C-+-C-N ~C-+-C-N
I I I I I
CH3 CHOH
JH3
:i ...
I
Alanin Threonin
" I T t
- C - N - .. ~ -C==-N- partieller Doppelbindungscharakter
Peptid gruppe
,.
Abbildung 1: Peptidgruppe
Die Peptideinheit ist als starr und planar einzuordnen. Der Wasserstoff der substituierten Aminogruppe hat fast immer trans-Position in Bezug auf den Sauerstoff der Carbonylgruppe. Freie Rotation um die Bindung zwischen dem C-Atom der Carbonylgruppe und dem N-Atom der Peptideinheit ist nicht möglich, weil diese Bindung partiellen Doppelbindungscharakter besitzt. Im Gegensatz dazu ist die Bindung zwischen dem a.-Kohlenstoff und dem Carbonyl-Kohlenstoff-Atom eine reine Einfachbindung. wie auch diejenige zwischen dem 0.-Kohlenstoffatom und dem Stickstoffatom. Die Rotationsfreiheit ist somit groß um die Bindung, die beiderseits von der starren Peptideinheit ausgehen.
I .
II
@
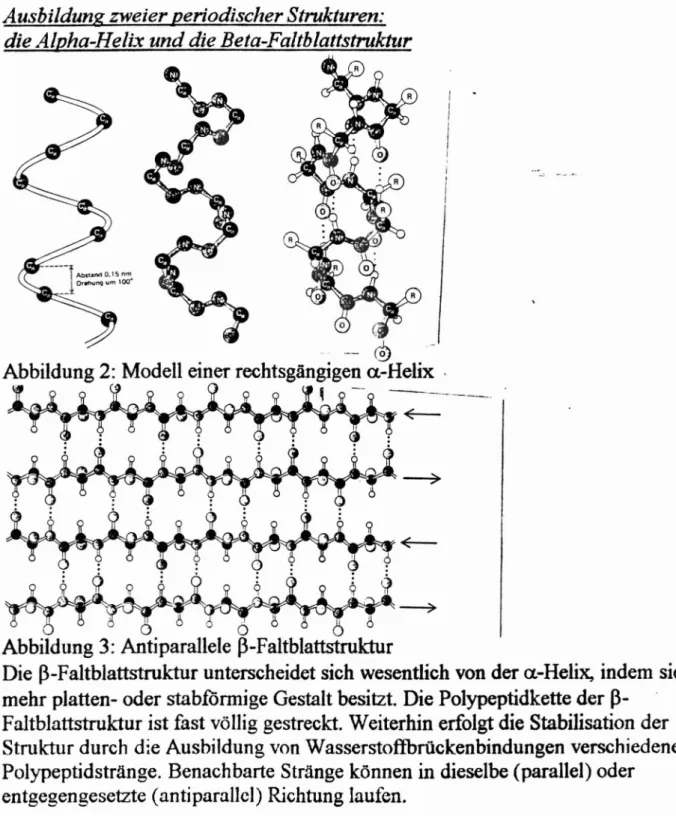
Abbildung 2:Modell einer rechtsgängigen a.-Helix .
'i7 •
Ausbildung zweier periodischer Strukturen:
die Alpha-Helix und die Beta-Faltblattstroktllr
~~~~~~.4I~~~~~~'.,A:1W' ~
• ö Ö . 9
: r.~~ ]: ~~~ : ~ ,
1 --7
~ 8 ' Ö
0 0 6
Abbildung 3: Antiparallele ß-Faltblattstruletur
Die ß-Faltblattstruktur unterscheidet sich wesentlich von der a.-Helix, indem sie mehr platten- oder stabförmige Gestalt besitzt. Die Polypeptidkette der ß-
Faltblattstruktur ist fast völlig gestreckt. Weiterhin erfolgt die Stabilisation der Struktur durch die Ausbildung von Wasserstoffbrückenbindungen verschiedener Polypeptidstränge. Benachbarte Stränge können in dieselbe (parallel) oder
entgegengesetzte (anti parallel) Richtung laufen.
Ca.= Chirales C-Atom Tertiärstruktur
Die Bezeichnung Tertiärstruktur bezieht sich auf die sterischen Wechselwirkungen von Aminosäureresten, die innerhalb der linearen Sequenz weit voneinander entfernt sind. Die Trennungslinie zwischen Sekundär- und Tertiärstruktur ist willkürlich.
Die Bindungsarten, die hierbei auftreten können sind unterschiedlicher Art und sollen kurz angesprochen werden: - -- "-- . .~ --~"-.'. .11
a) kovalente Bindungen .'
b) elektrovalente Bindungen c) WasserstofIbrückenbindungen d) Van der Waal'sehe Kräfte
Quartärstruktur ~
Bei Proteine, welche aus mehr als einer Polypeptidkette bestehen tritt ein weiteres Struktunnerkmal, das als Quartärstruktur bezeichnet wird,
auf Sie sagt etwas darüber aus, wie die einzelnen Ketten (protomere) ineinem solchem Proteinverband zueinander angeordnet sind.
Proteinkomplex aus Protomeren (Hc.:.."""cl'<;>/;;.'t.-7 )
Versuch 2: VorsteUung eines lebenswichtigenEnzymsim Blut:
die Katalase:
Chemikalien
2 ml Wasserstoffperoxidlösung, 100 ml Rinderblut Geräte
500 mI Becherglas, Pipette Durchführung
In einem Becherglas werden 100 ml Rinderblut vorgelegt und anschließend mit 2 ml H202versetzt.
An den Eintropfstellen bildet sich ein weißlich-rosa Schaum. Der entweichende Sauerstoff beginnt das Blut aufzuschäumen.
Wasserstoffperoxid wird in bestimmten Zellorganellen als Zellgift gebildet.
Das Enzym Katalase übernimmt die lebenswichtige Funktion dieses Gift abzubauen und den Organismus vor Schaden zu bewahren.
Abbau von H202im Organismus
2 H202 .. ·2 H20 +O2 + 196.2 KJ
Bei Zimmertemperatur ist die Zerfallstemperatur unmeßbar klein.
Die große Zerfallshemmung von H202 beruht darauf: daß der erste Schritt der H:O:-Thermolyse in einer energieaufwendigen Molekülspaltungen zwei HO- Radikale besteht. Letzteres setzt sich dann unter Auslösen einer Radikalkettenreaktion weiter mit H20,! um
(HO (HydroylradikaI) + H202 .. H20+ H02 (Perhydroylradikal) H02 + H202 • H20 + O2+ HO).
Die Katalase hierbei als Biokatalysator (s. u.), wodurch die Zersetzungsgeschwindigkeit des Wasserstoffs stark erhöht wird.
Der Wasserstoffperoxidzerfall durch Katalase erfolgt nach dem Haber-Weiss- Mechanismus:
+111
[Fe(HzO)6]2+ +HzOz
Kette:
+11
----... [Fe(HzO)sOQH]2++H30 +
+11
[Fe(H:P)6]2+ + H30+
+HOOH +111
[Fe(H20 )6]3++.OH
+HOOH +111
• [Fe(HzO)6]3++HOOe
. +11
- - - . [Fe(HzÜ)6]2+
- 02, -Ir
Das hier beschriebene Eisenatombefindet sich in dem Hämoglobinkomplex des Blutes gebunden. Die Katalase verdrängt einen H20 - Liganden in diesem Komplex, wodurch ein neuer,stabilerer Komplex ensteht. Dieser neue Komplex kann als Enzyrn-Substrat-Komplex betrachtet werden, der nun den Wasserstoffperoxidzerfall beschleunigt. Die Reaktion an sichverläuft ansonsten genauso wie oben beschrieben.
16
Protein
t
NHH, /H H, /H N) (His)
0 0
H20 . 1 ... OHz R2N . I ...NRz R2N.. I ..NR2
- - - - -
Fe (111) Fe (111) Fe (111)
1 \ 1 \ . 1
1
\N
HzO 10Hz RzN 1 NRz R2N R2
0 0 0
H/ 'H H/ 'H H/ 'H
: t <:»
!
+H2Ü2 +H2Ü2 +H2Ü2
-H3O+ - H3O+ -H3O+
Protein
H'O/H HzO..-. I .:.: OHz
Fe (111) HzO1 \1 0 Hz
o-,
OH Fe::--Aquokornplex kkat ~ 10~2 molls'
H, /H
o
RzN ... I ....NRz
- -
Fe (111) RzN1 \I NRz
o
"'OH Häm
(His)
Fe (111) RzN1 \1 NRz
O"'OH Katalase kkat z 108molls"
~--
1.2.3 Denaturierung von Proteinen
Die Denaturierung von Proteinen wie sie oben bereits beschrieben worden ist kann auf verschiedene Art und Weise geschehen und zu unterschiedlichen Ergebnissen führen.
Eine Denaturierung der dreidimensionalen Raumstruktur durch Wärme kann durchaus reversible erfolgen. Jedoch eine Zerstörung der Struktur durch Auflösung der Primärstruktur der Aminosäuren durch Säure geschieht irreversible.
• Säure / Lauge
• Temperatur
• Oxidationsmittel
Versuch 3: Nachweis von Aminosäuren im Eiweißhvdrolvsat mit Hilfe der DC und Ninhvdrin.
Im Rahmen dieses Versuches sollen die "Bausteine" der Proteine mit Hilfe der DC getrennt und mit Ninhydrin nachgewiesen werden.
Aus diesem Grund wurde ein Hühnereiweiß mit 0,1 m Salzsäure versetzt in eine Ampulle eingeschlossen und für 48 h bei 11QOC inkubiert.
Das so gewonnene Eiweißhydrolysat (das Protein ist vollständig denaturiert) enthält nun die aufgespaltenen und freien Aminosäuren des Proteins.
- "
~ flidm iblfroftl
,
-, ,
j ,
,, 0 0 .i'Il ,
0 dl
S 0 J
s.
0 CJ i,
'0 0 , ,
GlJciI ,-Ianin Gria Vitia lAcin
151'1 111'1 SIll'! Sill S",
Abb.6:
Dünnschicht- chromatographie
\...-/ Chemikalien
Merck-Ninhydrinlösung, Lösungsmittel Chloroform: konz. NB3 : Butanol (3 : 3 : 1)
Geräte
Fließkammer, DC-Folien, Pinzette,Trockenschrank, Fön.
Durchführung
Auf eine DC-Karte werden 8 verschiedene AS aufgetragen, eine Mischung aus allen acht und einen Punkt des Hydrolysats. Die aufgetragenen Punkte werden mit dem Fön gewissenhaft getrocknet, um Verwischungen zu vermeiden.
Anschließend wird die Folie für ca. 2h in die Fließkammer gestellt. Nachdem die oberste Fließmittelfront ermittelt worden ist, wird die Folie mit dem Fön kurz
getrocknet und mit Ninhydrin besprüht. Die Reaktion und Entwicklung erfolgt durch endgültige Trocknung im Trockenschrank (110°C).
Die so kenntlich gemachten AS des Hydrolysats können so qualitativ mit denen zum Vergleich aufgetragenen, bekannten AS verglichen werden.
Die Adsorptionschromatographie bedient sich der Unterschiede der AS in den Adsorptionskräften. Diese stellen sich aus den unterschiedlichen Eigenschaften der Aminosäuren dar(s.o.),
Die Bindungskräfte der stationären Phase wechselwirken nun mit den AS die sich in der mobilen Phase des Lösungsmittels befinden, wodurch diese im Laufe des Durchtritts aufgrund der verschiedenartigen Verteilung in den I Phasen (Nernt'scher Verteilungssa1z) getrennt werden.
Der endgültige Nachweis der einzelnen AS wird durch das Ninhydrin-Reagenz geliefert.
Nachweis derAminosäuren mit Hilfe von Ninhydrin:
1,2,3 - Indartrion
o
-
1,,2,3.- lndantrion - Hydrat (Ninhydrin) ,
OH OH
+ R - - c H --COOH NH2I
-H20
..
-N-CH-COOH
~
",COOH N -=-C
-'R
Hydrotyse ...
- CO 2 NH2
NH2 + OH
OH
blauer Farbstoff
2. Enzyme
In diesem zweiten Haupteil dieser Arbeit wird sich mit einem Unterkapitel der Proteine eingehender befaßt, um deren Wichtigkeit und Wirksamkeit verständlich zu machen.
2.1 Ebütihrung
Chemische Reaktionen in Abwesenheit eines Katalysators kommen In
biologischen Systemen kaum vor.
Die Enzymesind Biokatalysatoren mit bestimmtenEigenschaften:
• hohe katalytische Aktivität
• hohe Spezifität
• Enzymaktivität ist regulierbar
Manche dieser Enzyme sind direkt an der Umwandlung von verschiedenen Energieformen beteiligt.
Bsp.Umsetzungen im biologischen System, die ohne Enzyme kaum möglich wären:
• Atmung:
Carboanhydrase: Hydratisierung von CO2 CO2+H20 => H2C03 · --
=> Transfer von CO2aus dem Gewebe ins Blut
• Ab-, Um- und Aufbau von Molekülen DNAse
• Abbau von Harnstoff Urease
Enzyme als Biokatalysator
• wandeln verschiedene Energieformen ineinander um (ATP Verbrauch Aufbau bei der Muskelkontraktion)
• beschleunigt die Einstellung des Reaktionsgleichgewichtes
• erniedrigen die Aktivierungsenergie ._,~ ->. .•
( ' \ Unkatalysiert-I
I ~ I
\ />:
; "5,Q) i/" \\\
~ /K' . \
w I ata vsiert "
CI) . / • •- . \
"ä; I "
~ SUbs~at \
\
und
Produkt
B _
Produkt
A L . . . . - _ - - - -
Reaktionsverlauf Reaktlonsverjauf •
~ G'" =GObergangszustand -G.,ubstr3t
Abbildung7: Katalysewirkung der Enzyme
Enzyme beschleunigen Reaktionen um Faktoren von wenigstens einer Millionen.
In ihrer Abwesenheit würden die meisten Umsetzungen nicht in wahrnehmbaren Umfang ablaufen.
Versuch 4: Katall'sierte Umsetzung von HarnstoffmitHilfe von Urease Chemikalien
50 ml 1 % HarnstoffIlösung, 2 ml Ureaselösung (200mg in 100ml Wasser), 50 ml H2ü , BTB als Indikator.
Geräte
Demonstrationsreagensglas, Stativ, Glasstab, Pipette, Wasserflasche.
Durchführung
In dem Reagenzglas werden 50 ml der Harnstofflösung + 50 ml H~ eingefüllt und mit 2ml einer BIB -Indikatorlösung versetzt. Die Lösung färbt sich gelb (saurer pH-Bereich). Nach der Zugabe der Harnstoffllösung beginnt sich die
"--/ Lösung blau zu verfärben (alkalischer pH-Bereich).
Die Umsetzung erfolgt nach dem Carbamidsäure-Mechanismus:
Voraussetzung: Bildung eines Enzym-Substrat-Komplexes
\'----'
E +S - 4 - - -....~ ES ---+-E+P
Edukte
u
'[0 I
L ÄH~I ::J
.1I
1-
adsorbiertes Produkt
R~;l~tiunswc;;
NfA..=Reaktionsenthalpie
E~=Aktivicruugscnergi«,krAdsorptiollbzw. Desorption
E,F:....=A~1il'it:rIlIl~.rI!IIt!rgit!der katalysiertenbzw.lIichtkJf<i~l'si.:rtl·1IR.:ak:iIJII TI~HR
, Produkte l.~H~
Abb. 8: Energiediagramm für Reaktionen mit und ohne Katalysator
Die Enzyme verschieben die Gleichgewichte nicht sondern setzen wie auch in diesem Fall die Aktivierungsenergie der Reaktion herab.
Für die oben beschriebene Reaktion bedeutet dies, daß die Umsetzung bereits bei Raumtemperatur geschieht.
2.2 Das aktive Zentrum
Das aktive Zentrum eines Enzyms ist die Region, welche das Substrat bindet und gleichzeitig diejenigen Aminosäurereste bereitstellt, die direkt am Trennen und Zusammenfügen von Bindungen teilnehmen.
Die aktiven Zentren der unterschiedlichen Proteine zeichnen sich durch einige
Gemeinsamkeiten aus: .
I. Das aktive Zentrum macht nur einen relativ kleinen Teil des Enzyms aus.
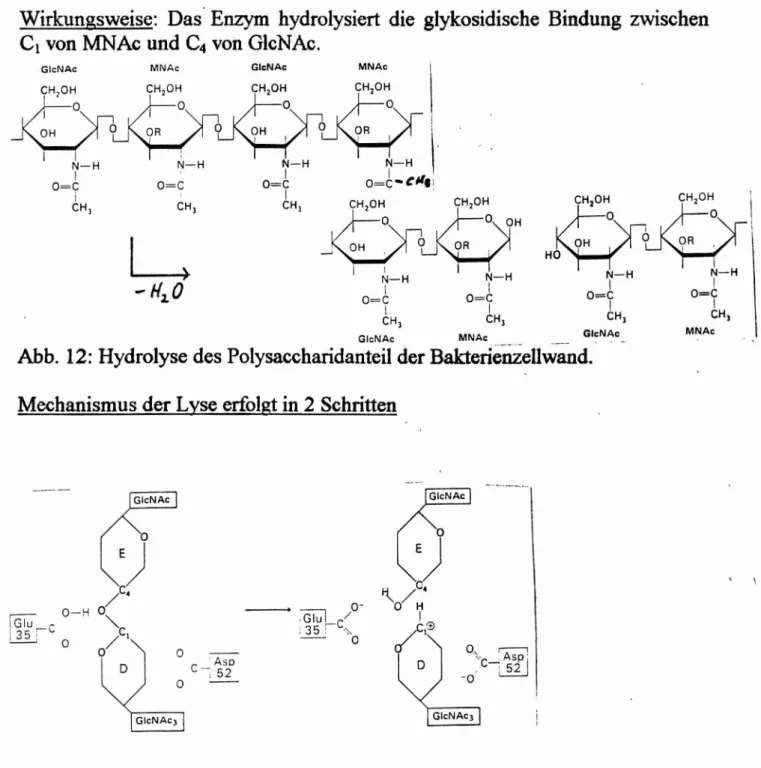
2. Es stellt eine dreidimensionale Einheit dar (siehe Lysozym).
3. Die Substratbindung an das Enzym erfolgt durch relativ schwache Kräfte.
4. Die aktiven Zentren sind höhlen- oder spaltenförmig,
5. Die Bindungsspezifität ist von der definierten Anordnung der Atome im
aktiven Zentrum abhängig.
Die Eigenschaften von aktiven Zentren:
Zwei Modellvorstellungen.
.R· :,.~ ._.1.-. 0:_._--'.' •_ _.'.__"
ES·Komplex
>
~
-1":....-..".-,. .
Schüssel - Schloß - Modell
Substrat
+,I
I\
II
Das aktive Zentrum des Enzyms hat eine dem Substrat komplementäre Gestalt. ' Induced - fit - Modell
~
a b CES·Komplex
)
+
Substrat
Das Enzym verändert sich bei der Substratbindung. Das aktive Zentrum hat die dem Substrat komplementäre Gestalt erst nach der Bindung des letzteren.
Versuch 5: Substratspezifität Umsatz von Thioharnstoff mit Urease Chemikalien
50 ml I % Thiohamstotllösung, 2 ml Ureaselösung (s.o.), BTB-Indikatorlösung.
50 ml H20 Geräte
Demonstrationsreagenzglas, Glasstab, Pipette, Stativ.
Durchführung
Die Thiohamstotllösung wird in das Reagenzglas gefüllt und mit der Indikatorlösung versetzt. Die Flüssigkeit färbt sich gelb. Nach. Zusatz der Ureaselösung tritt keine Farbänderung ein. Der Thioharnstoff kann nicht durch die Urease umgesetztwerden.
Versuch 6: Umsatz einer Harnstoff I. Thioharnstoff - Lösung mit Urease im Vergleich miteiner Harnstofllösltng.
Chemikalien
2 x50 ml 1% Harnstofflösung, 50 ml 1% Thioharnstofflösung. 50 mlH~, 2 ml Ureaselösung, 2 mlBTB-lösung.
Geräte
2 Demonstrationsreagenzgläser, Glasstab, Stativ, Pipette, 2 x2 mlSpritzen.
Durchfiihrung .:
Indas erste Reagenzglas werden 50 ml Harnstofflösung + SO ml H20 eingefüllt und mit 2 ml BTB-Iösung versetzt. In das zweite werden 50 ml Hamstofflösung + 50 ml Thioharnstofflösung gefüllt und ebenfalls mit 2 ml BTB-lösung versetzt.
Beide Lösungen färben sich gelb.
Nun werden gleichzeitig in beide Reagenzgläser je 2 ml Urease zugegeben.
Nach einiger Zeit färbt sich die reine Harnstofllösung blau, während das Gemisch aus Harnstoff / Thioharnstotllösung sich langsamer blauverfärbt,
Erwartung? :::) Kompetetive Hemmung .
Bei diesem Versuch handelt es sich um die Demonstration einer kompetctiven Hemmung, die im weiteren Verlauf dieser Ausarbeitung näher erläutert werden wird.
VerSllch 7: Umsatz einer Harnstoff/ Bleiacetat - Lösung mit Urease Chemikalien
50 ml 1~/o Harnstofflösung, 50 ml H20 , kleine Spatelspitze Bleiacetat, 2 ml BTB-Lösung, 2 ml Ureaselösung
v -
. !
'-,.:
Geräte
Demonstrationsreagenzglas, Pipette, Glasstab, kleiner Spatel.
Durchführung
In das Reagenzglas wird die Harnstoffiösung + H20 eingefüllt, mit 2 ml BTB- Lösung versetzt . Die Flüssigkeit färbt sich gelb. Nun wird wenig Bleiacetat hinzugegeben und anschließend Ureaselösung. Eine weitere Verfärbung bleibt aus. Die Blei-Ionen besetzen das aktive Zentrum der Urease wodurch ein Abbau des Harnstoffes nicht mehr möglich ist.
Der Mechanismus dieser Hemmung erfolgt nach dem der nicht-kompetetiven Hemmung (s.u.).
Erwartung? =>Nicht-kompetetive Hemmung 2.3 HemmungI Blockierung von Enzynlen
Im folgenden soll auf die qualitativen Unterschiede im Mechanismus der verschiedenen Hemmungstypen eingegangen werden und entsprechende Modelle vorgestellt werden.
1. Kompetitive Henunung
• reversible Hemmung durch eine schnelle Gleichgewichtseinstellung zwischen
Enzym und Inhibitor. .
• der kompetitive Inhibitor wird vom aktiven Zentrum gebunden.
• er vermindert die Katalysegeschwindigkeit.
2. Nicht - kompetitive Hemmung
• reversibel
• Inhibitor und Substrat werden gleichzeitig gebunden.
• nicht-kompetitiver Inhibitor wirkt durch die Erniedrigung der Wechselzahl eines Enzyms.
Blockierung eines Enzyms
• irreversibel
• aktives Zentrum wird blockiert
Substrat
f!J
(Kompetitiver Substrat
Inhibitor {
I Nichtkompetitiver
(li[\
Inhibitor ~G~"-@
Abbildung 9: Unterschied zwischen einem kompetitiven und einem nicht- kompetitiven Inhibitor.
'~.
2.4 Bindungsarten des aktiven Zentrums
Reversible molekulare Interaktionen in biologischen Systemen werde durch drei Arten von Kräften vermittelt:
a) elektrostatische Bindungen (gel.Substrate, Coulombsches Gesetz) b)Wasserstoff-Brücken-Bindungen (2 Atome teilensich einH-Atom) c) Van der Waals-Bindungen (sterisch komplementäre Strukturen)
Eine wichtige Komponente in der Ausbildung dieser Kräfte, ist die exakte Ausrichtung der Wirkungsrichtung dieser Kräfte.
Viele Substrate werden, obwohl ungeladen, trotzdem mit hoher Affinität und Spezifität an Enzymen gebunden.
Hier treten die charakteristischen Wasserstoflbrückenbindungen auf Eine wichtige Eigenschaft dieser Bindungsart ist ihre Bindungscharakteristik. Der stärkste Zusammenhang ist dann gewährleistet, wenn Donor, Akzeptor- und Wasserstoffatom auf einer Linie angeordnet sind.
2.5 Beeinßussung der Enzymaktivität durch "äußere" Faktoren
• pH-Abhängigkeit
• Medium
• Temperatur
Die drei genannten Faktoren nehmen Einfluß auf die zwischenmolekularen Kräfte, die zwischen dem aktiven Zentrum und dem Substrat wirken.
Das Medium Wasser z.B. setzt mit seiner hohen Dielektrizitätskonstante die Stärke der elektrostatischen Wechselwirkungen zwischen anderen (polaren) Molekülen und Ionen , wogegen es die Wechselwirkungen zwischen unpolaren Molekülen verstärkt, herab. . .
Die pH-Abhängigkeit erklärt sich aus den unterschiedlichen Dissoziationskonstanten der einzelnen funktionellen Gruppen, so daß bei einer bestimmten Umgebungs-pH die entsprechenden Gruppen ionisiert oder neutral vorliegen. Dies hat natürlich einen großen Effekt auf die Stärke und Art der Ausbildung der intermolekularen Kräfte (z.B, Ionen- oder Wasserstoflbrückenbindungen).
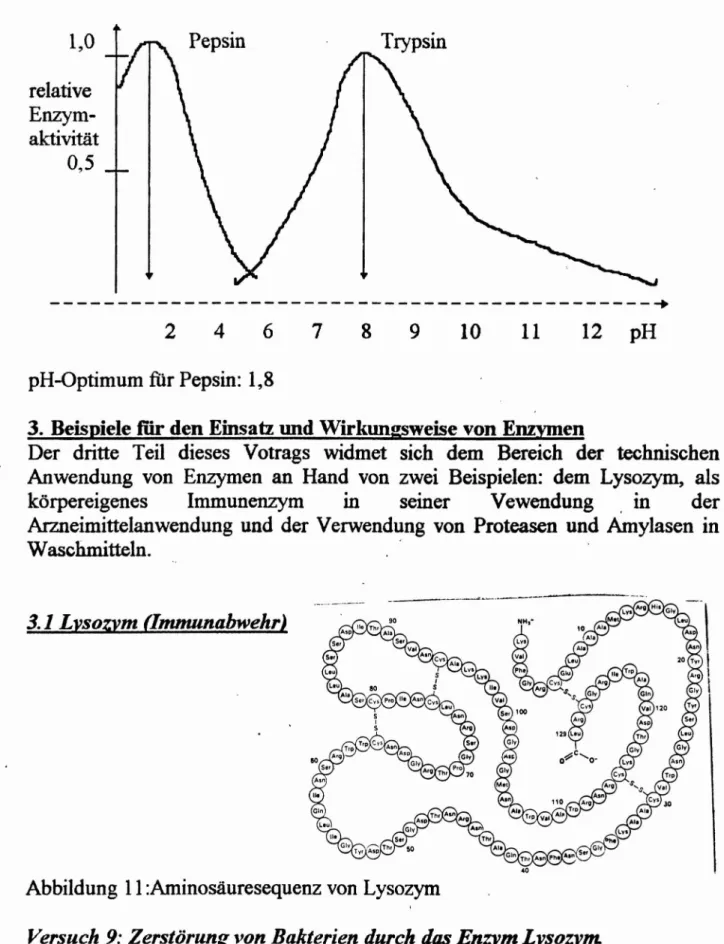
Versuch 8: pH- und Temperaturabhängigkeit der Enzvmaktivität
Dieser Versuch soll die pfl-Abhängigkeit des Verdauungsenzyms Pepsin verdeutlichen, indem bei verschiedenen pH-werten die gleiche Reaktion durchgeführt werden soll.
Aufgabe des Pepsin:
Die "Eiweißverdauung" ~ Hydrolyse von Esterverbindungen
i
CH3 : 0 H: H
1 : 11 I: I
H2N- C -+ C - N -+-C - COOH
I : I
H ---- ---- H
Alanin
Peptid
Glycin
Hydrolyse...
CH3 0
I 11
H2N-C-C-OH HI
Carboxylkomponente
H 0
I 11
H2N-C-C-OH HI
ArninokoFt:Jponente
Chemikalien
gekochtes Eiweiß, 3 x 50 ml Wasser, verd. Salzsäure, Pepsin Geräte
'0- 3 Demonstrationsreagenzgläser, Stativ, Wasserflasche, Tropfflasche, pH-Papier, Glasstab
Durchführung
Im ersten Reagenzglas befindet sich Eiweiß mit SO ml Wasser und Pepsin.
Im zweiten Reagenzglas befindet sich Eiweiß mit 50 ml Wasser und verd..
Salzsäure.
Im dritten Reagenzglas befindet sich Eiweiß mit SO mlWasser, verd. Salzsäure
und Pepsin. - ., -.
Um das Temperaturoptimumzu nutzen und somiteinen entsprechenden Umsatz der Reaktion, empfiehlt es sichbeica 37°C Wassertemperatur zu arbeiten.
InGlas 1 wird keine Reaktion eintreten.
In Glas 2 wirdnursehr langsam eine Reaktion einsetzen (-einige h),
In Glas 3 wird nach einigen Minuten eine Reaktion sichtbar. Es stellt sich eine
~/ Trübung des Wasser ein. Das Eiweiß wird durch das Pepsin gespalten.
In diesem dritten Glas kann das Enzym in seinem pll-Optimum operieren und wird somitseine höchste biologischeEffektivität erreichen.
Aktivität und Effektivität der Wechselwirkungsmöglichkeiten des aktiven Zentrums:
• die angesprochenen Gruppen liegen durch ihren pK-Wert beim entsprechenden pH-Wert der Umgebung günstig ionisiert vor.
• Wasserstoff-Brückenbildung
• Tertiärstruktur ist ebenfalls pH undTemperaturabhängig.
• Wasser schwächtpolare Wechselwirkungen(Bsp.: Eo)
1,0 relative Enzym- aktivität 0,5
Pepsin
---~
2 4 6 7 8 9 10 11 12 pH
plf-Optimum für Pepsin: 1,8
3. Beispiele für den Einsatz und Wirkungsweise von Enzymen
Der dritte Teil dieses Votrags widmet sich dem Bereich der technischen Anwendung von Enzymen an Hand von zwei Beispielen: dem Lysozym, als körpereigenes Immunenzym in seiner Vewendung. in der Arzneimittelanwendung und der Verwendung von Proteasen und Amylasen in
Waschmitteln. .
3.1 Lysozym (lmmunabwehr)
Abbildung 11 :Aminosäuresequenz von Lysozym
Versuch 9: Zerstörung von Bakterien durch dasEnzvmLvsoZVm.
In diesem Versuch soll die Wirkung von Lysozym auf Bakterien demonstriert werden.
Chemikalien und Geräte
1 AgaAga- Platte mit angezüchteten Bakterius subtilus Stämmen,
1 AgaAga- Platte mit angezüchteten Bakterius subtilus Stämmen und emem Tropfen konzentrierter Lysozym-Lösung.
Durchführung
Die beiden Platten sind bereits einige Tage vor dem Versuch entwickelt worden, so daß die Stämme genügend Zeit hatten zu wachsen.
Demonstriert wird zum Einen die Platte mit dem ungestörten Wachstum der Bakterien und zum Anderen die andere Platte mit einem durch das Lysozym entstandenen Lysehof da dort die Stämme durch das Enzym zerstört worden sind.
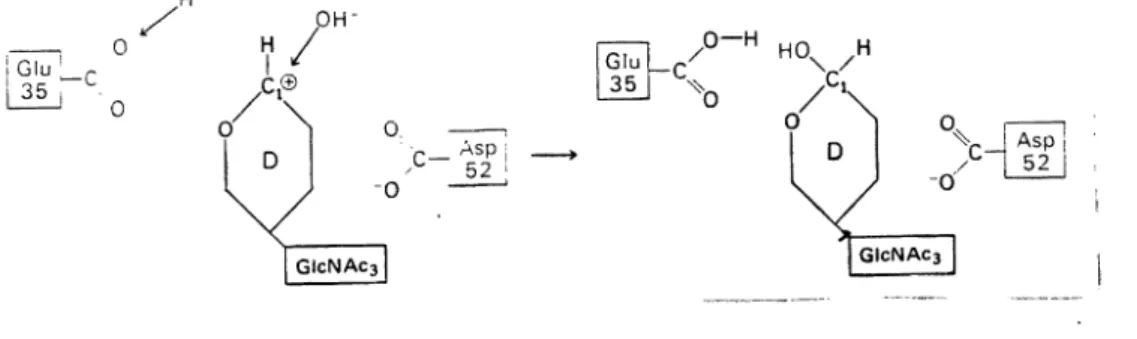
Wirkungsweise: Das'Enzym hydrolysiert die glykosidische Bindung zwischen Cl von MNAc und C4 von GlcNAc.
CHzOH CHzOH \
~0"'n V:-~y:
H~ ~N-H N-H
I !
o=c o=c
I I
CH) CH)
GlcNAc MNAc
Abb. 12: Hydrolyse des Polysaccharidanteil der Bakterienzellwand.
Mechanismus der Lyse erfolgt in 2 Schritten
.Asp C---: 52
- - - + --::::-:--l /0-
,GluLc
!3 5 ~ '"o
0, r--:---:
'·C~ASP
' :521
-0
Abbildung 14: 1. Schritt des katalytischen Mechanismus
-:H- 1 _ ' 0
IGlu I C
~ 0
0," Asp: ~
/c- 52 :
-0 - - t
D O\:-GTI/ 52s pI -0
-
Abbildung 15: 2.Schritt des katalytischen Mechanismus Ablauf der Lyse:
Die Caroxylgruppe von Glutaminsaüre 35 gibt ein Iran die Bindung zwischen Cl des Rings und dem glykosidischen Sauerstoffatom und Spaltung derselben ab. Es ensteht ein Carbeniumion. Die heiden Ringe trennen sich. Das Carbeniumion reagiert mit OH- des Lösungsmittels.
'---'-- Glutamin 35 wird durch Ir aus dem Lösungsmittel protonisiert, womit das Enzym für einen neuen Katalysevorgang bereit ist,
Enscheidende Element in dem Katalvseschema: . - 1.Allgemein und saure Katalyse (Glutaminsäure35).
I 2. Förderung der Bildung eines Carbeniumions als Intermediärprodukt durch zwei Faktoren:
a) elektrostatische Faktor, der durch die Anwesenheit einer negativ geladenen Gruppe (Asparaginsäure 52).
b) geometrischerFaktor, beim Bindungsprozeß drängt das Enzym das Substrat die Geometrie des Übergangszustandes anzunehmen.
3.2 Enzvme als Bestandteilvon Waschmitteln
~" • biologische Abbaubarkeit
• größere Effektivitätbei niedrigeren Waschtemperaturen
Viele Feinwaschmittel (-60°C) enthalten als Bestandteile Proteasen wie Versuch 10: Filmtest für Proteasen
Chemikalien
Waschmittel Burtil ohne Enzyme, Waschmittel Persil mit Enzymen, belichteter und entwickelter, jedoch unfixierter Röngtenfilm.
Geräte
2 Magnetrührer, 2 Rührfische, 700 ml Wasser, Pinzette.
Durchfühnlng
In zwei 500 ml Bechergläser wird jeweils ein Waschmittel in ca. 60 oe warmen
Wasser aufgelöst und der belichtete Röntgenfilm. der zuvor klein geschnippseit worden ist, zugegeben. Nach einiger Zeit tritt das kolloidale Silber in der Emulsion .Persil' aus dem Trägermaterial aus und färbt somit die Emulsion schwarz.
Die enthaltenen Enzyme spalten die Gelatine, die als Trägermaterial und Seilutzschicht für die Silberhalogenide dient.
Durch die Hydrolyse der Gelatine, wird das fein verteilte Silber frei gesetzt, daß so als Indikator für die Funktion der Enzymedient.
AgX+ hv ----. Ag+ 'l2 X2