Quanten- und Atomphysik I
Autor: Sebastian-Philip Harris
E-Mail: s.harris@stud.uni-goettingen.de
Abbildung 1: Quelle: Falls du XKCD Comcics noch nicht kennst, leg jetzt dieses Skript weg und prokrastiniere ein wenig indem du XKCDs googelst!
Inhaltsverzeichnis
1 Einleitung 1
2 Schwarzk¨orperstrahlung 1
2.1 UV-Katastrophe und die klassische Erkl¨arung . . . 1
2.2 Das Plancksche Strahlungsgesetz - die Geburtsstunde der Quantenmechanik 3 3 Der Photoelektrische Effekt 4 3.1 Ein experimenteller Aufbau . . . 4
3.2 klassische Erwartung . . . 5
3.3 Erwartung im Teilchenbild . . . 6
3.4 Der Erfolg der Quantenhypothese . . . 6
4 Anf¨ange der Atomphysik 7 4.1 Atomspektren . . . 7
4.2 Das Bohrsche Atommodell und der Wasserstoff . . . 8
4.3 Franck-Hertz Versuch . . . 10
5 Beugung und Streuung - Wellen und Teilchen 12 5.1 Compton Effekt - Licht als Teilchen . . . 12
5.2 Heisenbergsche Unsch¨arfe . . . 14
5.3 de Broglie - Elektronen als Wellen . . . 14
5.4 Wellen oder Teilchen? - Die Wellenfunktion . . . 15
6 LASER 16 6.1 Funktionsprinzip eines LASERs . . . 17
7 Schlusswort 18
Bildquellen 19
Textquellen 19
1 Einleitung
Im Rahmen dieser Einf¨uhrung in die Quanten- und Atomphysik sollen einige wichtige experimentelle Grundlagen skizziert werden, die dazu beigetragen haben, dass das klas- sische Weltbild zugunsten der Quantenmechanik aufgegeben werden musste. Dabei wird auf eine genaue mathematische Beschreibung der Ph¨anomene verzichtet und stattdessen der Fokus auf die qualitativen Aspekte gelegt. Das Ziel hier ist also einen ersten Einblick in die Probleme zu bekommen, vor denen die Physik am Anfang des letzten Jahrhunderts stand. Details dazu, wie diese durch die Quantenmechanik gel¨ost werden, sind Thema von “Quanten- und Atomphysik II”.
2 Schwarzk¨ orperstrahlung
Mit einem Blick auf eine Gl¨uhbirne, eine heiße Herdplatte oder die Sonne1, kann man sich jederzeit von einer experimentellen Tatsache ¨uberzeugen, die sich im Rahmen der klassischen Physik nicht hinreichend erkl¨aren l¨asst: Heiße K¨orper geben elektromagneti- sche Strahlung (Licht) ab. In den oben genannten Beispielen l¨asst sich das entstehende Spektrum durch sogenannte “Schwarzk¨orperstrahlung” beschreiben. Wir nehmen also an, dass unsere Strahlungsquelle ein “schwarzer K¨orper” - d.h. ein K¨orper, der Licht jeder Wellenl¨ange vollst¨andig absorbiert - ist. Oft spricht man auch von “Hohlraum- strahlung”, da eine naheliegende experimentelle Realisierung des idealisierten schwarzen K¨orpers ein Hohlraum mit einem kleinen Loch ist, bei dem durch das Loch eintretendes Licht mehrfach an den W¨anden des K¨orpers reflektiert und absorbiert wird, weshalb der das Loch wieder verlassende Anteil vernachl¨assigt werden kann. Mit dieser Umsetzung werden wir uns jetzt weiter besch¨aftigen. Ziel dieses Abschnittes ist also folgendes: Die aus einem kleinen Loch in einem Hohlraum innerhalb eines Materials mit vorgegebe- ner Temperatur austretende Strahlung soll beschrieben werden, um ein Modell f¨ur das Strahlverhalten heißer K¨orper zu erhalten.
2.1 UV-Katastrophe und die klassische Erkl¨arung
Zun¨achst zerlegen wir die Strahlung im Hohlk¨orper in seine verschiedenen Frequenzan- teile. Im wesentlichen gibt es dann zwei Gr¨oßen, die uns interessieren: Einerseits die spektrale Energiedichteu(ν,T). Sie gibt bei gegebener Temperatur T an, wie viel Ener- gie pro Volumen des Hohlk¨orpers in einem kleinen Frequenzbereich um ν verteilt ist.
Andererseits interessiert und die spektrale Strahlungsflussdichte P(ν,T)ges. Diese gibt an, wie groß die Leistung (d.h. Energie pro Zeit) ist, die pro Fl¨ache des Austrittslochs in Form von Strahlung mit einer Frequenzν abgegeben wird.
1Gut, vielleicht sollte man nicht direkt in die Sonne starren...
Drei entscheidende Ergebnisse sind zun¨achst die experimentellen Befunde, dass u(ν,T) und P(ν,T)ges f¨ur alle Hohlr¨aume unabh¨angig von ihrer Form gleich sind und, dass bei festemT das Maximum vonP(ν,T)gesbei einer zuT proportionalen Frequenz angenom- men wird. Die zweite Aussage ist als “Wiensches Verschiebungsgesetz” bekannt. Ferner l¨asst sich aus der klassischen Physik das Stefan-Boltzman Gesetz herleiten. Die gesamte abgestrahlte Leistung ist proportional zur vierten Potenz der Temperatur:
S= 2 Z ∞
0
P(ν,T)gesdν∝T4 (1) Nat¨urlich interessiert und aber nicht nur wie viel Strahlung insgesamt abgegeben wird, sondern wie die Funktion P genau aussieht, da wir erst damit Fragen wie z.B. “Welche Farbe hat ein 800 K heißes St¨uck Metall” beantworten k¨onnen. Auch daf¨ur liefert die klassische Physik eine Antwort: umu(ν,T) zu bestimmen ben¨otigt man im wesentlichen zwei Einsichten.
1. Aus der klassischen Elektrodynamik: Durch die W¨ande des Hohlk¨orpers gibt es Einschr¨ankungen an die m¨oglichen Frequenzen, die elektromagnetische Wellen in seinem Inneren haben k¨onnen. Mathematisch ist dieser Zusammenhang sehr ¨ahnlich zu einem anschaulicheren Beispiel aus der Mechanik: Spannt man eine Saite an beiden Enden fest ein, l¨asst sie sich nur noch mit bestimmten Frequenzen zum Schwingen bringen. Aus genaueren elektrodynamischen ¨Uberlegungen ergibt sich, dass die erlaubten Frequenzen mit wachsender Frequenz immer dichter auf einan- der folgen. Die Anzahl der anregbaren Frequenzen in einem kleinen Bereich um eine gegeben Frequenz ν - oder in Anderen Worten die “spektrale Modendichte”
dn
dν - steigt also mit ν. Genauer: Aus den Details der Rechnung ergibt sich ein quadratischer Zusammenhang dndν ∝ν2
2. Aus der Thermodynamik: Wir nehmen an, dass sich das gesamte System im the- romdynamischen Gleichewicht befindet, d.h. T,u und P ver¨andern sich nicht (Die N¨aherung besteht hier also darin, dass das Loch als so klein angenommen wird, dass der Energieverlust, der durch die aus dem Loch entweichende Strahlung ent- steht, vernachl¨assigbar ist). Jede anregbare Frequenz stellt einen Freiheitsgrad des Systems dar. Nach dem Gleichverteilungssatz f¨allt im thermodynamischen Gleich- gewicht auf jeden Freiheitsgrad im Mittel die EnergieEν =kT mit der Boltzmann Konstante k.
Setzt man diese beiden Annahmen zusammen, so ergibt sich das Rayleigh-Jeans-Gesetz:
u(ν,T) = Energie Anzahl der anregbaren Frequenzen Frequenzbereich =Eν
dn
dν ∝kT ν2. (2) Entsprechend ergibt sich auch f¨ur die spektrale Strahlungsflussdichte
P(T,ν)ges ∝u(T,ν)∝kT ν2. (3) F¨ur kleine Frequenzenν stimmt dieser Zusammenhang auch tats¨achlich mit der experi- mentell beobachtbaren Strahlungsverteilung ¨uberein. Es gibt nur ein großes Problem:P w¨achst mit steigendem ν immer weiter. Das bedeutet, dass das Rayleigh-Jeans-Gesetz vorhersagt, dass in h¨oheren Frequenzen immer mehr Leistung abgestrahlt wird. Die Gesamtleistung (Welche man aus P durch Integration ¨uber den gesamten Frequenz- bereich erh¨alt) wird also unendlich! Dieser gravierende Fehler in der Theorie wird als die “UV-Katastrophe” bezeichnet (da Ultraviolettes Licht eine hohe Frequenz hat und die Probleme des Rayleigh-Jeans-Gesetzes bei hohen Frequenzen auftreten). Die L¨osung dieses Problems erfolgte im Jahr 1900 durch Max Planck. Die damit angestoßene Ent- wicklung hat unser Weltbild grundlegend ver¨andert und f¨uhrte zu dem was wir heute als “Quantenmechanik” kennen.
2.2 Das Plancksche Strahlungsgesetz - die Geburtsstunde der Quantenmechanik
Planck l¨oste das im letzten Abschnitt vorgestellte Problem durch die Quantenhypothese.
Das Plancksche Strahlungsgesetz
u(ν,T) = 8πν2
c3(ehν/kT −1) (4)
entstand zun¨achst durch eine heuristische Suche nach einer Kurve, die die Messergebnisse gut wiedergibt. Hier taucht die Lichtgeschwindigkeit cund eine Hilfsgr¨oßeh auf. Kurze Zeit sp¨ater erkannte Planck, dass er sein Strahlungsgesetz herleiten kann, wenn er den Uberlegungen folgt, die zum Rayleigh-Jeans-Gesetz f¨¨ uhren, aber zus¨atzlich annimmt, dass die Energie, die in einer Schwingungsmode vorhanden ist immer ein vielfaches von h sein muss:
En=nhν, (5)
wobeineine nicht negative ganze Zahl ist.2 Damit werden hochfrequente Schwingungs- moden unterdr¨uckt, da diese f¨urkT << hνnicht angeregt werden k¨onnen. Auf diese Wei- se wird durch die Quantenhypothese die Ultraviolett-Katastrophe behoben. Details zu einer (etwa 17 Jahre nach der Originalarbeit von Planck) durch Einstein erfolgten etwas moderneren und leichter zug¨anglichen Herleitung gibt es in einer der ¨Ubungsaufgaben.
Ich empfehle diese Aufgabe besonders, da sich auch herausstellen wird, dass die hier verwendete Argumentation im Grunde auch schon alles liefert, was wir brauchen um sp¨ater ein ganz anderes Ph¨anomen - den “LASER” - zu verstehen.
2Heute Wissen wir, dass es besser w¨are von En = (n+ 1/2)hν auszugehen. Das ¨ubersteigt jedoch deutlich den Rahmen dieser Einf¨uhrung. Falls ihr euch aber daf¨ur interessiert sucht doch mal nach den Stichpunkten “harmonische Oszillator in der Quantenmechanik” und “Nullpunktsenergie”.
3 Der Photoelektrische Effekt
1905 ver¨offentlichte Albert Einstein seine Arbeit “ ¨Uber einen die Erzeugung und Ver- wandlung des Lichtes betreffenden Heuristischen Gesichtspunkt.” [Ein05] f¨ur die er 1921 mit dem Physik Nobelpreis ausgezeichnet worden ist. In ihr fasst er kurz die Ergebnisse Plancks zur Schwarzk¨orperstrahlung zusammen, welche wir im letzten Abschnitt dis- kutiert haben, und liefert noch einige zus¨atzlichen thermodynamischen ¨Uberlegungen3. In den letzten Abschnitten kommt er dann zu einer vollkommen neuen ¨Uberlegung: Er wendet die Quantenhypothese, welche zu dieser Zeit von den meisten Physikern nur f¨ur eine Art mathematischer Taschenspielertrick zur Beschreibung eines einzelnen Problems - Der Schwarzk¨orperstrahlung - gehalten worden ist, an, um ein weiteres bis dahin nicht verstandenes Ph¨anomen zu Erkl¨aren: Den (¨außeren) Photoelektrischen Effekt. Damit leistete Einstein einen entscheidenden Beitrag dazu, dass die Quantenhypothese nicht mehr als k¨unstliche Hiflskonstruktion, sondern ein Aspekt der Realit¨at, welcher in der klassischen Physik fehlt, angesehen worden ist. Der Bedarf nach einer neuen Theorie, die diese fremde Physik geschlossen beschreiben kann, ist dadurch gewachsen.
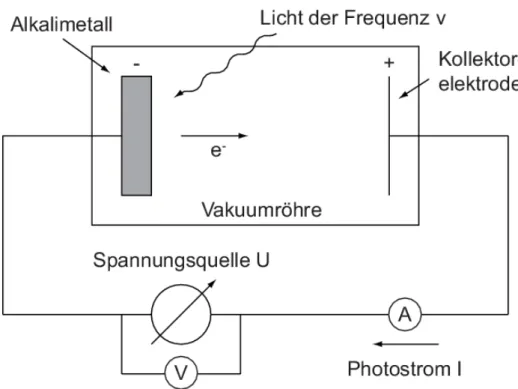
3.1 Ein experimenteller Aufbau
Typischer Weise verbindet man mit dem Photoelektrischen Effekt den in Abbildung 2 skizzierten und in der Bildunterschrift erl¨auterten Aufbau. Der Zusammenhang, der hier untersucht werden soll ist der Folgende: Legen wir eine Spannung U zwischen den bei- den Elektroden an, so ist es f¨ur die Elektronen energetisch G¨unstiger bei der positiv geladenen Elektrode zu sein, als bei der negativ geladenen zu bleiben. Um die Elektrode verlassen zu k¨onnen, muss an den Elektronen aber zun¨achst eine gewisse Austrittsar- beitWA geleistet werden. Vorzugsweise verwendet man also f¨ur die negative geladenene Elektrode Metalle, bei denen die Elektronen besonders schawach gebunden sind. Dies ist z.B. bei Alkalimetallen der Fall. Legen wir also einfach eine moderate Spannung an, so werden keine Elektronen die negativ geladene Elektrode verlassen k¨onnen und kein Strom fließt. Zu untersuchen ist jetzt, in wie fern wir durch die Bestrahlung der Metall- platte mit Licht den Elektronen die n¨otige Austrittsenergie liefern k¨onnen, sodass sie aus dem Alkalimetall herausgeschlagen werden und dann zur Kollektorelektrode beschleu- nigt werden. Quantitativ kann die Rate mit der Elektronen herausgel¨ost werden dann
¨uber den Strom, der am Amperemeter gemessen wird, bestimmt werden.
Die Beiden Elektronen befinden sich dabei in einer Vakuumr¨ohre, damit Elektronen, die bei der Bestrahlung der negativgeladenen Platte aus dem Metall gel¨ost werden nicht
3Diese ¨Uberlegungen f¨ullen Abschnitt 3 bis 6 und sind von etwas technischerer und ohne Vorkenntnisse in der Thermodynamik schwer zug¨anglicher Natur. Die F¨ur uns entscheidenden Abschnitte (also
§1,§2,§7,§8 und§9) sind aber leichter und zum Gl¨uck auch unabh¨angig von den anderen Abschnitten nachvollziehbar und ohnehin das Spannendste an der Arbeit. Zum Nachlesen kannst du das Paper auch auf der Orpheus Seite zusammen mit diesem Skript finden.
auf dem Weg zur Kollektorelektrode durch Kollisionen mit Gasatomen gest¨ort werden (Wenn wir bestimmte Gase in der R¨ohre haben, gibt es auch interessante Physik. Mehr dazu im Abschnitt ¨uber den Frank-Hertz-Versuch).
Im wesentlichen gibt es in diesem Versuch zwei Parameter, deren Einfl¨usse es zu unter- suchen gilt. Zum einen k¨onnen wir beobachten, wie sich der Photostrom in Abh¨angigkeit der Intensit¨at des einfallenden Lichts ver¨andern. Andererseits kann beobachtet werden, ob die Wahl der Frequenz des einfallenden Lichts eine Rolle f¨ur den Photostrom spielt.
Abbildung 2: Hier ist der f¨ur den Photoeffekt typischerweise verwendete Versuchsaufbau abgebildet. Er besteht aus einer regelbaren Spannungsquelle, ¨uber die die Potentialdif- ferenz zwischen dem Metall, aus welchem die Elektronen herausgel¨ost werden sollen, und der Kollektorelektrode eingestellt werden kann. Anode und Kathode befinden sich in einer Vakuumr¨ohre. Von Außen kann nun Licht mit einer Frequenz ν auf die nega- tiv geladene Metallplatte gestrahlt werden. Der dabei entstehende Photostrom wird mit einem Amperemeter aufgenommen. Quelle: [Pho]
3.2 klassische Erwartung
In der klassischen Elektrodynamik hat die Frequenz einer elektromagnetischen Welle nichts mit der Energie zu tun, die im Feld transportiert wird. Dementsprechend w¨urden wir klassisch erwarten, dass eine Ver¨anderung der Frequenz des einfallenden Lichts keinen
Einfluss auf den Photostrom hat. Entscheidend sollte die Intensit¨at des Lichts sein, da diese Auskunft ¨uber die im Feld transportierte Energie liefert. Entsprechend erwarten wir klassisch, dass der Photostrom unabh¨angig von der Wellenl¨ange des Lichtes ist und mit der Intensit¨at des Lichtes w¨achst.
3.3 Erwartung im Teilchenbild
Gehen wir nun davon aus, dass das Licht aus einem Strahl von einzelnen Teilchen (Pho- tonen) besteht. Die Intensit¨at des Lichtes ist dann proportional zu der Anzahl der Pho- tonen. Dabei tr¨agt bei einer Frequenz ν jedes Photon die Energie:
E=hν (6)
Wir stellen uns die Wechselwirkung zwischen Licht und Elektronen nun vereinfacht so vor, dass ein immer nur ein einzelnes Photon auf ein Elektron st¨oßt und von diesem vollst¨andig absorbiert wird. Ist die auf das Elektron ¨ubertragene Energiehν kleiner als die Austrittsarbeit des Metalls, so kann das Elektron das Metall verlassen. Ansonsten wird es herausgeschlagen und dann zur Kollektorelektrode hin beschleunigt. Im Gegen- satz zur klassischen Erwartung, m¨usste es also eine Grenzfrequenzνg geben, die durch:
hνg =WA (7)
bestimmt ist, sodass unterhalb dieser keine Elektronen aus dem Material gel¨ost werden k¨onnen. Und zwar egal wie groß die Intensit¨at des Einfallenden Lichtes ist! Hat das Licht eine Intensit¨at, die gr¨oßer als diese Grenzfrequenz ist erwarten wir ferener, dass der Photostrom proporional zur Intensit¨at des Lichtes ist.
3.4 Der Erfolg der Quantenhypothese
Wir haben jetzt also ein handfestes Experiment, mit dem wir entscheiden k¨onnen, wel- ches der beiden konkurrierenden Modelle falsch ist 4. Die tats¨achlichen Beobachtungen stimmen mit den Erwartungen ¨uberein, die sich aus dem Teilchenbild ergeben. Ein noch viel gr¨oßerer Erfolg liegt aber darin, dass das Experiment leicht angewandelt werden kann, sodass die Konstanteh gemessen werden kann. Wie das genau funktioniert k¨onnt ihr in einer der Aufgaben aus der Aufgabensammlung zur Quanten und Atomphysik I herausfinden. Eine solche Messung ergibt den selben Zahlenwert f¨ur h wie bei der Schwarzk¨orperstrahlung. Daraus schließen wir, dass h eine Gr¨oße ist, die nichts mit einem bestimmten Material oder Ph¨anomen zu tun hat, sondern eine grundlegende Na- turkonstante ist, die ein Maß f¨ur die Quantisierung von z.B. Energie im Strahlungsfeld angibt.
4Wir k¨onnen aber nie wissen, welches Modell “richtig” ist. Auch wenn das auf den ersten Blick wie eine sprachliche Pingeligkeit klingt, liegt darin der Kern der moderenen empirischen Wissenschaften.
Stichwort: Falsifikationismus
4 Anf¨ ange der Atomphysik
Am Anfang des Abschnittes ¨uber Schwarzk¨orperstrahlung habe ich davon geschrieben, dass ein Blick auf z.B. die Sonne ausreicht, um einen Aspekt unserer Alltagserfahrung zu finden, der das versagen der klassischen Physik demonstriert. Tats¨achlich h¨atte ich die Aussage noch spitzer formulieren k¨onnen. Die M¨oglichkeit, dass es ¨uberhaupt irgendein Zeug geben kann, dass wir ansehen/anfassen ... k¨onnen, ist ein in der klassischen Phy- sik unerkl¨arbares R¨atsel. Schon vor der Quantenmechanik war bekannt, dass Materie aus Atomen besteht, die wiederum aus positiv geladenen Protonen und negativ gelade- nen Elektronen zusammengesetzt werden. Die Stabilit¨at der Atome ist dabei aber nicht erkl¨arbar gewesen. In der klassischen Elektrodynamik geben beschleunigte Ladungen immer Energie in Form von elektromagnetischer Strahlung ab. Stellt man sich ein Atom also vor wie ein Sonnensystem, bei dem in der Mitte ein schwerer positiv geladener Kern ist, um den das negativ geladene Elektron kreist, dann sollte das Elektron bei seiner Kreisbewegung ununterbrochen Energie abstrahlen und schließlich in den Kern st¨urzen (in der Aufgabensammlung k¨onnt ihr dann auch mal ausrechnen, wie lange ein Atom im klassischen Weltbild ¨uberleben w¨urde). Abgesehen von dem Problem ein Modell zu finden, in dem Materie ¨uberhaupt stabil ist, gab es aber auch noch etwas ganz anderes, was noch erkl¨art werden musste.
4.1 Atomspektren
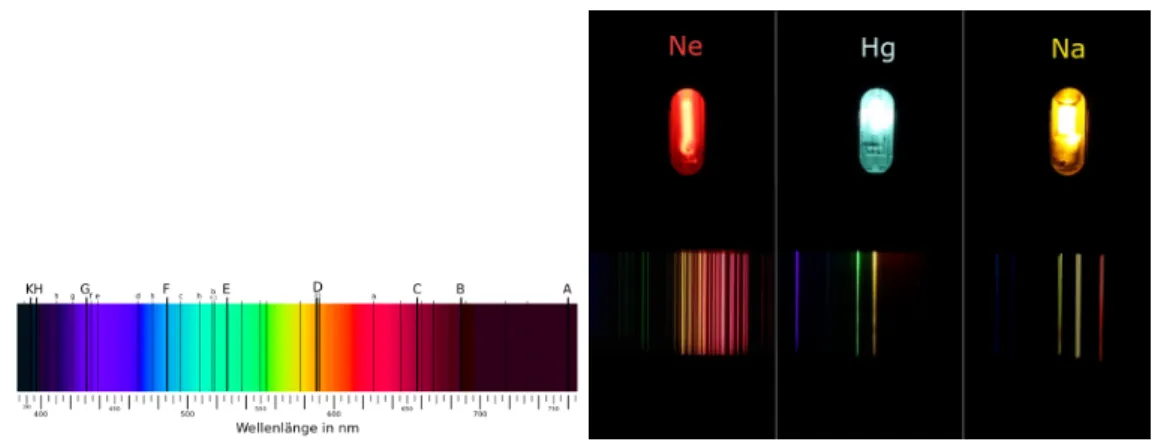
Schon seit Anfang des 19. Jahrhunderts war bekannt, dass neben dem kontinuierlichen Strahlungsspektrum heißer Materie, wie wir es in den ersten Abschnitten dieses Skripts kennengelernt haben, auch noch materialspezifische diskrete Strukturen im Spektrum auftreten. Dazu finden sich in Abbildung 3 zwei Beispiele. Schon lange bevor die Linien erkl¨art werden konnten sind sie in der Spektroskopie als Mittel eingesetzt worden, um Materialien zu untersuchen. Jedes Atom/Molek¨ul hat sein eigens diskretes Emissionss- pektrum. Um Substanzen zu bestimmen gen¨ugt es also das zu untersuchende Material anzuregen (z.B. durch Erhitzen) und dann das resultierende Spektrum abzugleichen mit bekannten Spektren. Man stellte außerdem fest, dass umgekehrt die Atome/Molek¨ule Licht auch bevorzugt bei den charakteristischen Frequenzen der Emission absorbiert.
Mit diesem Wissen kann man z.B. die Zusammensetzung der Sonne aus dem Spektrum des Sonnenlichts mittels der Frauenhofer Linien (siehe Abb. 3) bestimmen.
Schon fr¨uh entdeckte man heuritstische Zusammenh¨ange zwischen den charaktristischen Frequenzen. So fand z.B. Balmer 1885 eine Formel mit der einige Wellenl¨angen im Spek- trum des Wasserstoffs bestimmt werden konnten:
λn=A n2
n2−22. (8)
Hierbei istA eine empirisch zu bestimmende Konstante.
Abbildung 3: Auf der linken Seite ist das sichtbare Spektrum des Sonnenlichts darge- stellt. Man erkennt charakteristische Absorptionslinien - die sogenannten Frauenhoferli- nien - als schwarze Striche im Spektrum. Auf der rechten Seite sind verschiedene Dampf- lampen und darunter das durch etwa ein Prisma oder Gitter aufgespaltene Spektrum dargestellt. Man erkennt, dass die Lampen nur Licht in Form diskreter Linien abstrahlen.
Quellen: [Fra] und [Spe]
4.2 Das Bohrsche Atommodell und der Wasserstoff
Ende des 19. und Anfang des 20. Jahrhunderts entwickelten sich viele verschiedene Atom- modelle. Das erste davon, welches als quantenmechanisch bezeichnet werden k¨onnte ist das Bohrsche Atommodell f¨ur das Wasserstoffatom (das Wasserstoffatom ist das simpels- te Atom und besteht aus einem Proton und einem Elektron). Da von Ernest Rutherford in einem Streuversuch gezeigt werden konnte, dass Atome einen im vergleich zum Atom- durchmesser sehr kleinen positiv geladenen Kern haben, in welchem sich ein Großteil der Masse konzentriert, nimmt Bohr an, dass das Atom ¨ahnlich wie ein Sonnensystem aufge- baut ist. In der Mitte des Atoms befindet sich das positiv geladenen Proton. Dieses wird vom im Vergleich dazu sehr leichten negativgeladenen Elektron umkreist. Die Bewegung des Elektrons soll dabei aber nicht nur von der klassischen Elektrodynamik/Mechanik bestimmt werden, sondern zus¨atzlich noch den drei zun¨achst willk¨urlichen Bohrschen Postulaten gen¨ugen.
1. Das Elektron kann das Atom nicht auf allen klassisch M¨oglichen Bahnen, sondern nur auf ausgezeichneten Kreisbahnen umkreisen. Auf diesen Bahnen strahlt das Elektron (trotz seiner Beschleunigung!) keine elektromagnetische Strahlung ab, sondern beh¨alt seine Energie.
2. Das Elektron kann zwischen den verschiedenen erlaubten Bahnen wechseln. Die- ser Wechsel folgt aber auch nicht der klassischen Elektrodynamik/Mechanik. Wenn
∆E die Energiedifferenz wischen den Bahnen ist, so erfolgt er Wechsel durch Emis- sion eines Photons mit der Frequenz ν = ∆E/h. (Hier taucht also wieder das Plancksche Wirkungsquantum auf!)
3. Die Frequenz der beim ¨Ubergang zu einem benachbarten Zustand emittierten Strahlung n¨ahert sich f¨ur große Bahnradien immer weiter der Umlauffrequenz des Elektrons an.
Das erste Postulat garantiert die Stabilit¨at der Atome. Das zweite Postulat dient dazu die Emissionslinien korrekt zu beschreiben. Das letzte Postulat stellt dabei sicher, dass im Grenzfall großer Bahnradien die abgesendete Lichtfrequenz mit der klassisch erwarteten
¨
ubereinstimmt.
Der Erfolg des Bohrschen Atommodells liegt im wesentlichen in zwei Punkten. Einerseits ist es das erste Atommodell, in welchem die Materie stabil ist und nicht durch Strah- lung kollabiert. Andererseits kann es das charakterisitsche Spektrum des Wasserstoffs vorhehrsagen und z.B. die Balmer-Serie reproduzieren. Details dazu gibt es wieder in einer ¨Ubungsaufgabe.
Das Bohrsche Atommodell hat aber auch seine Schw¨achen. Die Gr¨oßte ist wohl die Willk¨ur in den Borschen Postulaten. Außerdem l¨asst sich das Modell nicht auf kom- pliziertere Atome verallgemeinern. Zum Schluss kommt noch hinzu, dass es z.B. rela- tivistische Effekte gibt, die im Wasserstoffatom relevant sind. Diese k¨onnen zum Teil mit einem leicht ver¨anderten ebenfalls semiklassischen Atommodell beschrieben wer- den: Dem Sommerfeldschen Atommodell. Im wesentlichen unterscheidet sich dieses zum Bohrschen Atommodell dadurch, dass auch Ellipsenbahnen zugelassen werden.
Letzten Endes sind aber die Atommodelle von Bohr und Sommerfeld nur ¨Ubergangs- modelle auf dem Weg zu einer korrekten quantenmechanischen Beschreibung gewesen.
In der Quantenmechanik wird das Modell der klassischen Elektronenbahnen vollst¨andig verlassen und wir betrachten anstelle von lokalisierten Punktteilchen nur noch Aufent- haltswahrscheinlichkeitsverteilungen. Mehr dazu in Abschnitt 6. Mit einer modernen quantenmechanischen Beschreibung k¨onnen auch kompliziertere Atome und Molek¨ule modelliert werden. Der Wasserstoff spielt dabei eine besondere Rolle, da nur f¨ur Atome mit einem einzigen Elektron (also Wasserstoff, oder eben Ionen schwererer Atome) die bei der quantenmechanischen Beschreibung entstehenden Differentialgleichungen analy- tisch l¨osbar sind. F¨ur kompliziertere Konstellationen muss man sich numerischer Ver- fahren und N¨aherungen bedienen. Es sei zum Schluss noch angemerkt, dass auch die Quantenmechanik nicht aller Weisheit Schluss ist. relativistische Effekte lassen sich im Rahmen der Quantenmechanik nicht vollst¨andig beschreiben. Um diese auch noch zu Ber¨ucksichtigen (was zu einer leichten Verschiebung und Aufspaltung der Energieniveaus f¨uhrt) muss man das Teilchenbild v¨ollig verlassen und sich dem Bereich der Quanten- feldtheorien zuwenden.
4.3 Franck-Hertz Versuch
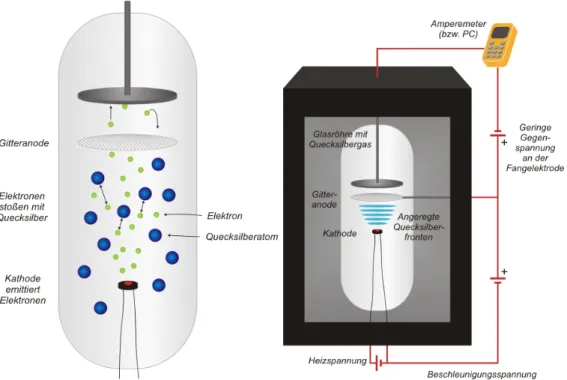
Einer der bekanntesten Versuche zu den diskreten Anregungsenergien von Atomen ist der Franck-Hertz Versuch 5. Der Versuchsaufbau ist in Abbildung 4 skizziert. Im We- sentlichen besteht er aus einer Glasr¨ohre, in der ein bestimmtes Gas vorliegt. In un- serem Fall ist dies Quecksilberdampf. In der Glasr¨ohre ist eine Kathode eingebaut, in der eine Gl¨uhwendel als Elektronenquelle dient. Die Elektronen verlassen die Kathode und werden dann auf eine Gitteranode hin beschleunigt. Dies geschieht ¨uber eine Be- schleunigungsspannung U1 zwischen Gitteranode und Kathode. Nach der Gitteranode durchwandern die Elektronen eine Gegenspannung U2 von der sie abgebremst werden.
Haben die Elektronen genug kinetische Energie, um die Bremsspannung zu ¨uberwinden, so treffen sie auf die Metallplatte hinter der Gitteranode und tragen zum Strom bei, der im Amperemeter gemessen wird. Im Versuch wird jetzt der Strom in Abh¨angigkeit der Beschleunigunsspannung bei fester Bremsspannung gemessen, um die Wechselwirkung zwischen Elektronen und Quecksilberatomen zu untersuchen.
Abbildung 4: Auf der linken Seite ist das die mit Quecksilberdampf gef¨ullte R¨ohre ab- gebildet. Auf der rechten Seite ist der gesamte Versuchsaufbau skizziert. Quelle: [LPGc]
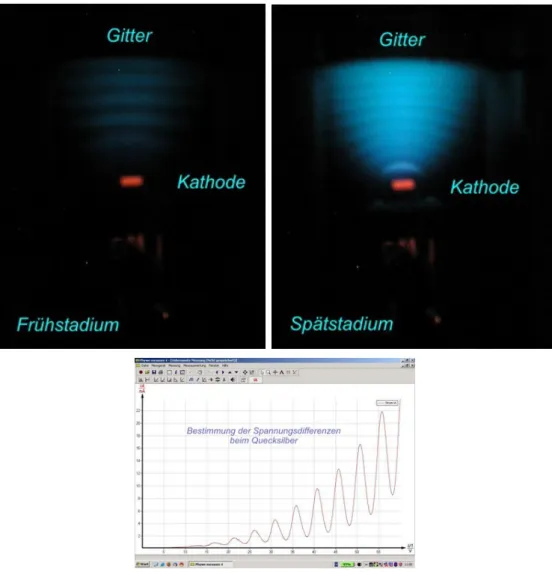
Wird der Versuch durchgef¨uhrt gibt es zun¨achst eine optische Beobachtung: Im Gas
5benannt nach James Franck (1882-1964) und Gustav Hertz (1882-1975)
bilden sich Leuchtende Streifen. Je h¨oher die Beschleunigunsgspannung ist, desto mehr Streifen sehen wir und desto dichter liegen die Streifen an einander. Andererseits er- leben wir auch bei der Strom/Spannungs - Kurve eine ¨Uberraschung. Die Kurve hat regelm¨aßigen Abst¨anden Minima und Maxima. Insbesondere gibt es Abschnitte in de- nen eine Erh¨ohung der Beschleunigungsspannung dazu f¨uhrt, das weniger Elektronen die Bremsspannung ¨uberwinden k¨onnen! Die beiden Beobachtungen sind in Abbildung 5 dargestellt.
Abbildung 5: Oben sieht man die zwischen Kathode und Gitter entstehenden leuch- tenden Streifen im Fr¨uhstadium (niedrige Beschleunigungsspannung U1) und im Sp¨atstadium (großesU1). Darunter ist der Stromverlauf in Abh¨angigkeit der Spannung U1 skizziert. Quelle: [LPGc]
Im quantenmechanischen Weltbild gibt es folgende Erkl¨arung f¨ur die Ph¨anomene: Die Elektronen brauchen eine MindestenergieE, um inelastisch mit den Quecksilberatomen zu stoßen, d.h. die Elektronen des Quecksilberatoms in einen h¨ohren Energiezustand anzuregen, da die einzelnen Energieniveaus diskret verteilt sind. Folglich k¨onnen die Elektronen, falls ihre kinetische Energie geringer als E ist nur elastisch mit den Queck- silberatomen stoßen. Aufgrund der Massenverh¨altnisse (Die Quecksilberatome sind viel schwerer als die Elektronen) k¨onnen die Elektronen bei dieser Art von St¨oßen kaum Energie verlieren. Was passiert ist also folgendes: Elektronen werden bei der Kathode freigesetzt und dann solange beschleunigt, bis sie gen¨ugt Energie haben, um die Queck- silberatome anzuregen. Wenn sie dann die erforderliche Energie haben geben sie sie an die Quecksilber Atome ab. Dort, wo das der Fall ist erscheint ein Leuchtender Streifen, da die angeregten Quecksilberatome die gewonnene Energie nach kurzer Zeit in Form von Licht wieder abgeben. Nachdem die Elektronen ihre kinetische Energie verloren ha- ben, werden sie wieder weiter beschleunigt, bis sie wieder genug Energie haben, um ein Quecksilberatom anzuregen usw. . Damit wird auch der Stromverlauf verst¨andlich.
Wenn die Elektronen beim durchqueren der Gitteranode gerade etwas zu wenig Energie haben, um die Quecksilberatome anzuregen, liegt ein Maximum im Strom vor. Erh¨oht man nun die Beschleunigungsspannung leicht, so geben die Elektronen ihre kinetische Energie kurz vor dem Gitter an das Quecksilber ab. Entsprechend haben sie dann nicht mehr gen¨ugend Energie, um die Bremsspannung zu ¨uberwinden und der Strom wird Verh¨altnism¨aßig klein.
5 Beugung und Streuung - Wellen und Teilchen
Nachdem wir jetzt einige interessante Ph¨anomene besprochen haben, die die Notwendig- keit einer (Anfang der letzten Jahrhunderts) neuen Quantenmechanik zeigen, wird es in diesem Kapitel um etwas grundlegenderes gehen. Wie beschreiben wir einzelne Teilchen in der Quantenmechanik? Um diese Frage zu beantworten verwenden wir zun¨achst die klassischen Bilder von Wellen und Teilchen und stellen fest, dass die beiden Konzepte im Rahmen der Quantenmechanik vermischt werden. Am Ende des Kapitels gebe ich noch einen kurzen Einblick in den Begriff der Wellenfunktion, um zu pr¨azisieren, was mit der Aussage “Wellen- und Teilcheneigenschaften werden vermischt” gemeint ist.
5.1 Compton Effekt - Licht als Teilchen
In den vorherigen Abschnitten haben wir schon von Quantisierung des Strahlungsfeldes gesprochen und Licht als eine Ansammlung von Photonen, welche wir als Teilchen auf- gefasst haben, interpretiert. Diese Teilchen waren bisher nur “Energiepackete” , die als solche von Atomen absorbiert und emittiert werden konnten. Um wirklich berechtigt zu sein von Teilchen zu sprechen, wollen wir den Photonen noch eine weitere Teilcheneigen- schaft zusprechen und zwar einen Impuls. Dass wir Photonen wirklich auf diese Weise
betrachten k¨onnen zeigt sich eindr¨ucklich im Compton Effekt 6.
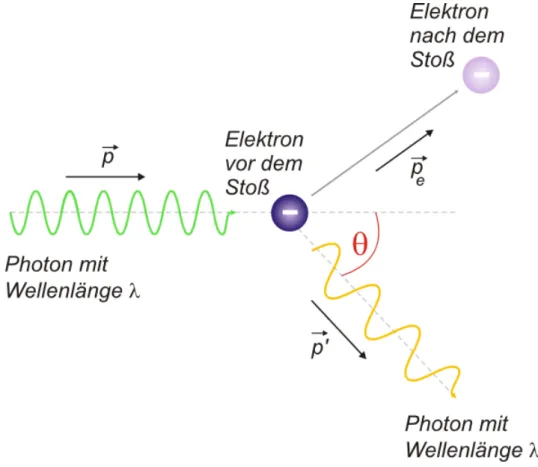
Abbildung 6: Von links fliegt ein Photon auf das ruhende Elektron zu. Es wird dann unter dem Winkelθgestreut. Das Elektron erh¨alt dabei einen Impulspe. Quelle: [LPGa]
Beim Compton Effekt wird ein Photon an einem Elektron gestreut. Das Photon hat eine relativistische Masse von
m= E c2 = hν
c2 = h
cλ (9)
und bewegt sich mit Lichtgeschwindigkeit. Sein Ausgangsimpuls ist als:
p=mc= h
λ (10)
Der Prozess l¨asst sich als relativistischer Stoß zwischen zwei Teilchen modellieren (siehe dazu Abbildung 6). Dabei gibt das Photon einen gewissen Impuls an das Elektron ab und fliegt dann mit einem ver¨anderten Impuls weiter. Dies f¨uhrt unter anderem zu einer
6F¨ur die Entdeckung des Compton Effektes erhielt Arthur Holly Compton 1927 den Physik Nobelpreis.
Anderung der Wellenl¨¨ ange. Nutzt man Impuls und Energieerhaltung ergibt sich f¨ur die Anderung der Wellenl¨¨ ange der Ausdruck
λ0−λ= h
mec(1−cosθ), (11)
wobei me die Elektronenmasse und c die Lichtgeschwindigkeit ist. Eine Herleitung die- ser Formel gibt es im Skript “Relativistische Teilchenphysik”. Wir stellen fest, dass die ¨Anderung der Wellenl¨ange nur von der Streurichtung und nicht etwa von dem ur- spr¨unglichen Wert der Wellenl¨ange abh¨angig ist. Diese Beobachtung l¨asst sich im Wel- lenbild nicht erkl¨aren und liefert damit eine Motivation Photonen als wirkliche Teilchen mit Eigenschaften wie Impuls und relativistischer Masse zu betrachten.
5.2 Heisenbergsche Unsch¨arfe
Der Compton Effekt weißt auf ein grundlegendes Problem bei der Messung von Orten und Impulsen hin. Angenommen wir wollen den Aufenthaltsort eines Elektrons bestim- men. Dazu gibt es verschiedene M¨oglichkeiten. Wir k¨onnten zum Beispiel das Elektron mit einer Art Mikroskop beobachten. Die Genauigkeit mit der wir den Ort feststellen k¨onnen ist dabei durch die Wellenl¨ange des verwendeten Lichtes begrenzt. Prinzipiell k¨onnten wir den Ort des Elektrons beliebig genau bestimmen, sofern wir immer kurz- welligeres Licht verwenden. Bei dem Stoß mit dem Photon wird nun aber Impuls auf das Elektron ¨ubertragen und zwar je mehr, desto k¨urzer die Wellenl¨ange ist. Wir verlieren also Information dar¨uber, was der urspr¨ungliche Impuls des Elektrons gewesen ist. Je genauer wir den Ort bestimmen, desto ungenauer wird unsere Kenntnis des Impuls eines Teilchens. Es stellt sich heraus, dass das Problem hier nicht unsere konkrete Wahl eines Messvorgangs, sondern eine grundlegende Eigenschaft der Natur ist. Die Gleichung
∆x∆p≈h (12)
liefert eine grobe Absch¨atzung der Gr¨oßenordnung der Unsch¨arfe ∆x im Ort bei einer Unsch¨arfe ∆pim Impuls. An dieser Stelle werden oft Pseudoherleitungen und Plausibi- lisierungen angestellt. Darauf m¨ochte ich hier verzichten. Die oben genannte Gleichung liefert in vielen Situationen eine ¨uberraschend gute erste Absch¨atzung des Verhaltens physikalischer Systeme. Wie solche Absch¨atzungen angestellt werden k¨onnen k¨onnt ihr in den ¨Ubungsaufgaben vertiefen.
5.3 de Broglie - Elektronen als Wellen
1929 (also zwei Jahre nach Compton) erhielt Louis de Broglie den Physik Nobelpreis f¨ur seine Dissertation “Recherches sur la th´eorie des quanta”. Ausgehend von der Gleichung f¨ur den Impuls eines Photons
p= h
λ, (13)
die uns beim Compton Effekt begegnet ist, kann man auch Teilchen mit einem Impuls p eine Wellenl¨angeλ- genannt de Broglie Wellenl¨ange - zuordnen:
λ= h
p . (14)
De Broglie stellte fest, dass diese Wellenl¨ange tats¨achlich eine Bedeutung im Bohrschen Atommodell hat. Die urspr¨unglich willk¨urlichen erlaubten Kreisbahnen sind genau die, f¨ur die der Bahnumfang ein vielfaches der de Broglie Wellenl¨ange des Elektrons ist, dass die Kreisbahn durchl¨auft. Die Bedingung an die erlaubten Bahnen l¨asst sich also auch so formulieren: Die erlaubten Bahnen sind genau die, auf denen das Elektron als Materiewelle betrachtet eine stehende Welle ausbildet.
Nachdem man durch de Broglies Arbeit motiviert angefangen hat zu suchen, sind auch schnell Ph¨anomene beobachtet worden, die klar den Wellencharakter von Elektronen zeigen. Im Davison-Germer Experiment werden zum Beispiel Elektronen auf einen Nickel Kristall geschossen. Beobachtet man dann die Verteilung der gestreuten Elektronen, so stellt man fest, dass sich ein Interferenzmuster bildet, welches bei einer Interferenz von Wellen mit der de Broglie Wellenl¨ange der Elektronen zu erwarten w¨are. Bestrahlt man einen Kristall mit Elektronen erh¨alt man also ein ¨ahnliches Ergebnis, wie wenn man ein Gitter mit koh¨arentem Licht bestrahlt.
Man kann praktisch alle Beugungs und Interferenzph¨anomene bei Elektronen beobach- ten, die man auch mit Licht erzeugen k¨onnte (mehr zu den Details von Beugung und Interferenz gibt es in der Wellenoptik). Außerdem stellte sich heraus, dass die Ph¨anomene sich nicht nur auf Elektronen beschr¨anken, sondern auch mit gr¨oßeren Objekten, wie et- wa Neutronen reproduzierbar sind. Heutzutage lassen sich sogar Inteferenzversuche mit großen Molek¨ulen, wie etwa dem C60 Fulleren durchf¨uhren.
5.4 Wellen oder Teilchen? - Die Wellenfunktion
Wie lassen sich die oben diskutierten Wellen- und die Teilcheneigenschaften der Mate- rie miteinander vereinbaren? Die Antwort auf diese Frage ist in der Quantenmechanik die Wellenfunktion7. Die Wellenfunktion eines physikalischen Systems ist eine komplex- wertige Funktion, die in der Quantenmechanik die gesamte Information eines Systems beinhaltet. F¨ur komplizierte Systeme wird die Wellenfunktion dementsprechend auch
7Warnung: Hier holt mich endg¨ultig das XKCD von der Titelseite ein. Ich versuche in diesem Ab- schnitt grob ein erstes Gef¨uhl f¨ur das mathematische Konzept der Wellenfunktion zu vermitteln.
Leider muss ich dabei immer etwas schwammig bleiben, da die genauen mathematischen Grundla- gen (Hilbertr¨aume und Operatoren) einzuf¨uhren hier vollkommen den Rahmen des Skripts sprengen w¨urde.
schnell ein sehr kompliziertes Objekt. Wir betrachten deshalb in diesem Abschnitt ein freies Teilchen, d.h. ein einzelnes Teilchen im leeren Raum. In diesem Fall wird unsere Wellenfunktion eine Abbildung vonR3 nach C, also eine Funktion, die jedem Punkt im Raum eine komplexe Zahl zuordnet, sein. Geben wir der Wellenfunktion den Namenψ.
Die Bedeutung der Wellenfunktion besteht nun darin, dass ihr Betragsquadratψψ∗ (wo- bei ψ∗ das komplex konjugierte ist) die Aufenthaltswahrscheinlichkeit des Elektrons in einem Raumgebiet angibt. Genauer: Sei Ω⊂R3 eine Gebiet im Raum. Die Wahrschein- lichkeit das Teilchen im Gebiet Ω zu finden ist dann gegeben durch:
Z
Ω
ψ(x,y,z)ψ∗(x,y,z)dxdydz (15) Es ist hier anzumerken, dass in der Wellenfunktion wirklich die vollst¨andige Informati- on ¨uber das System steckt. Die Quantenmechanik liefert mathematische Operationen, mit dem aus der Wellenfunktion auch Wahrscheinlichkeitsverteilungen f¨ur den Impuls gewonnen werden k¨onnen. Erst in diesem Formalismus kann man die Heisenbergsche Unsch¨arferelation pr¨azise Formulieren, n¨amlich als Aussage ¨uber die Varianzen dieser Wahrscheinlichkeitsverteilungen.
Wie entsteht nun in den Rechnungen mit diesen Wellenfunktion Wellen und Teilchencha- rakter? Interferenzph¨anomene treten dadurch auf, dass wir manchmal Wellenfunktionen haben, die als Summe von zwei Funktionen geschrieben werden. Bilden wir dann das Betragsquadrat entstehen Interferenzterme:
(ψ1+ψ2)·(ψ1+ψ2)∗ =ψ1ψ∗1+ψ1ψ∗2+ψ2ψ∗1+ψ2ψ2∗. (16) (Die Interferenzterme sindψ1ψ2∗ undψ2ψ1∗). Gleichzeitig gibt es aber auch klare Teilche- neigenschaften. So k¨onnen wir z.B. wie oben ein Gebiet Ω w¨ahlen und den Teilchenort messen. Auch wenn vor der Messung nur eine Wahrscheinlichkeitsverteilung vorliegt, die mir sagt, ob das Teilchen im Gebiet Ω liegt, habe ich nach der Messung wirklich die Ge- wissheit, dass sich das Teilchen entweder im Gebiet Ω aufh¨alt oder nicht. Entsprechendes gilt auch f¨ur eine Impulsmessung. Es gibt also immer noch typische Teilcheneigenschaften wie Ort und Impuls.
6 LASER
Am Ende dieser kleinen Einf¨uhrung in die Grundlagen der Quanten- und Atomphysik bietet es sich an noch eine technische Anwednung der Quantenmechanik zu diskutie- ren, die heute von maßgeblicher Bedeutung in der Industrie und Forschung ist. Der LASER8 ist ein Aufbau zu Gewinnung intensiver monochromatischer (d.h. aus einer einzigen Wellenl¨ange bestehender) koh¨arenter (Zum Begriff der Koh¨arenz schaut euch
8Light amplification by stimulated emission of radiation
doch mal das Skript und den Vortrag zur Wellenoptik an) Strahlung. LASER spielen heutzutage in vielen Bereichen eine zentrale Rolle. Einige besonders coole Anwendun- gen sind zum Beispiel Lunar Laser Ranging - ein Verfahren, bei dem die Entferung von Erde und Mond auf einige Zentimeter genau gemessen werden kann, indem ein Laser- strahl von der Erde auf Reflektoren geschossen wird, die am Mond montiert worden sind, STED Mikroskopie - eine neue (Nobelpreis 2014) Art von Mikroskopie mit der unter- halb von Beugungsgrenzen aufgel¨ost werden kann, was momentan Aufl¨osungen von etwa 50nm erlaubt - und Fotholitographie - ein Verfahren aus der Halbleitertechnik bei dem durch LASER lichtempfindliche Lacke beleuchtet und danach mit ¨Atztechniken bearbei- tet werden. Die Fotholitographie bietet eine M¨oglichkeit zur g¨unstigen Massenfertigung mikroelektronischer Schaltkreise und bildet damit eine der zentralen Grundlagen der modernen Halbleiterindustrie.
6.1 Funktionsprinzip eines LASERs
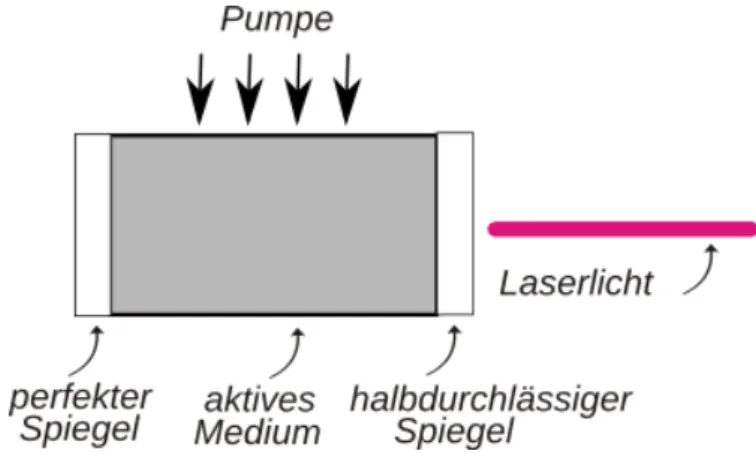
W¨ahrend die technischen Details bei der Konstruktion und Optimierung von LASERn hoch komplex sind, ist das gemeinsame Grundprinzip auf dem alle LASER aufbauen im Grunde sehr simpel. In Abbildung 7 sind die zentralen Bauelemente eines LASERs skizziert.
Abbildung 7: Hier ist eine vereinfachte Skizze der zentralen Bauelemente eines LASERs dargestellt. Quelle: [LPGb]
Im Herzen des LASERs befindet sich das aktive Medium, das kann zum Beispiel ein Gasgemisch, aber auch ein Kristall oder anderer Festk¨orper sein. Entscheidend ist, dass das Material ¨uber verschiedene Energieniveaus verf¨ugt, die angeregt werden k¨onnen.
Diese Anregung erfolgt durch das sogenannte Pumpen. Dem aktiven Medium wird da- bei Energie zum Beispiel durch Bestrahlung mit Licht zugef¨uhrt. In einem vereinfachten Modell besteht das aktive Medium aus Atomen, die in zwei verschiedenen Zust¨anden sein k¨onnen: Dem angeregten und dem unangeregten. W¨ahrend sich die Atome nor-
malerweise ¨uberwiegend im unangeregten Zustand befinden, kann durch das Pumpen eine sogenannte Besetzungsinversion durchgef¨uhrt werden, sodass sich ein die Mehrheit der Atome im angeregten Zustand befindet. Die angeregten Atome k¨onnen nun durch spontane Emission Photonen abgeben. W¨ahrend die meisten Photonen schr¨ag auf die Spiegel fallen und nach ein paar Reflexionen das aktive Medium verlassen und vom Geh¨ause des LASERs absorbiert werden, ist ein kleiner Teil der Photonen genau so aus- gerichtet, dass er immer wieder an den beiden Spiegelfl¨achen reflektiert wird (wobei am halbdurchl¨assigen Spiegel auch Photonen austreten k¨onnen, die dann verloren gehen).
An dieser Stelle setzt das eigentliche Prinzip des LASERs ein: Der senkrecht zu den Spie- gelfl¨achen ausgerichtete Strahl wird verst¨arkt. Dies geschieht durch stimulierte Emission.
Trifft ein Photon auf ein angeregtes Atom, so kann es das Atom dazu bringen in den unangeregten Zustand ¨uberzugehen und dabei ein weiteres Photon abzugeben. Im Ge- gensatz zur den Photonen, die bei der spontanen Emission freigesetzt werden haben diese Photonen aber eine besondere Eigenschaft: Sie sind exakte Kopien 9 der Photonen, die die Emission stimuliert haben. Da die Photonen im senkrecht zu den Spiegeln ausgerich- teten Strahl die Atome immer wieder treffen und stimulierte Emission ausl¨osen k¨onnen, w¨ahrend die anders ausgerichteten Photonen nur einige wenige Emissionen ausl¨osen k¨onnen bevor sie absorbiert werden, bildet sich durch stimulierte Emission nach und nach ein intensiver Strahl senkrecht zu den Spiegelfl¨achen aus.
W¨ahrend ein Teil dieses Strahls immer reflektiert wird, um weiter Emissionen auszul¨osen und das LASER Ph¨anomen aufrecht zu erhalten, tritt bei den Reflexionen am halb- durchl¨assigen Spielgel auch immer ein kleiner Teil des LASER-Lichts aus. Dieser austre- tende Anteil bildet den dann f¨ur die verschiedenen Anwendungen weiter genutzten (oder bei h¨ubschen LASER-Shows in die Luft gesendeten) LASER-Strahl.
Zu den Abst¨anden der Spiegel ist noch ein wichtiges Detail anzumerken. Damit sich eine stehende Welle im Resonator (d.h. zwischen den Spiegeln) ausbilden kann, so wie es im obigen Text beschrieben wird, m¨ussen die beiden Spiegel einen Abstand haben, der ein ganzes Vielfaches der Wellenl¨ange des LASER-Lichts ist.
7 Schlusswort
Falls du am Ende dieses Skriptes das Gef¨uhl habt mehr Fragen zu haben als vorher, dann hast du es genau richtig gelesen. Ich hoffe sehr mit diesem Skript ein wenig Neugier zu sch¨uren und dazu anzuregen sich weiter mit Quanten- und Atomphysik zu besch¨aftigen.
Falls du dabei Fragen hast kannst du diese gerne an meine auf dem Deckblatt dieses Skripts stehende Emailadresse oder ins Orpheus Forum schicken. Außerdem w¨urde ich mich sehr ¨uber Verbesserungsvorschl¨age und Kommentare zu Fehlern und Typos freuen!
9Der Grund daf¨ur ist etwas komplizierter und hat damit zu tun, dass Photonen Bosonen sind.
Bildquellen
[Fra] Frauenhoferlinien. https://de.wikipedia.org/wiki/Fraunhoferlinie#
/media/Datei:Fraunhofer_lines_DE.svg. Stand: 09.09.2020.
[LPGa] lp.uni-g¨ottingen, der compton effekt. :https://lp.uni- goettingen.de/get/text/1557.
[LPGb] lp.uni-g¨ottingen, der helium-neon laser. :https://lp.uni- goettingen.de/get/text/1804. Stand: 12.09.2020.
[LPGc] lp.uni-g¨ottingen, franck-hertz-versuch. ://lp.uni-goettingen.de/get/text/1612.
[Pho] Der photoeffekt. https://qudev.phys.ethz.ch/static/content/science/
BuchPhysikIV/PhysikIVch2.html. Stand: 08.09.2020.
[Spe] Spektrallampen. https://de.wikipedia.org/wiki/Datei:Spektrallampen.
jpg. Stand: 09.09.2020.
Textquellen
[Ein05] Einstein, A.: Uber einen die Erzeugung und Verwandlung des Lichtes be-¨ treffenden heuristischen Gesichtspunkt. In: Annalen der Physik 322 (1905), Nr. 6, 132-148. http://dx.doi.org/10.1002/andp.19053220607. – DOI 10.1002/andp.19053220607