DIPLOMARBEIT
Untersuchungen der molekularen Wechselwirkungen von Pilzen mit Uran und Europium
INVESTIGATION OF THE MOLECULAR INTERACTIONS OF FUNGI WITH URANIUM AND EUROPIUM
Name und Vorname des Verfassers Leander Freitag Geburtsdatum und -ort 16.01.1991 in Filderstadt
Technische Universität Dresden, Fakultät Maschinenwesen, Institut für Naturstofftechnik, Professur für Bioverfahrenstechnik
1. Gutachter/-in: Prof. Thomas Walther 2. Gutachter/-in: Dr. Alix Günther
Termin der Abgabe: Dresden, den 14.06.2019
Fakultät Maschinenwesen Institut für Naturstofftechnik, Professur für Bioverfahrenstechnik
Fakultät Maschinenwesen Institut für Naturstofftechnik Professur für Bioverfahrenstechnik
Aufgabenstellung für die Diplomarbeit Nr. 254
von
Leander Freitag
Studiengang Studienrichtung
Verfahrens- und Naturstofftechnik Bioverfahrenstechnik
Thema: Untersuchungen der molekularen Wechselwirkungen von Pilzen mit Uran und Europium
Radionuklide können durch anthropogene Freisetzung in die Umwelt gelangen. Da Pilze eine wichtige Rolle im Boden spielen, können sie die Migration von Radionukliden in der Umwelt durch ihre metabolischen Aktivitäten entscheidend beeinflussen. Durch verschiedene Prozesse wie beispielsweise Sorption, Mineralisierung oder Anreicherung, kann es zu einer Immobilisierung der Radionuklide kommen. Diese Immobilisierung bietet den Vorteil einer reduzierten Bioverfügbarkeit, die das Eindringen des Radionuklids in den Wasserweg und damit in die Nahrungskette verhindert. Ziel der Arbeit ist es, das Potenzial von Pilzen für Strahlenschutzvorsorgemaßnahmen und Bioremediationsverfahren für kontaminierte Böden zu untersuchen.
Arbeitsschwerpunkte: 1. Kultivierung der Pilze
2. Durchführung von Bindungsversuchen zwischen Pilz und Uran bzw. Europium und Bestimmung der entsprechenden Bindungskapazitäten
3. Charakterisierung der Metallbindung am Pilz mittels zeitaufgelöster laserinduzierter Fluoreszenz-spektroskopie 4. Aufnahme von elektronenmikroskopischen Bildern zur
Lokalisierung der gebundenen Metalle
Betreuer: Dr. Alix Günther ausgehändigt am: 15.01.2019 einzureichen am: 14.06.2019
Es gelten die von der Studienrichtung erlassenen Richtlinien zur Anfertigung von Diplomarbeiten sowie die Diplomprüfungsordnung
Studienrichtungsleiter und betreuender Hochschullehrer Prof. Dr.-Ing. Thomas Walther
Inhaltsverzeichnis
I
INHALTSVERZEICHNIS
Inhaltsverzeichnis ... I Bibliographische Beschreibung und Referat ... IV Abkürzungs- und Symbolverzeichnis ... V Abbildungsverzeichnis ... VI Tabellenverzeichnis ... VIII
1 Einleitung ... 1
2 Problemstellung und Zielsetzung ... 2
3 Grundlagen ... 3
Gefährdungspotential von Radionukliden ... 3
Ausgewählte Elemente ... 5
3.2.1 Uran ... 5
3.2.2 Europium ... 6
Wechselwirkungen mit biologischen Systemen ... 6
Das System Pilz ... 7
Ausgewählte Vertreter der Pilze... 8
3.5.1 Pleurotus ostreatus ... 8
3.5.2 Macrolepiota procera ... 8
4 Material und Methoden ... 9
Mikroorganismen, Chemikalien und Geräte ... 9
Kultivierung ... 10
4.2.1 Medium ... 10
4.2.2 Kultivierung auf festem Nährboden ... 11
4.2.3 Kultivierung in Flüssigkultur ... 11
4.2.4 Kultivierung im Bioreaktor ... 11
Bestimmung der Biotrockenmasse ... 12
Untersuchung der Wechselwirkungen von Pilzen mit den ausgewählten Elementen ... 13
4.4.1 Zusammensetzung der Medien und Lösungen ... 13
Inhaltsverzeichnis
II
4.4.2 Bindungsversuche mit U(VI) und Eu(III) ... 14
Analystische Methoden ... 15
4.5.1 ICP-MS ... 15
4.5.2 Mikroskopische Verfahren ... 15
4.5.3 Zeitaufgelöste laserinduzierte Fluoreszenzspektroskopie (TRLFS) ... 16
5 Ergebnisse ... 18
Vergleich des Wachstumsverhaltens und der Reinheit von Pilzen in Abhängigkeit von der Kultivierung... 18
5.1.1 Kultivierung auf Nährböden ... 18
5.1.2 Kultivierung im Schüttelkolben ... 20
5.1.3 Kultivierung im 5 l-Bioreaktor ... 22
Wechselwirkungen der Pilze mit U(VI) und Eu(III) ... 24
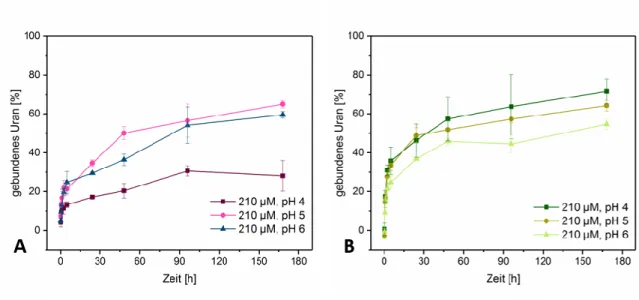
5.2.1 Wechselwirkung der Pilze mit Uran in Abhängigkeit des pH-Wertes ... 25
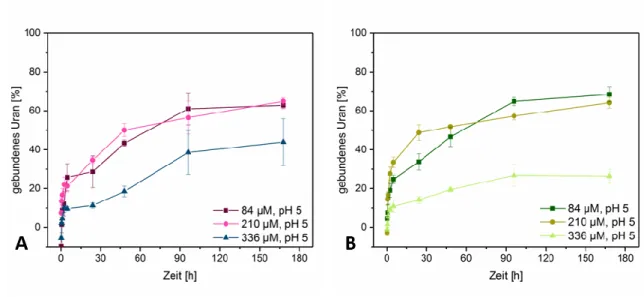
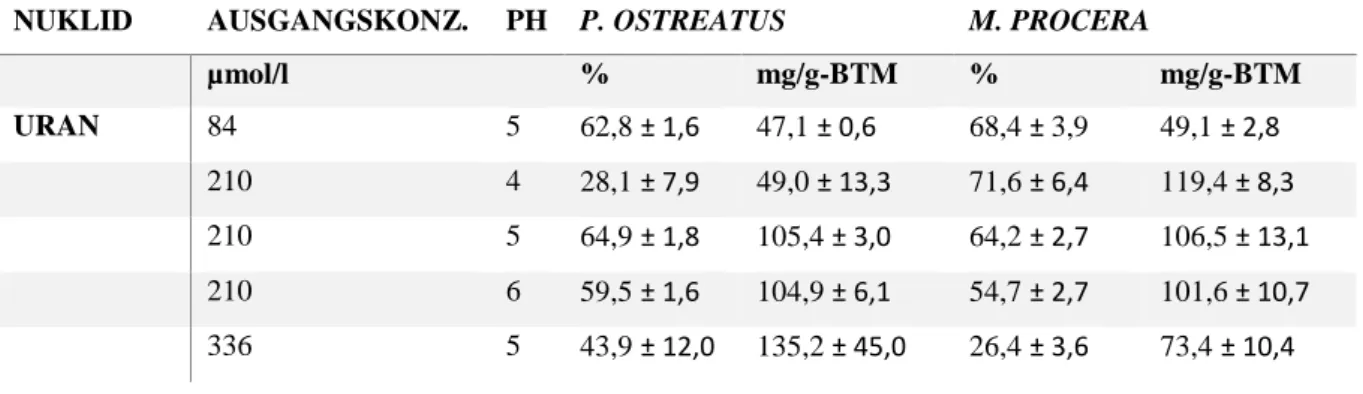
5.2.2 Wechselwirkung der Pilze mit Uran in Abhängigkeit der Ausgangskonzentration von U(VI) ... 26
5.2.3 Wechselwirkung der Pilze mit Europium in Abhängigkeit des pH-Wertes ... 27
5.2.4 Wechselwirkung der Pilze mit Europium in Abhängigkeit der Ausgangskonzentration von Eu(III) ... 28
Lokalisierung von U(VI) und Eu(III) in den kontaminierten Pilzen mittels Transmissionselektronenmikroskopie (TEM) und Röntgenmikroanalyse (EDX) ... 30
Bestimmung der U(VI)-Speziation durch zeitaufgelöste laserinduzierte Fluoreszenzspektroskopie (TRLFS) ... 34
5.4.1 U(VI)-Speziation im Mineralmedium vor den Bindungsversuchen... 34
5.4.2 U(VI)-Speziation im Mineralmedium und am Pilz nach den Bindungsversuchen ... 35
Bestimmung der Eu(III)-Speziation durch zeitaufgelöste laserinduzierte Fluoreszenzspektroskopie (TRLFS) ... 40
5.5.1 Eu(III)-Speziation im Mineralmedium vor den Bindungsversuchen ... 40
5.5.2 Eu(III)-Speziation im Mineralmedium und am Pilz nach den Bindungsversuchen ... 40
6 Diskussion ... 44
Vergleich der Kultivierungsarten von Pilzen ... 44
Inhaltsverzeichnis
III
Vergleich der Wechselwirkungen von Pilzen mit U(VI) und Eu(III) ... 45
Bedeutung der Ergebnisse im Kontext der Strahlenschutzvorsorge und biologischen Sanierungsverfahren ... 48
7 Zusammenfassung und Ausblick... 50
8 Literaturverzeichnis ... 52
Anhang ... 1
Selbständigkeitserklärung ... 1
Thesen ... 2
Danksagung ... 3
Bibliographische Beschreibung und Referat
IV
BIBLIOGRAPHISCHE BESCHREIBUNG UND REFERAT
UNTERSUCHUNGEN DER MOLEKULAREN WECHSELWIRKUNGEN VON PILZEN MIT URAN UND EUROPIUM
Freitag, Leander - Dresden: Technische Universität Dresden, Fakultät Maschinenwesen, Institut für Naturstofftechnik, Professur für Bioverfahrenstechnik, Diplomarbeit Nr. 254, Jahr 2019, 70 S., 31 Abb., 10 Tab.
Die vorliegende Arbeit dient der Untersuchung des Potentials von Pilzen für den Einsatz in Strahlenschutzvorsorgemaßnahmen und biologischen Sanierungsverfahren. Mit Hilfe der ausgewählten Vertreter Pleurotus ostreatus und Macrolepiota procera soll die Wechselwirkung mit U(VI) und Eu(III), als Analogon für dreiwertige Actinide, untersucht und hinsichtlich der Art und des Ortes der Metallanbindung charakterisiert werden.
Die Kultivierung der Pilze erfolgte sowohl auf Nährboden als auch im Schüttelkolben und im Bioreaktor. Es wurden Bindungsversuche mit U(VI) und Eu(III) in Abhängigkeit des pH-Wertes und der Ausgangskonzentration des Metalls durchgeführt und mittels ICP-MS analysiert. Die Metallspeziation wurde mit Hilfe von TRLFS untersucht und die Daten durch parallele Faktoranalyse (PARAFAC) ausgewertet. Zur Lokalisierung der Metalle wurden TEM-Aufnahmen angefertigt und mit energiedispersiver Röntgenspektroskopie analysiert.
Die Ergebnisse zeigen eine erfolgreiche Kultivierung in festem und flüssigem Nährmedium. U(VI) wird in die Zellen aufgenommen und mineralisiert, verbunden mit einer Speziationsänderung in der Biomasse und im Überstand. Eu(III) wird von P. ostreatus sorbiert und von M. procera in die Zelle aufgenommen und akkumuliert.
Die Produktion großer Mengen an Biomasse für biologische Sanierungen ist in Bioreaktoren möglich.
Die Pilze sind in der Lage, Radionuklide zu assoziieren und haben das Potential, diese langfristig zu immobilisieren.
Abkürzungs- und Symbolverzeichnis
V
ABKÜRZUNGS- UND SYMBOLVERZEICHNIS
Symbol Bezeichnung Einheit
Ac(III) Dreiwertige Actinide
BFM Biofeuchtmasse g
BM Biomasse(-konzentration) g/l
BTM Biotrockenmasse g
BV Bindungsversuch
c Gleichgewichtskonzentration des Metalls in der Lösung mg/l
c0 Anfangskonzentration des Metalls in der Lösung mg/l
cw Konzentration des Metalls an der Röhrchenwand mg/l
DI Deionisiertes Wasser DNS/DNA Desoxyribonukleinsäure
DSMZ Deutsche Sammlung von Mikroorganismen und Zellkulturen EDX Electron Density X-Ray (Röntgenmikroanalyse)
Eu(III) Europium (Oxidationsstufe +3)
HAADF High-Angle Annular Dark Field (ringförmiges Dunkelfeld) ICP-MS Massenspektrometrie mit induktiv gekoppeltem Plasma Ln(III) Dreiwertige Lanthanoide
MM Mineralmedium
M.p. Macrolepiota procera PARAFAC Parallele Faktoranalyse P.o. Pleurotus ostreatus
q Menge an gebundenem Metall mg/g BTM
REM Rasterelektronenmikroskop
RN Radionuklid
rpm Umdrehungen pro Minute min-1
RT Raumtemperatur °C
TEM Transmissionselektronenmikroskopie
TRLFS Zeitaufgelöste laserinduzierte Fluoreszenzspektroskopie U(VI) Uran (Oxidationsstufe +6)
V Volumen der Lösung l
τ Lebenszeit des Fluoreszenzzerfalls µs
Abbildungsverzeichnis
VI
ABBILDUNGSVERZEICHNIS
Abbildung 1: Bildung von farbigen Tröpfchen an den Hyphen bei P. ostreatus nach 11 Tagen
Kultivierung auf M90-Agar-Nährmedium. ... 19 Abbildung 2: Ausbildung von Hemmhöfen bei M. procera nach 10 Tagen Kultivierung auf M90- Agar-Nährmedium. ... 19 Abbildung 3: Fluoreszenzmikroskopische Aufnahme von P. ostreatus nach Kultivierung auf M90- Nährboden mit Objektträger. ... 20 Abbildung 4: Fluoreszenzmikroskopische Aufnahme von M. procera nach Kultivierung auf M90- Nährboden mit Objektträger. ... 20 Abbildung 5: Ausbildung von fadenförmigen Auswüchsen bei Flüssigkultur im Schüttelkolben von P. ostreatus. ... 21 Abbildung 6: Ausbildung von stachelartigen Auswüchsen bei Flüssigkultur im Schüttelkolben von M. procera. ... 21 Abbildung 7: Mikroskopische Aufnahme von P. ostreatus in Flüssigkultur ... 21 Abbildung 8: Mikroskopische Aufnahme von M. procera in Flüssigkultur mit Ausstülpungen an einzelnen Hyphenenden (rot markiert). ... 22 Abbildung 9: Mikroskopische Untersuchung von M. procera nach Eintrübung im Bioreaktor. ... 23 Abbildung 10: Mikroskopische Untersuchung (A) der kontaminierten Reaktorkultivierung (B) von P. ostreatus. ... 23 Abbildung 11: Graphische Darstellung der Abhängigkeit zwischen Biotrocken- und Biofeuchtmasse für M. procera und P. ostreatus. ... 24 Abbildung 12: Graphische Darstellung des U(VI)-Assoziationsvermögens von A) P. ostreatus und B) M. procera bei 210 µmol/l U(VI) in Abhängigkeit des pH-Wertes. ... 25 Abbildung 13: Graphische Darstellung des U(VI)-Assoziationsvermögens von A) P. ostreatus und B) M. procera bei pH 5 in Abhängigkeit der Metall-Ausgangskonzentration. ... 26 Abbildung: 14 Graphische Darstellung des Eu(III)-Assoziationsvermögens von A) P. ostreatus und B) M. procera bei 210 µmol/l Eu(III) in Abhängigkeit des pH-Wertes. ... 28 Abbildung 15: Graphische Darstellung des Eu(III)-Assoziationsvermögens von A) P. ostreatus und B) M. procera bei pH 5 in Abhängigkeit der Metall-Ausgangskonzentration und der Inkubationszeit.
... 29 Abbildung 16: (li.) TEM-Aufnahme von P. ostreatus mit Uran kontaminiert. (re.)
Dunkelfeldaufnahme (HAADF) und Röntgenmikroanalyse der Elemente Uran, Phosphor und
Sauerstoff. ... 31 Abbildung 17: (li.) TEM-Aufnahme von P. ostreatus mit Europium kontaminiert. (re.)
Dunkelfeldaufnahme (HAADF) und Röntgenmikroanalyse der Elemente Europium, Phosphor und Sauerstoff. ... 32
Abbildungsverzeichnis
VII Abbildung: 18: (li.) TEM-Aufnahme von M. procera mit Uran kontaminiert. (re.)
Dunkelfeldaufnahme (HAADF) und Röntgenmikroanalyse der Elemente Uran, Phosphor und
Sauerstoff. ... 33 Abbildung: 19 (li.) TEM-Aufnahme von M. procera mit Europium kontaminiert. (re.)
Dunkelfeldaufnahme (HAADF) und Röntgenmikroanalyse der Elemente Europium, Phosphor und Schwefel. ... 33 Abbildung 20: Theoretische U(VI)-Speziesverteilung im Mineralmedium mit 210 µmol/l U(VI) im pH-Bereich 4-6 ... 34 Abbildung 21: U(VI)-Lumineszenzspektrum (A) und Lumineszenzzerfallskurve des Mineralmediums mit 210 µmol(U(VI))/l und pH 5. Emissionsbanden bei 490,6 nm, 508,2 nm, 528,5 nm, 550,3 nm und 578,3 nm. ... 35 Abbildung 22 Darstellung eines zeitaufgelösten U(VI)-Lumineszenzspektrums am Beispiel der
Biomasse von P. ostreatus nach 48 h Kontaktzeit mit uranhaltigem Mineralmedium. ... 36 Abbildung 23: Änderung des U(VI)-Lumineszenzspektrums von P. ostreatus in der Biomasse (A) mit den Emissionsbanden 497,4 nm, 518,7 nm, 542,0 nm und im Überstand (B) mit den Emissionsbanden 492,5 nm, 512,8 nm, 536,3 nm... 37 Abbildung 24: Ausgabematrizen der parallelen Faktoranalyse der Spektren der Überstände von
P. ostreatus. A) Lumineszenzlebensdaueranalyse mit monoexponentiellem Fit für jede einzelne Spezies, B) Speziesverteilung in Abhängigkeit von der Inkubationszeit, C) mathematisch extrahierte Spektren der Einzelspezies. ... 38 Abbildung 25: Ausgabematrizen der parallelen Faktoranalyse der Biomasse von P. ostreatus.
A) Lumineszenzlebensdaueranalyse, B) U(VI)-Speziesverteilung nach 5 h bis 7 Tagen
Inkubationszeit, C) mathematisch extrahierte Spektren der Einzelspezies. ... 39 Abbildung 26: Theoretische Eu(III)-Speziesverteilung im Mineralmedium mit 210 µmol/l Eu(III) im pH-Bereich von 4-6. ... 40 Abbildung 27: Eu(III)-Lumineszenzspektren des Mineralmediums (MM) und der Überstände von P. ostreatus in Abhängigkeit von der Inkubationszeit bei einer Anregungswellenlänge von 394 nm und 298 K. ... 41 Abbildung 28: Eu(III)-Anregungsspektren nach 48 h Inkubationszeit von A) P. ostreatus und
B) M. procera bei 8 K. ... 42 Abbildung 29: Lumineszenzzerfall der Europium-Spezies in der Biomasse von A) P. ostreatus und B) M. procera. ... 43 Abbildung 30: Darstellung der Eu(III)-Emissionsspektren von P. ostreatus (PO) und M. procera (MP) bei einer Anregungswellenlänge von 579,43 nm und 8 K. ... 43 Abbildung 31: Vergleich der Uranspezies 1 und 2 in der Biomasse von P. ostreatus mit
Referenzproben nach TRLFS ... 47
Tabellenverzeichnis
VIII
TABELLENVERZEICHNIS
Tabelle 1: Mikroorganismen ... 9 Tabelle 2: Chemikalien ... 9 Tabelle 3: Geräte ... 10 Tabelle 4: M90. Zusammensetzung des Komplexmediums für Festa- und Flüssigkultivierung. Ansatz mit vollentsalztem Wasser (VE) und pH 5,6. ... 11 Tabelle 5 Stammlösungen. ... 13 Tabelle 6 Zusammensetzung des Minimalmediums mit Uran beziehungsweise Europium. ... 14 Tabelle 7: Mathematische Gleichungen der Abhängigkeit zwischen Biotrocken- und Biofeuchtmasse von P. ostreatus und M. procera. ... 24 Tabelle 8: Assoziationsvermögen von U(VI) nach 7 Tagen Kontaktzeit mit den jeweiligen Metall- Ausgangskonzentrationen und pH-Werten. ... 27 Tabelle 9: Assoziationsvermögen von Eu(III) nach 7 Tagen Kontaktzeit mit den jeweiligen Metall- Ausgangskonzentrationen und pH-Werten. ... 29 Tabelle 10: Lumineszenzlebenszeiten der Eu(III)-Spezies in den Überständen von P. ostreatus und M. procera bei einer Anregungswellenlänge von 394 nm. ... 42
Einleitung
1
1 EINLEITUNG
In der Umwelt kommen Radionuklide weitestgehend in sehr geringen Konzentrationen vor. Durch anthropogene Einflüsse, wie Störfälle in Kernkraftwerken (Tschernobyl, Fukushima), Einsatz von Atomwaffen sowie durch Uranbergbau, können lokal hohe Konzentrationen von Radionukliden in die Umwelt gelangen. Kommt es zu einer Freisetzung von Radionukliden und damit zu einer Kontamination des Erdbodens, besteht weiterhin die Gefahr einer Auswaschung der Radionuklide in tiefere Erdschichten, bis hin zum Grundwasser, wodurch es in letzter Konsequenz zu einem Eintrag in die Pflanzen und somit in die Nahrungskette von Tier und Mensch kommen kann.
Insbesondere Pilze spielen mit ihrem hohen Massegehalt im Boden und ihrer metabolischen Aktivität eine wichtige Rolle in der Bodenmikrobiologie und beeinflussen damit in besonderem Maße das Verhalten von Radionukliden in der Umwelt. Die bekanntermaßen sehr effiziente Akkumulation von Schwermetallen durch Pilze kann man sich auch im Rahmen einer Strahlenschutzvorsorge und eines biologischen Sanierungsverfahrens zu Nutze machen. Durch das weit verzweigte und verbreitete Myzelgeflecht von Pilzen ist es möglich, Radionuklide beispielsweise durch Sorption, Mineralisierung und auch intrazelluläre Akkumulation zu binden und somit effizient zu immobilisieren. Um technische Verfahren zur biologischen Sanierung von kontaminierten Böden zu entwickeln, ist es erforderlich, die Wechselwirkungsmechanismen und das Potential verschiedener Pilzgruppen, Radionuklide aufzunehmen, zu untersuchen und zu verstehen. Ausgehend von der makroskopischen Betrachtung der Pilze und ihres Myzels, über die quantitative Bestimmung des Assoziationsvermögens, bis hin zur molekularen Untersuchung der Wechselwirkung, soll eine Charakterisierung ausgewählter Organismen stattfinden.
Problemstellung und Zielsetzung
2
2 PROBLEMSTELLUNG UND ZIELSETZUNG
Die durch anthropogene Einflüsse verursachte Ausbringung radioaktiven Materials in die Umwelt stellt die Menschheit vor große Herausforderungen. Neben physikalischen, mechanischen und chemischen Verfahren bietet die biologische Sanierung eine Möglichkeit, die Migration von Radionukliden im Erdreich mit Hilfe lebender Organismen zu verlangsamen oder gar zu verhindern.
Zur Untersuchung der Eignung myzelbildender Pilze zur effizienten Immobilisierung von Radionukliden sollen in der vorliegenden Arbeit die Pilze Pleurotus ostreatus und Macrolepiota procera sowohl auf festen Nährböden als auch in flüssigem Medium im Schüttelkolben und Bioreaktor kultiviert und charakterisiert werden. Durch Bindungsversuche mit den Pilzen soll die Menge an pilzassoziiertem Uran oder Europium in Abhängigkeit der Metallkonzentration, des pH-Wertes und der Kontaktdauer ermittelt werden. Durch die Anfertigung von transmissionselektronenmikroskopischen Aufnahmen und anschließender Röntgenmikroanalyse sollen die Metalle innerhalb der Zelle lokalisiert und mögliche Bindungsorte ermittelt werden. Mit Hilfe der zeitaufgelösten laserinduzierten Fluoreszenzspektroskopie soll die U(VI)-Speziation im verwendeten Mineralmedium und die Veränderung dieser unter Einfluss der Pilze untersucht werden. Die Speziationsanalyse für Eu(III) erfolgt mittels laserinduzierter Fluoreszenzspektroskopie mit selektiver Anregung.
Grundlagen
3
3 GRUNDLAGEN
GEFÄHRDUNGSPOTENTIAL VON RADIONUKLIDEN
Bei Radionukliden handelt es sich um instabile Nuklide, beziehungsweise Isotope einzelner Elemente, welche unter Aussendung ionisierender Strahlung zerfallen. Hinsichtlich ihrer Entstehung werden Radionuklide in die Kategorien primordial, kosmogen, radiogen und künstlich unterteilt. Dabei entstanden primordiale Radionuklide während der stellaren Nukleosynthese und weisen sehr lange Halbwertszeiten auf, wie beispielsweise das mineralische Nuklid 235Uran mit 703 Millionen Jahren. Die kosmogenen Radionuklide entstehen durch die Wechselwirkung hochenergetischer kosmischer Strahlung mit der Erdatmosphäre. Ein bekannter Vertreter ist das radioaktive Kohlenstoffisotop 14C, mit einer Halbwertszeit von ca. 5730 Jahren, welches in der Radiokohlenstoffmethode zur Altersbestimmung, beispielsweise von Fossilen eingesetzt wird. Durch den Zerfall der primordialen Radionuklide kommt es zur Bildung der radiogenen Nuklide, wie beispielsweise 234Uran. Bei den künstlichen Radionukliden handelt es sich um Spalt- und Zerfallsprodukte durch menschlich herbeigeführte Kernreaktionen. Bekannte Vertreter sind die als Spaltprodukt in Kernreaktoren entstehenden Radionuklide Strontium-90 und Cäsium-137 [1–3] mit Halbwertszeiten von nur 28,78 (90Sr) oder 30,17 Jahren (137Cs).
Eine weitere Unterscheidung ist durch die jeweilige Strahlungsart gegeben. So emittieren α-Strahler Heliumkerne mit sehr hohen Energiedichten, diese jedoch nur über kurze Distanz. Eine Abschirmung des radioaktiven Materials ist somit leicht zu realisieren. Jedoch können Teilchen dieser Strahlungsart besonders gut mit biologischen Materialien in Wechselwirkung treten. Bei Inkorporation schädigt die freiwerdende Energie durch Ionisation oder Radiolyse Organe, Gewebe, Zellen und Zellbestandteile.
Innerhalb der DNA kann es zu Doppelstrangbrüchen und zum Verlust einzelner Basen kommen, sowie zur Zerstörung von Wasserstoffbrückenbindungen. Die Funktion der DNA wird somit beeinträchtigt.
Bei der β-Strahlung und den als β-Strahlern bezeichneten Radionukliden kommt es in Folge des Zerfalls zur Aussendung hochenergetischer Teilchenstrahlung, welche bei der Wechselwirkung mit Materialien einen Energieübertrag und eine Ionisation oberflächennaher Schichten erzeugt. Trifft die β-Strahlung auf biologische Materialien, wie beispielsweise menschliche Haut, so kann es zur Schädigung der oberen Hautschichten, in Form von Verbrennungen kommen. Bei der Inkorporation von β-Strahlern kann es zur lokalen Strahlenbelastung des umliegenden Gewebes kommen, in Abhängigkeit von der Akkumulation im Körper. Die Abschirmung lässt sich bereits mit wenige Millimeter dicken Absorbermaterialien, wie Plexiglas oder Aluminium realisieren, wobei zu beachten ist, dass ein Teil der β-Teilchen als Röntgen-Bremsstrahlung umgewandelt wird. Das Abschirmmaterial sollte somit um einen zweiten Absorber aus Schwermetall ergänzt werden.
Grundlagen
4 Die γ-Strahlung bildet die dritte Gruppe der Strahlungsarten. Hierbei handelt es sich im Gegensatz zu α- und β-Strahlung nicht um geladene Teilchen, sondern um elektromagnetische Strahlung. Diese tritt dadurch weniger mit Materialien in Wechselwirkung und besitzt somit ein hohes Durchdringungsvermögen. Die Abschirmung von γ-Strahlung erfordert somit einen deutlich höheren Materialaufwand im Vergleich zu Teilchenstrahlung. Die Intensität nimmt mit der Eindringtiefe exponentiell ab, weshalb das besonders dichte Element Blei zu Strahlenschutzzwecken eingesetzt wird.
Bei Kontakt mit biologischen Materialien kommt es zur Ionisation des Gewebes und zu Entstehung von Sekundärstrahlung, wodurch chemische Bindungen aufgebrochen werden können und es in der Folge zu somatischen und erbgutverändernden Schäden kommen kann [4–6].
Die Gefährdung durch Radionuklide hängt von der Mobilität, dem Transport und der Bioverfügbarkeit des Nuklids in der Umwelt ab. Werden Radionuklide beispielsweise durch Komplexbildung mit Bioliganden oder als Analoga zu Elementen wie Calcium in biologische Organismen aufgenommen, können sie sich innerhalb der Zellen anreichern. Neben der direkten Schädigung des Organismus kann es auch durch eine Verbreitung der Radionuklidbelastung durch die Nahrungskette zu einer Anreicherung und Schädigung in Organismen, wie dem Menschen oder Tieren kommen, welche ursprünglich keinen Kontakt zum Kontaminationsherd hatten. Neben der radiotoxischen Wirkung von Nukliden kann es zusätzlich auch zu chemotoxischen Schäden kommen [7, 8]. So schädigen beispielsweise besonders wasserlösliche Verbindungen des Urans die Tubuli der Nieren analog zu Schwermetallen, wie Blei, Cadmium und Quecksilber [9, 10].
Die Einflussfaktoren zur Mobilität, dem Transport und der Bioverfügbarkeit werden maßgeblich durch die Speziation, die Oxidationsstufe und den Bindungszustand der Ionen bestimmt. Die Speziation beschreibt hierbei die unterschiedlichen Bindungsformen des Metalls, im Hinblick auf den Oxidationszustand, die komplexe und molekulare Struktur, sowie die direkte chemische Umgebung. So variieren beispielsweise die Uran-Spezies je nach pH-Wert, Ionenkonzentration, Zusammensetzung der Lösung und Oxidationsstufe. Uran verfügt über die Oxidationsstufen +II bis +VI, wobei die stabilsten Stufen unter Umweltbedingungen +IV und +VI sind. Bei einem pH-Wert >2 liegt U(IV) hauptsächlich als Präzipitat vor und ist somit weitestgehend immobil. U(VI) ist hingegen gut löslich und somit relevant für die Verteilung in Gewässern und die Aufnahme in Organismen. Im sauren Milieu und unter oxidierenden Bedingungen dominiert in wässriger Lösung das freie Uranylkation (UO22+). Bei steigendem pH-Wert werden zunehmend Uranylhydroxide, -cabonate oder -phosphate gebildet. Neben anorganischen Komplexen sind auch Verbindungen mit organischen Liganden möglich [11, 12].
Grundlagen
5
AUSGEWÄHLTE ELEMENTE 3.2.1 Uran
Uran wurde erstmals 1789 von dem Chemiker Martin Heinrich Klaproth aus dem Mineral Pechblende isoliert [13]. Es stellte sich heraus, dass es sich bei dem entdeckten Element um ein Uranoxid handelte und reines Uranmetall erst etwa 50 Jahre später, 1841, durch Eugène Peligot gewonnen wurde [14]. Im Jahr 1896 stellte Antoine Henri Bequerel die Radioaktivität von Uran fest [15].
Natürliches Uran ist ein α-Strahler und gehört zur Gruppe der Actinide mit einer relativen Atommasse von 238,03 g/mol. Es kommt mit einem Krustenwert von 2,8 ppm in Böden, Gewässern und Steinen vor [16]. In den Geosphären kommt es nicht in gediegener Form vor, jedoch in Mineralen gebunden.
Die wichtigsten uranhaltigen Minerale sind Uraninit (UO2), Brannerit (UTi2O6), Tobernit (Cu[UO2|PO4]2*10-12 H2O) und Carnotit (K2[UO2|VO4]2*3H2O) [17].
Das natürliche Uran setzt sich aus den Isotopen 238U (99,27%), 235U (0,72%), 234U (0,0055%) und 236U (in Spuren) zusammen. 238U, mit einer Halbwertszeit von 4,468 Milliarden Jahren, gilt als das Mutternuklid der Uran-Radium-Reihe, woraus das Tochternuklid 234U hervorgeht. 235U hingegen ist das Mutternuklid der Uran-Actinium-Reihe und weist eine Halbwertszeit von 703,8 Millionen Jahren auf [18].
Während im 19. Jahrhundert Uran hauptsächlich zum Färben von Glas und Keramik eingesetzt wurde, änderte sich die Verwendung nach Entdeckung der Spaltbarkeit von 235U hin zum kerntechnischen Einsatz. Die heutige Verwendung von Uran lässt sich in die drei Hauptbereiche (1.) zivile Energiegewinnung, (2.) militärische Anwendung und (3.) Forschung einteilen. Im Zuge der Gewinnung von Uranerzen in Bergwerken kann es zu starken Radionuklidbelastungen in den Abraumhalden [19], wie auch zu einer Verschleppung durch die Luft mittels radioaktiv kontaminierter Stäube kommen [20, 21]. Bei der Energiegewinnung durch Kernspaltung entstehen sogenannte Transurane und Zerfallsprodukte, welche neben den verbrauchten Kernbrennmaterialien gelagert werden müssen. Ein weiteres Szenario für den anthropogenen Austrag von Uran und anderer Radionuklide bilden Reaktorkatastrophen, wie 1986 in Tschernobyl oder 2011 in Fukushima, und militärische Anwendungen, wie Atombombenabwürfe und -tests, sowie der Einsatz von Uranmunition in panzerbrechenden Geschossen [22]. Somit kommt Uran und seinen Zerfallsprodukten eine tragende Rolle im Umweltschutz und in der Sanierung kontaminierter Böden zu und wurde in der vorliegenden Arbeit als Vertreter der Radionuklide verwendet.
Grundlagen
6
3.2.2 Europium
Europium konnte 1896 von Eugène-Anatol Demarcay das erste Mal spektroskopisch nachgewiesen und anschließend isoliert werden [23]. Es gehört zur Gruppe der Lanthanoide und ist mit einer relativen Atommasse von 151,964 g/mol ein silberglänzendes Schwermetall.
Im Gegensatz zum oben erwähnten Uran ist Europium selbst nicht radioaktiv, allerdings besitzt das dreiwertige Eu(III) chemische Ähnlichkeiten zu dreiwertigen Actiniden, welche in der Ac(III)-Ln(III)- Analogie genutzt werden, um Aussagen über Radionuklide, wie beispielsweise Americium, treffen zu können [24]. Auf Grund der hohen Sicherheitsanforderungen im Umgang mit radioaktiven Stoffen, erleichtert Eu(III) mit der entfallenen Radioaktivität die Durchführung von Experimenten beispielsweise zur Aufnahme von dreiwertigen Actiniden in biologische Systeme. Zudem weist Eu(III) mit einem Ionenradius von 1,12 Å starke Ähnlichkeit zu Ca(II) (1,14 Å) auf, wodurch es bei biologischen Zellen zum Ionenaustausch und somit einer Erhöhung des Gefahrenpotentials kommen kann [25].
WECHSELWIRKUNGEN MIT BIOLOGISCHEN SYSTEMEN
Ein großes Gefahrenpotential für Mensch und Natur ergibt sich aus der Wechselwirkung von Radionukliden mit biologischen Systemen. Hierzu gehören neben der direkten Exposition gegenüber radioaktivem Material und ionisierender Strahlung auch die Aufnahme von Radionukliden über die Nahrungskette und das Grundwasser. Während die Auswirkungen von kontaminierten Stäuben und radioaktivem Niederschlag meist zeitlich begrenzt sind, kommt den Wechselwirkungen von Radionukliden mit biologischen Systemen in Böden und Gewässern eine größere Bedeutung zu, da in diesen Umgebungen Radionuklide über lange Zeiträume hinweg stabil vorliegen und gegebenenfalls auch angereichert werden können [26, 27].
Bei den Wechselwirkungen im Hinblick auf (Im)mobilisierung und Aufnahme von Radionukliden durch Mikroorganismen verhalten sich diese analog zu anderen Metallen [28, 29]. Hierbei kann die Art der Wechselwirkung in die Kategorien Biosorption, -akkumulation, -präzipitation, -mineralisation, sowie - transformation und -chelatisierung unterteilt werden und um die Lokalisation des Nuklids (extrazellulär, intrazellulär, an der Zelloberfläche) erweitert werden.
Durch Biosorption können sich positiv geladene Metall-Ionen an negativ geladene Gruppen an der Oberfläche von Mikroorganismen anlagern. Daneben ist bei intakten Zellen auch ein aktiver Transport in die Zelle möglich, wo es zu einer Anreicherung, der Bioakkumulation, in Vakuolen, an Membranen und weiterer Zellbestandteile kommen kann [28, 30–32]. Der Transport kann jedoch auch passiv durch Diffusion über Konzentrationsgradienten stattfinden [33, 34]. Extrazellulär können Metalle oder Radionuklide über ausgeschleuste Verbindungen sorbiert und komplexiert werden [35]. Zur Bildung unlöslicher Verbindungen mit anorganischen Liganden kommt es bei der Biopräzipitation (amorphe Strukturen) und Biomineralisation (kristalline Strukturen). Dies kann unabhängig vom
Grundlagen
7 Zellmetabolismus innerhalb oder außerhalb der Zelle, sowie an der Zelloberfläche stattfinden. Unter Nährstoffmangel und anderweitigem Zellstress können Mikroorganismen Siderophore, organische Säuren und Protein enzymatisch bilden, welche im Falle einer Ausschleusung zu einer Biochelatisierung in der näheren Zellumgebung führen können. Die Mobilität und Löslichkeit von Radionukliden und Metallen wird außerdem maßgeblich durch die Biotransformation beeinflusst. Hierbei kommt es zu einer Änderung der Oxidationsstufe und somit zu einer veränderten Metallspeziation. Zusätzlich kann es zu einer Änderung des pH-Wertes und des elektrochemischen Potentials der Umgebung kommen, wodurch auch die Bioverfügbarkeit der Radionuklide sowohl erhöht als auch verringert werden kann [36, 37].
DAS SYSTEM PILZ
Pilze sind eukaryontische Mikroorganismen, welche in Abhängigkeit von klimatischen Einflüssen und der Bodenbeschaffenheit in weitestgehend allen Naturräumen, in Anwesenheit von Sauerstoff vorkommen [38]. Mit ihren langen Pilzfäden, den Hyphen, bilden sie ein weitverzweigtes Pilzgeflecht im Boden, das Myzel. Eine Einteilung erfolgt anhand ihrer Ernährungsweise im Boden. So ernähren sich saprophytische Pilze hauptsächlich von toter organischer Materie und zersetzen dabei Proteine, Kohlenhydrate und Lignin, wodurch sie maßgeblich zur Bildung von Dauerhumusschichten im Waldboden beitragen. Die Mykorrhiza bilden hingegen Symbiosen mit Pflanzen. Mit ihrem Myzel umschließen sie die Wurzeln von Bäumen und versorgen diese mit Wasser und Nährstoffen, wie Phosphor. Im Gegenzug erhalten diese Pilze kohlenhydrathaltige Lösungen von den Pflanzen. Die dritte Gruppe bilden die pathogenen, beziehungsweise parasitären Pilze. Sie können Pflanzen stark schwächen und beim Befall der Wurzeln diese auch zum Absterben bringen [39, 40].
Neben dem weitverzweigten Myzel, welches den Boden durchdringt, weisen Pilze mit bis zu 0,66 mg Trockenmasse pro 1g getrocknetem Boden sehr hohe Biomassekonzentrationen im Boden auf [41].
Hinzu kommt eine hohe Lebenserwartung der Organismen von mehreren hundert Jahren und eine Flächenausdehnung von bis zu 1000 Hektar, wie im Falle des Armillaria ostoyae in Nordamerika, dessen Alter auf bis zu 2000 Jahre geschätzt wird [42]. Verbunden mit einer großen Sorptionsoberfläche und der Möglichkeit, Schwermetalle und Radionuklide an und in der Biomasse zu immobilisieren, scheinen Pilze in besonderem Maße für die Strahlenschutzvorsorge und mit entsprechenden technischen Verfahren auch für die biologische Sanierung von kontaminierten Böden und Gewässern geeignet zu sein.
Diese Eigenschaften qualifizieren Pilze für die Untersuchung der Wechselwirkungen mit Radionukliden, ebenfalls im Hinblick auf einen möglichen technischen Einsatz für biologische Sanierungsverfahren.
Grundlagen
8
AUSGEWÄHLTE VERTRETER DER PILZE 3.5.1 Pleurotus ostreatus
Pleurotus ostreatus (dt. Austernseitling) ist ein Weißfäuleerreger, der sowohl als Schwächeparasit an Baumstämmen und -stümpfen, als auch saprothroph auftreten kann, sich also von abgestorbenen organischen Substanzen ernährt. Die bevorzugten Holzarten sind Laubbäume (Pappel und Buche), seltener auch Nadelhölzer. Beim Pleurotus ostreatus handelt es sich um einen Speisepilz, der leicht kultiviert werden kann und heute zu den meistangebauten Zuchtpilzen weltweit gehört. Er gehört zur Familie der Pleurotaceae. Seine Sporen weisen eine Größe von 8-12,5 x 3-4,5 µm auf und sind zylindrisch und glatt [43, 44]. In seiner Funktion als Schwächeparasit sorgt er durch Abbauprozesse des braunen Lignins für eine Aufhellung des Holzes, welche als Weißfäule bezeichnet wird. Da der Pilz seinen Nährstoffbedarf nicht vollständig durch den Abbau von Holz decken kann, bildet er in seinem Myzel ein Kontaktgift, welches als Tröpfchen ausgeschleust wird und dazu dient, kleine Fadenwürmer (Nematoden) zu lähmen. Anschließend wird der Wurm vom Pilzmyzel durchwachsen und zersetzt. Die Nematoden dienen somit als Stickstoffquelle [45]. Neben zahlreichen Enzymen zum Abbau von Cellulose und Lignin werden auch solche gebildet, die in der Lage sind, komplexe organische Verbindungen abzubauen. Diese Eigenschaften werden zunehmend in der Umwelttechnik untersucht und eingesetzt, um kontaminierte Böden zu sanieren [46]. Zusätzlich zur Spaltung organischer Verbindungen verfügt P. ostreatus über ein großes Potential zur Bindung von Schwermetallen, wie Blei, Chrom und Cadmium aus wässrigen Lösungen. So konnten Yang et al. Aufnahmen von bis zu 119,8 mg/g Pb (99,9 %), 8,7 mg/g Cr (64,5 %) und 1,6 mg/g Cd (61,1 %) aus schwermetallbelastetem Wasser, nach 10 Tagen Inkubationszeit beobachten [47]. Bei Kultivierung in flüssigem Malzextraktmedium für 30 Tage wurde von Favero et al. eine Aufnahme von 20 mg/g Cd beobachtet, was einer Aufnahme von 12,5 % der Ausgangskonzentration entspricht [48]
3.5.2 Macrolepiota procera
Der Pilz Macrolepiota procera (dt.: Gemeiner Riesenschirmling) gehört zur Klasse der Agaricomyceten und zur Familie der Champignonverwandten (Agaricaceae) [49]. Die Basidien weisen vier Sporen und eine Basalschnalle auf. Dabei sind die Sporen ellipsoid geformt und dickwandig, mit einer Größe von 12-18 x 9-11 µm. Der Fruchtkörper weist einen Hut mit bis zu 300 mm Durchmesser auf und ist essbar [43, 50]. Die Verbreitung ist astral bis boreal. M. procera kommt in fast allen mesophilen Waldgesellschaften mit lehmigen, frischen Böden, mit nährstoffreichem Untergrund vor. Der Pilz ist ebenfalls ein Vertreter der Saprobionten, im Gegensatz zu P. ostreatus ist er jedoch kein Schwächeparasit und nutzt ausschließlich die im Boden verfügbaren Nährstoffe. Der Gehalt von Schwermetallen bei unbehandelten Proben liegt bei bis zu 1,67 mg/kg Trockengewicht für Pb, 2,92 mg/kg Cr, 2,30 mg/kg Cd und 1,24 mg/kg Hg [51]. Das radioaktive Bleiisotop 210Pb kann mit bis
Material und Methoden
9 zu 13,42 Bq/kg und Polonium mit bis zu 16,70 Bq/kg aufgenommen werden [52]. Konkrete Bindungs- versuche mit Schwermetallen wurden für den Pilz M. procera in der Literatur bisher nicht beschrieben.
4 MATERIAL UND METHODEN
MIKROORGANISMEN, CHEMIKALIEN UND GERÄTE
Tabelle 1: Mikroorganismen
Name Bezugsquelle deutscher Name natürliches Substrat
Pleurotus ostreatus VII DSMZ (Nr.:1020) Austernseitling Holz Macrolepiota procera 23 DSMZ (Nr.:3501) Gemeiner Riesenschirmling Boden
Tabelle 2: Chemikalien
Name Bezugsquelle Anmerkungen
Malzextrakt Carl Roth GmbH + Co. KG
Pepton aus Soja Carl Roth GmbH + Co. KG
Ethanol VWR International GmbH
Glutardialdehyd Serva 25 % in wässriger Lösung
Antifoam
H2SO4 Carl Roth GmbH + Co. KG
NaOH Merck
FeCl3 Merck
MgSO4 Merck
K2HPO4 Carl Roth GmbH + Co. KG
UO2(NO3)2 Chemapol
EuCl3 Sigma-Aldrich Chemie GmbH
HNO3 Rückdestilliert von ICP-MS
Material und Methoden
10 Tabelle 3: Geräte
Typ Hersteller Anmerkungen
Certomat MO II B. Braun Biotech International Axialer Schüttler
Discovery ABIMED HAT Kolbenhubpipette
Schottflasche Schott 25 ml – 1 l
HERA safe Thermo Scientific Sterilwerkbank
HICLAV Autoklav HMC
pH-Meter inoLab
Feinwaage Sartorius
Centrifuge 5403 Eppendorf
Schüttelkolben Schott
Bioreaktor Applikon Arbeitsvolumen: 5 l
Stirrer Controller P310 Applikon
Thermo Circulator Applikon
pH-Sonde Applikon
pO2-Sonde Applikon
Lasersysteme Beschreibung siehe Kapitel
4.5.3.2 und 4.5.3.3
KULTIVIERUNG 4.2.1 Medium
Für die Stammhaltung und die Kultivierung der Pilze sowohl in Fest- als auch in Flüssigkultur wurde das durch die DMSZ empfohlene M90-Medium verwendet. Hierbei handelt es sich um ein Komplexmedium auf Basis von Malzextrakt und Sojapepton, wie in Tabelle 4 beschrieben. Der pH- Wert wurde vor der Dampfsterilisation mit Hilfe von 2 M NaOH auf 5,6 eingestellt. Das mit Agar versetzte Medium für die Kultivierung auf festem Nährboden wurde nach der Sterilisation bei etwa 60 °C in sterile Petrischalen gegossen, während das Medium der Flüssigkultur ohne Agar nach dem Erkalten im Kühlschrank bei 7 °C bis zur Benutzung gelagert wurde. Im Zuge der Reaktorkultivierung erfolgte die Herstellung des Mediums direkt im Bioreaktor. Der pH-Wert wurde nach der Dampfsterilisation des gesamten Gefäßes über die reaktoreigene pH-Regelung eingestellt.
Material und Methoden
11 Tabelle 4: M90. Zusammensetzung des Komplexmediums für Festa- und Flüssigkultivierung. Ansatz mit
vollentsalztem Wasser (VE) und pH 5,6.
Bestandteil Konzentration [g/l]
Malzextrakt 30
Sojapepton 3
aAgar-Agar 20
4.2.2 Kultivierung auf festem Nährboden
Die Kultivierung der Pilze auf festem Nährboden diente neben der Stammhaltung auch der Untersuchung des Wachstums und der Ausbildung verschiedener Myzelarten, wie beispielsweise Luftmyzel. Die Kultivierung erfolgte hierbei in sterilen Petrischalen, welche bis zu einer Schichtdicke von 5 mm mit dem oben beschriebenen M90-Medium gefüllt wurden. Nach dem Abkühlen auf Raumtemperatur und Aushärten des Nährbodens wurde dieser mit jeweils drei Präparaten pro Platte einer vorangegangenen Kultur beimpft.
4.2.3 Kultivierung in Flüssigkultur
Die Kultivierung der Pilze in Flüssigkultur erfolgte ebenfalls mit dem in Tabelle 4 beschriebenen Komplexmedium. Als Reaktionsgefäße kamen Schüttelkolben mit einem Volumen von 300 ml zum Einsatz, welche unter sterilen Bedingungen mit 80 ml Medium gefüllt wurden. Die Inokulation erfolgte initial über zwei bis drei Präparate aus einer Pilzkultur auf festem Nährboden. In der Folge wurden die Flüssigkulturen im 7-Tage-Rhythmus mittels steriler serologischer Pipetten umgesetzt, wobei hierbei etwa fünf Pilzagglomerate pro Kolben transferiert wurden. Die Kultivierung wurde anschließend bei Raumtemperatur auf einem axialen Tischschüttler bei 120 rpm durchgeführt.
4.2.4 Kultivierung im Bioreaktor
Die Kultivierung im Bioreaktor erfolgte sowohl für Macrolepiota procera als auch für Pleurotus ostreatus in Reaktoren der Firma Applikon mit einem Arbeitsvolumen von jeweils 5 l bei Raumtemperatur für fünf Tage. Dem verwendeten M90-Medium (Tabelle 4) wurden fünf Tropfen Antischaummittel (1 Tropfen/l) hinzugegeben, um das Aufschäumen des zucker- und proteinhaltigen Komplexmediums aufgrund des Gaseintrages zu verhindern. Die Durchmischung wurde durch zwei axial versetzte Propellerrührer mit einer Geschwindigkeit von initial 300 rpm realisiert, wobei die Rührerdrehzahl bei einem Absinken der Gelöstsauerstoffkonzentration auf unter 30 % auf bis zu 500 rpm erhöht wurde. Der pH-Wert wurde auf 5,6 eingestellt und mithilfe von H2SO4 und NaOH geregelt. Die Begasungsrate betrug 1,5 l/min Luft.
Material und Methoden
12 In Vorbereitung der Inokulation wurde die Biomasse von zwei Schüttelkolben (siehe Kapitel 4.2.3) nach einwöchiger Kultivierung über einen sterilen Rotilabo®-Rundfilter, Typ 113A abgetrennt und in einem Zentrifugenröhrchen (50 ml) gewogen. Die Biomasse wurde anschließend mit 30 ml sterilem VE- Wasser versetzt, um den Transfer in den Reaktor zu erleichtern. Nach der Desinfektion der Reaktorkopfplatte mit 70 % Ethanol wurde ein Blindstopfen unter einer Gasflamme geöffnet und die Biomasse in den Reaktor gefüllt. Zu verschiedenen Zeitpunkten der Kultivierung wurden Proben entnommen und lichtmikroskopisch untersucht, um die axenischen Kultivierungsbedingungen zu überprüfen.
Nach Ende der Kultivierung wurde der Reaktorinhalt mittels Peristaltikpumpe in 1-l-Zentrifugen- behälter gefüllt und bei 15 000 ∙ 𝑔 und 4 °C für eine Stunde zentrifugiert. Der Überstand wurde verworfen und die verbleibende Biomasse abgepackt und gewogen.
BESTIMMUNG DER BIOTROCKENMASSE
Da die gravimetrische Biotrockenmassebestimmung sehr zeitintensiv ist und die Proben nach der Wasserreduktion im Trockenschrank nicht mehr aktiv sind, ist diese Methode für den täglichen Gebrauch nicht praktikabel. Für die Vergleichbarkeit der Versuchsergebnisse ist es jedoch erforderlich, die Berechnung der aufgenommenen Nuklidmenge und eingesetzten Medien auf die Biotrockenmasse zu beziehen. Hierzu wurde zunächst die Korrelation von Biofeucht- zu Biotrockenmasse bestimmt. Für jeden Pilz wurden jeweils 20 Reaktionsgefäße (1,5 ml) im Trockenschrank bei 100 °C für 48 h getrocknet. Nach dem Abkühlen auf Raumtemperatur wurde das Leergewicht der Reaktionsgefäße gravimetrisch ermittelt. Anschließend wurde die Biomasse einer Flüssigkultur nach einer Woche zweimal mit VE-Wasser gewaschen und über eine Bottle-Top-Vakuumpumpe mit einem 0,45 µm-Filter abgetrennt. Die Biofeuchtmasse wurde in der Folge in verschieden große Proben zerteilt und in die getrockneten Reaktionsgefäße gefüllt. Nach dem Wiegen erfolgte eine erneute Trocknung bei 100 °C für 48 h mit anschließender gravimetrischer Bestimmung der Biotrockenmasse bei Raumtemperatur.
Nach Abzug des Leergewichts der Reaktionsgefäße wurden die ermittelten Biofeucht- und Biotrockenmassen gegeneinander aufgetragen und mit Hilfe einer linearen Regression die mathematische Gleichung der Korrelation ermittelt.
Material und Methoden
13
UNTERSUCHUNG DER WECHSELWIRKUNGEN VON PILZEN MIT DEN AUSGEWÄHLTEN ELEMENTEN
4.4.1 Zusammensetzung der Medien und Lösungen
Zur Durchführung der Bindungsversuche wurden chemisch definierte Mineralmedien (MM) eingesetzt, welche aus den in Tabelle 5 beschriebenen Stammlösungen hergestellt wurden. Die Herstellung der Stammlösungen erfolgte aus den pulverförmigen Chemikalien (siehe Tabelle 2), mit Ausnahme des Uranylnitrates, welches aus einer höher konzentrierten Lösung (2,5 ∙ 10−2 𝑚𝑜𝑙/𝑙) verdünnt wurde. Die Lagerung der Stammlösungen erfolgte nach Sterilfiltration (0,45 µm) in autoklavierten Schottflaschen.
Tabelle 5 Stammlösungen.
Name Summenformel Konzentration [mol/l]
Eisen(III)-chlorid FeCl3 1,4 ∙ 10−4
Dikaliumhydrogenphosphat K2HPO4 1,0 ∙ 10−2
Magnesiumsulfat MgSO4 1,1 ∙ 10−2
Uranylnitrat UO2(NO3)2 1,0 ∙ 10−3
Eu(III)-chlorid EuCl3 1,4 ∙ 10−3
Die in Tabelle 6 beschriebenen Mineralmedien wurden an der Sterilwerkbank hergestellt und ebenfalls in zuvor autoklavierten Glasflaschen gelagert. Die Verdünnungen wurden mit sterilem vollentsalztem (VE) Wasser durchgeführt. Die Einstellung des pH-Wertes erfolgte in Abhängigkeit der durchzuführenden Experimente mit 2 M HCl und 2 M NaOH auf die Werte 4, 5 oder 6. Bei der Variation der Stoffmenge von Uran und Europium ändert sich die jeweilige Konzentration zu 8,40 ∙ 10−5 𝑚𝑜𝑙/𝑙 beziehungsweise 3,36 ∙ 10−4 𝑚𝑜𝑙/𝑙, während die übrigen Medienbestandteile indes unverändert bleiben.
Material und Methoden
14 Tabelle 6 Zusammensetzung des Minimalmediums mit Uran beziehungsweise Europium.
Name MM-Uran [mol/l] MM-Europium [mol/l]
FeCl3 1,5 ∙ 10−5 1,5 ∙ 10−5
K2HPO4 5,0 ∙ 10−6 5,0 ∙ 10−6
MgSO4 1,6 ∙ 10−4 1,6 ∙ 10−4
UO2(NO3)2 2,1 ∙ 10−4 -
EuCl3 - 2,1 ∙ 10−4
4.4.2 Bindungsversuche mit U(VI) und Eu(III)
Ein wichtiger Parameter bei der Untersuchung der Wechselwirkungen von Pilzen mit Radionukliden ist die Menge der Nuklide, welche in einer definierten Zeit von dem Pilz assoziiert und somit immobilisiert wird. Die Menge an assoziiertem U(VI) und Eu(III) wurde in sogenannten Bindungsversuchen ermittelt.
In 10 ml-Probenröhrchen wurde die gewaschene und abfiltrierte Biofeuchtmasse der Pilze in einem Verhältnis von 300 mg BTM/l mit den jeweiligen Minimalmedien versetzt und auf einem Axialschüttler bei 120 rpm und Raumtemperatur inkubiert. Die Bindungsversuche wurden mit neun verschiedenen Kontaktzeiten (10 min, 30 min, 1 h, 2,5 h, 5 h, 1 d, 2 d, 4 d, 7 d) durchgeführt. Nach Ende der Kontaktzeit wurden Proben des flüssigen Überstandes abgenommen und nach Ansäuern mit konzentrierter Salpetersäure (10 µl/ml) mittels Massenspektrometrie mit induktiv gekoppeltem Plasma (ICP-MS) analysiert.
Die Ausgangsbedingungen für die Bindungsversuche sind durch eine Metallkonzentration von 210 µmol/l und pH 5 definiert. In weiteren Experimenten wurde sowohl die U(VI)-, als auch die Eu(III)- Konzentration (84 µmol/l und 336 µmol/l) sowie der pH-Wert (4 und 6) variiert. Sämtliche Bindungsversuche wurden als Triplikat durchgeführt. Um Verfälschungen der Messergebnisse zu verringern, welche durch das Anlagern von U(VI), beziehungsweise Eu(III) an der Gefäßwand der Probenröhrchen zu Stande kommen, wurden die Reaktionsgefäße nach der Probennahme entleert und zweimal mit deionisiertem Wasser (DI) gespült. Anschließend wurden die Gefäße für 3 Minuten bei 8000 rpm zentrifugiert, um das verbliebene Wasser am Gefäßboden zu sammeln. Dieses wurde in der Folge mit einer Pipette entfernt. Zur Herstellung der Referenzproben wurden die Probenröhrchen erneut mit 2 ml DI-Wasser und 20 µl konzentrierter HNO3 gefüllt und geschüttelt. Die entnommenen Proben wurden anschließend ebenfalls mittels ICP-MS analysiert. Für die Auswertung wurde die modifizierte Formel (1) nach Gadd genutzt [28].
Material und Methoden
15 𝑞 =𝑉((𝑐0− 𝑐𝑤) − 𝑐)
𝐵𝑇𝑀 (1)
mit
q= Menge an gebundenem Metall (im Gleichgewicht) mg/g BTM
V= Volumen der Lösung l
c0= Anfangskonzentration des Metalls in der Lösung mg/l cw= Konzentration des Metalls an der Röhrchenwand mg/l c= Gleichgewichtskonzentration des Metalls in der Lösung mg/l
BTM= Biotrockenmasse mg
ANALYSTISCHE METHODEN 4.5.1 ICP-MS
Die Massenspektrometrie mit induktiv gekoppeltem Plasma (engl.: Inductively Coupled Plasma – Mass Spectrometry, ICP-MS) ist eine Analysemethode der anorganischen Elementaranalytik, welche unter anderem zur Spurenanalyse von Schwermetallen eingesetzt wird. Durch einen hochfrequenten Strom wird ionisiertes Argon induziert und die Probe somit auf 5 000-10 000 °C erhitzt. Die Atome werden dabei ebenfalls ionisiert und ein Plasma entsteht. Die im Plasma generierten Ionen werden in Richtung des Analysators beschleunigt und im Massenspektrometer messtechnisch erfasst. Die Vorteile dieser Methode liegen in den sehr geringen Nachweisgrenzen (ng/l) für die meisten Elemente und im hohen linearen Bereich bei der quantitativen Bestimmung über 9 Größenordnungen [53].
4.5.2 Mikroskopische Verfahren
4.5.2.1 Transmissionenelektronenmikroskopie (TEM) und Röntgenmikroanalyse (EDX)
Die Transmissionselektronenmikroskopie ist eine Betriebsart der Elektronenmikroskopie, welche es ermöglicht, einzelne Zellen und deren Zusammensetzung im Nanometerbereich zu betrachten. Im Gegensatz zur Rasterelektronenmikroskopie (REM) werden die Elektronen hierbei nicht von der Oberfläche reflektiert, sondern durch das Objekt geleitet. In Abhängigkeit von der Masse der Moleküle ändern die Elektronen beim Durchgang der zu untersuchenden Probe ihre Bewegungsrichtung und verlieren teilweise Bewegungsenergie. Die Methode eignet sich somit gut, um die massereichen Metalle Uran und Europium innerhalb der Zelle zu lokalisieren.
In Vorbereitung der TEM-Aufnahmen wurden Bindungsversuche mit einer U(VI)- beziehungsweise Eu(III)-Konzentration von 210 µmol/l, pH 5 und einer Kontaktzeit von 48 h durchgeführt. Die Biomasse wurde anschließend mit sterilem vollentsalztem Wasser gewaschen und in einem Puffer aus
Material und Methoden
16 Natriumcacodylat und Glutaraldehyd fixiert. Die Einbettung in Acrylharz und Präparation der Dünnschnitte mit einer Dicke von 50 nm wurde am Forschungszentrum für Regenerative Therapien Dresden (CRTD) durchgeführt. Die anschließenden TEM-Aufnahmen wurden am Institut für Ionenstrahlphysik und Materialforschung des Helmholtz-Zentrums Dresden-Rossendorf, durch Herrn Dr. Hübner erstellt.
Durch eine Fixierung der Dünnschnitte in sogenannten Findergrids, war es möglich, einzelne Zellen, welche bereits unter dem Transmissionselektronenmikroskop betrachtet wurden, wiederzufinden und für eine Röntgenmikroanalyse heranzuziehen. Bei dieser Methode wird ein Elektronenstrahl auf die Probe gerichtet und die in der Folge unterschiedlich gestreuten Elektronen detektiert. Anhand der elementspezifischen elastischen und inelastischen Streuung kann anschließend die Elementverteilung in der Probe berechnet werden.
4.5.2.2 Lichtmikroskopie
Für die lichtmikroskopische Untersuchung wurden Proben der Platten- und Schüttelkolbenkulturen entnommen und in sterile Reaktionsgefäße (1,5 ml) überführt. Aus dem Myzel der Pilze auf Agarplatten wurde jeweils ein Quadrat mit einer Kantenlänge von circa 4 mm herausgeschnitten. Aus den Flüssigkulturen wurde jeweils ein Pilzagglomerat von circa 3 mm Durchmesser zusammen mit 1 ml Medium entnommen. Bei der Reaktorkultivierung wurden die Proben mittels serologischer Pipette aus dem Reaktor entnommen. Um der starken Zusammenlagerung der Hyphen entgegenzuwirken, wurden einzelne Nährböden mit Objektträgern ausgestattet. Somit konnten die Pilze diese Träger direkt überwachsen, wodurch die natürliche Myzelstruktur betrachtet wurde. Die weitere Verarbeitung und Erstellung der mikroskopischen Aufnahmen erfolgte in Zusammenarbeit mit Luca Kühnel.
4.5.3 Zeitaufgelöste laserinduzierte Fluoreszenzspektroskopie (TRLFS)
4.5.3.1 Theoretische Speziationsrechnung
Zusätzlich zu den mittels zeitaufgelöster laserinduzierter Fluoreszenzspektroskopie gemessenen Spezies wurde eine theoretische Speziationsrechnung in den Ausgangsmedien mit Uran, beziehungsweise Europium durchgeführt. Hierfür wurde das Computerprogramm ‚Geochemist’s Workbench‘ Modul
‚React‘ in der Version 12.0.4. [54], zusammen mit der thermodynamischen Datenbank ‚PSI/Nagra Chemical Thermodynamic Database‘ verwendet [55].
4.5.3.2 U(VI)-Messung
Für die Messung mittels zeitaufgelöster laserinduzierter Fluoreszenzspektroskopie wurden die flüssigen Überstände und die Biomasse aus den Bindungsversuchen mit den Ausgangsbedingungen sowie aus Versuchen mit uranfreiem Medium verwendet. Die Biomasse wurde nach dem Ende der jeweiligen
Material und Methoden
17 Bindungsversuche zweimal in sterilem VE-Wasser gewaschen, auf einem Filterpapier abgetupft und anschließend in ein steriles Reaktionsgefäß überführt. Für die Fluoreszenzuntersuchungen der Proben wurde ein Nd:YAG-Lasersystem (INLITE, Continuum) genutzt. Die U(VI)-Messungen erfolgten mit einer Anregungswellenlänge von 266 nm bei einer Probentemperatur von 153 K. Die Detektion des von der Probe emittierten Lumineszenzlichtes erfolgte mit einer ICCD-Kamera (HORIBA Jobin-Y) und einem iHR 550 Spektrograph (HORIBA Jobin-Yvon) im Bereich von 380-660 nm. Die Steuerung der Schrittweite bei der zeitaufgelösten Messung wurde nach Formel (2) mit einer Matrixgröße von 51 durchgeführt.
0,1 + 0,05𝑥 + 𝑥4 500⁄ (2)
Die Datenerfassung erfolgte durch das Computerprogramm Labspec 5 (HORIBA Jobin-Yvon, Edison, NY, USA). Die auf diese Weise gewonnenen Daten wurden mit Origin 9.1 (OriginLab Corporation, Nothhampton, MA, USA) und PARAFAC (N-way toolbox für Matlab The MathWorks Inc., Natick, MA, USA) ausgewertet.
4.5.3.3 Eu(III)-Messung
Für die Speziationsuntersuchung der europiumhaltigen flüssigen Sorptionsüberstände und der Pilzproben wurden die Proben unter den gleichen Ausgangsbedingungen, wie auch für die Uran-TRLFS hergestellt und vorbehandelt. Die zeitaufgelösten laserinduzierten Fluoreszenzmessungen wurden anschließend mit zwei verschiedenen Methoden durchgeführt.
Die Lumineszenzspektren der Sorptionsüberstände wurden mit einem gepulsten Nd:YAG-OPO- Lasersystem (Powerlite Precision II 9020 mit einem Green PANTHER EX OPO von Continuum, Santa Clara, CA, USA) und einer Anregungswellenlänge von 394 nm bei 298 K aufgenommen. Die Energie der Laserpulse betrug hierbei 2 bis 4 mJ. Die Detektion der Spektren erfolgte durch ein Mehr-Kanal- Analysesystem mit einem Oriel MS 257 Monochromator und Spektrograph mit Gittergrößen von 1200 Reihen/mm (Einzelspektren) und 600 Reihen/mm (zeitaufgelöste Spektren) in Kombination mit einer Andor iStar ICCD-Kamera (Lot-Oriel Group, Darmstadt, Deutschland) [56, 57].
Die Eu(III)-Emissionsspektren wurden im Bereich 570-650 nm (Gitter: 1200 Reihen/mm, Auflösung:
0,2 nm) aufgenommen. Für die zeitaufgelösten Spektren erfolgte die Detektion im Bereich von 500- 700 nm (Gitter: 600 Reihen/mm, Auflösung¨>0,6 nm). Es wurde ein festes Zeitfenster von 1 ms festgelegt. Die Spektren wurden basislinienkorrigiert, energiekorrigiert und normiert mittels Origin 9.1 (OriginLab Corporation, USA). Die Lumineszenzlebensdauer der Spezies wurde ebenfalls mit Hilfe dieses Programms berechnet. Die Normierung erfolgte auf den 5D0 →7F1-Übergang, da es sich um einen magnetischen Dipol handelt, der nicht durch die chemische Umgebung des Metallions beeinflusst wird.
Die Anzahl der koordinierten Wassermoleküle in der ersten Koordinationssphäre des Eu3+ wurde mit Formel (3) nach Kimura et al.[58] berechnet, mit τ als der gemessenen Lebenszeit in ms.
Ergebnisse
18
𝑛𝐻2𝑂 ± 0,5 = 1,07 ∗ 1 𝜏 − 0,62⁄ (3)
Auf Grund der hohen Energie des auf die Probe auftreffenden Laserstrahls bei Raumtemperatur kann im Falle der Eu(III)-belasteten Biomasseproben eine Veränderung der Probe nicht ausgeschlossen werden, sodass die fluoreszenzspektroskopischen Untersuchungen dieser Proben mit Hilfe einer site- selectiven Eu(III)-Anregung um den 7F0-Übergang bei 8 K durchgeführt wurden.
Die Proben wurden hierzu mittels Helium-Cryostat (Cryophysics CCS 100) auf 8 K heruntergekühlt, um sie möglichst zerstörungsfrei untersuchen zu können und eine höhere spektrale Auflösung im Vergleich zu Messungen bei RT zu erreichen. Die Anregung erfolgte mit einem Nd:YAG-System (Continuum Surelite II, USA) und gepumpten Farbstofflaser (Radiant Dyes NarrowScan). Als Farbstoff für die direkte Anregung des Eu3+-Ions wurde Rhodamin 6G verwendet. Die Anregungswellenlängen im Bereich des 7F0-Übergangs wurden mittels Wellenlängenmessgerät (High Finesse WS-5) eingestellt und gemessen sowie die Laserenergie mittels Laserenergiemessgerät (Newport 1918-R) registriert.
Detektiert wurde die Lumineszenz von einem Spektrographen (Shamrock 393i) mit einem Polychromator und Gitterweiten von 150 oder 600 Reihen/mm in Kombination mit einer ICCD-Kamera (Andor iStar 734 [59]).
5 ERGEBNISSE
VERGLEICH DES WACHSTUMSVERHALTENS UND DER REINHEIT VON PILZEN IN ABHÄNGIGKEIT VON DER KULTIVIERUNG
5.1.1 Kultivierung auf Nährböden
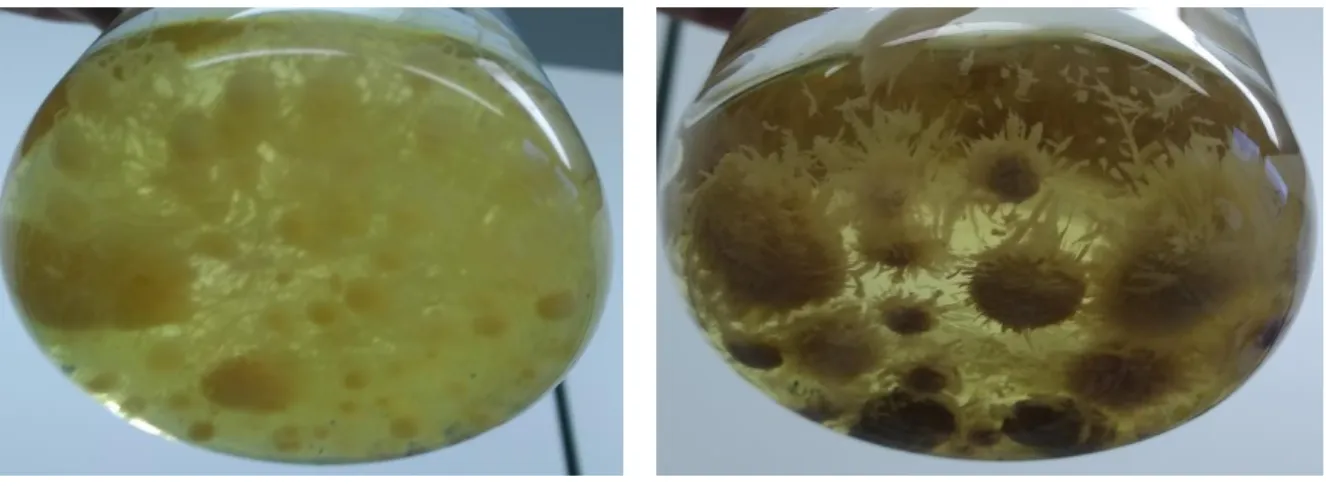
Die Pilze Pleurotus ostreatus und Macrolepiota procera zeigen während der Kultivierung auf festem Nährboden ein vergleichbares Wachstum. Bereits zwei Tage nach dem Beimpfen bilden die Pilze ein sichtbares Myzel um die Impfstelle und sind auf dem Nährboden verankert, weshalb die Petrischalen in der Folge über Kopf gelagert werden können. Hierdurch wird verhindert, dass gebildetes Kondenswasser vom Deckel der Petrischale auf das Myzelgeflecht tropft und dieses gegebenenfalls beschädigt. Die Pilze breiten sich kreisförmig von den Impfstellen aus und überwachsen die gesamte Fläche der Petrischale innerhalb der ersten zehn Tage. Dies geschieht hauptsächlich in Form von weißlichem Luftmyzel. Ein deutliches Wachstum innerhalb des Nährbodens ist optisch nicht erkennbar, allerdings deutet der mechanische Widerstand, welcher sich beim Ablösen des Myzels von der Platte zeigt, bei beiden Pilzen auf eine Durchdringung des Nährbodens hin. Jedoch zeigen sich bei M. procera nach zehn Tagen Kultivierungszeit sogenannte Hemmhöfe um die Impfstellen, wie in Abbildung 2 zu
Ergebnisse
19 sehen ist, in denen das Myzelgeflecht kreisförmig reduziert ist und nicht mehr die weiße Farbe des Luftmyzels aufweist.
Abbildung 1: Bildung von farbigen Tröpfchen an den Hyphen bei P. ostreatus nach 11 Tagen Kultivierung auf M90-Agar-Nährmedium.
Abbildung 2: Ausbildung von Hemmhöfen bei M. procera nach 10 Tagen Kultivierung auf M90- Agar-Nährmedium.
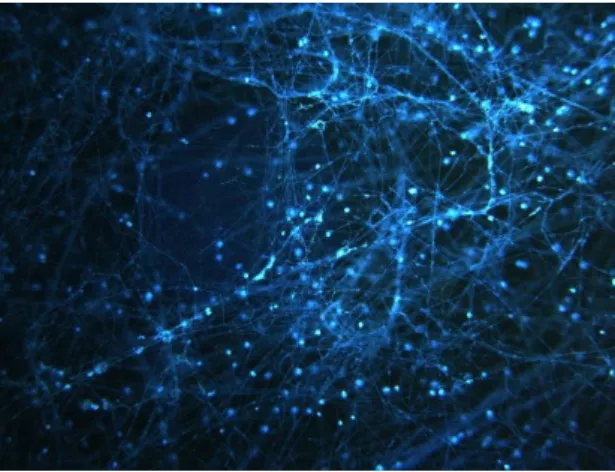
P. ostreatus zeigt dieses Phänomen nicht in derselben Gleichmäßigkeit, allerdings kommt es hier nach mehr als zehn Tagen zur Bildung von kleinen orangefarbenen Tröpfchen auf der Oberfläche, beziehungsweise an den Enden der Hyphen, wie in Abbildung 1 dargestellt ist. Dies deutet auf das in Kapitel 3.5.1 beschriebene Kontaktgift hin, welches der Pilz nutzt, um Fadenwürmer aus der Umgebung anzulocken und zu lähmen. Bei der lichtmikroskopischen Betrachtung zeigen sich die Hyphen als dichtes Geflecht, welches nur schwer separiert werden kann. Allerdings wurden neben den Pilzbestandteilen keine Fremdorganismen sichtbar, wodurch von mikroskopischer Seite aus von einer Reinkultur ausgegangen werden kann. Der Hyphendurchmesser beträgt bei beiden Pilzen etwa 1 µm, kann jedoch innerhalb einer Probe deutlich variieren. Durch Aufnahmen mit dem Fluoreszenzmikroskop (siehe Abbildung 3 und Abbildung 4) lässt sich bei P. ostreatus eine flache Hyphenstruktur erkennen, während bei M. procera kleine helle Punkte sowohl innerhalb als auch außerhalb der Hyphen sichtbar sind.
Ergebnisse
20 Abbildung 3: Fluoreszenzmikroskopische Aufnahme
von P. ostreatus nach Kultivierung auf M90- Nährboden mit Objektträger.
Abbildung 4: Fluoreszenzmikroskopische Aufnahme von M. procera nach Kultivierung auf M90- Nährboden mit Objektträger.
Dies können beispielsweise ausgeschleuste Lipidtröpfchen sein. Eine tiefergehende Untersuchung dieser Bestandteile wurde jedoch nicht durchgeführt. Die Kultivierung auf festen Nährböden eignet sich auch für längerfristige Stammhaltung. So bleiben die Kulturen auch nach Standzeiten von drei Monaten aktiv und können ohne erkennbare Verzögerung nach der Überimpfung auf ein neues Medium dieses bewachsen.
5.1.2 Kultivierung im Schüttelkolben
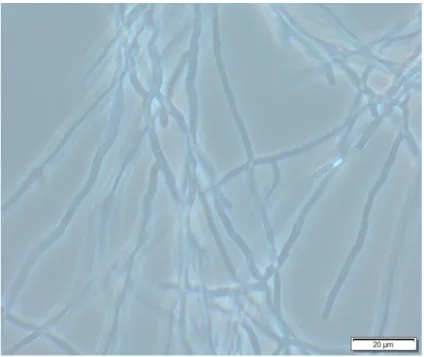
Bei der Kultivierung im Schüttelkolben zeigen sich deutlichere Unterschiede zwischen den verwendeten Pilzen im Vergleich zu ihrem Wachstum auf festen Nährböden. So bilden sich bei P. ostreatus schon nach kurzer Zeit kleine kugelförmige Agglomerate, welche durch die Schüttelbewegung bedingt sind und nach einer Woche auf eine Größe von etwa 1 cm Durchmesser anwachsen. Mit zunehmender Passagenzahl (Anzahl der Medienerneuerung innerhalb der Flüssigkultur) verändert sich auch die Form der Agglomerate, wie in Abbildung 5 dargestellt ist. Die einst kompakten und gelartigen Kugeln bilden fadenförmige Auswüchse und formen sich in zunehmend kürzerer Zeit zu großen Agglomeraten, welche keine einheitliche Kugelform mehr aufweisen, dafür jedoch eine pelzartige Oberfläche besitzen. In diesem Stadium bilden sich nur noch ein bis drei dieser Gebilde pro Kolben, welche beim Umsetzen der Kultur mit einer serologischen Pipette jedoch problemlos zerteilt werden können. Das verwendete M90- Medium bleibt während der Kultivierung klar und nimmt eine zitronengelbe Farbe an. Bei mikroskopischer Betrachtung (siehe Abbildung 7) zeigt sich eine Hyphenstruktur, die ähnlich der Kultur auf festem Nährboden ist. Allerdings ist der Hyphendurchmesser mit 2-3 µm größer, was auf das flüssige Umgebungsmedium und die damit verbundene bessere und schnellere Nährstoffverteilung zurückzuführen ist.
Ergebnisse
21 Abbildung 5: Ausbildung von fadenförmigen
Auswüchsen bei Flüssigkultur im Schüttelkolben von P. ostreatus.
Abbildung 6: Ausbildung von stachelartigen Auswüchsen bei Flüssigkultur im Schüttelkolben von M. procera.
M. procera bildet in der ersten Wachstumsphase nach dem Überimpfen von der Nährbodenplatte in den Schüttelkolben zunächst ähnliche Agglomerate wie P. ostreatus. Jedoch zeigen sich bereits nach der zweiten Passage, wie in Abbildung 6 zu sehen ist, stachelförmige Auswüchse an den etwa 1 cm großen Pilzkugeln. Diese können bei mechanischer Belastung abbrechen und werden in der Folge auch in das Medium abgegeben. Durch die freischwimmenden Hyphen kommt es zu einer Eintrübung des Mediums, wodurch eine regelmäßige mikroskopische Überprüfung (siehe Abbildung 8) der Reinkultur wichtiger wird. Hierbei zeigen sich vereinzelt kugelförmige Ausstülpungen an den Enden der Hyphen, welche bereits bei den fluoreszenzmikrokopischen Aufnahmen aufgefallen sind. Nach etwa fünf Passagen im Schüttelkolben kommt es verstärkt zur Eintrübung des Mediums und die Agglomerate bilden sich zunehmend langsamer, wodurch ein weiterführendes Arbeiten mit der Pilzbiomasse erschwert wird.
Abbildung 7: Mikroskopische Aufnahme von P. ostreatus in Flüssigkultur
Ergebnisse
22 Abbildung 8: Mikroskopische Aufnahme von M. procera in Flüssigkultur mit Ausstülpungen an einzelnen Hyphenenden (rot markiert).
5.1.3 Kultivierung im 5 l-Bioreaktor
Für die Kultivierung im Bioreaktor wird das gleiche M90-Medium verwendet, wie bereits bei der Flüssigkultivierung im Schüttelkolben. Auch das Inokulum stammt aus einer Schüttelkolbenkultur. Bei M. procera bilden sich zu Beginn der Reaktorkultivierung ebenfalls die bereits beschriebenen kugelförmigen Agglomerate. Durch die höhere Scherbelastung auf Grund der Rührerdrehzahl von initial 300 rpm lösen sich die herauswachsenden Hyphen jedoch schneller ab, wodurch es bereits nach drei Tagen zu einer Eintrübung des Mediums kommt. Mit Hilfe der lichtmikroskopischen Untersuchung zeigt sich jedoch, dass es sich hierbei nicht um eine Kontamination handelt, wie in Abbildung 9 zu sehen ist. Auf Grund des nicht heterogen verteilten Pilzmyzels im Reaktor kann es vorkommen, dass die Sauerstoffelektrode während der Kultivierung überwachsen wird, wodurch es zu verfälschten Messwerten kommen kann. Daher sollte die Rührerdrehzahl nicht direkt mit der pO2-Messung gekoppelt werden, sondern in jedem Fall die Sonde überprüft und die Drehzahl gegebenenfalls händisch angepasst werden. Nach der Inokulation mit 15 g Biofeuchtmasse können mit dieser Betriebsfahrweise nach fünf Tagen etwa 230 g Biofeuchtmasse geerntet werden. Die Zentrifugation des Reaktorinhaltes in 1 l- Zentrifugationsgefäßen für eine Stunde bei 15 000 ∙ 𝑔 zeigt sich hierbei als schnelle und vorteilhafte Methode.
Ergebnisse
23 Abbildung 9: Mikroskopische Untersuchung von M. procera nach Eintrübung im Bioreaktor.
Trotz der Verwendung eines reinen Inokulums erweist sich P. ostreatus bei der Kultivierung im Bioreaktor anfälliger für Kontaminationen. So weist die Kultur bei gleicher Vorbereitung und Durchführung bereits nach zwei Tagen eine Trübung des Mediums und einen stark erhöhten Sauerstoffbedarf auf. Durch die mikroskopische Untersuchung einzelner Proben lässt sich die bakterielle Kontamination leicht erkennen.
Abbildung 10: Mikroskopische Untersuchung (A) der kontaminierten Reaktorkultivierung (B) von P. ostreatus.
Ergebnisse
24 In der Folge bietet sich die Zugabe von Antibiotika, in Form von Chloramphenicol an, welches im Rhythmus von zwei Tagen appliziert wird. Die wiederholte Zugabe ist notwendig, da ein Teil des Chloramphenicols durch den Pilz metabolisiert werden kann und seine Wirkung somit abgeschwächt wird. Nach zweimaliger Zugabe des Antibiotikums kam es jedoch erneut zu einer Eintrübung des Mediums auf Grund einer sich ausbreitenden Kontamination, wie Abbildung 10 zeigt.
WECHSELWIRKUNGEN DER PILZE MIT U(VI) UND EU(III)
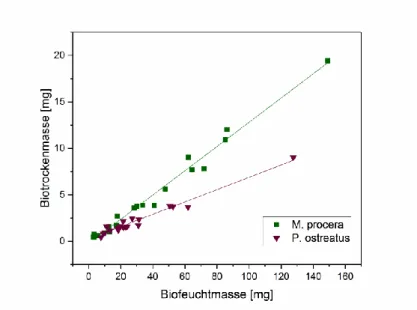
Da sich die Mengen der eingesetzten Nuklide und das sich daraus ergebende Assoziationsvermögen auf die Biotrockenmasse der Pilze bezieht und auch in der Literatur in dieser Form diskutiert wird, erfolgte zunächst eine Korrelation zwischen Biofeucht- und Biotrockenmasse. In Abbildung 11 wird die ermittelte Biotrockenmasse in Abhängigkeit der Biofeuchtmasse graphisch dargestellt, während in Tabelle 7 die Gleichungen der linearen Regression aufgeführt werden.
Abbildung 11: Graphische Darstellung der Abhängigkeit zwischen Biotrocken- und Biofeuchtmasse für M. procera und P. ostreatus.
Tabelle 7: Mathematische Gleichungen der Abhängigkeit zwischen Biotrocken- und Biofeuchtmasse von P. ostreatus und M. procera.
PILZ GLEICHUNG R²
PLEUROTUS OSTREATUS y=0,0663x + 0,2459 0,98 MACROLEPIOTA PROCERA y=0,1305x + 0,2456 0,96