Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Dr.Buten uth
Lehramtsvortragsseminar SS 1993
Metalle:
Vorgelegt: von:
Thomas Meisterknecht Ernst Lemmerstr.14/123
35041 Marburg
Metallvortrag Thomas Meisterlmccht
o. AUGEMEINE EINFÜHRUNG: 3
I. PHYSIKALISCHE EIGENSCHAFTEN VON METALLEN: 3
1.1.Theorie der Metalfucben BinduDg 3
1.1.1 Thermische Leitfähigkeit 3
1. Versuch zur Thermischen Leitfähigkeit: 4
1.1.2 Leitung des elektrischen Stroms (Unterscheidung Metall , Halbmetall, Nichtmetall): 5
2 .Versuch zur Leitfähigkeit 6
1.1.3 Metallischer Glanz: 6
3.Versuch Kupferverspiegelung: 6
1.1.4 Schmelz und Siedepunkte von Metallen allg. 7
2. Kristalliner Aufbau von Metallen aJlg. 8
1.2.1 Mikrostruktur 8
1.2.2 Herleitung dereinfachsten drei Kugelpackungen 8
1.2.3 Veranschaulichung des Einflusses der Struktur auf die Eigenschaften: 10
5.Versuch Zinn: 10
1.2.4 Erklarung der
guteplastischen Verformbarkeit: 10
6 .Versuch NaCl und Kupfer 10
II..CHEMISCHE EIGENSCHAFTEN VON METALLEN: 11
2.1. aUgemeiat
~hriodilcbe EigeDSChafteD. 11
2.1 .1 Def : Ionisierungsenergie: 11
2.1.2 Der ElcktroneDcgativitat: 12
2.2 Affiaitlt
1'011Metdea zu Sauentufl': 12
7.Versoch: VedJrenmmg von Metallen: 12
2.3. Korrosion
VOllMetallen: 13
2.3.1 Einleitung: 13
2.3 .2 Korrosion : 13
2.3.2 .1 chem Korrosision: 13
2.3.2.2 ElektrochemKorrosion: 13
8.Versuch:Galvanisches Element: 13
2.3.3 Korrosionsschutz. 14
2.4. Metalle ihren Rohstoffen und ihre Bedeutung, 14
2.4.1 Wirtschaftliche Bedeutung von Metalle 14
2.4.2 Vorkommen der meisten Metalle 15
2.4.3 Metallgewinnung aus den Erzen: 15
9.Versuch : Aluminothermische Reduktion von Eisen 16
IO.Versuch: Zinnbaum: 16
;",
J-....
"
Metallvortrag Tbomas MdsteItmecbt
:' .'-r~
..
,'.~,'
. ~ aller Elemente Sind ~Perod ~tem Metalle
Abb1.0 Periodensystem
.::.'.:.~~
.
.... .
.
." .
O-...--.WIIr'l b-.~ ---:=.
( - - . . ...~...~l...
IIt\ltOM~_ _ ...t1M>- 111
- ... .... ..
VllI-
r-- .
.... - ..- - ::""I...·" .. - - · · - • . -
..-
AI.
B. .
:::- - ...
Si.C-. ' i:: - - - . .. . - .
N'p::'. . . - .- ..
oS:i::;"~.- ... . - - . a-'
F-. _ .
'- .... ..
NIAl- . -
--,
.. .. - - - - - -
. · . .
" ". . . .. .
'. .. . .. . . .
"
CI::'1II Ga::'Ge::' AI :::
SI::' Ir. -
Kr~
- - - - - - - -
F'
::
"N = At .. ::' .. ... .. . . . . ..
'."'". _ ..
.,C. In Sn sa~ 11~J I.,~. XI
- - · - ' .. - - -
..· -
..-
"- . . - - ' -
.- - -
~- .. - -
.,u.I::-
PI=
All. .
HOn
t:Pll :::: BI :
~l! ~t ~n- - - - ...: - '-= - -
..
..e. · ... - W=
po- ..111.... .
Dy..
~....
111..
::&
'- ; _ 11 . . : "
. .0.,. .. :: . .
Lu...
--- - - - -
'-- - -
-- --- - - - - - - -
.
'· .. · . , - - - .. :: - - - . . -
:'
- _
.".r:l. - -
~' - -
~~- -
,;j- - -
&- m - -
~- - -
i8I-
l.r_ ._ - - --_ ... - - - ---- -
._._ - -- ----'; ~F ;;; - _,-m ..
SII...
..
':-
Thf '
l'I..
~.
tl'=.. - -
Jl,. . :- .. hi
..-~
-
I
:.:1
--'I.... ....
Vb... -
I , . - -
... -
:~
K / ;'
I" M. · · . .
.... ..
1''-
'- 1 ~I :: ·~
:: TI:: Vi; Cl':.: ..
; Ftf:: CI!~ ... ~, . ~ • Srl ;· n ;
11::..·
"',.
N~::
•
~ 'ft:111:-
llII--=! - - - - - -
. . I" .. .. .. · .
'"
~I ~
Bl1=-
li~Hf :
TI~W : III=:-
111:: Ir-:1 . - - - - - - -
j- , -
i'". · ·
I .' :
· --1
....~ r;~il (I~J ll~h 1~ui :..1
'-'- - . _-
'- ''.
w G
deGnlyter
- " - - 1 1...
Das Wort "Metall" kommt aus dem Griechischen von metalIon
(Bergwer k). Sie zeigen Unterschiede im Verhalten, die jedoch nicht so extrem unterschiedlich sind, wie sie bei Nicht-Metallen sind.
Der metallische Charater der Elemente wachst von oben nach unten und von rechts nach links.Die Eigenschaften bleiben im flüssigen Zustand erhalten und gehen erst im Dampfzustand verloren.
!:"'physikalische Eigenschaften von Metallen:
1.1.Theorie der Metallischen Bindung 1.1. t Thermische Leitfähigkeit
Zwei typische Eigenschaft von Metallen sind die elektrische und thermische Leitfähigkeit.
Seite: 3
'.;
j ..
~...
Versuchsaufbau:
Beschreibung:
Die Metall und Glasstange werden nahezu gleichzeitig gleichstark am Ende erhitzt.
Beobachtung:
Es ist zu sehen, daß die Kerzen auf dem Metall-8tab herunterfallen, da der Wachs geschmolzen ist, bei Glasstab nicht.
Die Valenzelektronen (die Elektronen der äußeren Schalen) sind beweglich und nicht an ein bestimmtes Atom gebunden.:
Es kommt zur Ausbildung eines Elektronengas.
'.'_..'
Abbildungl.I: _-- V ~ ~ ~ V V ... Elektronen- gas
Beispiel: Alluminium 666
Die kugelförmigen Al 3 + Rümpfe beanspruchen nur 18% des Gesamtvolums das Elektronengas den Rest des Volumens.
Die Elektronendichte bei den verschiedenen Bindungsarten : Abbildung 1.2:
Ionenbindung Kovalente Bindung Metallische Bindung ../
Na· CI- C
Natriumchloriq _ Diamant
C Mg
Magnesium
\
\
\
\
.j ' ,
Metallvortrag Tbomas Meistcrtnecht.
1.1.2 Leitung des elektrischen Stroms (Unterscheidung Metall, Halbmetall, Nichtmetall):
Das Energiebandermodell beruht auf folgender Erscheinungen:
Im isolierten Metallatom sind die Elektronen am Rumpf fest lokalisiert, im Metallverband kommt es zu einer Delokalisierung bestimmter Elektronen.
Zur Erklärung der Delokalisierung braucht man das MO-Verfahren.
Dabei sind MOs Wellenfunktionen mit dennen man mathematisch operieren kann .
Durch immer weitere Addition der MOs kommt es zu einer großen Anzahl von Linearkombinationen:
Wechselwirkung von Linearkombinationen
Lithiumatomen 2s-Elektronen
2 2
3 3
4 4
.. . ...
1g Lithium enthalt 10 23 Atome.
Abbildung 1.3 zeigt die "Verschmierung der Energieorbitale zum Leitungsband" . '
E 2p
2s
15
--_ .. - .... -
.- ----
-- .-
,
~.---= -'- - - - ... - ..
2 3 4 5 6
_ O CDie Energieorbitale unterliegen dem Pauli-Prinzip (jedes Orbital darf nur von zwei Elektronen mit entgegengesetzten Spin besetzt werden .)
Bei Schwefel gibt es keine delokalisierten Elektronen, da kovalente Bindungen vorliegen .
Aus vollständig leeren oder vollen Bändern resultiert kein
Elektronenfluß. aus nichtvollständigbesetzten oder überlappenden Bändern das Leitungsband.
Seite: 5
Metallvortrag 1bomas Meisterknecbt
Abbildung 1.4 SchematischeEnergiebänderdiagramme
Leitungsband Leitungsband
Valenzband
Metall
2.Versuch zur Leitfähigkeit
Schaltbild: c=Q)==~_'"""'I
'1'/
~---P""'" 0 - - - 1
~---l<
Verbotene Zone
. } Valenzband
"---~
Isolator
0.) &~eA~~ck.
~) ~(.A;~~eL k~sta.Ql
Beschreibung:
Mit dem Schaltkreis wird demonstriert, daß bei Berührung der Nadel am Metallquader der Stromkreis geschlossen wird, bei Berührung mit dem Schwefel Kristall jedoch nicht.
1.1.3 Metallischer Glanz:
Das im Metall vorhandene Energieband sorgt für die Auf- und Abgabe von Energie ( auch im sichtbaren Bereich des Lichts), 3.Versuch Kupferverspiegelung:
Materialien:
-Reagenzglas, ReagenzglaskJammer, Bunsenbrenner, Schutzbrille -250 ml Becherglas, gefüllt mit Kühlwasser,
-Carbonsäure,V(Säure) = 5 ml (Ameisensäure, w=98%; Essigsäure, w=99% ; Propionsäure, w = 99%),
-Wasserstoffperoxid, wO 30%; V(H202) = 2 ml.
- Kupferdraht m(Cu) = 20-30 mg.
Versuchsbeschreibung: (Abzug!)
Der abgewogene blank polierte Kupferblechstreifen wird mit der Schere in ca.
0,5 cm große Stücke geschnitten. Diese Kupferstückchen werden in ein
Reagenzglas eingebracht, welches bereits die Säure enthält. Man versetzt mit 1 ml Wasserstoffperoxid-Lösung und erhitzt zum Sieden. Hierbei schäumt das Reaktionsgemisch zu Beginn der Reaktion sehr stark und es kann zum
Überschäumen kommen. Um ein Überschäumen zu vermeiden, wird das
Reaktionsgemisch von Außen im bereitstehenden Kühlwasser (Becherglas)
gekühlt. Diese Prozedur muß u. U. mehrmals wiederholt werden, bis das
ganze Kupfer gelöst (zersetzt) ist und die charakteristisch gefärbte Lösung
vorliegt. (Nachdem etwa bis zur Hälfte eingeengt ist, kann zur
20H-(aq) Metallvortrag Thomas Meisterknecht
Vervollständigung der Reaktion mit einem weiteren ml Wasserstoffperoxid- LOsung versetzt werden - dies ist im Falle von Ameisensaure notwendig.) Schließlich wird die Kupfersatz-lOSUng vorsichtig bis zur Trockene
eingedampft und weiter bis zum Erscheinen des Kupferspiegels erhitzt. - Es empfiehlt sich, nicht über längere Zeit an der Luft weiter zu erhitzten, da sonst Oxidbildung (Luftsauerstoff) erfolgen kann.
Reaktionen:
1. RedoxvorganglOxidation des metallischen Kupfers:
(1) Cu(s) + H202(aq) ~ Cu 2+ (aq) + 2. Säure-Base-ReaktionNerlagerung des Gleichgewichtes:
(2) 20H-(aq)+ 2 H+(aq) + 2)(aq)
~ 2 H20(1) + 2X-(aq)
3. Eindampfen der Lösung und Auskristaliesieren der kupferverbindung:
(3) Cu 2+ (aq) + 2X(aq) ~ CuX2(s) 4. Thermische Zersetzung von CuX2(S):
(4) CuX2(s) ~ Cu(s) + aq 5. Thermische Zersetzung des Liganten:
(5) X2 ~ Zerstetzungsprodukte Versuchsdauer: 5-8 min
+ aq
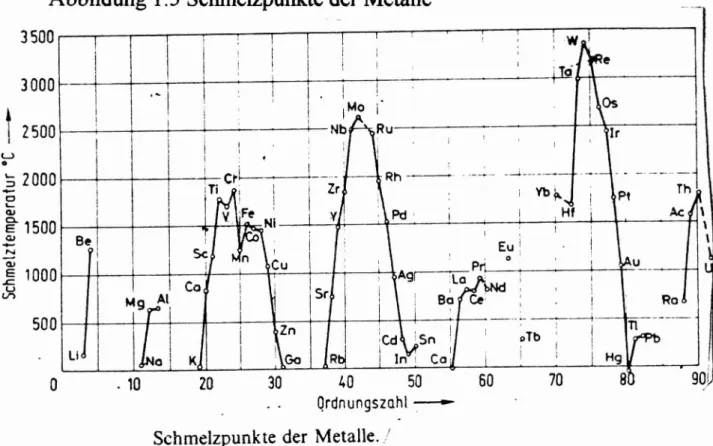
1.1.4 Schmelz und Siedepunkte von MetaUen allg.
Alle Metalle (außer Hg) sind fest bei Raumbed.. Die Schmelzpunkte liegen im Bereich von -38°C (Hg) - 3380°C (W).
Abbildung 1.5 Schmelzpunkte der Metalle
1
i
I I
I
!
!
!
!I
, Vb ;"
iPt
, '~ i
Co
Mg AI
I
t" i
I
!
JNo I K
,
I I i
Zn
\Go
30
I
I :
I Sr I
ARJ I
40
: , i
-Cd !S n '
I I
i In ! Ca 1
50
i 60 Qrdnungszahl -:--- Schmelzpunkte der Metalle . ./
Seite: 7
Metallvortrag Thomas MeisterkDcc.bt "
2. Kristalliner Aufbau von Metallen allg.
1.2.1 Mikrostruktur
Die Mikrostruktur besteht aus Metallekristalliten oder Konen.
{4.Versuch Zinngeschrei}
Material: linstab , 2 Halteklammem
Durchführung: Man spannt den linnstab in beide Klammem ein und übt auf ihn leichte Spannung aus. Man hört ein knarrendes Geräusch, das auf das Verschieben der Mikrostuktur des Zinn zurückzuführen ist.
..~_.
- - - --_. -
._.-_
.._~ _ . _...- - - Abb 1.6 Mikrostruktur
1.2.2 Herleitung der einfachsten drei Kugelpackungen
Metalleatome im Kristallgitter eines reinMetalls haben identische Ladungen und Atomradien. Es treten Wechselwirkung zwischen Elektronengas und Atomrümpfen auf Die maximale
Raumausfilllung beträgt 740/0.
Abb 1.7 Die drei wichtigsten Gittertypen in Periodensystem
OODO
.,;....:
kdp hdp krz , hdp/kdp
Metallvortrag Thomas Meisterknecht
a) Die Elementarzellen in einer kubischdichtsten Kugelpackung.
, > -- - . . . '. . .. . . . ._ -- . . .
- 0", -
• •
•
•
• •
T
I
Q)
b)
a) Flächenzentrierte kubi;;he Elementarzelle.
; b) Die Schichten dichteste~ck~ngJiegcn senkrecht zu den Raumdiagonaleu der EJemc:ntar-
7~J11" \
b) Die ElementarzeÜen ' in einer.hexagonaldichtsten KugelpackUng: - -
- t
c) Die Elementarzellen in einer Kubisch-raumzentrierten
Kugelpackung:
.\ I -- .
f
Die ' gezeichneten Atome gehören zu Nachbarzellen]
Jedes Atom hat 8 nächste
N~baP'lund 6 übcr- l
nächste N~~barn. die nur t 5% weiter entfe!:!,~ sind. '.
Z usammen assung: f1
Kp . Koordinationszahl: . : Raumerfüllung. .
kdp 12 74%
hdp 12 74%
krz 8 (14)* 680/0
*mit Ubemächsten nur 15% weiterentfernt ..
Seite: 9
Metallvortrag Thomas Meisterknecht
1.2.3 Veranschaulichung des Einflusses der Struktur auf die Eigenschaften:
Viele Metalle sind polymorph, z.B. Zinn (Zinnpest in Kirchen).
5.Versuch Zinn:
Material : Zinnstäbe, Verbrennungslöffel, Bunsenbrenner, Hammer,
Durchführung: Es wird gezeigt Das ein Zinnstab bei Zimmertemperatur gut biegsam ist. Erhitzt man ihn in der Bunsenbrennerflamme vorsichtig (nicht schmelzen) und biegt ihn. so bricht er. Als Erklärung dient die Polymorphie des Zinns.
a- Zinn
0( 18°C)ß- Zinn
0( J610c )z- Zinn
graues Pulver
tetragonal, silberweiß,
rhombisches sehr spröde
.,'
1.2.4 Erklärung der gute plastischen Verformbarkeit:
Sie kann nicht nur aus Kristallgitter resultieren, wie das folgende Experiment zeigen wird.
6.Versuch NaCI und Kupfer
Materialien: Kupferdraht, NaCI-Kristall. Hammer
Durchführung: Auf den Draht und das Kristall wird mit dem Hammer vorsichtig geschlagen. Der Kristall zerspringt, der Draht verformt sich nur.
Natriumchlorid und Kupfer haben ähnliche Kristallstrukturen. Den Kupferdraht kann man mit einem Hammer leicht platt klopfen, schlägt man auf ein Salzkristall zerspringt es in viele Teile .
Die gute Verschiebarkeit im Metall resultiert aus Metallbindung.
Abb 2.7 Verschiebung der Gitterebene in
a)Metallen
Metallvortrag Thomas Meisterknecht
b) Ionengittern:
-
.>
"
II..Chemische Eigenschaften von Metallen:
2.1. allgemeine Eigenschaften, Periodische Eigenschaften, 2.1.1 Der: Ionisierungsenergie:
Ist die mindest. Energie um ein Elektron aus einem Atom zu entfernen
Atom + Ionmsierungsenergte-o einfachpositive....Eei.Jon+ Elektron X+I ~X+ +e-
Abb 2.1 Ionisierungsenergie der Hauptgruppenelemente:
.f"TT"----r--r--:.---r--.-~--.~r--S'1r-:-,.
. ,- : '; F : :-
s,
5 U
21·lIl 39-4. ~·Il -. Ilrdnlllg$lchl -
Sie spiegelt die Stabilität von halbbesetzten Unterschalen wieder.
Seite : 11
-;".
MetallvortragThomas Meisterknecbt
2.1.2 Der ElektronenegativitAt:
Bez. für die Fähigkeit der an ehern. Bindungen beteiligten Atome von benachbarten Atomen innerhalb eines Mollekals gemeinsame
Elektronen unterschiedlich anzuziehen.
Abb 2.2 Elektronennegativität einiger Elemente:
Periode 1
Z 3 4
5 :.-
. . :1
.. I6 ~ es
o 2 3
Elelc.!~~negativität..
.. _
4
• Metalle o Halbmetal1e
• Nichtmetalle
Daraus folgt, daß die meisten Metall-Nichtmetallverbindungen einen ionischen Charakter haben (Differenz der EN-Werte >2,5)
2.2 Affinität von Metallen zu Sauerstoff:
Viele Metalle habe eine hohe Affinität zu Sauerstoff 7.Versuch : Verbrennung von Metallen:
Materialien: Eisenoxalat, Reagenzgläser, Uhrglas, ReagenzgJashalter, Bunsenbbrenner.
Durchführung: Das Eisenoxalat wird im Reagenzglas vorsichtig in der
Bunsenbrennerflamme erhitzt, bis es vollkommen schwarz ist. Schüttelt man dann das pyrophore Eisen über dem Uhrglas aus, reagiert es sich an der Luft mit dem Luftsauerstoff. Dauer: 2-3 min.
Versuchsgleichungen:
FeAc +
~H ~4Fe + 30
2 ~F e(pyrophore)
2 Fe
20 3
+
Metallvortrag Thomas Meisterknccht
2.3. Korrosion von Metallen:
2.3.1 Einleitung:
Es entsteht ein hoher wirtschaftlicher Schaden durch
Korrosion. 1967/68 lag der jährliche Verlust an Stahl durch Umwandlung in Rost bei ca. 350 000 t, das ergab einen
volkswirtschaftlichen Verlust durch Rostschäden von ca. 200 Mill.DM.
2.3.2 Korrosion:
Def: Unter Korrosion versteht man die Zerstörung von Werkstoffen durch ehern. oder elektro Reaktion in ihrer Umgebung,
2.3.2.1 ehern. Korrosision:
Def :chem. Korrosion ist die Reaktion von Metallen mit Gasen
Me + Az ~ Me+ + Az-
2.3.2.2 Elektrochem.Korrosion:
Oxidation und Reduktion sind örtlich von einander getrennt zum Beispiel:
Anode: Fe
-40Fe
2++ 2e- Kathode: !.... O
2+ H
20+ 2e-
-4020n-
2
8.Versuch :Galvanisches Element:
Geräte: Pneumatische Wanne, Kochsalz, Leitungswasser,
Kaliumhexacyanoferrat(III) , Phenolphtalein , Eisenblech, KupferbI ech, Draht, Holzstäbchen.
Durchführung : Eine Pneumatische Wanne wird mit 50 ml Leitungswasser gefüllt, dem 10g NaCI, 1g !<J[Fe(CN)61 und 1 ml alkoholische
Phenolphtaleinlsg zugesetzt worden sind.
Jeweils gleich große Bleche aus Eisen und Kupfer werden an einen
Holzstäbchen so befestigt, daß sie senkrecht in die Lösung tauchen . Beide Metalle werden leitend miteinander verbunden . Das Experiment läßt sich auch sehr gut auf dem Overheadprojektor demonstrieren.
Es tritt eine leichte Blaufärbung ("Tumbullsblau") an dem Eisenblech und eine leichte Rotfärbung arn Kupferblech (Hydroxidionen + Phenolphtalein) auf.
Reaktionsgleichung:
4Fe
2++ 4[Fe3+(CN)6t
-40[Fe3+(CN)6t + (Fe3+)[Fe3+(CN)6h
1/20
2+ H
20+ 2e" ~ 20H
Seite: 13
MetaJJvortrag Thomas Meisterknecht
2.3.3 Korrosionsscbutz:
Optimaler Schutz durch eine Schutzscbicht bedarf:
1 )ehern. Widerstandsfähigkeit der Schutzschicht.
2) notwendige Harte der Schutzschicht, 3) Verforbarkeit der Schutzschicht, -andere Schutzmaßmahmen sind:
-Veränderung der Umgebung des Metalls, -Beeiflussung der Metalleigenschaften, -Schutzwirkung durch überzug.
2.4. Metalle ihren Rohstoffen und ihre Bedeutung,
2.4.1 Wirtschaftliche Bedeutung von Metalle -Metallproduktion als Wirtschaftsfaktor,
Abb 2.3 Entwicklung der Weltproduktion ausgewählter Metalle:
lDtlJ 10
13
Entwi4:klunl der Wehproduklion
.usse....
lhftcr Metalle ab 192'(7.2. 7.31 ___~ N°MI.- . rg
]94$ 7955 1'65 ~75
lJ85
Jahreszahl
3
2
o
200
Joo
700 71
n
Metallvortrag Thomas Meisterknecht
2.4.2 Vorkommen der meisten MetaUe
Die primären Rohstoffe sind Erze.
Def Erze sind Mineralgesteine, die die ökonomische Herstellung von Metallen gestatten.
Man trennt die Erze in oxidisch und sulfidische Erze . Abb.2.4 Bindungsgruppen der Metalle in den Mineralien:
V l.·· , uu:hf-
U
fMraJlrO
Nr.:~,oJlt',,,,-7 8 I 9
N 0 I F
"
15 ' 16 : 17 Si I 0
!
S : CI33 , 34 35
i
2; He
10 N.
18 Ar 36
~r
2.4.3 Metallgewinnung aus den Erzen:
Abb .2.5 Schema zur Metallgewinnung:
C ',- -
---- ~; " ,
I •
Seite : 15
1
:i
:'
• :?OItmt'tmJ4
I,;«JJ/id·C!i'Ut.,.·...;.1/?J'I l
j(r,. ~. "".11..;,.: .. ,
I
L i
,
I i
I I
- - - -- , -- - - -,
I
I
0.,",,,,,"I .
I I
I 1 I
: I
~..,.n.ql.JO'~4u~'!O>'r ~I [ ~01'""!"'Qf I i .\
~- - -i . .' 1 \
j
I
.""V""'$L~ <4J.J/~.""f~r
I'm..'. ,
:lr. r~IJ:J·
~~faltf'M
...,tl9:;
!J,",_
I:(1"'CuI ,
-------~
. .
' .'~Mefallvorttag Tbomas Meistcrtnccht
a) ehern Reduktion:
9.Versueh: Aluminothermische Reduktion von Eisen
'.','Materialien: Blumentopf, Fe203, AJuminiumgrieß, Bariumoxid,Magnesium, Zündschnur, Sandbad, Magnet.
Versuchsbeschreibung: Der Blumentopf (Boden mit Loch) wird mit folgendem Gemisch gefüllt: 240g Fe203 (trocken,pulverisiert) und 100 9 AJuminiumgrieß . Vor dem Füllen wird das Loch im Tiegel mit Papier abgedeckt. Dann drückt man ein Loch in die Mischung und füllt es mit einer Zündmischung aus 5 9 8a02 und 7g Magnesiumpulver. In die "Zündkirsche" kommt die Zündschnur.
Man zündet in dem Sandbad unter einem Abzug.
Es tritt eine heftige Reaktion ein . In dem abgekühlten Reaktionsprodukt läßt sich mit einem Magneten nach Zerkleinerung metall. Eisen nachweisen.
Reaktionsgleichung:
AI + Fe203 ~ Ab03 + Fe
b) elektrische Reduktion:
lO.Versuch: Zinnbaum :
Materialien: Stativ, tubulierter Zylinder, Kupferelektrode, Zinnelektrode, 2 Klemmen, Kupferdraht mit Stecker, Gleichstromquelle, Stellwiderstand, Dreifuß, Glasrohr, 2 durchbohrte Stopfen, Becherglas, Abdampfschale, Stopfen mit eingebrantem Loch, Zinnfolie, Salzsäure
Versuchsbeobachtung:
a) Ein tubulierter Zylinder wird an einem Stativ befestigt. Als Anode wählt man ein Zinnblech, an dessen unterer Fläche ein dicker Kupferdraht angelötet wird. Man isol iert den Kupferdraht gegen den Elektrolyten, indem man einen kleinen Stopfen, durch den vorher mit einem Draht ein Loch gebrannt wurde, über den Kupferdraht bis dicht auf die Lötstelle schiebt und den Stopfen zuletzt in eine Glasröhre einpaßt. Diese führt man durch die Bohrung des Stopfens, der den Zylinder unten verschließt. In den oberen Teil des Zylinders hängt man eine Kupferkatode , die aus einem Kupferblech besteht, an das ein Kupferdraht angelötet ist. Beide Elektroden sollen voneinander einen Abstand von etwa 20 cm haben .
b) Als Elektrolyt dient eine konzentrierte Zinn(II)-chloridlösung, die man durch Auflösen reiner Zinnfolie in Salzsäure erhält. Die Lösung füllt man in den vorbereiteten Zylinder. Nun schaltet man die Kupferelektrode als Katode und die Zinnelektrode als Anode und verbindet beide unter Zwischenschalten mit einer Gleichstromquelle von 3,5 - 4 V. Man schaltetden Strom ein und
reguliert ihn derart, daß an der Katode kein Wasserstoff entwickelt wird.
Ergebnis: An der Katode scheidet sich Zinn in glänzenden, bandförmigen
Streifen ab, die sich seitlich verzweigen (Zinnbaum).
Elektrolyse von Zinn(lI)chlorid:
".~,
,"·r
:---
~+$»Ip". ' , \
1$."". I
---~ I
. •
~.':".'..
·;r~·.,~~• • •"1-~~ "~
> \'} -,
'':'~.\ ',
Tlttltb,;, '
f:,' ...
..
;."~..LIMflJ-dtloritt-
~ Ilsunq . ,
r~
All;"" änlt...
/10.7'" Stopfrn.
.,-,_._.--~.