Kreislaufschließung beim Recycling von Nickelmetallhydrid-Akkumulatoren
Matthias Kaindl, Alexander Poscher und Stefan Luidold
1. Einleitung ...322
2. Selektive Gewinnung von Metallen und Verbindungen aus wässrigen Lösungen ...323
2.1. Elektrolyse von Nickel und Cobalt ...324
2.1.1. Cobaltelektrolyse ...324
2.1.2. Nickelelektrolyse ...325
2.2. Fällung und Kristallisation von Verbindungen ...326
2.3. Wasserstoffreduktion ...326
2.4. Solvent-Extraktion ...328
3. Bisherige Entwicklungen und deren Probleme ...330
3.1. Fällung von Metallsulfiden ...330
3.2. Laugenreinigung mittels Elektrolyse ...331
4. Laugungs- und Fällungsversuche von Nickelmetallhydrid-Akkumulatoren ...333
5. Kreislaufführung der wässrigen Phase ...336
6. Zusammenfassung und Ausblick ...338
7. Literaturverzeichnis ...338
Die hydrometallurgische Aufarbeitung von Nickel-Metall-Hydrid Akkumulatoren wurde schon in verschiedenen vorangegangenen Versuchen erfolgreich durchgeführt.
Zur Vermeidung von großen Abwassermengen und der Verringerung des Verbrauchs an Salzsäure erfolgten am Lehrstuhl für Nichteisenmetallurgie der Montanuniversität Leoben Untersuchungen zur Fällung der Seltenen Erden in Form von Oxalaten und zur Zirkulation der wässrigen Phase zur Schließung des Kreislaufes. Es konnte gezeigt werden, dass die Volumina deutlich geringer sind, wenn zur Einstellung des pH-Wertes
für die SE-Fällung keine großen Mengen an NaOH-Lösung hinzugefügt werden, außer- dem kann durch Fällung bei geringen pH-Werten die Lösung zur erneuten Laugung von NiMH-Zellen Einsatz finden.
1. Einleitung
Bei der Anwendung von mobilen Energiespeichersystemen spielt die Leistungsfähigkeit eine große Rolle. Die Energie- bzw. Leistungsdichten von unterschiedlichen wieder- aufladbaren Batterien ist in Bild 1 dargestellt, die zurzeit besten Ergebnisse liefern die verschiedenen Varianten der Lithium-Ionen-Batterien (kurz: LIB), Nickelmetallhy- drid-Akkumulatoren (kurz: NiMH-Akku) werden hauptsächlich als Nachfolger von Nickelcadmium-Zellen verwendet.
100.000
1.000 10.000
10 100 Leistungsdichte W/kg
0 20 40 60 80 100
Energiedichte Wh/kg Super-Kondensatoren
120 140 160 180 200
Li-Ion very high power Li-Ion high power
Li-Polymer Li-Ion high energy Bleisäure
Ni-Cd Ni-Mh 1
Bild 1: Energie- und Leistungsdichten von verschiedenen Batteriesystemen
Quelle: Guibert, A. de: Critical materials and alternative for storage batteries. Online: http://energy.gov/sites/prod/files/Session _B6_Anne_de_Guibert.ppt, Abruf: 20.11.2011
Im Bereich der Hybridfahrzeuge (HEV) bleiben laut Pillot[2] die NiMH-Systeme noch bis etwa 2020 dominierend, während bei reinen Elektrofahrzeugen (kurz: EV) die LIB den größeren Bereich abdecken. Die Haupteinsatzgebiete neben HEV´s sind heutzutage tragbare Anwendungen, wie Akku-Werkzeuge, Modellsport usw., bei Handy-Akkus
wurden sie komplett von lithiumbasierenden Systemen ersetzt. Die Produktions- mengen für wiederaufladbare Batterien in Europa, mit einer Aussicht bis 2015, sind in Bild 2 dargestellt, der Anteil an NiMH-Batterien stellt sich bei etwa 10.000 t/Jahr ein, während die Zuwächse in diesem Markt von den LIB abgedeckt werden. Ein großer Wachstumsschub wird im Bereich der Microhybrid-Fahrzeuge gesehen, dabei kann durch die Verwendung von verbesserten Blei-Akkumulatoren eine kostengünstige Va- riante zur Verringerung der CO2-Emission bzw. des Kraftstoffbedarfs erzielt werden.[2]
60.000
30.000 40.000 50.000
10.000 20.000 Tonnen pro Jahr
2008 2009 2010 2011 2012 2013 2014 2015
Li-Ion NiMH NiCd
0
Bild 2:
Markt in Europa für wiederauf- ladbare Batterien
Quelle: Pillot, C.: Strategic analysis of Lithium ion Battery (LIB) business opportunities for FMC. Online: http://
www.rechargebatteries.org/Portable_Re- chargeable_Battery_Market_in_Europe _ _ 2 0 0 8 - 2 0 1 5 _ - _ Ja n _ 2 0 1 1 . p d f , Abruf: 21.11.2011
Das Recycling von Batterien wird von der Europäischen Union durch zwei Verordnun- gen vorgeschrieben (2006/66/EG[4] und 2008/12/EG[5]), in Österreich wurden diese als sogenannte Batterienverordnung [6] in geltendes Recht übernommen.
Das Verwerten von gebrauchten NiMH-Akkus findet meist auf pyrometallurgischem Wege statt, hauptsächlich wird auf die Elemente Nickel (bis 42 Gew.-%), Eisen (bis 25 Gew.-%) und Cobalt (bis 4 Gew.-%) abgezielt. Das Produkt ist eine Ferrolegierung, welche in der Stahlveredelung Einsatz findet. Die enthaltenen Seltenen Erden, mit einem Anteil von bis zu 10 Gew.-%, gehen bei dieser Behandlung in die Schlacke.
Um eine SE-Gewinnung durchzuführen, muss eine zusätzliche hydrometallurgische Aufarbeitung der Schlacke stattfinden.
2. Selektive Gewinnung von Metallen und Verbindungen aus wässrigen Lösungen
Bei hydrometallurgischen Verfahren wird oftmals eine große Anzahl an unterschied- lichen Stoffen in sauren oder basischen Medien in Lösung gebracht. Im Falle der NiMH-Akkus sind dies hauptsächlich die Elemente der Seltenen Erden, Eisen, Nickel
und Cobalt. In Tabelle 1 werden die Zusammensetzungen von unterschiedlichen NiMH-Batterietypen aufgelistet. Für eine hydrometallurgische Aufarbeitung dieser Zellen ist es zu Beginn notwendig, die zu rezyklierenden Elemente möglichst vollständig in Lösung zu bringen.
Zylindrische Prismatische Zellen aus HEV´s Zellen Zellen (nur Metalle) Gew.-%
Nickel 36 – 42 38 – 40 47 Eisen 22 – 25 6 – 9 30,8 Cobalt 3 – 4 2 – 3 3,7 La, Ce, Nd,
Pr, Sm 8 – 10 7 – 8 11,8 Grafit < 1 < 1 – Kunststoffe 3 – 4 16 – 19 – Kalium 1 – 2 3 – 4 3,1 Wasserstoff,
Sauerstoff 15 – 17 16 – 18 – Rest 2 – 3 3 – 4 3,6
Tabelle 1:
Zusammensetzung von unter- schiedlichen NiMH-Zelltypen
Quellen:
Larsson, K.; Ekberg, C.; Ødegaard-Jensen, A.: Dissolution and characterization of HEV NiMH batteries. Waste Manage- ment, Ausgabe 33., 2013 S. 689-698 Weyhe, R.: Stoffliche Verwertung mo- derner Batteriesysteme. In: Recycling und Rohstoffe, Band 3. Neuruppin:
TK Verlag Karl Thomé-Kozmiensky, 2010, S. 663-674
Müller, T.; Friedrich, B.: Development of a recycling process for nickel-metal hyd- ride batteries. Journal of Power Sources, Ausgabe 158, 2006, S. 1498-1509
Eine große Herausforderung bei der Extraktion dieser Metalle aus der Lösung ist die selektive Gewinnung von einzelnen Elementen bzw. Verbindungen, in den nachfol- genden Kapiteln sind die grundlegenden Mechanismen zur Trennung erklärt.
2.1. Elektrolyse von Nickel und Cobalt
Für die beiden Metalle ist es möglich, jeweils eine wässrige Elektrolyse durchzuführen, dabei kann ein Einsatz von löslichen (Raffinationselektrolyse) als auch von unlöslichen (Gewinnungselektrolyse) Anoden stattfinden. Bei der Raffinationselektrolyse erfolgt ein Auflösen eines als Anode geschalteten Vormaterials, welches noch hohe Mengen an Verunreinigungen bzw. Begleitelementen enthält, und anschließender Reduktion an einer Kathode. Im Gegensatz dazu dient die Gewinnungselektrolyse der Abscheidung von bereits in einer Lösung vorliegenden Ionen an einer Kathode, die Anode besteht in diesem Falle aus einem unlöslichen Material, wie z.B. Blei oder Grafit.
2.1.1. Cobaltelektrolyse
Bei der Elektrolyse muss mit einem Diaphragma gearbeitet werden, welches den Katholyten vom Anolyten trennt, der sogenannten Hybinette-Zelle. Der Anolyt wird laufend abgezogen und einer Laugenreinigung unterzogen.[10]
Der pH-Wert bei der Raffinationselektrolyse beträgt zwischen 3,3 und 4,8 und die Zellspannung wird auf einen Wert zwischen 1,2 und 1,8 V eingestellt. Der Gehalt an Co in der Lösung kann bis zu 120 g/l betragen, eine Stromausbeute von 95 Prozent ist erreichbar.[10]
Bei der Gewinnungselektrolyse ist eine selektive Abscheidung des Cobalts möglich, da dieses aufgrund der höheren Metallüberspannung bevorzugt abgeschieden wird. Die pH-Werte mit 5,5 bis 6,5 als auch die Zellspannung ist mit 4 bis 5 V sind im Vergleich zur Raffination höher, während die Co-Konzentration mit 20 bis 80 g/l deutlich nied- riger ist. Eine Stromausbeute von bis zu 95 Prozent ist möglich, dazu sind Tempera- turen zwischen 50 bis 60 °C und Stromdichten von 250 bis 500 A/m2 notwendig. Eine Kathodenreise dauert vier Tage, das abgeschiedene Cobalt muss noch im Elektroofen umgeschmolzen werden.[10]
2.1.2. Nickelelektrolyse Für die Elektrolyse von Nickel kommen hauptsächlich Sulfat/Chlorid-Elektrolyte zum Einsatz, wobei auch reine Sulfat- bzw. Chlorid-Elektrolyte möglich sind. Bei der Raffination von Anoden aus Rohnickel erfolgt ein Auflösen der enthaltenen Verun- reinigungen (Cu, Co, Fe, Pb und As), das Abscheiden dieser Elemente an der Kathode muss jedoch verhindert werden. Dazu muss, wie bei der Co-Elektrolyse, die Nutzung einer Hybinette-Zelle stattfinden, welche die Zuleitung des kathodischen Elektrolyten innerhalb des Diaphragmas diesen vom Anolyten trennt und die Abscheidung von Begleitelementen an der Kathode verhindert. Die Temperatur für den Prozess beträgt etwa 60 °C, die Badspannung bei Sulfat/Chlorid-Elektrolyten beträgt etwa 1,6 V und die Stromdichte 110-135 A/m2. Der Energieverbrauch pro produziertem Kilogramm Nickel (99,5 Prozent) ist etwa 4 kWh[11]. Eine Entfernung von eventuell enthaltenem Kupfer wird durch Zugabe von Nickel erreicht, dies führt zu einer Zementationsreak- tion. Eine Fällung mittels Schwefelwasserstoff ist auch möglich, dabei erfolgt ebenfalls ein Ausfallen von Arsen. Die Eisenentfernung basiert auf Luftoxidation und Hydrolyse, wodurch Eisen(III)-Hydroxid ausfällt. Auch das Cobalt kann in Form eines Hydroxides gefällt werden, dies geschieht bei pH-Werten von etwa vier, unlösliches Bleisulfat lässt sich durch Zugabe von Bariumkarbonat bilden. Eine typische Zusammensetzung eines gereinigten Elektrolyten ist in Tabelle 2 aufgelistet.[11]
Element/
Verbindung Ni SO42- Na+ Cl- H3BO3 g/l
60 95 35 55 20
Tabelle 2:
Typische Zusammensetzung eines gereinigten Elektrolyten bei der Ni-Elektrolyse
Quelle: Lossin, A.: Kupfer und Nickel.
In: Chemische Technik: WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2006, S. 609-668
Der aus den löslichen Anoden entstehende Schlamm wird aufgrund der hohen Gehalte an Wertmetallen ebenfalls aufgearbeitet. Eine Verwendung von Nickelfeinstein als Anode ist auch möglich, die Stromausbeute ist mit 95 Prozent jedoch geringer als bei der Verwendung von Rohnickel (99,5 Prozent).[11]
2.2. Fällung und Kristallisation von Verbindungen
Die Stabilität von Metallionen in einer Lösung kann durch die Zugabe von gewissen Reagenzien beeinflusst werden, es bilden sich Verbindungen, welche in einem bestimm- ten pH-Wertbereich stabil sind. Wenn die Löslichkeit dieser Stoffe im vorherrschenden Medium niedrig ist, fallen die gebildeten Produkte aus der Lösung aus und es bildet sich ein fester Niederschlag, eine anschließende Filtration dient zur Gewinnung des Feststoffes. Eine allgemeine Fällungsreaktion wird in Formel 1 dargestellt, dabei bildet sich ein stabiles Hydroxid.
Me3+ + 3 OH– + 3 M+ → Me(OH)3 + 3 M+ (1)
Abhängig von der Art der Verbindung ist es eventuell notwendig, eine pH-Wert- Anpassung durchzuführen, wie z.B. bei der Bildung von Sulfaten muss ein Wert > 2 vorliegen, während beispielsweise ein Metalloxalat auch bei einem pH-Wert von 0 ausfällt. Eine weitere Möglichkeit liegt in der Form der Komplexzerstörung, diese wird durch Zugabe von bestimmten Reagenzien erreicht. Auch eine Oxidation bzw. Reduk- tion von gelösten Elementen könnte zu einem Ausfallen von Verbindungen führen.[12]
Die Unterschreitung der Löslichkeit einer Verbindung kann außerdem durch Aufkon- zentrierung erfolgen, dabei wird die Sättigungskonzentration überschritten und eine Kristallisation einer Verbindung findet statt. In diesem Salz ist meist noch Kristallwasser enthalten, wie in Formel 2 dargestellt.
Me2+ + 2A– + x H2O → MeA2• x H2O (2)
Die Bildung von Kristallen beruht auf dem Wachstum von primären oder sekundären Keimen, wobei die sekundären, wie z.B. Staub, Abrieb, Reaktorwände oder andere Fremdpartikel, industriell deutlich häufiger Anwendung finden.[13]
Um eine Trennung von mehreren Metallionen in einer Lösung zu realisieren, darf nicht das gesamte Volumen eingedampft werden, da sich Mischsalze bilden. Beim Verflüchtigen nur eines bestimmten Teils des Lösungsmittels bleibt in der restlichen wässrigen Phase meist eine hohe Konzentration des Metallsalzes enthalten.
2.3. Wasserstoffreduktion
Die Reduktion von Nickel bzw. Cobalt aus einer wässrigen, sulfidischen Lösung mittels Wasserstoff wurde von Sherritt-Gordon entwickelt.[14] Die Laugung des Ausgangs- materials erfolgt in einem Autoklaven bei 70 bis 90 °C mittels einer ammoniakalischen Lösung. Ein Einblasen von Luft dient zur Umwandlung des im Grundstoff enthaltenen Sulfidschwefels zu Sulfat, Thiosulfat und weiteren Schwefelverbindungen. Die löslichen Aminsalze von Ni, Co und Cu gehen in die wässrige Phase, während das unlösliche Eisensulfid und Eisenhydroxid als fester Rückstand übrig bleiben. Die eigentliche
Wasserstoffreaktion findet bei einem H2-Partialdruck von 2,8 MPa und einer Tempe- ratur von 170 bis 200 °C statt, als Keimbildner und Katalysator dient Eisensulfat. Die Reduktion findet laut Formel 3 statt.[15]
[Me2+] Lsg. + {H2} → Me0 + [2 H+] Lsg. (3) Das entstandene Nickelpulver weist eine Reinheit von bis zu 99,8 Prozent auf, Cobalt, welches noch in der Restlösung enthalten ist, kann durch eine Sulfidfällung gewonnen werden.
Eine weitere Möglichkeit der Wasserstoffreduktion ist die von Ahn et al.[16] beschrie- bene Reaktion von inertem Nickeloxidpulver mit Wasserstoff. Dazu erfolgt ein Auflösen des NiO gemeinsam mit verschiedenen Zusätzen, unter anderem NiSO4 und K2HPO4, unter erhöhter Temperatur und hohem Druck. Die Einleitung von Wasserstoff führt nach Formel 4 und Formel 5 zu reinem, metallischem Nickel.
NiO + 2 H+ → Ni2+ + H2O (4)
Ni2+ + H2 → Ni0 + 2 H+ (5)
Die Reaktion ist in einem pH-Wertbereich zwischen vier bis sechs möglich, wie aus dem Pourbaix-Diagramm in Bild 3 zu sehen.
Bild 3:
Pourbaix-Diagramm für Ni-H2O
Quelle: Ahn, J. G. et al.: Direct synthesis of nickel powders from NiO slurry by hy- drothermal hydrogen reduction process.
Hydrometallurgy, Ausgabe 102, 2010, S. 101-104
Die Reinheit des erzeugten Nickelpulvers beträgt etwa 99,5 Prozent und die Ausbring- raten sind annähernd hundert Prozent, bei einer Temperatur von 250 °C und einem pH-Wert von 5,4[16].
1,6
0,4 0,8 1,2
-0,8 -0,4 0 Eh,V
0 2 4 6
pH Ni Ni++
HNiO2- Ni(OH)2
H2 H2O
Ni3O4
Ni2O3 NiO2
8 10 12 14
-1,2 O2
H2O
2.4. Solvent-Extraktion
Die Trennung von gelösten Ionen aus einer Lösung kann auch aufgrund der unter- schiedlichen Löslichkeit der einzelnen Komponenten in zwei flüssigen, unmischbaren Phasen erfolgen. Diese sogenannte Flüssig-Flüssig- bzw. Solvent-Extraktion nutzt eine organische Phase, welche aus drei Bestandteilen besteht, sowie einem wässrigen Anteil.
Die Substanzen der org. Phase sind ein hochmolekulares Ionenaustauscherreagenz (5 bis 30 Gew.-%), ein flüssiges Verdünnungsmittel, z.B. Kerosin oder Xylol, (65 bis 95 Gew.-%) und zusätzlich kann auch ein Lösungsvermittler mit 1 bis 10 Gew.-% ent- halten sein, welcher eine unerwünschte Metallkomplexbildung verhindert.[10, 15, 17]
Bei der Solvent-Extraktion erfolgt eine Mischung der wässrigen Lösung, welche die verschiedenen Metallionen enthält, mit der organischen Phase. Dabei kommt es zu einem Stoffübergang von bestimmten Ionen in die Organik, wie in Formel 6 für Cobalt zu sehen ist.
Co2+ + 2 HRorg. ←→ CoR2org. + 2 H+ (6)
Die Trennung von Co und Ni aus einer wässrigen Lösung erfolgt durch einen Stoff- übergang des Cobalts in die organische Phase, das Raffinat, welches beinahe das ge- samte Nickel enthält, wird abgetrennt. Dazu wird der Dichteunterschied der beiden Substanzen ausgenutzt, die leichtere Organik schwimmt auf der wässrigen Lösung auf und kann in einer Settler-Apparatur separiert werden. Diese Reaktion bzw. der Stoffübergang ist pH-Wert abhängig, dies ermöglicht eine Extrahierung des Cobalts aus der organischen Phase. Die Ionenaustauscherreagenz ist spezifisch für bestimmte Ionen, die Abhängigkeit der Speziesaufnahme bzw. Extraktion vom pH-Wert ist in Bild 4 dargestellt. Diese Extraktionsisothermen gelten für 0,5 M Versatic 10 und 0,35 M LIX 63 bei einem Verhältnis der wässrigen zur organischen Phase von 1:1.[18]
Die vom zu extrahierenden Ion abgereicherte Lösung wird Raffinat genannt, aufgrund der Ähnlichkeit von Cobalt und Nickel kann bei einer einstufigen Extraktion keine vollständige Trennung erreicht werden. Die Gewinnung des Metallions aus der orga- nischen Phase nach der Dichtetrennung wird Strippen bzw. Reextraktion genannt und ist eine Umkehrung des ersten Schrittes. Eine Vermischung der beladenen Organik mit einer wässrigen Lösung, welche einen niedrigeren pH-Wert als die Ausgangslösung besitzt, führt zum Stoffübergang in die wässrige Lösung. Zur Erhöhung der Effizient erfolgt die Solvent-Extraktion im Gegenstromprinzip und über mehrere Stufen, eine schematische Darstellung ist in Bild 5 zu sehen. Dabei kann aus einer Ausgangslösung mit ursprünglich 235 mg/l Co und 2,8 g/l Ni eine beladene organische Phase mit 0,53 g/l Co und 10 mg/l Ni und ein Raffinat mit 5,3 mg/l Co und 2,8 g/l Ni erzeugt werden.
Nach dem Strippen der Organik sind 7,2 g/l Co und 5 mg/l Ni in der wässrigen Lösung enthalten. Dies bedeutet eine Anreicherung von einem Co:Ni-Verhältnis von 0,08 in der Ausgangslösung auf Co:Ni von 1.440 in der beladenen wässrigen Lösung.[17]
Bild 4: Extraktionsisothermen für verschiedene Metallionen
Quelle: Kerfoot, D.: Process for the separation of cobalt from nickel. US 5,468,281
Bild 5: Schematische Darstellung eines Scavenger-Kreislaufs für die Trennung von Co und Ni
Quelle: Soldenhoff, K.; Hayward, N.; Wilkins, D.: Direct solvent extraction of cobalt and nickel from Laterite-Acid Pressure Leach Liquors. In: Extraction & Processing Division EPD Congress 1998, S. 153-165
100
50 60 70 80 90
10 20 30 40 Extraktion
%
Nickel 1,5 2,0 2,5 3,0 3,5 4,0 4,5
pH-Wert
5,0 5,5 6,0 6,5 7,0 7,5 8,0
Zink Kupfer Cobalt Mangan Magnesium Calcium
0
Abfalllösung
Aufgabe Strip-Lösung
beladene Lösung
recyclierte Lösung Abwasser Salzhaltige
Lösung
Aufgabe
Speicher- becken Aufgabe
Reinigungs- lösung 1-stufige Reinigung
1-stufiges Waschen
5-stufige Extraktion Raffinat
Absetzbecken beladene organische Phase
3-stufiges Strippen
Zur Erhöhung des Durchsatzes muss der geschwindigkeitsbestimmende Schritt, der Übergang der Ionen von einer in die andere Phase, erhöht werden. Dies lässt sich durch eine intensive Durchmischung der beiden Lösungen und somit verbundene Oberflächenvergrößerung erreichen.
3. Bisherige Entwicklungen und deren Probleme
Vorangegangene Arbeiten[19, 20, 21] zeigen die Möglichkeit des Recyclings mit einem rein hydrometallurgischen Weg, dabei erfolgt die Gewinnung der Seltenen Erden in Form eines Doppelsulfates aus der Lösung. Das Problem besteht in den großen Men- gen an wässrigen Rückständen, welche hohe Gehalte an Wertmetallen (Nickel, Eisen und Cobalt) enthalten und noch aufzuarbeiten sind. Außerdem muss zur Fällung des Doppelsulfates eine Anpassung des pH-Wertes durchgeführt werden, dies führt dazu, dass die Restlösung (pH-Wert liegt bei etwa zwei) für einen weiteren Laugungsschritt nicht verwendbar ist. In den folgenden Unterkapiteln sind die Versuche zur Laugen- reinigung mittels Schwermetallfällung und Elektrolyse beschrieben.
3.1. Fällung von Metallsulfiden
Die Restlösung, aus welcher bereits die Seltenen Erden gefällt wurden, hat nach der pH-Wertanpassung noch relativ hohe Gehalte an Ni, Co und Fe. Die Konzentrationen in der Lösung sind in Tabelle 3 aufgelistet. Aufgrund dieser Analyse wurde versucht, die Metalle in Form von Sulfiden auszufällen.
Tabelle 3: Metallkonzentration in der Aus- gangslösung
Element Fe Co Ni mg/l
8.160 840 25.200
Die Zugabe des erforderlichen Schwefels wurde mit dem Reagenz Natriumhyd- rogensulfid nach dem Auflösen in ent- ionisiertem Wasser durchgeführt. Der Überschuss an erforderlichen Schwefel betrug zwanzig Prozent, für eine Lösung von 200 ml erfolgte ein Auflösen von 20,7 g NaHS, wodurch eine Konzentration von 100 g/l S erreicht wurde. Eine tropfenweise Zugabe führte zu einer kleinen Menge an sehr feinem Niederschlag, der mit einem Keramikfilter (Porenweite: 1,0-1,6 µm) gewonnene Feststoff hatte eine Masse von 1,35 g. Laut Berechnung sollten sich alleine für das Nickelsulfid etwa 7,8 g Fällungsprodukt ergeben, eine REM-EDX-Analyse zeigte sehr geringe Gehalte an Nickel bzw. Schwefel. Obwohl laut Formel 7 und Formel 8 eine Fällung der Wertmetalle in Sulfidform zu erwarten war, fand dies aufgrund der herrschenden Bedingungen nicht statt.[22]
Co2+ + S2– ←→ CoS ΔG(25 °C) = –127,1 kJ/mol (7) Ni2+ + S2– ←→ NiS ΔG(25 °C) = –131,6 kJ/mol (8)
3.2. Laugenreinigung mittels Elektrolyse
Neben der Sulfidfällung wurde auch mittels Elektrolyse versucht, die Lösung zu rege- nerieren, um diese für eine weitere Laugung zu verwenden und die Wertmetalle zu gewinnen. Die hierfür eingesetzte wässrige Phase stammt aus der NiMH-Laugung mittels HCl, nach der SE-Fällung, bei der etwa 174 g Feststoff abfiltriert wurden, und noch 11,5 g/l Nickel, 0,99 g/l Cobalt und 4,5 g/l Eisen im Filtrat enthalten waren. Die Versuchsdurchführung bzw. der Aufbau der Elektrolyse ist in Bild 6 zu sehen. Die eigentliche Elektrolysezelle war mit einem Teflondeckel versehen, durch die erhöhte Temperatur wäre es sonst zu einem Verdampfen des Elektrolyten gekommen. Die Badumwälzung erfolgte durch eine Pumpe, die Lösung wurde durch einen Tiefenfilter geleitet, um ausfallende Verbindungen zu entfernen und die Ausbeute der Elektrolyse nicht zu verschlechtern. Die Temperatureinstellung geschah mit einem Wasserbad.
1 Zelle 2 Tiefenfilter
5 1
4 2
3
3 Pumpe
4 T-Messung 5 Wasserbad
Bild 6:
Versuchsaufbau der Elektro- lyseversuche für die Laugen- reinigung
Als Versuchsparameter wurden die Temperatur zwischen 40 bis 80 °C, der Elektroden- abstand (10 bis 30 mm) und die Stromdichte (150 bis 400 A/m²) variiert. Drei beispiel- hafte Arten von kathodischen Niederschlägen bei unterschiedlichen Versuchsbedingun- gen sind in Bild 7 zu sehen. Bei hoher Temperatur und niedriger Stromdichte erfolgte eine schlecht haftende Abscheidung, welche sich einfach wieder ablösen ließ, während bei niedrigeren Temperaturen und höherer Stromdichten bessere Ergebnisse vorlagen.
In Summe waren eine selektive Metallgewinnung und eine pH-Wert-Anpassung durch Elektrolyse nicht möglich, durch Wasserstoffbildung während des Prozesses waren die Niederschläge außerdem sehr porös.
Zur Verdeutlichung des schichtweisen Aufbaus wurden EDX-Elementverteilungs- Mappings mit einem Rasterelektronenmikroskop durchgeführt, die Ergebnisse sind in Bild 8 zu sehen.
In den Schichten ist abwechselnd Ni, Co und Fe eingelagert, speziell bei den eisenhalti- gen Bereichen ist auch der Gehalt an Sauerstoff erhöht. Dies lässt auf eine Einlagerung des nicht komplett im Tiefenfilter abgeschiedenen Eisenhydroxides in das kathodisch
Versuch bei 60 °C und 256 A/m2
Versuch bei 80 °C und 150 A/m2
Versuch bei 40 °C und 356,25 A/m2
Bild 7: Niederschläge an der Kathode bei unterschiedlichen Parametern
Bild 8: Elementverteilungs-Mapping eines kathodischen Niederschlags
Quelle: Kaindl, M.; Luidold, S.; Poscher, A.: Recycling von Seltene Erden aus Nickel-Metallhydrid-Akkumulatoren unter be- sonderer Berücksichtigung von Säurerückgewinnung. Berg- und Hüttenmännische Monatshefte, Ausgabe 157, 2012, Seite 20-26
Nickel 800 μm
800 μm
800 μm
800 μm
Cobalt
Eisen Sauerstoff
abgeschiedene Metall schließen. Die Selektivität der Elektrolyse für eine Trennung von Nickel, Cobalt und Eisen war nicht gegeben, allenfalls als Reinigungsschritt zur Entfernung dieser Ionen aus der Lösung könnte der Einsatz möglich sein. Der ent- stehende Wasserstoff, welcher die Stromausbeute verringert, führt zu einer hohen Porosität der Probe.[20]
4. Laugungs- und Fällungsversuche von Nickelmetallhydrid-Akkumulatoren
In diesem Kapitel wird der erste Kreislauf der Laugung von NiMH-Zellen und der Fällung der Seltenen Erden bzw. des Nickels und Cobalts aus der Lösung beschrieben.
Im Gegensatz zu den bereits durchgeführten Versuchen, erfolgte die Fällung der Selte- nen Erden nicht in Form eines Doppelsulfates, sondern als SE-Oxalat, welches schon bei deutlich niedrigeren pH-Werten aus der Lösung ausfällt. Dadurch wird einerseits das Volumen der Lösung kleiner gehalten, da keine Anpassung mit einer zusätzlichen Lösung stattfinden muss, andererseits eignet sich die Lösung auch nach der Fällung noch, um weitere Laugungsschritte durchzuführen. Versuche zur Bestimmung der Zusammensetzung des Fällungsproduktes in Abhängigkeit vom Zeitpunkt der Filtration zeigten, dass der zuerst gebildete Feststoff aus einem relativ reinen Selten-Erd-Oxalat besteht. Je später die Filtration des Fällungsproduktes geschieht, desto höher wird die Konzentration an Nickel, Cobalt und Eisen. Aus diesem Grund ist die zeitliche Einhaltung der einzelnen Prozessschritte sehr wichtig, da ansonsten keine selektive Trennung der Seltenen Erden von den restlichen Bestandteilen erreicht werden kann.
Eine hundertprozentige Fällung der gesamten enthaltenen SE ist selektiv nicht reali- sierbar, da bei genügend langer Fällungsdauer eine Mitfällung von unerwünschten Elementen auftritt.
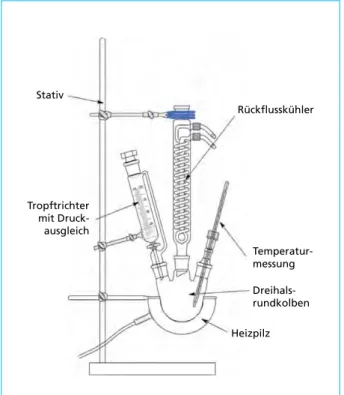
Das Ausgangsmaterial für die durchgeführten Versuche waren handelsübliche wie- deraufladbare NiMH-Zellen der Fa. Duracell mit einer Nennleistung von 2.400 mAh und 1,2 V. Für jeden Durchlauf wurde genau eine Zelle verwendet, das Volumen der wässrigen Phase betrug beim ersten Versuch zwei Liter. Als ersten Behandlungsschritt, für ein möglichst vollständiges Lösen der Wertstoffe, erfolgte eine Zerkleinerung des Ausgangsmaterials, um die Oberfläche zu vergrößern und somit der Säure ein schnelleres Auflösen zu ermöglichen. Dazu wurden die Zellen in vier gleich große Teile zerschnitten, gewogen und anschließend in die Laugungsapparatur, schematisch in Bild 9 zu sehen, chargiert.
Nach Zugabe der verdünnten Salzsäure wurde die Temperatur auf 60 °C gesteigert und die Badbewegung durch einen Rührknochen aktiviert. Die Laugung dauerte bei jedem Versuch ab dem Erreichen der eingestellten Temperatur sechs Stunden, eine Filtration trennte anschließend die unlöslichen Bestandteile von der wässrigen Phase. Die Analyse der gewonnenen Lösung ist in Tabelle 4 aufgelistet. Es ist zu sehen, dass die Hauptbe- standteile Nickel und Eisen sind, während Cobalt bzw. die Seltenen Erden in kleineren Mengen auftreten. Im Gegensatz zu vorhergehenden Untersuchungen ist der Anteil an Samarium in der Lösung gestiegen, während der Cer-Gehalt zurückgegangen ist. Dies deutet auf eine Änderung der Zusammensetzung der Wasserstoffspeicherlegierung hin.
Zur selektiven Gewinnung der Seltenen Erden aus der Lösung erfolgte eine überstöchi- ometrische Zugabe von 60 ml Oxalsäure mit einer Konzentration von 80 g/l H2C2O4. Nach einer Rührzeit von 24 Stunden und einer sichtbaren Ausbildung eines Nieder- schlags erfolgte die Filtration mit einer Nutsche der Porosität 4. Nach einer Trocknung bei 120 °C für 24 h wurde das gewonnene Pulver in ein feuerfestes Schiffchen chargiert und bei 750 °C für 6 h kalziniert, dabei erfolgte eine Überführung der Oxalate, welche auch noch anhaftendes Hydratwasser enthalten können, in deren Oxide. Die Analy- seergebnisse mittels Röntgenfluoreszenz (RFA) sind in Tabelle 5 aufgelistet. Es ist zu sehen, dass der Anteil an oxidischen Seltenen-Erden-Verbindungen mit > 99,5 Prozent sehr hoch ist, die Verunreinigungen sind hauptsächlich Oxide der Metalle Zirkonium, Nickel und Zink. Die Hauptbestandteile sind die Oxide von Lanthan bzw. Samarium, während Neodym, Cer, Yttrium und Praseodym nur in kleinen Mengen vorkommen.
Stativ
Tropftrichter mit Druck- ausgleich
Rückflusskühler
Temperatur- messung Dreihals- rundkolben
Heizpilz Bild 9:
Schematischer Aufbau der Lau- gungsapparatur für die NiMH- Behandlung
Tabelle 4: Zusammensetzung der Lösung nach dem ersten Durchlauf
Element Fe Co Ni Y La Ce Pr Nd Sm mg/l
2.150 202,5 6.025 17,5 1.242,5 30 5 22,5 300
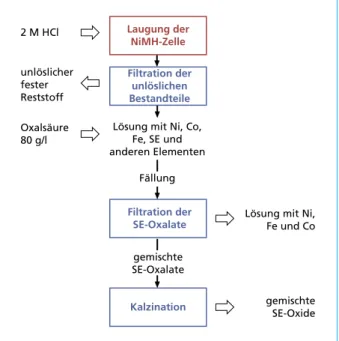
Neben dem oxidischen Pulver fällt noch eine zweite Fraktion an, die Restlösung, welche noch das Nickel, Eisen und Cobalt enthält, sowie die nicht vollständig mitausgefällten Seltenen Erden. Der Ablauf des ersten Prozessdurchlaufes ist in Bild 10 dargestellt.
Tabelle 5: Zusammensetzung des Pulvers nach der Kalzinierung
Verbindung La2O3 Sm2O3 Nd2O3 CeO2 Y2O3 Pr6O11 Cl ZrO2 NiO ZnO Gew.-% 49,03 44,44 2,67 2,24 0,97 0,204 0,155 0,141 0,122 0,0329
StdErr 0,25 0,25 0,08 0,07 0,048 0,044 0,008 0,01 0,029 0,0077
Bild 10:
Flow-Sheet der NiMH-Laugung, erster Prozessdurchlauf Die Analyse der Lösung nach der Oxalat-Fällung mit Ni, Fe und Co ist in Tabelle 6 aufgelistet. Es ist zu sehen, dass im Vergleich zur Analyse vor der Fällung die Werte an Eisen, Cobalt und Nickel annähernd gleich sind, während die Seltenen Erden deutlich geringere Konzentrationen aufweisen.
Tabelle 6: Zusammensetzung der Lösung nach der Oxalsäurefällung
Element Fe Co Ni Y La Ce Pr Nd Sm mg/l
1.950 187,5 5.550 5,0 322,5 5 0 2,5 10
Eine vollständige Fällung der Seltenen Erden konnte nicht erreicht werden, die Ex- traktionsraten liegen zwischen 71,42 Prozent für Yttrium und bis zu hundert Prozent für Praseodym.
2 M HCl Laugung der
NiMH-Zelle unlöslicher
fester Reststoff
Filtration der unlöslichen Bestandteile Oxalsäure
80 g/l
Filtration der SE-Oxalate gemischte SE-Oxalate
gemischte SE-Oxide Kalzination
Lösung mit Ni, Co, Fe, SE und anderen Elementen
Lösung mit Ni, Fe und Co Fällung
5. Kreislaufführung der wässrigen Phase
Aufgrund der hohen Gehalte an Wertelementen, wie Nickel oder Cobalt, und des niedrigen pH-Wertes erfolgte eine erneute Laugung einer zerkleinerten NiMH-Zelle mit der Restlösung aus dem ersten Laugungskreislauf. Dabei, wo die Einstellung der selben Parameter wie beim ersten Laugungsschritt stattfand, fällt bereits ein Feststoff aus. Eine Filtration sowie anschließende Trennung des Fällungsproduktes und der eigentlichen unlöslichen Bestandteile der Zelle führt zu insgesamt drei Fraktionen:
• Wässrige Phase: Gelöste Seltene Erden und das nicht ausgefällte Nickel, Cobalt und Eisen
• Unlösliche Bestandteile: Kunststoffseparatoren und nicht komplett gelöste Metall- fraktion
• Fällungsprodukt: Hydratisierte Oxalate von Nickel, Cobalt und Eisen
Der Ablauf ist in Bild 11 zu sehen, der prinzipiell gleich wie bei der ersten Laugung ist, jedoch erfolgt bereits während dem Laugen eine Fällung. Die festen Produkte nach der Laugung enthalten zusätzlich die Oxalate und müssen separiert werden.
Bild 11:
Flow-Sheet der NiMH-Laugung, ab dem zweiten Prozessdurch- lauf
Die Analyse der wässrigen Phase ist in Tabelle 7 zu sehen. Es ist zu erkennen, dass die Fällung von Eisen, Nickel und Cobalt nicht vollständig abgelaufen ist, die Konzent- rationen sind noch zwischen 275 mg/l für Co bis zu 8.400 mg/l für Ni. Die Werte für die Seltenen Erden sind im Vergleich zur ersten SE-Oxalatfällung wieder gestiegen.
HCl Laugung der
NiMH-Zelle
unlöslicher fester Reststoff + Ni-, Co- und Fe-Oxalate
Filtration der unlöslichen Bestandteile Oxalsäure
80 g/l
Filtration der SE-Oxalate gemischte SE-Oxalate
gemischte SE-Oxide Kalzination
Lösung mit Ni, Co, Fe, SE und anderen Elementen
Lösung mit Ni, Fe und Co
Fällung Fällung
Das während der Laugung gebildete hydratisierte Oxalat wurde bei einer Temperatur von 750 °C für sechs Stunden kalziniert, um das angelagerte Hydratwasser zu entfernen und die Oxalate in Oxide zu überführen. Die Analyse erfolgte anschließend mittels RFA, die Ergebnisse für die Kreisläufe zwei und drei sind in Tabelle 8 aufgelistet. Es ist zu sehen, dass die Selektivität bezüglich der Trennung der Gruppe der Seltenen Erden und Gruppe Ni, Co und Fe gut ist, der oxidische SE-Gehalt im Fällungsprodukt ist
< 0,9 Prozent.
Tabelle 7: Zusammensetzung der Lösung nach der Laugung eines zweiten Akkus und der dabei stattfindenden Fällung von Ni, Co und Fe
Element Fe Co Ni Y La Ce Pr Nd Sm mg/l
3.350 275 8.400 25 1.272,5 20 2,5 7,5 90
Tabelle 8: RF-Analyse des kalzinierten Fällungsproduktes nach dem zweiten und dritten NiMH- Laugungskreislauf
Laugungs- Verbindung
kreislauf NiO Fe2O3 Co3O4 Er2O3 ZnO La2O3 2 Gew.-% 80,12 14,98 3,33 0,797 0,555 0,0821 StdErr 0,20 0,18 0,09 0,081 0,027 0,0041 3 Gew.-% 83,53 12,42 2,74 0,715 0,521 0,0392 StdErr 0,19 0,16 0,08 0,069 0,026 0,0031
Wie bereits erwähnt, ist die Dauer der Fällung ein wesentlicher Einflussparameter, wenn die optimale Dauer für die Oxalatfällung der Seltenen Erden überschritten wird, ändert sich die Zusammensetzung des Fällungsproduktes. In Tabelle 9 ist die Analyse des kalzinierten Fällungsproduktes zu sehen, in diesem Fall dauerte die Fällung um 24 Stunden länger als im Normalfall. Es liegt eine oxidische Mischung aus allen in der Lösung vorhandenen Elemente vor, eine direkte Weiterverarbeitung dieses Stoffes bzw.
als Einsatz für die Primärerzeugung erscheint nicht sinnvoll.
Tabelle 9: Zusammensetzung des kalzinierten Fällungsproduktes bei zu langer Fällungsdauer Verbindung NiO La2O3 Sm2O3 Fe2O3 ZnO Co3O4 CeO2 Nd2O3 Y2O3 Gew.-% 40,76 26,66 12,72 11,71 2,8 2,27 1,14 1,01 0,542 StdErr 0,25 0,22 0,17 0,16 0,08 0,07 0,05 0,05 0,027
Zur Untersuchung des Einflusses des pH-Wertes erfolgten Versuche, bei denen der pH- Wert nach jedem Laugungskreislauf wieder auf einen bestimmten Wert durch Zugabe von HCl eingestellt wurde. In parallelen Versuchen fand eine Nutzung der Lösung für die Laugung direkt nach der SE-Oxalatfällung, ohne HCl-Zugabe, statt.
Wie erwartet, steigt der pH-Wert nach mehreren Laugungszyklen ohne HCl-Zugabe schnell an, die metallische Fraktion im Laugungsrest wird stetig größer. So war die verbleibende metallische Fraktion bei den Versuchen ohne HCl-Zugabe nach sieben Kreisläufen bei einem Wert von etwa 2,75 g, während bei jenen Experimenten mit Zugabe von frischer Salzsäure nach jedem Versuch nur etwa 1,75 g nicht aufgelöst wurden. Durch das Hinzufügen von Oxalsäure in wässriger Form konnte auch bei den Versuchen mit HCl-Zufuhr eine Vergrößerung des Volumens nicht verhindert werden. Aufgrund der Beschränkung des Volumens auf zwei Liter, erfolgte ab dem fünften Kreislauf auch hier keine Zugabe mehr. Weitere Versuche, bei denen die Vo- lumenzunahme durch Eindampfen der Lösung verhindert werden soll, sind geplant.
6. Zusammenfassung und Ausblick
Mit den Versuchen am Lehrstuhl für Nichteisenmetallurgie der Montanuniversität Leoben konnte gezeigt werden, dass eine selektive Trennung der Seltenen Erden und der Elemente Eisen, Nickel und Cobalt aus einer Lösung, welche durch Laugung von Nickel-Metallhydrid-Akkumulatoren erzeugt wurde, mittels Oxalat-Fällung möglich ist. Die Weiternutzung des Laugungsmediums, in diesem Falle eine verdünnte Salz- säure, für eine Verwendung im Kreislauf ist realistisch und die Zugabe von frischer HCl soll nur in einem sehr kleinem Ausmaß erfolgen. Ziel für weitere Forschungs- aktivitäten ist die Durchführung eines stabilen Prozesses, bei der so wenig Salzsäure wie möglich während eines Zyklus verbraucht wird. Der pH-Wert der Lösung ist ein wichtiger Einflussparameter, da bei zu geringen Werten keine Ausfällung der einzelnen Fraktionen möglich ist, andererseits kann bei einem zu hohen Wert keine vollständige Auflösung der Wertmetalle erreicht werden. Ein weiterer wichtiger Parameter ist die zeitabhängige Filtration, da bei zu langer Fällungsdauer keine selektive Trennung der Seltenen Erden von Eisen, Nickel und Cobalt möglich ist. Die gewonnen Fraktionen, einerseits ein SE-Mischoxid mit La2O3, Sm2O3, CeO2, Nd2O3 usw., andererseits die Oxide von Nickel, Eisen und Cobalt, müssen zur Gewinnung von verwertbaren Stoffen weiterverarbeitet werden, dabei erscheint es sinnvoll, die Seltenen Erden der primären Gewinnungsroute zuzuführen und eine Auftrennung in die einzelnen Elemente durch- zuführen, während die restlichen Oxide in Form einer Ni-Co-haltigen Ferrolegierung Einsatz finden können.
Danksagung
Die Autoren bedanken sich beim Bundesministerium für Wirtschaft, Familie und Jugend (BMWFJ) und der Österreichischen Forschungsförderungsgesellschaft mbH (FFG) für die finanzielle Unterstützung.
7. Literaturverzeichnis
[1] Guibert, A. de: Critical materials and alternative for storage batteries. Online: http://energy.gov/
sites/prod/files/Session_B6_Anne_de_Guibert.ppt, Abruf: 20.11.2011
[2] Pillot, C.: The Rechargeable Battery Market and Main Trends 2011-2020. Online: http://www.re- chargebatteries.org/wp-content/uploads/2013/04/Batteries-2012-Avicenne-Energy-Batteries- Market-towards-20251.pdf, Abruf: 05.12.2013
[3] Pillot, C.: Strategic analysis of Lithium ion Battery (LIB) business opportunities for FMC.
Online: http://www.rechargebatteries.org/Portable_Rechargeable_Battery_Market_in_Euro- pe__2008-2015_-_Jan_2011.pdf, Abruf: 21.11.2011
[4] Richtlinie 2006/66/EG des europäischen Parlaments und des Rates vom 6. September 2006 über Batterien und Akkumulatoren sowie Altbatterien und Altakkumulatoren und zur Aufhebung der Richtlinie 91/157/EWG, 2006
[5] Richtlinie 2008/12/EG des europäischen Parlaments und des Rates vom 11. März 2008 zur Änderung der Richtlinie 2006/66/EG über Batterien und Akkumulatoren sowie Altbatterien und Altakkumulatoren im Hinblick auf die der Kommission übertragenen Durchführungsbe- fugnisse, 2008
[6] Verordnung des Bundesministers für Land- und Forstwirtschaft, Umwelt und Wasserwirtschaft über die Abfallvermeidung, Sammlung und Behandlung von Altbatterien und -akkumulatoren (Batterienverordnung), 2008
[7] Larsson, K.; Ekberg, C.; Ødegaard-Jensen, A.: Dissolution and characterization of HEV NiMH batteries. Waste Management, Ausgabe 33., 2013 S. 689-698
[8] Weyhe, R.: Stoffliche Verwertung moderner Batteriesysteme. In: Recycling und Rohstoffe, Band 3. Neuruppin: TK Verlag Karl Thomé-Kozmiensky, 2010, S. 663-674
[9] Müller, T.; Friedrich, B.: Development of a recycling process for nickel-metal hydride batteries.
Journal of Power Sources, Ausgabe 158, 2006, S. 1498-1509 [10] Pawlek, F.: Metallhüttenkunde: Walter de Gruyter, 1983
[11] Lossin, A.: Kupfer und Nickel. In: Chemische Technik: WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2006, S. 609-668
[12] Gösele, W. et al.: Feststoffbildung durch Kristallisation und Fällung. Chemie Ingenieur Technik, Ausgabe 7, 1990, S. 544-552
[13] Rombach, E.: Grundlagen der Kristallisation aus wässrigen Lösungen. In: Schriftenreihe der GDMB Gesellschaft für Bergbau, Metallurgie, Rohstoff- und Umwelttechnik, Heft 82, Fortschrit- te in der Hydrometallurgie: Vorträge beim 34. Metallurgischen Seminar des Fachausschusses für Metallurgische Aus- und Weiterbildung der GDMB vom 18. bis 20. November 1998 in Goslar, Clausthal-Zellerfeld: GDMB-Informationsges, 1998, S. 11-28
[14] Schatt, W.; Wieters, K. P.; Kieback, B.: Pulvermetallurgie: Technologien und Werkstoffe, 2nd ed.:
Springer, 2007
[15] Gock, E.; Vogt, V.; Kähler, J.: Rohstoffaufbereitung. In: Chemische Technik: WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2006, S. 69-202
[16] Ahn, J. G. et al.: Direct synthesis of nickel powders from NiO slurry by hydrothermal hydrogen reduction process. Hydrometallurgy, Ausgabe 102, 2010, S. 101-104
[17] Soldenhoff, K.; Hayward, N.; Wilkins, D.: Direct solvent extraction of cobalt and nickel from Laterite-Acid Pressure Leach Liquors. In: Extraction & Processing Division EPD Congress 1998, S. 153-165
[18] Kerfoot, D.:Process for the separation of cobalt from nickel. US 5,468,281
[19] Kaindl, M.; Luidold, S.; Antrekowitsch, H.: Extraction of rare earths from used nickel metal hydride batteries. Proceedings EMC 2011, S. 1401-1415
[20] Kaindl, M.; Luidold, S.; Poscher, A.: Recycling von Seltene Erden aus Nickel-Metallhydrid- Akkumulatoren unter besonderer Berücksichtigung von Säurerückgewinnung. Berg- und Hüt- tenmännische Monatshefte, Ausgabe 157, 2012, Seite 20-26
[21] Luidold, S. und Antrekowitsch, H.: Rückgewinnung von Seltenen Erden aus Nickelmetallhydrid- Akkumulatoren. In: DepoTech 2010, Seite 301-306
[22] HSC Chemistry. 6: Outotec, 2006
Die Deutsche Bibliothek – CIP-Einheitsaufnahme Recycling und Rohstoffe – Band 7
Karl J. Thomé-Kozmiensky, Daniel Goldmann.
– Neuruppin: TK Verlag Karl Thomé-Kozmiensky, 2014 ISBN 978-3-944310-09-1
ISBN 978-3-944310-09-1 TK Verlag Karl Thomé-Kozmiensky
Copyright: Professor Dr.-Ing. habil. Dr. h. c. Karl J. Thomé-Kozmiensky Alle Rechte vorbehalten
Verlag: TK Verlag Karl Thomé-Kozmiensky • Neuruppin 2014
Redaktion und Lektorat: Professor Dr.-Ing. habil. Dr. h. c. Karl J. Thomé-Kozmiensky, Dr.-Ing. Stephanie Thiel, M.Sc. Elisabeth Thomé-Kozmiensky
Erfassung und Layout: Ginette Teske, Fabian Thiel, Janin Burbott, Cordula Müller, Katrin Krüger
Druck: Mediengruppe Universal Grafische Betriebe München GmbH, München
Dieses Werk ist urheberrechtlich geschützt. Die dadurch begründeten Rechte, insbesondere die der Übersetzung, des Nachdrucks, des Vortrags, der Entnahme von Abbildungen und Tabellen, der Funksendung, der Mikroverfilmung oder der Vervielfältigung auf anderen Wegen und der Speicherung in Datenverarbeitungsanlagen, bleiben, auch bei nur aus- zugsweiser Verwertung, vorbehalten. Eine Vervielfältigung dieses Werkes oder von Teilen dieses Werkes ist auch im Einzelfall nur in den Grenzen der gesetzlichen Bestimmungen des Urheberrechtsgesetzes der Bundesrepublik Deutschland vom 9. September 1965 in der jeweils geltenden Fassung zulässig. Sie ist grundsätzlich vergütungspflichtig. Zuwiderhand- lungen unterliegen den Strafbestimmungen des Urheberrechtsgesetzes.
Die Wiedergabe von Gebrauchsnamen, Handelsnamen, Warenbezeichnungen usw. in diesem Werk berechtigt auch ohne besondere Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Warenzeichen- und Markenschutz-Gesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürfen.
Sollte in diesem Werk direkt oder indirekt auf Gesetze, Vorschriften oder Richtlinien, z.B. DIN, VDI, VDE, VGB Bezug genommen oder aus ihnen zitiert worden sein, so kann der Verlag keine Gewähr für Richtigkeit, Vollständigkeit oder Aktualität übernehmen. Es empfiehlt sich, gegebenenfalls für die eigenen Arbeiten die vollständigen Vorschriften oder Richtlinien in der jeweils gültigen Fassung hinzuzuziehen.