Philipps-Universität Marburg FB 15: Chemie (Lehramt)
Übungen im Experimentalvortrag Referentin: Kristina Hildebrand SS 2004
Anorganischer Experimentalvortrag:
Silber
Hinweis:
Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule).
Dort können unterschiedliche Materialien für den Schulunterricht herunter geladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende:
http://online-media.uni-marburg.de/chemie/chids/veranstaltungen/uebungen_experimentalvortrag.html
Inhaltsverzeichnis
Seite
1. Einleitung 2
2. Historisches 2
3. Vorkommen 4
4. Darstellung 5
5. Verwendung 12
6. Elementares Silber 13
7. Silberverbindungen 22
8. Alltagsrelevanz – Schulrelevanz 25
9. Literaturverzeichnis 26
1. Einleitung
Das chemische Symbol für Silber lautet Ag und leitet sich aus dem Lateinischen „Argentum“ für weiß, hell, glänzend ab. Das Land Argentinien wurde aufgrund seiner großen Silbervorkommen nach dem Element Silber benannt. In der Regel ist es immer umgekehrt, chemische Elemente werden nach ihrem Fundort benannt.
In der Alchemie des Mittelalters wurde der Halbmond als Symbol für Silber verwendet, aufgrund seines Glanzes wurde Silber der Mondgöttin Luna geweiht.
Die Elemente der ersten Nebengruppe (11. Gruppe), zu denen neben Silber noch Kupfer und Gold
gehören, werden auch als Münzmetalle bezeichnet. Außerdem bilden diese Elemente zusammen mit den Platingruppenmetallen die Edelmetalle, was auf ihre Korrosionsbeständigkeit gegenüber Luftsauerstoff zurückzuführen ist.
2. Historisches
4000 v. Chr. Entdeckung von Silber als Nebenprodukt bei der ägyptischen Goldgewinnung.
3400 v. Chr. Gold- und Silberringe werden als Zahlungsmittel eingesetzt.
700 v. Chr. Beginn der Münzprägung in Griechenland. Aus dieser Zeit stammen die ersten Funde von Silbermünzen.
16. Jh. n. Chr. Blütezeit der mitteldeutschen Silberproduktion (Freiberg). 1515 wird in St. Joachimsthal der „Thaler“ als amtliche Währung des deutschen Reichs hergestellt, und damit die heutigen Begriffe „Taler“ und Dollar“ geprägt.
Um 1540 Entdeckung großer Silbervorkommen in Südamerika und deren Ausbeutung durch die Spanier.
Abb. 1: Der Halbmond als alchemistisches Symbol für Silber
Abb. 2: Griech. Münze
mit Bild von Homer
(700 v. Chr.)
Zunächst wurde Silber für Münzen und Schmuckstücke verwendet. Da das Reinmetall zu weich ist, wurde recht bald das Legieren entdeckt.
Legierungsmetalle waren zuerst Kupfer, später Zink, Cadmium, Zinn, Antimon, Magnesium, Nickel, Silizium und Phosphor.
Um die Echtheit von Silbergegenständen zu überprüfen, wurden im Mittelalter Farbe, Klang und Gewicht in Augenschein genommen. Zum Nachweis von Silber in Legierungen diente den Goldschmieden die sog.
Strichprobe. Dabei wurde das Metall über einen Schwarzschieferstein gerieben und auf den entstandenen weißen Strich ein Tropfen
„Silberprobierwasser“ gegeben. Rotfärbung zeigt Silber an. Dieser Versuch soll hier in leicht abgewandelter Form nachgestellt werden.
_____________________________________________________________________________________________________
V ERSUCH 1: N ACHWEIS VON S ILBER IN L EGIERUNGEN M ATERIAL : Pipette
C HEMIKALIEN : HNO 3 -saure Kaliumdichromatlösung (1 Spatelspitze K 2 Cr 2 O 7 auf 5 mL Wasser mit 3 Tropfen HNO 3 (konz.)
Silberlöffel
D URCHFÜHRUNG : Ein Tropfen der sauren Kaliumdichromatlösung wird auf den Silberlöffel gegeben und kurz einwirken gelassen.
Ein roter Fleck zeigt Silber an.
A USWERTUNG : Es bilden sich dunkelrotes Silberdichromat und braunes Silberchromat, betrachtet man die Kristalle unter dem Mikroskop, erkennt man tiefrote rhombische Säulen und rautenförmige Kristalle mit schief abgeschnittenen Ecken.
Im sauren pH-Bereich stellt sich ein Gleichgewicht zwischen Chromat und Dichromat ein:
Silber wird durch Dichromat oxidiert (E o Cr 2 O 7 2- /Cr 3+ = +1,33 V im sauren Bereich; E 0 Ag + /Ag= +0,7991 V):
O H 3 O
Cr O
H 2 CrO
2 2 4 ( aq ) 3 ( aq ) 2 2 7 ( aq ) 2
Oxidation:
Reduktion:
Anschließend findet eine Fällung von schwerlöslichem Silberchromat Ag 2 CrO 4 (braunrot) und Silberdichromat Ag 2 Cr 2 O 7 (rot) statt.
___________________________________________________________
3. Vorkommen
Der Gehalt von Silber in der Erdkruste ist mit 0,1 g/t (0,1 ppm) relativ gering. Aufgrund seines positiven Normalpotentials (E 0 = +0,799 V) kommt Silber in gediegener Form in der Natur vor. Des Weiteren gibt es Silbererze, besonders Silbersulfid, Doppelsulfide und Silberhaltige Erze:
Silbererze:
Ag
2S (Silberglanz, Argentit) CuAgS (Kupfersilberglanz) AgCl (Hornsilber)
Silberhaltige Erze:
PbS (Bleiglanz) enthält 0,01-1% Silber in Form von Ag
2S CuFeS
2(Kupferkies)
Die Gewinnung von Silber aus silberhaltige Erzen wie Bleiglanz und Kupferkies ist an den Bedarf nach Blei und Kupfer gekoppelt.
Die geografische Verteilung von Silber auf der Welt ist stark gestreut, was auf die starke Affinität von Silber zu Schwefel zurückgeführt wird.
Hochsilberhaltige Vorkommen entstehen meist durch Rekristallsation in Gebieten mit (ehemaliger) vulkanischer Aktivität, die Rekristallisation führt zur Bildung von Silbererzen (z. B. Ag 2 S).
6 Ag 6 e Ag
6 0 ( s ) 1 ( aq )
O H 21 r
C 2 e 6 O
H 14 O
Cr 2 3 ( aq ) 3 ( 3 aq ) 2 )
aq ( 2 7
6
Hauptlagerstätten:
Seit 1990 besteht ein Jahresbedarf an Silber von etwa 25 000 t, wobei dieser nur zum Teil gedeckt wird:
Weltjahresbedarf (1990): 25 000 t
6200 t Recycling 9300 t Erzförderung 4650 t Silberbergwerke Defizit: 4850 t (aus Lagerbeständen)
Das bestehende Defizit wird durch Silber aus Lagerbeständen gedeckt, diese gehen jedoch zu Neige. In den letzten Jahren stieg die Recyclingrate (z. B. aus der Fotoindustrie) rasch an und lag 2001 bei etwa 60%. Obige Zahlen geben also die Verhältnisse um 1990 wieder, aktuelle Zahlen lagen mir nicht vor.
4. Darstellung
USA
Russland
Mexiko
Peru
Australien China
Bolivien Chile
Japan Kanada
Abb. 3:
Hauptlagerstätten von
Silber auf der Welt
Die größte Menge der heutigen Silberproduktion stammt aus silberhaltigen
Blei- und Kupfererzen, somit wird die Silberproduktion über den Bedarf an
Blei und Kupfer geregelt.
Übersicht zur Silberdarstellung:
Aus Silbererzen: Cyanidlaugerei
Rohsilber
Aus Blei- und Kupfererzen:
„Parkesieren“
„Pattinsonieren“
Kupellation
Rohsilber
Feinreinigung: Elektrolytische
Raffination
Feinsilber
Rückgewinnung von Silber aus Sekundärrohstoffen (Fotoindustrie, Röntgenfilme, Legierungen)
Cyanidlaugerei:
Als Ausgangsmaterial werden Silbererze (Ag, AgCl, Ag 2 S) verwendet. Das Material wird gemahlen und zu Schlamm zerkleinert, anschließend wird mit einer 0,1-0,2 %igen Natriumcyanidlösung ausgelaugt, wobei Luft in den Schlamm geblasen wird. Dabei geht Silber als Dicyanoargentat- Komplex in Lösung:
Silber:
Die Auflösung des elementaren Silbers in Cyanidlauge ist auf die Verschiebung des Standardpotentials des Silbers zurückzuführen. Dies erkennt man, wenn man die Nernst’sche Gleichung für das obige System betrachtet:
( aq ) 2 1 2 ( g ) 2 2 ( aq ) ( aq )
) s
( 4 CN O H O 2 Ag ( CN ) 2 OH
Ag 2
0 0 +1 -2
0 (aq)
Ag /
Ag
log Ag
1
059
,
E 0
E
Infolge der großen Stabilität des Dicyanoargentat-Komplexes sinkt die Konzentration der Silberionen so stark, dass das Potential von Silber einen negativen Wert annimmt und somit von Luftsauerstoff oxidiert werden kann:
Hornsiber:
Argentit:
Aus der bei den drei Reaktionen entstandenen Lauge fällt man mittels Zementation (Zugabe eines unedleren Metalls, z. B. Zinkstaub) das edlere Silber aus:
Parkesieren:
Dies ist die heute gebräuchlichste Methode, um Silber aus silberhaltigen Bleischmelzen (0,01-1% Silbergehalt) anzureichern. Die Methode ist benannt nach A. Parkes und wird seit 1842 angewendet. Sie beruht auf der Tatsache, dass flüssiges Zink und Blei unterhalb 400°C nicht mischbar sind, Silber sich jedoch sehr gut (Verteilungskoeffizent ~300) in Zink löst.
Beim Abkühlen bilden sich nun zwei Schichten, eine spezifisch leichtere, feste Schicht aus Zinkschaum (Smp. ca. 419°C, enthält Silber-Zink- Mischkristalle), die auf dem flüssigen Blei (Smp. 327°C) schwimmt. Als Produkt erhält man Zinkschaum mit etwa 10% Silbergehalt und Bleiresten (sog. Reichblei).
0,80V Ag/Ag
+Ag/[Ag(CN)
2]
--0,31V 0V 0,40V
2OH
-/O
2(pH 14) H
2/2H
+
( aq ) 2 ( aq ) ( aq )
) s
( 2 CN Ag ( CN ) Cl
AgCl
( aq ) 2 ( g ) 2 ( aq ) 2 4 ( aq )
) s (
2 S 4 CN 2 O 2 Ag CN SO
Ag -2 0 +6 -2
Ag ( CN ) 2 ( aq ) Zn ( s ) Zn ( CN ) 4 ( 2 aq ) 2 Ag ( s )
2
Rohsilber 0
+1 0 +2
Pattinsonieren:
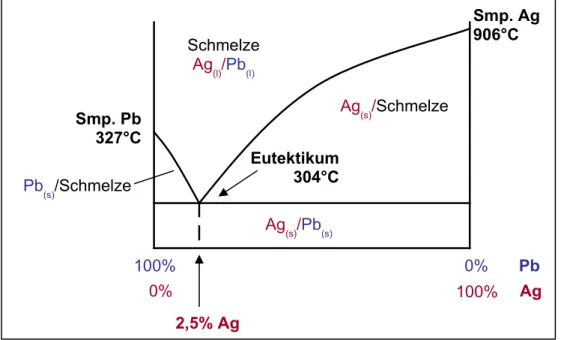
Dieses Verfahren wurde nach H.L. Pattinson benannt und bereits 1833 entdeckt. Auch hier wird als Ausgangsprodukt eine silberhaltige Bleischmelze eingesetzt. Diese wird abgekühlt, dabei scheidet sich solange reines Blei ab, bis der Silbergehalt 2,5% erreicht hat, nun liegt ein eutektisches Gemisch (Reichblei) vor.
Ag Ag Ag Ag
„Zinkschaum“
10% Silber nach Anreicherung Pb-Schmelze
(Ag-haltig)
Smp. Pb 327°C
Smp. Ag 906°C
Eutektikum 304°C
100% 0% Pb
0% 100% Ag
Schmelze Ag
(l)/Pb
(l)
Pb
(s)/Schmelze
Ag
(s)/Pb
(s)
Ag
(s)/Schmelze
2,5% Ag
Abb. 4: Parkesieren einer silberhaltigen Bleischmelze
Abb. 5: Schmelzdiagramm einer Schmelze von Silber und Blei
Isolierung des angereicherten Silbers:
Die Produkte der beiden Anreicherungsverfahren bestehen zum größten Teil aus Blei, außerdem sind sie durch Zink verunreinigt. Durch Treibarbeit (Kupellation) wird Blei in Blei(II)oxid überführt und flüssig abgezogen. Zink wird durch Destillation entfernt (Sdp. Zn: 908°C). Als Produkt erhält man Rohsilber mit einer Reinheit von 95%.
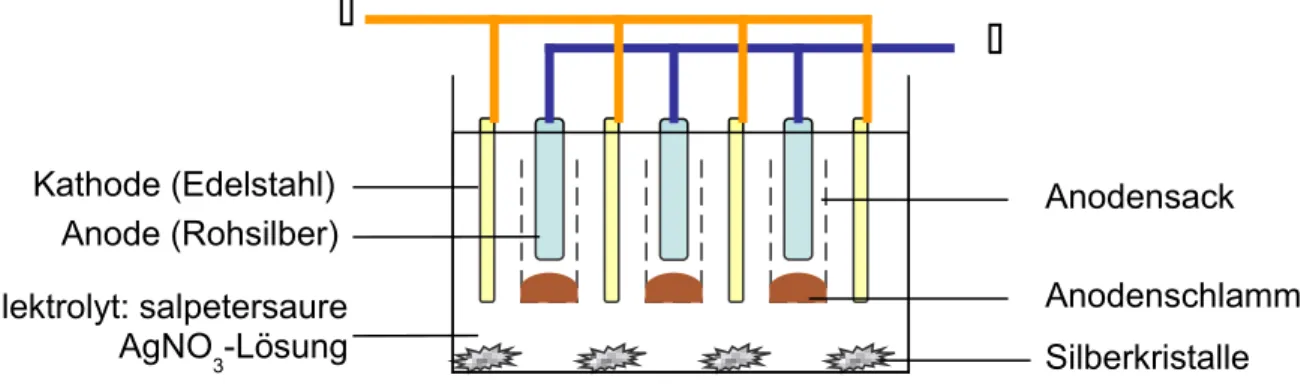
Elektrolytische Feinreinigung (Möbius-Verfahren):
Das Rohsilber wird in Anodenplatten gegossen, als Elektrolyt dient salpetersaure Silbernitratlösung. Als Kathoden werden Edelstahlplatten geschaltet (oder Feinsilber). Bei der Elektrolyse gehen Silber und unedlere Metalle in Lösung, edlere Metalle fallen in den Anodensack und bilden den Anodenschlamm, der zur Gewinnung von Gold oder Platin weiterverwendet wird. An der Kathode scheidet sich reines Silber ab. Die Abscheidung erfolgt in Form von verästelten Kristallen, sog. Dendriten, die durch einen Abstreifer von der Kathode abgestreift werden, um einen Kurzschluss zu vermeiden.
Reaktionen:
_____________________________________________________________________________________________________
V ERSUCH 2: F RAKTALE S ILBERSTRUKTUREN
Kathode (Edelstahl)
Anode (Rohsilber) Anodensack
Anodenschlamm Silberkristalle Elektrolyt: salpetersaure
AgNO 3 -Lösung
Anode:
Rohsilber
) s ( )
aq
( e Ag
Ag
Kathode :
Feinsilber
Ag e Ag ( s ) ( aq )
Abb. 6: Elektrolytische Feinreinigung von Silber, Möbius-Verfahren
M ATERIAL : Stativmaterial 2 Krokodilklemmen 5 Strippen
Voltmeter Amperemeter Trafo (25 V)
Overhead-Projektor Petrischale
2 Büroklammern
C HEMIKALIEN : AgNO 3 -Lösung (0,1 mol/L) NH 3 (konz)
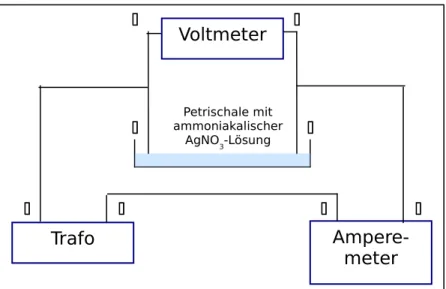
D URCHFÜHRUNG : Der Schaltskizze entsprechend wird die Apparatur aufgebaut, wobei die Petrischale sich auf dem Overhead- Projektor befindet.
Etwa 50 mL AgNO 3 -Lösung werden tropfenweise mit Ammoniak versetzt, bis sich der entstehende Niederschlag von Silberhydroxid wieder auflöst, und in die Petrischale gefüllt. Zwei Büroklammern dienen als Elektroden, der Pluspol taucht in die Lösung ein, die als Minuspol dienende Elektrode wird so angebracht, dass sie die Oberfläche der Lösung gerade berührt (Oberflächenspannung!).
Petrischale mit ammoniakalischer
AgNO
3-Lösung
Voltmeter
Ampere- meter
Trafo
Abb. 7: Schaltskizze zur Elektrolyse
Man elektrolysiert bei 20 V Gleichstrom (1,2 A).
A USWERTUNG : An der Kathode (-) wächst ein farnartiger Silberbaum mit filigranen Verästelungen. Bevor der Silberbaum die Anode erreicht, muss die Elektrolyse abgebrochen werden, um einen Kurzschluss zu vermeiden.
An der Anode ist eine Gasentwicklung zu beobachten, durch Oxidation entsteht hier Sauerstoff.
Anode:
Kathode:
Die Fraktalbildung wird bestimmt durch zufällige Ereignisse (Zufalls- bewegungen der Ionen in Lösung) und festen Abscheidungsregeln (Reduktion von Ag + bei Kontakt mit der Kathode). Da es wahrschein- licher ist, dass Ag + -Ionen an den Auswüchsen des „Silberbäumches“
anstoßen als in die entstandenen
„Fjorde“ einwandern, entstehen
„Äste“. An den entstandenen Unebenheiten wächst das „Bäum-
chen“ weiter, es kommt so zu einem Selbst- verstärkungseffekt.
___________________________________________________________
Feinsilber und Legierungen
In Deutschland sind folgende Feingehalte an Silber handelsüblich:
Feinsilber-Qualitäten:
Feinheit 835 (83,5 %): 835 Teile Feinsilber, 165 Teile Legierungsmetalle Feinheit 925 (92,5 %): „Sterling-Silber“
Abb. 8:
Silberbäumchen
0 +1
0 -2
) s ( )
aq
(
2 e 2 Ag
Ag
2
O H O 2 e
OH
2 ( aq ) 2 1 2 ( g ) 2
Feinheit 999 (99,9 %): Reines Feinsilber Preis:
ca. 6 $ pro Feinunze (ca. 200 €/kg) 1 Feinunze (oz) = 31,104 g
Die Feinheit ist definiert als der Silbergehalt in Promille. So entspricht Feinsilber der Qualität 925 einem Silbergehalt von 92,5%, der Rest sind Legierungsmetalle, meist Kupfer. Das „Sterling-Silber“ wird für Gebrauchsgegenstände (Bestecke, Schmuck) verwendet, der hohe Kupferanteil sorgt für Härte und Widerstandsfähigkeit.
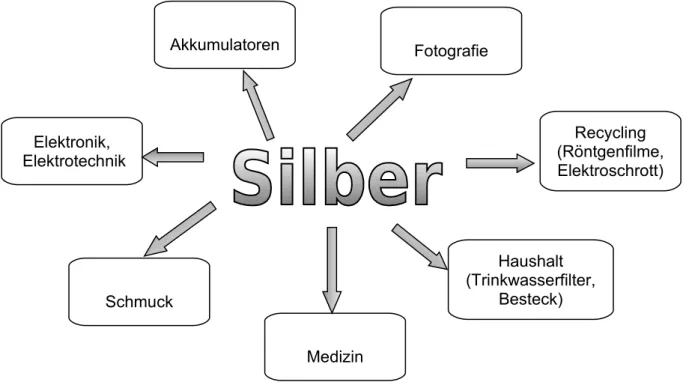
5. Verwendung
Im folgenden Diagramm ist die Verwendungsverteilung von Silber (elementares Silber und Verbindungen) dargestellt.
Aufgrund seiner Korrosionsbeständigkeit und Leitfähigkeit ist die Elektroindustrie ein großes Einsatzgebiet von Silber. Auch zur Herstellung von fotografischen Filmen und Röntgenfilmen wird Silber eingesetzt, dieser Sektor macht den größten Teil des Silberverbrauchs aus. Daher ist es sehr lukrativ, Silber aus gebrauchten Filmen und Fixierbädern, aber auch aus Elektroschrott, zu recyceln.
Abb. 9:
Verwendungsverteilug
von Silber (1991)
6. Elementares Silber
Eigenschaften:
1. Nebengruppe (11.Gruppe), Elektronenkonfiguration [Kr]4d 10 5s 1
Isotope: 107 Ag (51,83%) und 109 Ag (48,17%)
Smp. 960,8°C, Sdp. 2212°C
Kubisch dichteste Kugelpackung
Sehr duktil (Silberfolien, dünne Drähte)
Beste elektrische und Wärme- leitfähigkeit unter den Metallen
Silber als Edelmetall
Aufgrund seines positiven Normalpotentials (E 0 Ag/Ag + = 0,799V) wird Silber den Edelmetallen zugeordnet. Weiterhin gehören dazu noch Kupfer, Gold und die Platingruppenmetalle, die allesamt das Vermögen besitzen, als Oxidationsmittel gegenüber der Normalwasserstoffelektrode zu wirken.
Dementsprechend lassen sich Metalle, je positiver ihr Normalpotential ist, schwerer oxidieren.
Silber ist also oxidationsbeständig gegenüber Luftsauerstoff und nicht oxidierenden Säuren, in konz. HNO 3 ist es jedoch löslich. Diese wird daher auch Scheidewasser genannt ist, da sie Gold von Silber „scheidet“, letzteres löst sich nicht in HNO 3 (konz.). Die Oxidationsbeständigkeit gegenüber Luftsauerstoff beruht auf der Bildung einer dünnen passivierenden Silberoxid-Schicht (10-20 nm), die Silber seinen typischen warmen Glanz verleiht.
Abb. 10: Ausschnitt aus dem PSE (Silber)
47 107,87
Ag
Silber [Kr] 4d 10 5s 1
Abb. 11: Kubisch dichteste
Kugelpackung
Trotzdem ist ein Anlaufen von Silber an der Luft zu beobachten, hervorgerufen durch schwefelhaltige Gase, die in der Luft von bewohnten Räumen, besonders Küchen, in Spuren vorhanden sind.
Anlaufen von Silber an der Luft:
Begünstigte Adsorption und Reaktion von H 2 S an der Ag 2 O-Schicht:
) 0 E ( O
H S Ag S
H O
Ag
2 (s)
2 (g)
2 (s)
2 (g)
Im folgenden Versuch soll das Anlaufen einer Silbergabel nachgestellt werden.
_____________________________________________________________________________________________________
V ERSUCH 3: S ULFIDIEREN EINER S ILBERGABEL
M ATERIAL : Demonstrationsreagenzglas mit Ständer und Stopfen Reagenzglasklammer
Abzug C HEMIKALIEN : Silbergabel
Ammoniumsulfidlösung (verdünnt)
D URCHFÜHRUNG : Die Silbergabel wird kurz mit Hilfe der Klammer in das Reagenzglas mit Ammoniumsulfidlösung getaucht und anschließend an der Luft getrocknet. Alle Arbeiten sind unter dem Abzug durchzuführen und das Reagenzglas ist mit einem Stopfen verschlossen zu halten.
A USWERTUNG : An der Luft bildet sich auf der Gabel sofort ein braun- schwarzer Überzug von Silbersulfid, der durch Reiben nicht zu entfernen ist.
Unter der oxidierenden Wirkung des Luftsauerstoffs bildet sich Silbersulfid:
0 0 +1 -2
( aq ) 2 1 2 ( g ) 2 ( s ) ( aq )
) s
( HS O Ag S OH
Ag 2 0
0 +1 -2
schwarz
O H S Ag O
S H Ag
2 ( s ) 2 ( g ) 2 1 2 ( g ) 2 ( s ) 2
___________________________________________________________
Zur Reinigung von angelaufenen Silber kennt man ein altes Hausrezept:
Man legt Silber auf Alufolie und bedeckt es mit einer Lösung von Kochsalz und Backpulver. Im folgenden Versuch ist diese Methode nachgestellt, die auf der Tatsache beruht, dass Silberionen durch unedlere Metalle wieder zu Silber reduziert werden.
_____________________________________________________________________________________________________
V ERSUCH 4: R EINIGEN EINER ANGELAUFENEN S ILBERGABEL M ATERIAL : Hohes Becherglas (100 mL)
C HEMIKALIEN : Angelaufene Silbergabel Alufolie
Soda-Lösung (Na 2 CO 3(aq) ) w = 0,15
D URCHFÜHRUNG : Das Becherglas wird von innen mit Alufolie verkleidet und die Silbergabel so hineingestellt, dass sie Kontakt zur Folie hat. Anschließend füllt man das Becherglas mit Soda-Lösung.
A USWERTUNG : Man beobachtet nach kurzer Zeit eine starke Gasentwicklung an der Gabel und an der Folie, die Gabel wird schnell wieder sauber und glänzend.
In alkalischer Lösung wird die passivierende Oxidschicht der Aluminiumfolie zerstört:
(aq) 2 4 (aq)) s ( 3
2
O 2 OH 3 H O 2 Al ( OH )
Al
Unter Bildung von Tetrahydroxoaluminat wird Aluminium oxidiert (E 0 Al/Al 3+ = -1,7 V):
4 OH Al ( OH ) 3 e
Al 0 ( s ) ( aq ) +3 4 ( aq )
Reduktion von Ag 2 S unter Bildung von elementarem Silber:
Wasserstoffentwicklung am Aluminium:
___________________________________________________________
Antibakterielle Wirkung
Die antibakterielle Wirkung von Silber ist schon in der Zeit Alexanders des Großen nachzuweisen, jedoch ist unklar, ob der Zusammenhang damals schon bekannt war oder erst später darauf geschlossen wurde. Auf seinen Kriegszügen nach Indien erkrankten seine Soldaten an Durchfallkrankheiten, außer den Heerführern, die ihre Getränke aus Silberbechern zu sich nahmen.
Die bakterizide, fungizide und antiseptische Wirkung von Silber-Ionen ist auf die Blockade von Thioenzymen durch Ag + zurückzuführen.
Verunreinigungen durch andere Metalle und die Ag 2 O-Schicht auf Silbergegenständen führen dazu, dass immer geringe Mengen von Ag + in Lösung gehen. Schon 2 g Ag + reichen aus, um 1 Mio. Kubikmeter Wasser zu sterilisieren, man spricht daher von einer oligodynamischen Wirkung.
Noch heute findet Silber wegen seiner keimtötenden Eigenschaften Anwendung in Form von chirurgischen Instrumenten und Kathetern (als Legierungsmetall), in Medikamenten (kolloidales Silber als Antibiotikaersatz), Essbesteck- und Geschirr (nicht nur aus ästhetischen, sondern auch hygienischen Gründen) und in der Trinkwasserreinigung. In Wasserfiltern, die primär dem Entkalken von Trinkwasser dienen, werden geringe Mengen von Silber zugesetzt, um Keimbildung zu verhindern. Dies soll im folgenden Versuch nachgewiesen werden.
_____________________________________________________________________________________________________
+1 0
) g ( 2 2 ) 1 aq (
2 O e OH H
H
+1 0
(s) 2(aq)) s (
2
S 2 e 2 Ag S
Ag
V ERSUCH 5: N ACHWEIS VON S ILBER IN T RINKWASSERFILTERN M ATERIAL : 2 Demonstrationsreagenzgläser und Stopfen C HEMIKALIEN : HNO 3 (konz.)
Entionisiertes Wasser NaCl-Lösung
Wasserfilter (Firma Brita)
D URCHFÜHRUNG : Aus dem Wasserfilter füllt man etwas Granulat (enthält hautsächlich Aktivkohle und Ionenaustauscher) in ein Demonstrationsreagenzglas (etwa 1 cm hoch). Man überschichtet mit HNO 3 (konz.), verschließt mit einem Stopfen und schüttelt. Mit entionisiertem Wasser verdünnt man die Lösung und schlägt so die nitrosen Gase nieder. Man lässt das Granulat absitzen und dekantiert den Überstand in ein weiteres Reagenzglas.
Durch Zutropfen von NaCl-Lösung weist man Ag + nach.
A USWERTUNG : Durch die oxidierende Säure HNO 3 wird Silber unter Entwicklung nitroser Gase gelöst:
Bei Zugabe von NaCl-Lösung fällt ein weißer Niederschlag von AgCl aus, der in verdünntem Ammoniak löslich ist:
___________________________________________________________
Versilbern
Man kennt drei Methoden des Versilberns:
O H 5 NO
Ag 3 O
H 3 HNO
Ag
3 0 ( s ) +5 3 ( aq ) 3 ( aq ) +1 ( aq ) +2 ( g ) 2
) g ( 2 )
g ( 2 1 2 ) g
( O NO
NO
0 +4 -2
farblos
braun
+2
) s ( )
aq ( ) aq
(
Cl AgCl
Ag
Galvanisches Versilbern von Metallgegenständen durch kathodische Abscheidung von Silber aus einer Lösung von K[Ag(CN) 2 ], so erhält man glänzende Silberüberzüge, während bei der Abscheidung aus einer Silbernitratlösung grobe Kristalle entstehen.
Stromloses Versilbern, dies ist bei unedleren Metallen möglich und wird in Form der „Anreibeversilberung“ angewendet. (Reiben des Metallgegenstandes mit einer Aufschlämmung aus Silbernitrat, Natriumthiosulfat, Wasser und Schlämmkreide)
Glasversilberung mit Hilfe eines Reduktionsmittels, zur Spiegelherstellung.
_____________________________________________________________________________________________________
V ERSUCH 6: S TROMLOSE V ERSILBERUNG M ATERIAL : 2 Bechergläser
Demonsrationsreagenzglas und Ständer Pipette
C HEMIKALIEN : AgNO 3 -Lösung (1%) Kupferblech
NH 3 (konz.)
D URCHFÜHRUNG : In ein Becherglas füllt man AgNO 3 -Lösung und stellt das Kupferblech hinein. Nach einigen Minuten nimmt man es heraus und stellt es zur Ansicht in das andere Becherglas.
Die Lösung dekantiert man vom evtl. auftretenden Niederschlag in ein Reagenzglas und gibt einige Tropfen konzentrierten Ammoniak zu.
A USWERTUNG : Stellt man das Kupfer-Blech in die Lösung, bildet sich am
Blech sofort eine schwarze Schicht von elementarem
Silber, die mit der Zeit immer dicker wird und teilweise in
Flocken zu Boden sinkt.
Das unedlere Metall Kupfer wird oxidiert, während Ag + zu elementarem Silber reduziert wird:
E 0 (Ag/Ag + ) = +0,7991 V E 0 (Cu/Cu 2+ ) = +0,337 V
Die dabei entstehenden Cu 2+ -Ionen weist man durch Zugabe von NH 3 nach, es bildet sich der charakteristisch blaue Kupfertetraminkomplex:
___________
________________________________________________
Durch diese Art der stromlosen Versilberung erhält man keine glänzenden Überzüge, daher werden zur Metallversilberung in der Technik das sog.
„Anreibeverfahren“ oder elektrolytische Verfahren angewandt (s. o.).
Bei der Glasversilberung setzt man als Reduktionsmittel meist Aldehyde ein, die „Silberspiegelprobe“ dient auch als Nachweis für reduzierende Aldehyd-Gruppen. Aus einer Silbernitratlösung wird mit Hilfe des Reduktionsmittels eine dünne Silberschicht an der Glasoberfläche niedergeschlagen.
_____________________________________________________________________________________________________
V ERSUCH 7: H ERSTELLUNG EINES S LBERSPIEGELS M ATERIAL : Messzylinder 100 mL
3 Messzylinder 50 mL
Braune Schliffflasche (100 mL) Neues (!) Reagenszglas
Wasserbad (80°C)
Becherglas und Glasstab C HEMIKALIEN : AgNO 3 -Lösung (10%)
NH 3 (aq) (konz.)
Glucose-Lösung (2,5%)
aq ) ( s ) ( s ) ( 2 aq )
( Cu 2 Ag Cu
Ag
2 +1 0 0 +2
3 ( aq ) 3 4 2 ( aq )
2 ) aq
( 4 NH Cu ( NH )
Cu
blau
KOH-Lösung (ρ*= 18 g/L) (NH 4 ) 2 SO 4
D URCHFÜHRUNG : 10 mL der Silbernitratlösung werden tropfenweise mit Ammoniak versetzt, bis sich der Niederschlag von Silberhydroxid gerade wieder auflöst. Zu dieser Lösung werden 0,15 g Ammoniumsulfat gegeben und die Lösung mit Wasser auf 50 mL aufgefüllt. In der braunen Schliffflasche kann sie so einige Stunden aufbewahrt werden.
In den Messzylindern werden folgende Lösungen abgemessen und in der angegebenen Reihenfolge in das Becherglas gefüllt:
25 mL KOH-Lösung 25 mL Glucose-Lösung
50 mL ammoniakalische AgNO 3 -Lösung
Mit dem Glassstab wird gut umgerührt und die Lösung sofort (!) in das zu versilbernde Reagenzglas gefüllt.
Stellt man dieses in ein warmes Wasserbad, kann man die Reaktion noch beschleunigen.
Auf diese Weise kann man auch selber Spiegel herstellen, indem man statt eines Reagenzglases eine saubere Glasplatte (mit KOH (aq) (10%) und Aceton reinigen und einseitig mit Klebefolie bekleben) verwendet.
A USWERTUNG : An der inneren Wand des Reagenzglases scheidet sich schon bald ein Silberspiegel ab. Die Glucose fungiert in diesem Fall als Reduktionsmittel und reduziert Ag + zu elementarem Silber.
Glucose zeigt das Phänomen der Mutarotation, es
besteht ein Gleichgewicht zwischen α-D-Glucopyranose
und β-D-Glucopyranose. Ein geringer Teil der Glucose
liegt auch in offenkettiger Aldehydform vor, diese wirkt als Reduktionsmittel.
Öffnung der Glucose zur Aldehydform:
C
CH 2 OH
H OH
O
H H
H OH
H H
O
OH C
CH 2 OH
H OH
O
H H
H OH
H OH
O H
Glucopyranose Aldehydform
Bildung des Silberspiegels (Tollens-Reaktion):
C
CH 2 OH
H OH
O
H H
H OH
H OH
O H
NH 3
C
CH 2 OH
H OH
O
H H
H OH
H OH
O O
O H 2 2 Ag +
+ 3 OH -
+1 +3
+ 2 Ag (s)
(aq)
(aq)
+ (aq) +
+1 0
2
___________________________________________________________
Historisches zum Silberspiegel:
Im alten Ägypten schon wurden polierte Bronze und Kupferspiegel verwendet.
Die Römer benutzten Glas, das sie mechanisch mit Gold und Lack beschichteten.
Im Mittelalter (ab 13. Jh.) kamen Zinn-Amalgam-Spiegel auf, auf großen Tischen wurden Glasplatten mit Zinn-Amalgam bedeckt, überschüssiges Quecksilber floss ab, ein sehr ungesundes Verfahren, das jedoch qualitativ hochwertige Spiegel hervorbrachte.
1835 entwickelte Justus von Liebig das Nassversilberungsverfahren
zur Herstellung von Silberspiegeln, das noch heute angewandt wird.
Heute erhalten Silberspiegel zusätzlich eine Schutzschicht aus Kupfer oder werden mit Schutzlack besprüht.
7. Silberverbindungen
Silber liegt in seinen Verbindungen fast ausschließlich in der Oxidationsstufe +1 vor, da dort die stabile 4d 10 -Konfiguration eingenommen werden kann. Die Oxidationsstufen +2 und +3 sind selten, aber durchaus existent (Bsp.: Ag I Ag III O 2 ). Folgendes Potentialdiagramm verdeutlicht, dass zur Oxidation zum Ag 2+ sehr viel Energie notwendig ist, dies liegt an der im Vergleich zu Ag 2+ sehr viel höheren Hydratationsenergie von Ag + :
In Ag(I)-Komplexen ist Silber linear koordiniert, die Koordinationszahl beträgt stets 2 (Bsp.: [Ag(CN) 2 ] - .
Bis auf AgF, AgNO 3 und AgClO 4 sind alle Ag(I)-Salze schwerlöslich. In diesem Kapitel wird aufgrund ihrer Schulrelevanz nur auf Silbernitrat und auf die Silberhalogenide näher eingegangen.
Silbernitrat AgNO 3
Silbernitrat stellt das wichtigste lösliche Silbersalz dar und dient im Labor sowie in der Technik als Ausgangsprodukt für die meisten
0,7991VAg
1,980VAg
2Ag
Abb. 12: Historische
Spiegelherstellung nach dem
Amalgamverfahren
Silberverbindungen. Es ist sehr gut wasserlöslich (215g/100g Wasser) und nicht hygroskopisch. Die Darstellung erfolgt durch Auflösen von Silber in konzentrierter Salpetersäure:
In der Medizin findet Silbernitrat als sog. „Höllenstein“ Anwendung in der Behandlung von Warzen und Wucherungen. Auf der Haut wirkt es stark oxidierend und bildet schwarze Flecken von elementarem Silber, gleichzeitig entstehen Ag 2 S und Ag 2 O. Die durch Protonierung des Nitrats entstehende Salpetersäure wirkt außerdem ätzend.
Schwerlösliche Silberhalogenide
Die Darstellung der Silberhalogenide erfolgt entweder direkt aus den Elementen oder durch Fällung aus einer Silbernitratlösung.
Mit zunehmender Ordnungszahl der Halogenide steigt die Schwerlöslichkeit der Silberhalogenide. Der kovalente Charakter der Ag-X- Bindung nimmt zu, da die Weichheit der Lewis-Basen (Halogenide) mit zunehmendem Radius steigt. Mit der weichen Lewis-Säure Ag + bildet I - somit die am schlechtesten lösliche Verbindung. Es findet außerdem eine Farbvertiefung von weiß nach gelb statt, hierbei handelt es sich um Charge-Transfer-Effekte.
Farbe Löslichkeitsprodukt KL [mol
2/L
2]
AgCl Weiß 1,7 ·10-10 AgB
r Hellgelb 5 ·10-13 AgI Gelb 8,5 ·10-17
Eine weitere wichtige Eigenschaft ist die Lichtempfindlichkeit von Silberhalogeniden, bei Einwirkung von Tageslicht findet eine Zersetzung in elementares Silber und Halogen statt. Diese Eigenschaften, die man in der Schwarz-Weiß-Fotografie ausnutzt, sollen im nächsten Versuch verdeutlicht werden:
O H 5 NO
Ag 3 O
H 3 HNO Ag
3 0 ( s ) +5 3 3 ( aq ) +1 ( aq ) +2 ( g ) 2
_____________________________________________________________________________________________________
V ERSUCH 8: L ICHTEMPFINDLICHKEIT VON S ILBERBROMID
M ATERIAL : 2 Demonstrationsreagenzgläser mit Stopfen, mit Alu- Folie ummantelt
C HEMIKALIEN : AgNO 3 -Lsg. (0,1 mol/L) in Gelatine-Lsg. (0,5%) Verhältnis 1:1
KBr-Lösung
D URCHFÜHRUNG : Vorbereitung: Die Gelatine wird unter Erwärmen in Wasser gelöst und die Lösung mit der gleichen Menge AgNO 3 -Lösung versetzt. Wenn die Lösung „andickt“, fällt man durch Zugabe weniger Tropfen KBr-Lösung AgBr, teilt die Lösung auf zwei Reagenzgläser auf und bewahrt diese im Dunkeln auf.
Eines der Reagenzgläser setzt man für 2-5 Minuten dem Tageslicht (oder Overhead-Projektor) aus und vergleicht mit der Dunkel-Probe.
A USWERTUNG : Durch Zugabe von KBr-Lösung bildet sich eine Niederschlag von gelbem Silberbromid, der aber durch die Gelatine, die als Schutzkolloid dient, kolloidal in Lösung gehalten wird:
) s ( )
aq ( ) aq
(