Gruppe 13 – vorgegebener Versuch
Volltext
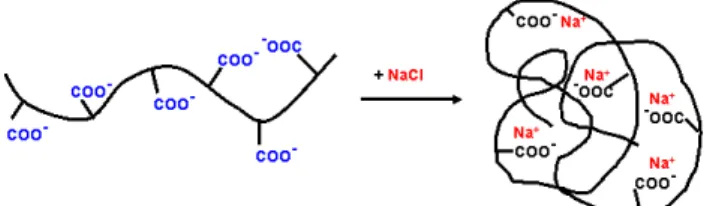
Abbildung

ÄHNLICHE DOKUMENTE
Wurde diese Essigsäureethylester-Lösung in das n-Hexan gegeben, so bildete sich rasch ein trüber Festkörper, der sich am Gefäßboden absetzte.. Der Gefäßboden war mit
Nach Zugabe der Schwefelsäure zum Fettalkohol verfärbte sich die Lösung leicht gelblich.. Es bildete sich ein gelber Tropfen am Boden des Reagenzglases, der sich nach vorsichtigem
Das nicht umgesetzte Kaliumchlorat muss nach Versuchsende zunächst abkühlen und aus dem Reagenzglas entfernt werden.. Dieser Prozess, sowie die weitere Entsorgung mit einer
Leitung: Herr Dr.. 1.: verwendete Test-Lösungen Abb. Das Becherglas wird mit „Probe-A“ beschriftet. In ein zweites 50 mL Becherglas gibt man etwa 4 mL Brenztraubensäure.
Nach der Zugabe der wässrigen Methanol-Lösung verklumpten die Erythrocyten und klebten am Boden des Zentrifugenglases fest. Die Lösung, die das Enzym enthielt war leicht gelb-
Nach Zugabe der Phosphorsäure färbte sich die blaue Lösung türkisfarben.. Die rote Lösung behielt auch nach Zugabe der Phosphorsäure
Dann beschreiben sie in Worten die im Kasten dargestellte Stoffumwandlung einschließlich der Koeffi- zienten: „6 Moleküle Kohlenstoffdioxid und 6 Moleküle Wasser reagieren zu 1
Gib in das erste Becherglas einen Teelöffel Salz, in das zweite die gleiche Menge Zucker, in das dritte etwas Sand und in das vierte etwas Öl.. Rühre die Mischungen