EXPERIMENTALVORTRAG ANORGANIK
Monika Preis WS 2007/2008
Leitung: Prof. Dr. Neumüller, Dr. P. Reiß
Ein Blick in die Welt unter unseren Füßen
BODEN
Abb.1 Waldboden mit Lebewesen 1
Inhaltsverzeichnis
1 Definition Boden 1
2 Bodenentwicklung 1
2.1 Verwitterung 2
Demonstration 1 3
Demonstration 2 4
2.2 Bodenzusammensetzung 6
3 Lebensraum Boden 7
3.1 Fauna 7
Versuch 1 8
Versuch 2 12
3.2 Flora 15
Demonstration 3 16
4 Der Stickstoffkreislauf 19
Versuch 3 21
5 Bodeneigenschaften 23
5.1 Silicate und Tonminerale 23
Versuch 4 24
Versuch 5 27
7 Boden- ein Thema für den Chemieunterricht 29
Themenkomplex Boden 29
Lehrplanbezug 30
8 Literatur 31
1
1 Definition Boden
Boden ist ein hochkomplexes lebendiges System. Ohne seine Wasser- und Nährstoffkreisläufe und seine Entstehung aus Gesteinssubstanz könnte der Boden jedoch nicht Lebensgrundlage für Tiere, Pflanzen und den Menschen sein. Es gibt viele Definitionen für das System Boden.
Eine gute Arbeitsdefinition stellt die folgende dar:
„Unter Boden versteht man die obere, lockere, belebte Verwitterungsschicht der Erdkruste.
Er ist Standort für Pflanzen und Basis für vielfältige Nahrungsnetze. Er bildet somit die Lebensgrundlage für alle Lebewesen auf der Erde.“
Die Pedosphäre wird nach oben durch die Atmosphäre begrenzt, nach unten durch die Lithosphäre. Im weiteren Sinne kann man Boden als eigenen Naturkörper sehen. Die Pedosphäre ist der Überschneidungsbereich von Atmosphäre, Hydrosphäre, Biosphäre und Lithosphäre. Die Ökosphäre umfasst alle Ökosysteme.
Abb. 2 Ökosphäre mit ihren 5 Ökosystemen
2 Bodenentwicklung
Böden entstehen durch den Einfluss verschiedener Faktoren. Sechs Faktoren sind daran maßgelblich beteiligt. Dazu gehören neben dem Ausgangsgestein (G) und dem Klima (K) die
Hydrosphäre Biosphäre
Lithosphäre Atmosphäre
Pedosphäre
Vegetation und die Bodenorganismen (O), die je nach Art der Zusammensetzung unterschiedliche Auswirkungen auf die Bodenentwicklung haben können. Des Weiteren spielt das Oberflächenrelief (R) eine Rolle. Zum Schluss sind an dieser Stelle noch menschliche Einflussfaktoren (M) und der Faktor Zeit (Z) zu nennen. Ein russischer Bodenkundler definierte Böden (B) als Funktion dieser verschiedenen Faktoren. Es ergab sich folgende Gleichung:
B = f (G, K, O, R, M) · Z
Abb. 3 Einflussfaktoren auf die Bodenentwicklung 3
2.1 Verwitterung
Physikalisch, chemische und biologische Faktoren ändern die Beschaffenheit des Bodens ständig. Die wichtigsten Einflüsse sind: Temperaturschwankungen, Luftfeuchtigkeit, Regenmenge, Sonneneinstrahlung und die Lebewesen. Die dadurch resultierende Gesteinsaufarbeitung wird als Verwitterung bezeichnet.
Für die Bodenbildung sind bestimmte Verwitterungsvorgänge Vorraussetzung. Es gibt drei Arten der Verwitterung:
• chemische Verwitterung
• physikalische Verwitterung
• biologische Verwitterung
Chemische Verwitterung
Bei der chemischen Verwitterung werden Minerale in ihrer chemischen Zusammensetzung verändert oder vollständig gelöst. Neben Sauerstoff sind Wasser und darin gelöste
anorganische Säuren, CO2 und Huminsäuren die wichtigsten Reagenzien.
Physikalische Verwitterung
Gesteinsverfall
Unter physikalischer Verwitterung versteht man den Zerfall der Gesteine in kleinere Teile, jedoch OHNE chemische Veränderung. Dies kann durch Windschliff, Wasser oder Temperatur geschehen. Durch gefrierendes Wasser in Haarrissen des Gesteins kann es zur Gesteinssprengung kommen. Auch im Wasser gelöste Salze können bei Auskristallisation eine Gesteinssprengung hervorrufen. Durch die schlechte Wärmeleitfähigkeit von Gesteinen können auch starke Temperaturschwankungen zur Gesteinssprengung führen. Das abgesprengte Gestein ist nun der chemischen Verwitterung ausgesetzt.
Demonstration 1
Frostsprengung
Geräte: Glasflasche 0,7 L mit Stopfen
Chemikalien: Leitungswasser
Versuchsdurchführung:
Die Glasflasche wird ganz voll mit Wasser gefüllt und der Stopfen vorsichtig zugeschraubt.
Die Flasche wird in eine Plastiktüte gesteckt. Die mit Wasser gefüllte Flasche wird in die Gefriertruhe gelegt! Dort bleibt sie für 2- 3 Tage, bis das Wasser gefroren ist und die Flasche zerborsten ist.
Abb. 4 Risse im Fels 4
Hinweise für den Vortrag:
Die zerborstene Glasflasche müssen mit Vorsicht behandelt werden, da die Glaskanten sehr scharf sind und trotz der Plastiktüte zu tiefen Schnittwunden führen können.
Versuchsauswertung:
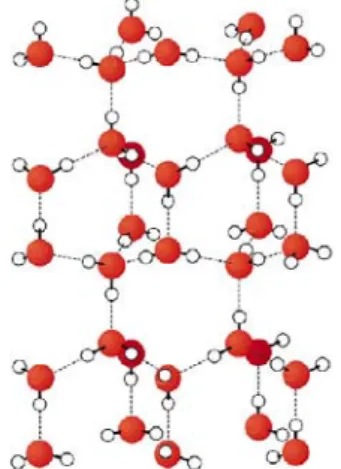
Die Flasche dient als Modell für den Innenraum eines Gesteins in den Wasser eingedrungen ist. Wenn Wasser gefriert kommt es zu einer Volumenerhöhung von ca. 10%, wodurch die Flasche zerplatzt.
Abb. 5 Anordnung der Wassermoleküle im Eis5
Biologische Verwitterung
Die biologische Verwitterung kann streng genommen sowohl der chemischen als auch der physikalischen Verwitterung zugeordnet werden, da die Wurzeln durch ihre feinen Haarwurzeln in Gesteinsrisse eindringen können und dann durch Wurzeldruck sowie die Absonderung organischer und anorganischer Säuren das Gestein Sprengen / Auflösen können.
Demonstration 2
Wurzelsprengkraft
Geräte: 2 Plastikgefäße (z.B. Joghurtbecher)als Formvorlage
1 Plastiklöffel
Chemikalien: Leitungungswasser
Gipspulver Erbsen
Versuchsdurchführung:
Man rührt etwas Gips mit Wasser an, dazu gibt man 8 Eßlöffel Gips in 30 mL Wasser und rührt so lange, bis ein zäher Brei entsteht. Dies geschieht direkt in dem Plastikschälchen. In dem zweiten Plastikschälchen wird ebenfalls Gips angerührt und anschließend werden je nach Größe des Plastikgefäßes einige Erbsen in den Gips gedrückt, so dass sie mehr oder weniger gleichmäßig in dem Gips verteilt sind und nicht mehr zu sehen sind. Wenn der Gips hart geworden ist nimmt man ihn aus der Form und legt ihn auf eine Unterlage. Nach ca. 6, 12 und 24 h guckt man, wie sich der Gips verändert hat.
Hinweise für den Vortrag:
Der Gips ohne Erbsen lässt sich lange halten, der mit den Erbsen darf erst am Tag vor dem Vortrag angesetzt werden, da er sonst zu stark zerfällt und der Effekt der Wurzelsprengkraft nicht mehr deutlich wird.
Versuchsauswertung:
Der Gips ist als Modell für Mineralgestein zu sehen und die Erbsen als Modell für Wurzeln, die als feine Haarwurzeln in kleine Gesteinsrisse eindringen und dann durch ihr Wachstum und den Wurzeldruck das Gestein physikalisch zerkleinern.
Die Erbsen haben das Wasser aus dem Gips in sich aufgenommen und haben dadurch ihr Volumen vergrößert. Sie sind weiter gequollen, auch als der Gips um die Erbsen herum schon hart geworden ist. Der Druck im Inneren der Erbse wird so groß, dass der Gips zerspringt.
Es entstehen Risse.
Abb. 6 Wurzel 6
2.2 Bodenzusammensetzung
Ein typischer Grünlandboden setzt sich aus 45% mineralischer Substanz, 25% Luft, 23%
Wasser und 7% organischer Substanz zusammen. Bei der Verwitterung kommt es zur Bildung von Hohlräumen, die sich mit Luft und Wasser füllen. Die Luftzusammensetzung im Boden entspricht nicht der Luftzusammensetzung der Atmosphäre. Während im Boden mehr als 0,2% CO2 vorhanden sind, befinden sich in der Luft lediglich 0,03% CO2. Für bodenchemische Reaktionen ist vor allem die Bodenlösung interessant. Auch die Luft steuert die im Boden ablaufenden Oxidations- und Reduktionsprozesse und ist wichtig für die Atmung der Wurzeln und der aeroben Bodenorganismen.
Abb.6 Bodenzusammensetzung
Tab.1 Zusammensetzung der Atmosphärischen Luft und der Bodenluft
O2 CO2 N2
Atmosphärische Luft 20,95 0,03 79
Bodenluft < 20,6 > 0,2 79
Damit sich aus Gestein Boden bilden kann, muss in der Regel erst der Gesteinsverband gelockert werden. Durch Verwitterung bildet sich aus dem Festgestein lockerer Boden. Das Muttergestein/ Ausgangsgestein bildet den C- Horizont. Die Mineralien des Verwitterungsgesteins bilden den B-Horizont, er besteht ausschließlich aus mineralischen Bestandteilen. Abgestorbene Pflanzenreste und durch Bodenlebewesen zersetztes organisches Material zusammen mit mineralischen Bestandteilen bilden den A-Horizont, in dem sich
45 % mineralische
Substanz
25 % Luft
23 % Wasser
7 % organische
Substanz
weniger als 30% organische Substanz befindet. Dem A-Horiont liegt eine organische Auflage auf, die als O-Horizont bezeichnet wird. Bei landwirtschaftlich genutzten Böden ist diese Horizontierung nicht mehr feststellbar. Durch Pflugarbeiten werden die obersten Schichten ständig durchmischt.
Abb. 7 Bodenstrukturen 7
3 Lebensraum Boden
Der entstandene Boden stellt Lebensgrundlage für Tiere und Pflanzen dar.
3.1 Fauna
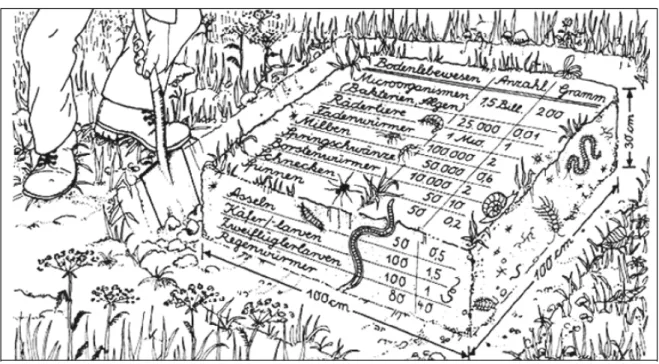
In einer Fläche von 1m 2 und 30 cm Tiefe leben unglaublich viele Lebewesen. Die Lebewesen können aufgrund ihrer Körpergröße in Gruppen eingeteilt werden.
Abb. 8 Lebewesen in einer Fläche von 1 m2 und 30 cm Tiefe8
Tab. 2 Bodenfauna
Organismengruppe: Größe: Ausgewählte Vertreter:
Mikroorganismen Bakterien, Pilze, Algen
Mikrofauna 2 µm – 0,2 mm Wimperntierchen, Wurzelfüßer Mesofauna 0,2 mm – 2 mm Bärtierchen, Springschwänze Makrofauna 2 mm – 2 cm Asseln, Spinnen, Insekten
Megafauna > 2 cm Regenwurm
Die Makro- und die Megafauna sind zahlenmäßig eher unbedeutend. Sie beeinflussen jedoch die physikalischen Bodeneigenschaften enorm, indem sie durch Wühlen für die Belüftung und die Durchmischung des Bodens sorgen. Darüber hinaus zerkleinern sie die Pflanzenstreu und machen diese erst damit für den mikrobiellen Abbau verwertbar.
Alle Bodenorganismen bauen organische Ausgangsprodukte zu anorganischen Endprodukten um. Dieser Prozess wird als Mineralisierung bezeichnet. Es handelt sich um eine Abbauprozess, bei dem Kohlenstoffdioxid freigesetzt wird. Die anorganischen Endprodukte sind pflanzenverfügbare Nährstoffe. Kleinere Organismen atmen relativ stärker als große, so dass die Zersetzungsleistung sogar bei 80 % liegen kann. Bakterien haben den größten Anteil an der CO2- Produktion, weil sie 80 % der aufgenommenen Nahrung veratmen. Pilze wandeln etwa 40 – 60 % in körpereigene Verbindungen um.
Versuch 1
Bodenatmung
Geräte: 250 mL Weithalserlenmeyerkolben
Bürette 3 x 1 L Weckglas mit Gummi und Klammer Magnetrührer mit Rührfisch
Becherglas 50 mL
Becherglas 100 mL
Abb. 9 Boden-Mikroorganismen 9
Chemikalien: Bodenprobe (am besten Kompost) Natronlauge c(NaOH) = 0,1 mol/L (Xi)
Phenolphthaleinlösung Salzsäure c(HCL) = 0,1 mol/L
Versuchsdurchführung:
In ein 50 mL Becherglas gibt man 20 mL verdünnte Natronlauge. Man wiegt 200 g des Kompostes ab und füllt ihn in das 1 L Einmachglas. Anschließend stellt man das Becherglas mit der Natronlauge in das Einmachglas und verschließt es dicht. Das Ganze wird dann an einem Platz mit konstanter Temperatur für 12 h aufbewahrt. Die Temperatur im Brütungsraum ist zu notieren. Man sollte mindestens zwei weitere Einmachgläser in der gleichen Art und Weise ansetzten, um nicht nur ein Titrationsergebnis zu erhalten.
Ist die Bebrütungszeit vorbei entnimmt man das 50 mL Becherglas aus dem Einmachglas und füllt den Inhalt in einen 250 mL Weithals-Erlenmeyerkolben. Man versetzt das ganze mit 50 mL Wasser und gibt wenige Tropfen Phenolphthalein dazu. Anschließend wird mit Salzsäure aus einer Bürette unter rühren bis zum verschwinden der Rosafärbung titriert. Der Verbrauch an Salzsäure wird notiert.
Hinweise für den Vortrag:
Je nach Qualität und Frischegrad des Kompostes und somit natürlich der Individuenzahl kann die Bebrütungszeit variieren. Aus diesem Grunde sollte man in mehreren Durchläufen testen wie lange die Proben in dem Einmachglas bleiben müssen, um eine ordentliche Titration durchführen zu können. Der Verbrauch an HCl sollte so bei ca. 10 mL liegen. Ist der Kompost zu „aktiv“ kann die Konzentration der NaOH und der HCl auf 1 mol/L erhöht werden, oder die Menge an Boden reduziert werden.
Versuchsauswertung:
Mikroorganismen im Boden, Bakterien und Pilze, gewinnen ihre Energie durch den Abbau von organischen Stoffen. Hierzu benötigen sie Sauerstoff und scheiden Kohlenstoffdioxid aus.
Durch die Bestimmung der von den Organismen ausgeschiedenen Menge an
Titerbestimmung:
20 mL NaOH Vorlage
VerbrauchHCl: c=0,1mol/L =18,4 mL tatsächlicher Verbrauch 18,4 mL
Titer = = =0,9mol/L
theoretischer Verbrauch 20 mL c(NaOH)=0,09mol/L
n (NaOH)=c(HCl)×V (HCl)un
=0,1mol/L×0,01L
=0,001mol
=1mmol
Kohlenstoffdioxid erhält man eine Vorstellung über die Aktivität der Mikroorganismen im Boden. Das Kohlenstoffdioxid wird dazu in dem Becherglas mit 20 mL Natronlauge absorbiert. Es reagiert dabei zunächst mit Wasser zu Kohlensäure, diese kann dann mit den Hydroxid-Ionen zu Hydrogencarbonat- bzw. Carbonat-Ionen reagieren. Der unverbrauchte Teil der Natronlauge kann anschließend mit Salzsäure maßanalytisch bestimmt werden. Als Indikator dient Phenolphthalein.
Für die Berechnung der Stoffmenge des entwickelten Kohlenstoffdioxids gilt folgende Beziehung:
" " + -
2 (l) 2(aq) 2 3 (aq) 3 (aq)
+ -
(aq) (aq) 2 (l)
- - 2-
3 (aq) (aq) 2 (l) 3 (aq)
- - -
2 0 un
H O +CO H CO H +HCO
H + OH H O
HCO +OH H O +CO
2n(CO )= n (OH ) - n (OH )= n(OH )
-
n (OH )= V(HCl)×c(NaOH)0
=0,02L×0,09mol/L
=0,0018mol
=1,8mmol
- - -
2 0 un
2
2 2 2
2n (CO )=n (OH ) - n (OH )=n(OH )
= 1,8mmol-1mmol
= 0,8mmol /:2 n(CO ) = 0,4 mmol
m(CO )=M(CO )×n(CO )
= 44 mg/mmol×0,4 mmol
=17,6 mg
Die Bodenorganismen in 200 g Boden haben in 12 h 17,6 mg CO2 ausgeatmet.
Die von den Bodenorganismen durch die Bodenatmung freigesetzte Menge an CO2 entspricht in landwirtschaftlich genutzten Böden 25 bis 30 kmol ha-1 a-1 Wasserstoff-Ionen (H+) aus Kohlensäure.
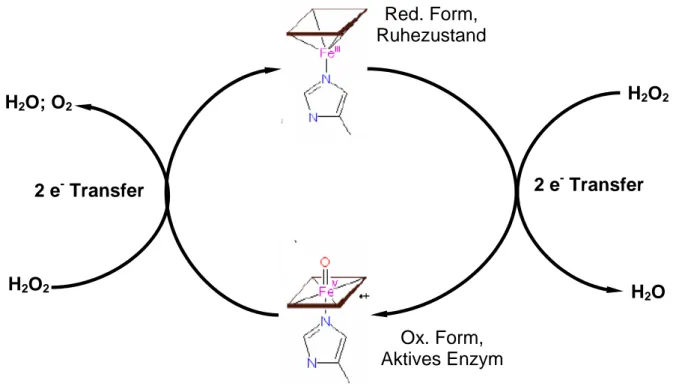
Bodenorganismen stoßen nicht nur CO2 aus, sondern auch Enzyme, die für den Boden wichtig sind. Zu diesen Enzymen gehört auch die Katalase, die Wasserstoffperoxid umsetzt. Bei der Verbindung Wasserstoffperoxid handelt es sich um ein Zellgift. Das Enzym besitzt eine Umsatzzahl von 5· 106 Molekülen pro Minute und ist somit eines der effektivsten Enzyme überhaupt.
Die Katalse enthält vier Porphyrin- Häm- Gruppen. Sie ist ein tetrameres Enzym. Ein einzelnes Porphyrinringsystem setzt sich aus 4 Pyrrolringen zusammen, die über CH2- Gruppen verknüpft sind. Die Stickstoffatome wirken als Komplexliganden, im Zentrum befindet sich ein Eisen- Ion, dessen 4 äquatoriale Positionen vom Porphyrinrin besetzt werden. Einen weiteren Liganden stellt ein Imidazolring eines Histidins in der Proteinseitenkette dar, der ebenfalls an das Eisen-Zentralatom koordiniert (Z). Die letzte freie äquatoriale Position kann durch das Substrat besetzt werden (Y). In unserem konkreten Beispiel ist das Substrat Wasserstoffperoxid.
Abb. 11 Strukturformel Katalase 11
Die Katalse katalysiert die eaktion von 2 Molekülen Wasserstoffperoxid zu 2 Molekülen Wasser und einem Molekül Sauerstoff. Weitere wichtige Tetrapyrrolsysteme mit unterschiedlichen Zentralatomen sind:
Chlorophyll: Zentralatom Mg Hämoglobin: Zentralatom Fe
Die Katalasezahl ist ein Maß für die Aktivität der Katalase im Boden. Sie wird in mL O2 pro Minute angegeben. Ist die Katalasezahl hoch, deutet dies auf eine hohe Anzahl von Bodenorganismen hin.
Versuch 2
Katalasetest
Geräte: Magnetrührer mit Rührfisch
Absaugflasche 100 mL mit passendem Stopfen PVC Schlauch 30 cm
Messzylinder 50 mL
Glaswanne Stativmaterial Stoppuhr Holzstab Feuerzeug
Chemikalien: Bodenprobe (am besten Kompost) 5 g H2O2-Lösung w = 3% 10 mL
Versuchsdurchführung:
Man trocknet ca. 50 g Kompost bei 30 °C im Trockenschrank und siebt diesen anschließend, so dass 5 g gesiebter Kompost übrig bleiben. Die 5 g Kompost füllt man in die 100 mL
Abb. 12 Enzym Katalase 12
Absaugflasche und gibt einen Rührfisch dazu. Zuvor ist die Apparatur jedoch aufzubauen.
Dazu wird die Glaswanne mit genügend Leitungswasser gefüllt, so dass der Zylinder tief genug eintauchen kann. Den Zylinder füllt man randvoll mit Wasser, deckt ihn mit einem Urglas ab und stülpt ihn kopfüber in die Wanne. Der Zylinder wird mit einer Klammer nach Kaufmann an einer Stativstange befestigt. Dann verbindet man das eine Schlauchende mit der Absaugflasche und führt das andere in den mit Wasser gefüllten Zylinder mindestens bis zur Hälfte ein. Die Absaugflasche wird auf einen Magnetrührer gestellt und ebenfalls mit einer Klammer an einer Stativstange befestigt. Dann hält man den Stopfen bereit, gibt 10 mL H2O2- Lösung zu dem Kompost, verschließt das ganze schnellstmöglich. Die Stoppuhr und der Magnetrührer werden eingeschaltet. Das sich in einer Minute bildende Gasvolumen wird abgelesen. Ist der Zylinder komplett mit Gas gefüllt, verschließt man ihn mit einem Uhrglas und nimmt ihn aus der Wanne. Mit einem glühenden Holzstab kann nun die Glimmspanprobe durchgeführt werden, um das Gas nachzuweisen.
Hinweise für den Vortrag:
Es muss geprüft werden, ob die entstehende Gasmenge ausreicht, um den Zylinder nach der 1 Messminute mit Gas zu füllen, um die Glimmspanprobe durchzuführen.
Versuchsauswertung:
Bodenorganismen scheiden eine Vielzahl von Enzymen aus, die auch außerhalb des Bodens wirken. Sie sind für die Humusbildung von Bedeutung. Diese Enzyme können nun zur Bewertung der Umsatzleistung und Humusbildung im Boden herangezogen werden. Die Bodenkatalse baut- wie im Stoffwechsel- giftiges Wasserstoffperoxid ab.
Ist der Boden katalasereich, sind viele Mikroorganismen an der Humusbildung beteiligt. Der erhaltene Katalasewert (Sauerstoffentwicklung pro Minute) erlaubt nun die
Bodenbeurteilung:
-1 -2 0
Katalase
2(aq) (l) 2(g)
2 2
2 H O ⎯⎯⎯⎯→ 2H O + O ↑
+3 -1 + +4 -2
2 2 2
+ +4 -1 +3 0 -2
2 2
2 2
Bildung des Eisen(IV)-Porphyrinradikalkations:
Enz(Por-Fe ) +H O Enz(Por -Fe=O) +H O
Rückbildung des Ferriporphyrins:
Enz(Por -Fe=O)+H O Enz(Por-Fe )+O H O
•
•
→
→ +
Katalasewert (mL O2/min)
Bodenbeurteilung
0 - 5 sehr schlecht
6 – 14 Schlecht
15 25 Befriedigend
26 – 49 Gut
50 & höher sehr gut
Betrachtet man die Umsetzung von Wasserstoffperoxid zu Wasser und Sauerstoff genauer, dann erkennt man, dass im ersten Reaktionsschritt das Eisenzentralatom seine Oxidationszahl ändert, es wird von der Oxidationsstufe +3 zur Oxidationsstufe +4 oxidiert. Die beiden Sauerstoffatome im Wasserstoffperoxid besitzen jeweils die Oxidationsstufe -1. Sie werden beide reduziert und erhalten jeweils ein Elektron. Eines der Elektronen stammt vom Eisenzentralatom, das andere aus dem Porphyrinring. Es entsteht so ein Eisen(IV)- Porphyrinradikalkation. Der zweite Schritt stellt die Rückbildung des Enzyms in seinen Ausgangszustand dar. Dazu wird ein Weiteres Molekül Wasserstoffperoxid benötigt. Das Zentralatom wird reduziert und das andere Elektron wird auf ein Sauerstoffatom übertragen;
es bildet sich molekularer Sauerstoff.
Mechanistisch kann man die Reaktion folgendermaßen verstehen:
Sobald Wasserstoffperoxid in das aktive Zentrum eintritt tritt es in Wechselwirkung mit einer Aminosäure der Proteinseitenkette. Es kommt zur Koordination eines der Sauerstoffatome des Wasserstoffperoxids. Ein Proton des einen Sauerstoffatoms des Peroxids wird auf das andere übertragen und die Sauerstoff-Sauerstoff-Bindung heterolytisch gespalten. Bei diesem Schritt wurden 2 Elektronen übertragen, eins stammt vom Eisen, das andere vom Porphyrinringsystem. Es kommt zur Bildung eines Eisen(IV)Porphyrinradikalkations. In einem zweiten Schritt reagiert die Oxospezies mit einem weiteren Molekül
Wasserstoffperoxid, das ebenfalls über eines seiner Sauerstoffatome koordiniert wird, über einen 2-Elekronen-Transfer unter Regeneration und Bildung von Wasser und molekularem Sauerstoff zu dem ursprünglichen Fe(III)-Enzym. Dieses steht nun wieder für die Umsetzung bereit.
Abb. 13 Mechanismus Katalasereaktion
3.2 Flora
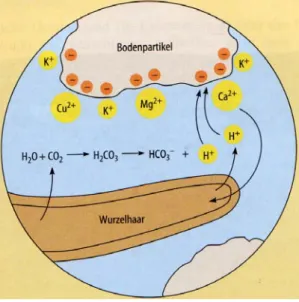
Neben der oben erwähnten Menge an CO2, das durch die Bodenatmung in den Boden eingetragen wird, scheiden auch die Wurzeln der Pflanzen H+-Ionen durch aktive H+- Exkretion durch „Protonenpumpen“ direkt aus, wodurch etwa 10 kmol ha- a- H+ frei werden.
Es ist auch noch zu erwähnen, dass die Wurzeln Polysaccharide und Polyuronsäuren („Wurzelexudate“) freisetzen, die auch zu CO2 veratmet werden. Das alles führt dazu, dass der pH Wert in unmittelbarer Umgebung der Wurzel um 1 bis 2 pH-Einheiten unter der des umgebenden Bodens liegt. Auch durch Niederschläge wird Säure eingetragen. Im „sauren Regen“ überwiegen die starken Säuren, so dass ca. 0,5 bis 1,5 kmol ha-1 a-1 Protonen vom Boden aufgenommen werden. Der Boden verfügt über verschiedene Puffersysteme, die bei Säureeintrag nach und nach aktiviert werden können.
H2O2
H2O H2O; O2
H2O2
2 e- Transfer 2 e- Transfer
Red. Form, Ruhezustand
Ox. Form, Aktives Enzym
Demonstration 3
Protonenabgabe von Wurzeln
Geräte: Reagenzglas Magnetrührer mit Rührfisch
Becherglas pH-Meter
Chemikalien: Agar Agar 1,5 g
Bromthymolblau 10 mg
Calciumchlorid CaCl2 200 mg
Kaliumchlorid KCl 200 mg 0,01 mol/L NaOH
Wurzel
Versuchsdurchführung:
Herstellung des Agars:
In ein Becherglas gibt man 1,5 g Agar agar, 10 mg Bromthymolblau, 200 mg CaCl2, 200 mg KCl und 200 mL dest. Wasser. Man erhitzt auf dem Magnetrührer unter gelegentlichem Umrühren so lange, bis der Agar in Lösung gegangen ist und die Flüssigkeit klar erscheint, sie muss aufkochen! Nachdem der Agar auf etwa 45 °C abgekühlt ist wird der pH-Wert mit 0,01 mol/L NaOH auf 6,5 eingestellt. Anschließend wird das Reagenzglas mit dem grün gefärbten Agar gefüllt und eine Pflanzenwurzel hineingehalten. Man wartet, bis der Agar erstarrt.
Abb. 14 Pfahlwurzel 14
Hinweise für den Vortrag:
Der erstarrte Agar kann längere Zeit aufbewahrt werden. Um ihn erneut zu verflüssigen sollte der Rührfisch im Becherglas belassen werden und der erstarrte Agar langsam auf dem Magnetrüher erhitzt werden.
Am besten eignen sich Pfahlwurzeln (wie z.B von Löwenzahn) für den Versuch. Wird der Vortrag im Wintersemester gehalten, kann man sich Erbsenpflanzen in wenigen Tagen selbst anziehen.
Versuchsauswertung:
Nach etwa 5 Minuten verfärbt sich der Agar in unmittelbarer Umgebung der Wurzel von blaugrün nach gelb. Mit zunehmender Versuchsdauer breitet sich die Gelbfärbung immer weiter aus.
Der Indikator Bromthymolblau verfärbt sich aufgrund einer pH-Senkung von blaugrün (etwa pH 6,5) nach gelb (pH < 6. Die Wurzeln geben Protonen in den Rhizosphärenraum ab und bewirken somit eine leichte Ansäuerung ihrer unmittelbaren Umgebung. Im Austausch gegen Kationen wie Ca2+ oder K+ geben die Wurzeln Protonen ab.
pH-Skala BTB
5,8 6,5 7,6
Abb. 15 Protonenabgabe der Wurzel 15
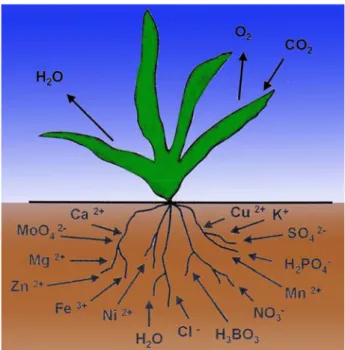
Pflanzen sind chemische Fabriken, die aus anorganischen Vorstufen organische Verbindungen synthetisieren. Pflanzen benötigen nicht nur Sonnenlicht und CO2 zum Wachsen, sondern auch Wasser und Mineralsalze. Das Kohlenstoffdioxid wird über die Spaltöffnungen der Blätter, Wasser mit den Wurzelhaaren aufgenommen. Die Mineralsalze stellen essentielle Nährelemente für die Pflanze dar. In größeren Mengen (> 20 mg/L) sind folgende 10 Elemente erforderlich, die auch als Makronährelemente bezeichnet werden:
Kohlenstoff (C), Sauerstoff (O), Wasserstoff (H), Stickstoff (N), Phosphor (P), Schwefel (S), Kalium (K), Calcium (Ca), Magnesium (Mg), Eisen (Fe). Die übrigen Elemente, die in weit geringerer Menge dem Nährmedium zugeführt werden müssen (< 0,5 mg/L) gehören zur Gruppe der Mikronährelemente (Spurenelemente): Mangan (Mn), Zink (Zn), Kupfer (Cu), Bor (B), Chlor (Cl), Molybdän (Mo), Nickel (Ni).
Für ihre Syntheseleistung benötigen die Pflanzen 17 chemische Elemente, die in unterschiedlicher Form meist aus dem Boden oder aus der Atmosphäre aufgenommen werden müssen um organische Verbindungen zu synthetisieren.
Abb. 16 Makro- und Mikronährstoffe16
Einige Elemente des Periodensystems sind am Aufbau wichtiger Verbindungen in der Pflanze beteiligt. Stickstoff ist Bestandteil der Aminosäuren und somit auch in den Proteinen vorhanden. Phosphor kommt in Form von Phosphat in den Nucleinsäuren (DNA, RNA) und im ATP, Adenosintriphosphat, dem Energieträger der Zelle vor. Magnesium stellt das Zentralatom des Chlorophylls dar und ist an der Aktivierung vieler Enzyme beteiligt. Eisen ist Bestandteil vieler prosthetischer Gruppen verschiedener Enzyme (u.a. in der Katalase). Eisen
ist auch wichtig bei der Chlorophyllsynthese. Dies wurde herausgefunden, indem man Pflanzen in Mangelkulturen aufzog. Wurde den Pflanzen ein Nährmedium ohne Eisen zum Wachsen aufgezogen, konnte folgendes festgestellt werden:
„Die neuen Blätter, die in eisenfreien Kulturen aufwuchsen blieben völlig weiß und erzeugen kein Chlorophyll.“ Dies wurde 1882 von J. Sachs festgestellt.
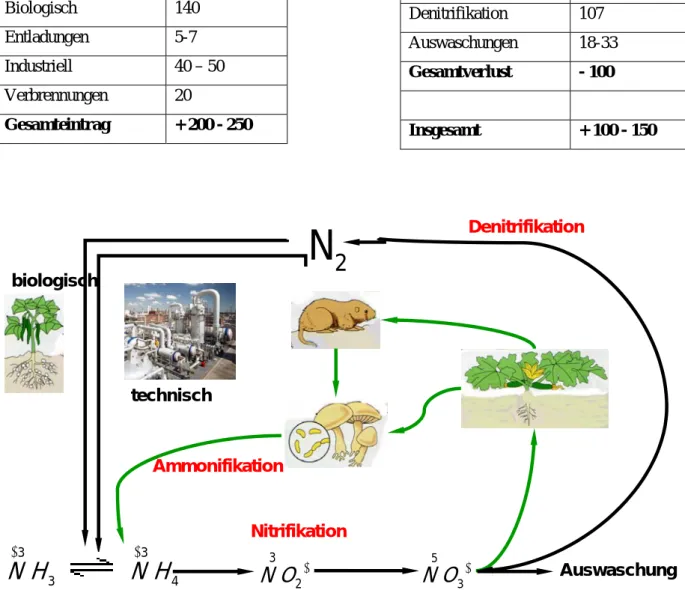
4 Der Stickstoffkreislauf
Der Stickstoff ist essentielles Bauelement aller Proteine und vieler anderer bedeutsamer Biomoleküle.
Obwohl Stickstoff (N2) mit 78% in der Atmosphäre vorhanden ist, kommt es zu Stickstoffmangel, da der molekulare Stickstoff von den Pflanzen nicht genutzt werden kann.
Es gibt jedoch stickstofffixierende Bakterien der Gattung Rhizobium, die in den Wurzelknöllchen von Schmetterlingsblütern (Leguminosen: z. B. Erbsen, Bohnen, Linsen und Kleearten) leben und den Luftstickstoff fixieren. Die Knöllchenbakterien fixieren mehr Stichstoff aus der Luft als die freilebenden Bakterien (Azobakter). Sind die Wurzeln mit diesen Bakterien infiziert, kommt es zur Entwicklung von neuen Organen, den so genannten
„Knöllchen“. Das Besondere an den neuen Organen ist, dass sie das Enzym Nitrogenase synthetisieren, das in der Lage ist, molekularen Stickstoff (N2) zu Ammoniak (NH3) zu reduzieren. Im Prinzip handelt es sich um den gleichen Prozess, der im Haber-Bosch- Verfahren genutzt wird, um Luftstickstoff für die Produktion von mineralischen Stickstoff- Düngemitteln zu fixieren. Allerdings ist der biochemische Prozess um einiges effizienter als die technische N2-Fixierung. Die biologische N2-Fixierung erfolgt bei physiologischen Temperaturen und Atmosphärendruck, die technische N2-Fixierung benötigt trotz des Einsatzes von Katalysatoren Temperaturen von 400 °C und einen Druck von 20 MPa (200- facher Atmosphärendruck).
Knöllchenbakterien:
enzymatisch, Umgebungstemperatur, Normaldruck
Nitrogenase
- +
2
3 2 i
N +8 e +8H +16 ATP
2NH +H +16ADP+P
⎯⎯⎯⎯⎯→
2(g) 2(g) 3(g)
3H +N 2NH +92kJ
Haber Bosch Verfahren:
katalytisch, 500 °C, 200 bar
In der Bodenlösung wird aus Ammonium-Ionen Nitrat gebildet, das von nitrifizierenden Bakterien gebildet wird, die Ammonium über die Stufe des Nitrits zu Nitrat umwandeln. Der Prozess stellt die Nitrifikation dar. Nitrat wird in der Pflanze in Ammonium zurückverwandelt und in die Biomasse eingebaut. Tiere können nur organischen Stickstoff verwenden, das heißt, sie müssen Pflanzen oder andere Tiere essen. Organische Stickstoffverbindungen werden vor allem durch Pilze und Bakterien zersetzt, es entstehen wieder Ammoniumionen. Diesen Prozess der Remineralisierung nennt man Ammonifikation.
Das durch die Nitrifikation entstehende Nitrat kann über die Denitrifikation wieder zu molekularem Stickstoff umgewandelt werden und wird so dem inneren Kreislauf entzogen.
Abb. 17 Stickstoffkreislauf
N-Verlust Mio. t
Denitrifikation 107 Auswaschungen 18-33 Gesamtverlust - 100
Insgesamt + 100 - 150 N2- Fixierung Mio. t
Biologisch 140 Entladungen 5-7 Industriell 40 – 50 Verbrennungen 20
Gesamteintrag + 200 - 250
N
23 3
3 4
N H− N H− +
technisch biologisch
3
N O+ 2− N O+5 3− Auswaschung Denitrifikation
Nitrifikation Ammonifikation
Versuch 3
Nitratnachweis
Geräte: Demoreagenzglas
Reagenzglasständer mit weißem Hintergrund
Becherglas Glasfilter mit Filterpapier
Chemikalien: Bodenprobe gedüngt
Schwefelsäure c(H2SO4) = 2,5 mol/L
Konz. Schwefelsäure
Eisen(II)sulfat FeSO4
Versuchsdurchführung:
Vor Versuchsbeginn muss eine Bodenlösung hergestellt werden. Dazu filtriert man eine Bodenaufschlämmung (5 g Boden & 15 mL Wasser). Da Nitrate im Boden wasserlöslich sind kann mit dieser Bodenlösung der Nachweis durchgeführt werden. Einige Milliliter der Probelösung werden in das Demoreagenzglas gefüllt. Dazu gibt man die gleiche Menge von Eisensulfatlösung und säuert das ganze mit 2,5 mol/L H2SO4 an. Dann unterschichtet man das Ganze vorsichtig mit konzentrierter Schwefelsäure, indem man das Demoreagnezglas schräg hält und die Schwefelsäure an der Innenseite des Reagenzglases runterfließen lässt.
Versuchsauswertung:
An der Grenzfläche zwischen den beiden Flüssigkeiten bildet sich ein brauner Ring, weshalb man bei diesem Nitratnachweis auch von der „Ringprobe“ spricht. Dort werden die Nitrationen zu Stickstoffmonoxid (NO) reduziert, wobei Fe2+ zu Fe3+ oxidiert wird Redoxreaktion).
Abb. 18 Ringprobe 18
Das NO fungiert als Ligand. Es kommt zum Ligandenaustausch zwischen einem Wasserliganden des Eisenhexaquakomplexes und dem enstehenden Stickstoffmonoxid.
Fehlt es zum Beispiel an Nitrat können andere Elemente im Überschuss vorhanden sein, dennoch können sie das fehlende Element nicht ersetzen. In anderen Worten ausgedrückt:
Das Wachstum der Pflanze wird von dem Nährelement bestimmt, das relativ zu den anderen Nährelementen in mangelhaften Konzentrationen vorliegt. Ein Erhöhen der übrigen Nährelemente kann den Mangel nicht ausgleichen. Dieses Prinzip wird durch die Minimumstonne veranschaulicht. Die einzelnen Dauben stellen die verschiedenen Nährelemente dar. Auf den vorderen Dauben stehen Makronährelemente, auf den hinteren die Mikronährelemente.
Erste Überlegungen über die Pflanzenernährung wurden von ARISTOTELES angestellt. Er stellte sich vor, dass sich die Pflanzen von abgestorbenen organischen Substanzen ernähren.
Man spricht in diesem Zusammenhang von der Humustheorie. Diese wurde im 20.
Jahrhundert von der Mineralstofftheorie abgelöst, die besagt, dass sich Pflanzen ausschließlich von anorganischen Stoffen ernähren. Fehlt einer dieser Stoffe, so werden Wachstum und Entwicklung der Pflanze beeinträchtigt. Der Giessener Chemiker LIEBIG verhalf der Mineralstofftheorie zum Durchbruch, das Prinzip wird durch die
„Minimumstonne“ veranschaulicht.
Abb. 19 Minimumstonne19
+5 +2
- 2+ + 3+
3 (aq) (aq) (aq) (aq) (aq) 2
+2 +2 +2
2+
(aq) 2 6 2 5 (aq) 2
N O +3Fe + 4 H 3Fe + N O +2H O
N O + Fe (H O) Fe (H O) (NO) +H O
→
⎡ ⎤ → ⎡ ⎤
⎢ ⎥ ⎢ ⎥
⎣ ⎦ ⎣ ⎦
Im Laufe der Zeit werden dem Boden, je nach Art des Anbaus, bestimmte Ionen in unterschiedlichem Ausmaß entzogen. Die fehlenden lebensnotwendigen Elemente können nicht durch andere Elemente ersetzt werden. Daher hängen Wachstum und Ertrag immer von dem Element ab, das in geringsten Mengen vom Boden angeboten wird. Hier setzt nun die Aufgabe der Düngung ein.
5 Bodeneigenschaften
Will man die Bodeneigenschaften betrachten, so muss man die Bodenbestandteile und deren Eigenschaften kennen. Silicate sind die häufigsten Mineralien der Erdkruste (90 %) und somit auch wesentliches Ausgangsprodukt für die Mineralien, die bei der Verwitterung entstehen.
Aus Silicaten (Glimmer, Feldspäte, Quarze) entstehen so genannte Tonmineralien (sekundäre Minerale) durch Verwitterung. Tone sind wichtiger Teil aller fruchtbarer Böden.
5.1 Silicate und Tonminerale
Die Grundbaueinheit der Silikate ist das SiO4-Tetraeder mit einem Si4+-Kation im Zentrum und Oxid-Ionen an den Spitzen. Statt des Si4+ als Zentralatom des Tetraeders kann auch Al3+
das Tetraeder besetzen. Man spricht von isomorphem Ersatz, da der räumliche Bau des Tonminerals erhalten bleibt. Dabei entsteht jedoch eine negative Überschussladung, die durch die lockere Bindung eines Kations an der Oberfläche kompensiert wird.
In ihrer Struktur ähneln die Tonminerale den Schichtsilicaten, wie zum Beispiel den Glimmern. Die Siliziumteraoxid-Tetraeder sind mit drei in einer Ebene liegenden O2- Ionen verknüpft. Das vierte O2- Ion verknüpft die Tetraederschicht mit der Oktaederschicht. Im Oktaeder sind Al3+, Mg2+ und Fe2+ Ionen 6-fach koordiniert. Von den sechs O2- Ionen dienen zwei der Verknüpfung zur nächsten Tetraederschicht, zwei weitere bilden mit Protonen Hydroxylionen und die letzten beiden verknüpfen die Oktaeder untereinander zu Schichten.
Man spricht auch von den 2:1 oder 3-Schichtmineralen, da eine Schicht aus 3 Lagen besteht oder genauer betrachtet, aus 2 Tetraederschichten mit dazwischen liegender Oktaederschicht.
Daran schließt sich eine Schicht aus Kationen an. Mit dieser Kationenschicht kommt man auf eine Schichtdicke von ca. 9,94 Å, also ungefähr einem Nanometer.
Abb. 20 Aufbau eines Schichtsilicates20
Versuch 4
Filterwirkung von Böden
Geräte: 2 Erlenmeyerkolben 200 mL 2 Erlenmeyerkolben 100 mL 2 Erlenmeyerkolben 500 mL 2 Glastrichter mit Faltenfilter
Chemikalien: Eosin-Lösung w = 0,01 %
Methylenblau-Lösung w = 0,01 % Gartenerde
Versuchsdurchführung:
Man füllt den im Glastrichter befindlichen Faltentrichter mit Gartenerde und drückt die Erde im Filter etwas an. Den mit Erde gefüllten Trichter stellt man in den großen 500 mL
Tetraederschicht Oktaederschicht Tetraederschicht
Zwischenschichtkationen K+
O2-
Si4+/Al3+
OH- Al3+
Abb. 21 Bodenprofil 21
Erlenmeyerkolben, das macht man mit dem zweiten Filter ebenfalls. Dann stellt man die beiden Farbstofflösungen her (jeweils 200 mL), indem man jeweils gleich viele Tropfen der Farbstofflösung in dest. Wasser gibt, bis die Färbung zu erkennen ist. 100 mL der Farbstofflösungen werden entnommen und in einen 100 mL Erlenmeyerkolben gegeben, diese Lösung dient später als Vergleichslösung. Die anderen 100 mL werden in die Bodenprobe geschüttet und man fängt das Filtrat im Erlenmeyerkolben auf. Zum besseren Erkennen des Farbunterschieds stellt man die entsprechenden Lösungen neben das Filtrat.
Versuchsauswertung:
Eosin ist ein anionischer Farbstoff, das heißt, er ist negativ geladen. Methylenblau ist ein kationischer Farbstoff, er ist positiv geladen. Die Bodenkolloide des Bodens tragen eine negative Überschussladung. Somit wird der kationische Farbstoff Methylenblau an der Oberfläche der Bodenkolloide adsorbiert, während Eosin als anionischer Farbstoff nicht aus der Lösung durch Adsorption entfernt wird.
Abb. 23 Adsorption von Anionen und Kationen an den Bodenpartikeln O
Br
Br
Br
Br O
COO- HO
S N
N N
H3C
CH3
CH3
CH3
Neben den oben erwähnten Tonmineralien sind auch im Boden vorhandene Huminstoffe negativ geladen. Die Humusbildung ist ein Aufbauprozess und darf nicht mit der Mineralisierung verwechselt werden. Bei der Mineralisierung werden organische Ausgangsprodukte zu anorganischen Endprodukten abgebaut. Bei Humus handelt es sich um hochmolekulare Substanzen, die verzögert mineralisiert werden. Ausgangsstoffe sind vor allem Lignin, phenolische Verbindungen und Cellulose. Durch enzymatische Spaltung entstehen niedermolekulare Bruchstücke, die wiederum zu Huminstoffen kondensieren. Die Humusbildung ist demnach im Gegensatz zur „Verwesung“/Mineralisierung ein Aufbauprozess.
Verbinden sich anorganische Partikel mit organischen Fragmenten durch die Tätigkeit der Bodenorganismen bilden sich Ton-Humus-Komplexe, die für die Eigenschaften des Bodens von enormer Bedeutung sind. Der Humusanteil des Bodens erhöht das Sorptions- und Austauschvermögen an Kationen und ist wichtig für den Wasserhaushalt.
Durch die negativ geladenen Bodenkolloide kann der Boden als Kationenaustauscher fungieren. Er stellt ein Reservoir für Pflanzennährstoffe dar, verhindert die Auswaschung aus von Kationen aus dem Boden und bindet jedoch auch Schwermetallkationen, wie Blei-, Cadmium-, Quecksilberkationen.
Betrachtet man die negativ geladenen Bodenkolloide binden Kationen als Gegenionen zusammen mit Wasser durch elektrostatische Wechselwirkungen mehr oder weniger fest an die Bodenkolloide. Es entsteht eine elektrische Doppelschicht. Man spricht auch von der Sternschicht. Außerhalb der fest haftenden Sternschicht befindet sich die Diffuse Außenschicht, in der die Kationen weniger fest gebunden sind. Der Kationenanteil der Sternschicht steht mit dem der diffusen Ionenschicht in Wechselwirkung. Die Kationenkonzentration in der Sternschicht ist um ca. 2-3 Zehnerpotenzen höher als die Kationenkonzentration in der Bodenlösung. Zwischen den adsorbierten Kationen und den Kationen in der Bodenlösung kommt es zur Diffusion in Richtung des Konzentrationsgefälles.
So entsteht ein Kationenschwarm um die Tonmineralien herum. Die Anionenkonzentration ist direkt in der Doppelschicht geringer als in der Außenschicht, da es in unmittelbarer Nähe zu den Tonmineralien zur Abstoßung kommt.
Abb. 24 Sternschicht und Diffuse Doppelschicht in der Umgebung der Tonmineraloberfläche
Häufig vorkommende Tonminerale besitzen Austauscherplätze zwischen 20 mmol und 150 mmol pro 100 g. Noch wesentlich mehr Kationen können in der organischen Substanz des Bodens gespeichert werden, vor allem die typischen Huminstoffe weisen bis zu 500 mmol Kationenaustauscherplätze pro 100 g auf. Da Böden ein Gemisch aus unterschiedlichen Mineralien sind und unterschiedlich humos sein können, erstreckt sich die Ionenaustauscherkapazität über einen weiten Bereich.
Versuch 5
Ionenaustausch
Geräte: 2 Erlenmeyerkolben 500 mL 2 Glastrichter mit Faltenfilter
2 Demoreagenzgläser
Reagenzglasständer mit schwarzem Hintergrund
Chemikalien: Gartenerde luftgetrocknet -
Sternschicht
Elektrische Doppelschicht
Diffuse Ionenschicht
Kationenaustausch- kapazität:
Tonmineralien:
0,2 – 0,8 mol/kg
Org. Substanzen:
1,5 – 5 mol/kg -
-
- -
- - - - - - - -
+ +
+
+ +
+ + + + + + + +
Abb. 25 Bodenpartikel 25
Kaliumchlorid-Lösung w = 5 % Ammoniumchlorid-Lösung w = 3 %
Calciumoxalat-Lösung
Versuchsdurchführung:
Etwas Gartenerde wird in den Filter im Glastrichter gegeben und leicht angedrückt. Der Filter wird in den Erlenmeyer gestellt. Dann werden 50 mL dest. Wasser durch den Filter gegossen und das Filtrat im Erlenmeyerkolben aufgefangen. Durch den anderen mit Boden gefüllten Filter werden 50 mL KCl-Lösung gegossen. Das Filtrat wird ebenfalls im darunter stehenden Erlenmeyerkolben aufgefangen. Von den Filtraten werden einige Milliliter in Demoreagenzgläser gefüllt und mit Oxalat C2O42- auf Ca2+-Ionen überprüft.
Versuchsauswertung:
Bei der Überprüfung des Filtrats, das mit dest. Wasser hergestellt worden ist, tritt kein weißer Niederschlag auf. Beim Bodenfiltrat der KCl Lösung kommt es zur Bildung eines weißen Niederschlags. Der Nachweis auf Ca2+ mit Oxalat ist positiv.
Abb. 26 Ionenaustauschkapazität von Bodenpartikeln
+
+ H O3
2+ 2-
(aq) 2 4 (aq) 2 4(s)
Ca +C O CaC O
Ca2+
Ca2+
Na+ Al3+
Mg2+
Fe3+
Ca2+
K+ Na+ Fe3+
Ca2+
Ca2+
Na+ Al3+
Mg2+
Fe3+
Ca2+
K+ Na+ Fe3+
Ca2+
Ca2+
Na+ Al3+
Mg2+
Fe3+
Ca2+
K+ Na+ Fe3+
Ca2+
Ca2+
Na+ Al3+
Mg2+
Fe3+
Ca2+
K+ Na+ Fe3+
K+ K+
K+
K+ K+
K+
+ 6 K
+H3O+
Gibt man dest. Wasser zu sind keine Kationen vorhanden, die an die Bodenpartikel gebundene Kationen verdrängen können. Die durch die Autoprotolyse von Wasser vorhandenen Hydroxoniumionen haben kaum einen Einfluss auf die Reaktion. Gibt man jedoch eine Salzlösung hinzu verdrängen die vorhandenen Kationen an die Bodenkolloide gebundene Ionen unter anderem Ca2+- Ionen. Diese sind mit Oxalat als weißer Niederschlag nachweisbar.
7 Boden- ein Thema für den Chemieunterricht
Themenkomplex Boden
Luft, Wasser und Bodenqualität sind elementare Vorraussetzungen für pflanzliches, tierisches und menschliches Leben. Angesichts der drohenden Gefährdung der Böden durch Erosion, Schadstoffbelastung und Bodenverbrauch ist es von großer Bedeutung dem Thema Boden die angemessene Bedeutung im naturwissenschaftlichen Unterricht zukommen zu lassen.
Das Thema Boden ist ein sehr komplexes Thema, das nicht nur im Chemieunterricht behandelt werden kann. Über die Schulfächer hinaus ist die Bodenanalytik für weitere gesellschaftliche Bereiche von großer Wichtigkeit. Dies zeigt auch die folgende Abbildung:
Notwendigkeit Von
Bodenanalysen
Chemie:
Nährstoffe, Düngemittel…
Mineralogie:
Bodenbildung, Untergrundgestein…
Soziologie:
Ernährung der Weltbevölkerung…
Politik:
Gesetze für Land- Wirtschaft und Umwelt…
Ernährungs- wissenschaften:
Gesunde Ernährung, unbelastete Lebensmittel…
Biologie:
Nährstoffbedarf der Pflanzen…
Bodenkunde:
Klassifizierung von Böden…
Agrarwissenschaften:
Ertragssteigerung, Qualitätsverbesserung…
Abb. 27 Bodenanalyse- fächerübergreifend 27
Für die Schüler/innen hat das Thema Boden einen großen Alltagsbezug (eigener Garten, Balkon, Landwirtschaft). Durch die Sensibilisierung für das Thema können die eigenen Verhaltensweisen beeinflusst werden. Nicht nur für die Schule sondern auch für die Gesellschaft ist das Thema Boden wichtig. In der Öffentlichkeit liest man öfters von
„Überdüngung und Trinkwasserbelastung“ und anderen aktuellen Meldungen über Umweltbelastungen und Boden.
Lehrplanbezug
Die 9. Klasse des 8-jährigen Gymnasiums beginnt mit dem Themenkomplex „Wasser“. In diesem Zusammenhang kann man über den Kontext „Saurer Regen- saures Wasser- saurer Boden“ zum Thema Boden hinführen. Das Thema Boden wird jedoch auch als eigenständiger Themenbereich im Lehrplan erwähnt. In diesem Zusammenhang wird insbesondere auf den Aufbau, die Inhaltsstoffe und die Funktion von Böden eingegangen. Werden Bodenuntersuchungen durchgeführt soll auf folgende Punkte besonders Wert gelegt werden:
Verhalten gegenüber Wasser,
Nachweis von Mineralsalzen,
pH-Wert,
Kalkgehalt und
Humusgehalt.
Der Lehrplan schlägt weitere Themen zur Behandlung im Unterricht vor, dazu gehören:
Versauerung
Versalzung
Kompensationskalkung
Kompostierung
Ionenaustasuchkapazität / Pufferverhalten
Düngemittel
Die Themen Störung stofflicher Gleichgewichte, Versalzung, Versauerung, Überdüngung und Stoffkreisläufe gehören zu dem übergeordneten Leitziel des Lehrplans, der Umwelterziehung und ökologischen Bildung.
Aufgrund des Komplexität des Themenbereichs „Boden“ bietet sich an dieser Stelle ein projektorientierter Unterricht an.
8 Literatur
Bodenkunde Lehrbücher
Scheffer- Schachtschabel: Lehrbuch der Bodenkunde, Heidelberg: Spektrum Akadamischer Verlag 15. Auflage
Schichtling, E.: Einführung in die Bodenkunde, Berlin: Pareys Studientexte, 5. Auflage.
Gisi, U.: Bodenökologie, Georg Thieme Verlag, Stuttgart 1990.
Rid, H.: Das Buch vom Boden, Stuttgart: Ulmer 1984.
Chemiebücher:
Blasius, J.: Lehrbuch der analytischen Chemie, 15. Auflage, Leipzig: Hirzel Verlag 2002.
Riedel, E.: Anorganische Chemie, 6. Auflage, Berlin: Walter de Gruyter, 2004.
Schulmaterialien
Praxis der Naturwissenschaften, 6/42 Jg. 1993 Praxis der Naturwissenschaften, 7/46 Jg. 1997
Naturwissenschaft im Unterricht Chemie, 3 1992 Nr. 15.
Chemie in unserer Zeit, 2004, 38, 242 f.
Unterricht Chemie, Themenheft BODEN (Bibliotheksbüro FB Chemie)
Internetquellen
Unterrichtsbausteine zum Thema Boden:
http://www.nua.nrw.de/nua/content/oeffentl/publikat/br_27_1.htm Boden Werkstatt:
http://hypersoil.uni-muenster.de
Kreuz und Quer ums Thema Boden:
http://www.bodenwelten.de/bodenframe.htm
www.wzw.tum.de/bk/pdfs/vorlesungen/bk1_ws/edaphon.pdf
Abbildungsverzeichnis
1 Geoheft 10/2003
3 www.bgr.bund.de
www.walther-rathenau-sw.de www.drweb.de
www.geo.tu-freiberg.de www.naturseite.ch
alpenblumen.gabathuler.org www.obsthof-eberl.at www.physikfuerkids.de
4 http://www.staff.uni-mainz.de/hjfuchs/Tirol/Homepage%2012.12/
ergebnisse_und_auswertung_risiko-Dateien/image006.jpg letzter Zugriff 09.01.2008
5 http://www.hamm-chemie.de/images/k9/abb/wbb_eis.gif
6 http://www.rebenholz.de/assets/images/Wurzel_klein.jpg letzter Zugriff 09.01.2008
7 http://www.umwelt.tg.ch/pictures/bodenprofil.gif
8 www.nua.nrw.de/nua/content/de/oeffentl/publikat/pdfs/bodenwerkstatt/bodenwerkstatt0 55-062.pdf
9 http://www.uni-heidelberg.de/magazin/2004/grafik/0304/vortrag_holst2.jpg letzter Zugriff 09.01.2008
10 http://www.cup.uni-muenchen.de/ac/kluefers/homepage/L/BAC/1qwl.gif letzter Zugriff 09.01.2008
11 http://upload.wikimedia.org/wikipedia/commons/thumb/9/9b/Protoporphyrin_IX.png/
200px-Protoporphyrin_IX.png
12 http://i102.piczo.com/view/2/1/m/9/b/n/1/c/n/x/8/1/img/i139357941_75196_6.gif?
redirsrc=img letzter Zugriff 09.01.2008
14 http://www.kircheneuenhagen.de/Wurzel.jpg letzter Zugriff 09.01.2008
15 Campell, N. A.; Reece, J.B.; Biologie 6., aktualisierte Auflage, München, Pearson 2006.
16 ChiuZ, 2004, 38, S. 242
18 www.chemgapedia.de/vsengine/media/vsc/de/ch/6/ac/versuche/grafiken/nitrat_foto 204.jpg letzter Zugriff 09.01.2008
19 http://rs-maxdorf.bildung-rp.de/cm/images/stories/minimumtonne.jpg
20 www.winona.edu
21 http://www.ag.ch/umwelt/shared/bilder/bodenprofil.gif letzter Zugriff 09.01.2008
27 Verändert nach: NiU-Chemie 3 (1992) Nr. 15 Abb. 1.