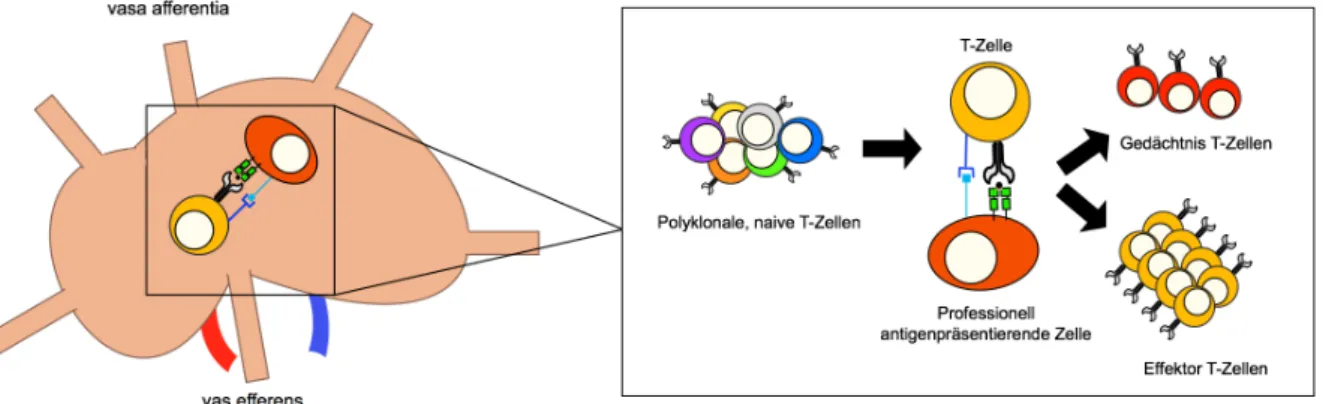
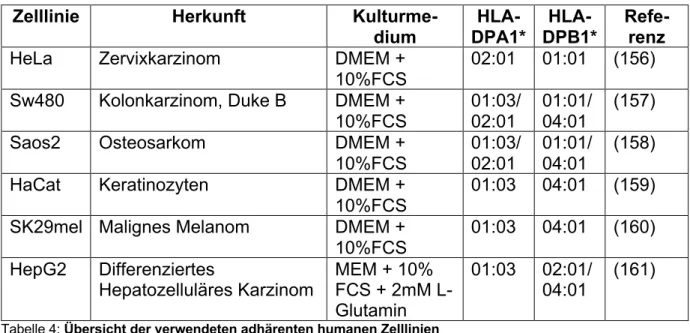
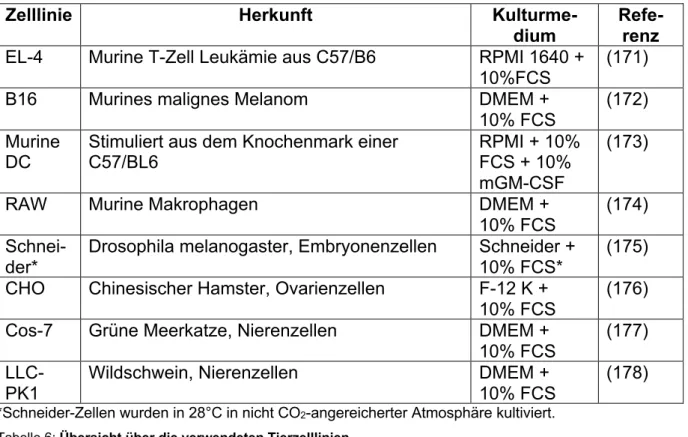
CHARAKTERISIERUNG EINES HLA-DP SPEZIFISCHEN T-ZELL REZEPTORS
Volltext
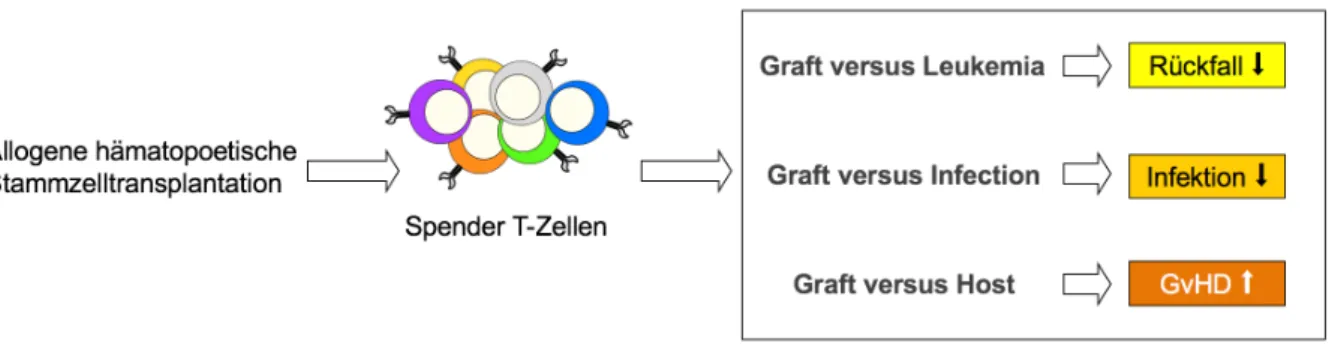
Abbildung


ÄHNLICHE DOKUMENTE
To identify pDR-.3-1, highly purified HLA-DR antigen (3 chains derived from Raji cells were subjected to NH2-terminal amino acid sequence determination.. This se- quence
Er- schwert wird die Abgrenzung auch dadurch, daß bei Patienten mit einer alkoholischen Herzerkrankung an- dere Manifestationen eines chroni- schen Alkoholabusus wie eine
Es konnte gezeigt werden, daß - im Vergleich zu den asymptomatischen (klinisch gesunden) Individuen - einzelne HLA-Antigene und ihre Kombina- tionen und geschätzten
Diese demonstrieren mehr akute und chronische Abstoßungsreaktionen (129, 130) und eine kürzere Transplantatüberlebenszeit (131), als Patienten ohne Antikörperbildung
• Benachrichtigung über endgültige Zusage eines Schulplatzes, Platz auf Nachrückliste oder endgültige Absage (Information per Download in
The different flexibilities of the peptide and its binding grooves, as seen both in the simulations and in the time- resolved experiments, explain the measured entropy changes for
The in vitro generation of PLTs can originate from CD34 + cells derived from peripheral blood, umbilical cord blood, bone marrow and human embryonic stem cells
1) Bei Nichteinhaltung der Sicherheitsbestimmungen (bei der Waffenkontrolle vor dem Start - Hülse in der Patronenkammer) erfolgt nur beim 1.DP und für jeden Sportler nur