P H Y S I K
T H E R M O DYNAM IK
F. HERRMANN
SKRIPTEN ZUR EXPERIMENTALPHYSIK ABTEILUNG FÜR DIDAKTIK DER PHYSIK UNIVERSITÄT KARLSRUHE
AUFLAGE 1997
Hergestellt mit RagTime
Druck: Universitätsdruckerei Karlsruhe
Vertrieb: Studentendienst der Universität Karlsruhe März 1997
Alle Rechte vorbehalten
Inhaltsverzeichnis
1. Mengenartige Größen und der Aufbau der Physik
... 72. Entropie und Temperatur
... 112.1 Die Entropie als Wärmemaß ... 11
2.2 Die Festlegung der Entropieskala ... 12
2.3 Entropie und Energie, die Festlegung der Temperaturskala ... 13
2.4 Die Einheiten von Temperatur und Entropie ... 14
2.5 Wärmemotor und Wärmepumpe ...15
2.6 Entropieerzeugung – reversible und irreversible Prozesse ... 16
2.7 Der Wirkungsgrad ...18
2.8 Das thermische Gleichgewicht...19
2.9 Die Messung von Temperatur und Entropie ... 20
2.9.1 Die Messung der Temperatur ...20
2.9.2 Die Messung der Entropie ...20
2.10 Der erste und der zweite Hauptsatz ...21
2.11 Entropieinhalt am absoluten Nullpunkt ... 22
2.12 Die Entropiekapazität ...22
2.13 Die Entropieleitfähigkeit ...25
2.14 Zur Geschichte des Wärmebegriffs ...27
3. Stoffmenge und chemisches Potential
... 293.1 Stoffe und Grundstoffe ...29
3.2 Die Menge ...31
3.3 Das chemische Potential ... 33
3.4 Die Skala des chemischen Potentials ... 34
3.5 Der Nullpunkt des chemischen Potentials ... 35
3.6 Die Werte des chemischen Potentials ... 36
3.7 Beispiele für den Umgang mit dem chemischen Potential ... 37
3.8 Der Reaktionswiderstand ... 40
3.9 Reversibel ablaufende Reaktionen – elektrochemische Reaktionen ...43
3.10 Irreversibel ablaufende Reaktionen – die Entropiebilanz chemischer Reaktionen ...44
3
4. Gibbssche Fundamentalform, Gibbsfunktion, Gleichgewicht
... 474.1 System und Zustand ... 47
4.2 Die Gibbssche Fundamentalform ...47
4.3 Gibbsfunktionen ...49
4.4 Die Zerlegung von Systemen ... 50
4.5 Energieformen ...52
4.6 Zustandsgleichungen ...54
4.7 Lineare Approximation der Gibbsfunktion ...58
4.8 Kreisprozesse ... 59
4.9 Warum die Energieform Wärme nicht in einem System enthalten sein kann ... 60
4.10 Gleichgewichte ...62
4.11 Fließgleichgewichte ... 64
5. Spezielle Systeme und Prozesse
... 675.1 Das ideale Gas ...67
5.1.1 Die thermische Zustandsgleichung des idealen Gases ...67
5.1.2 Die p- und die V-Abhängigkeit von Energie, Entropie und chemischem Potential bei T = const ...68
5.1.3 Gelöste Stoffe als ideale Gase ...71
5.1.4 Das gravitochemische Potential ... 72
5.1.5 Gemische idealer Gase ...73
5.1.6 Das Massenwirkungsgesetz ... 74
5.1.7 Die zweite Zustandsgleichung: S = S(T, p, n) ... 75
5.1.8 Isentropen, Isobaren und Isochoren des idealen Gases ...77
5.1.9 Die dritte Zustandsgleichung: µ = µ(T, p, n) ... 78
5.1.10 Einfache Kreisprozesse mit idealen Gasen ... 79
5.2 Flüssigkeiten und Feststoffe ...80
5.2.1 Das chemische Potential ... 80
5.2.2 Die Entropie von Feststoffen ... 82
5.3 Strömungen ... 84
5.3.1 Strömungen ohne Energiefluß durch die Rohrwand ...85
5.3.2 Strömung eines idealen Gases ohne Energiefluß durch die Rohrwand ... 86
5.3.3 Isotherme Strömung des idealen Gases ... 87
5.3.4 Ideale Strömungen inkompressibler Flüssigkeiten ... 87
5.3.5 Flüssigkeitsströmungen im Schwerefeld ... 88
5.4 Phasenübergänge ...89
5.4.1 Phasen ... 89
5.4.2 Phasenübergänge ...89
5.4.3 ξ-X-Diagramme ...90
5.4.4 Die Clausius-Clapeyron-Gleichung ... 91
5.4.5 Verdunsten und Sieden ... 92
5.4.6 Lösungen ... 92 4
5.5 Reale Gase ...93
5.5.1 Der kritische Punkt ...93
5.5.2 Die Van-der-Waals-Gleichung ... 93
5.5.3 Adiabatische Strömung eines realen Gases – der Joule-Thomson-Effekt ... 93
5.6 Das Licht-Gas ... 95
5.6.1 Thermische Strahlung ... 95
5.6.2 Die Entropie des Lichts ...96
5.6.3 Die Temperatur des Lichts ... 96
5.6.4 Das chemische Potential des Lichts ... 97
5.6.5 Die Größe Strahldichte ...98
5.6.6 Das Stefan-Boltzmann-Gesetz ... 100
5.6.7 Druck und Entropie der schwarzen Strahlung als Funktion der Temperatur .... 100
5.6.8 Isotherme, isentrope und isoenergetische Expansion des Lichts ... 102
5.6.9 Die kosmische Hintergrundstrahlung ...102
5.6.10 Das Gas-Kondensat-Analogon ... 103
5.6.11 Licht, dessen chemisches Potential ungleich null ist ... 103
5.6.12 Energietransport mit thermischer Strahlung ... 103
5.6.13 Das Kirchhoffsche Strahlungsgesetz ...104
6. Thermische Maschinen
...1056.1 Überblick ... 105
6.2 Warum man Wärmekraftmaschinen benutzt ...105
6.3 Maschinen mit äußerer Verbrennung ... 106
6.3.1 Zyklisch arbeitende Maschinen – der Stirlingprozeß ...106
6.3.2 Strömungsmaschinen ... 107
6.4 Maschinen mit innerer Verbrennung ...109
6.4.1 Zyklisch arbeitende Maschinen – der Ottomotor ... 109
6.4.2 Strömungsmaschinen – die Gasturbine ... 109
6.5 Kältemaschinen ... 110
6.5.1 Umgekehrter Stirling- und Clausius-Rankine-Prozeß ...110
6.5.2 Das Linde-Hampson-Verfahren ... 110
7. Entropie und Wahrscheinlichkeit
...1117.1 Die Datenmenge ... 111
7.2 Verallgemeinerung des Zustandsbegriffs – das Gibbssche Ensemble ... 113
7.3 Die Entropie einer Verteilung ... 115
7.4 Die physikalische Entropie eines Systems ... 116
7.5 Entropie und Temperatur ... 117
7.6 Entropie und Datenmenge ... 118
Literatur...
... 119Register
... 120Inhaltsverzeichnis
1. Mengenartige Größen und der Aufbau der Physik
... 72. Entropie und Temperatur
... 112.1 Die Entropie als Wärmemaß ... 11
2.2 Die Festlegung der Entropieskala ... 12
2.3 Entropie und Energie, die Festlegung der Temperaturskala ... 13
2.4 Die Einheiten von Temperatur und Entropie ... 14
2.5 Wärmemotor und Wärmepumpe ...15
2.6 Entropieerzeugung – reversible und irreversible Prozesse ... 16
2.7 Der Wirkungsgrad ...18
2.8 Das thermische Gleichgewicht...19
2.9 Die Messung von Temperatur und Entropie ... 20
2.9.1 Die Messung der Temperatur ...20
2.9.2 Die Messung der Entropie ...20
2.10 Der erste und der zweite Hauptsatz ...21
2.11 Entropieinhalt am absoluten Nullpunkt ... 22
2.12 Die Entropiekapazität ...22
2.13 Die Entropieleitfähigkeit ...25
2.14 Zur Geschichte des Wärmebegriffs ...27
3. Stoffmenge und chemisches Potential
... 293.1 Stoffe und Grundstoffe ...29
3.2 Die Menge ...31
3.3 Das chemische Potential ... 33
3.4 Die Skala des chemischen Potentials ... 34
3.5 Der Nullpunkt des chemischen Potentials ... 35
3.6 Die Werte des chemischen Potentials ... 36
3.7 Beispiele für den Umgang mit dem chemischen Potential ... 37
3.8 Der Reaktionswiderstand ... 40
3.9 Reversibel ablaufende Reaktionen – elektrochemische Reaktionen ...43
3.10 Irreversibel ablaufende Reaktionen – die Entropiebilanz chemischer Reaktionen ...44
4. Gibbssche Fundamentalform, Gibbsfunktion, Gleichgewicht
... 474.1 System und Zustand ... 47
4.2 Die Gibbssche Fundamentalform ...47
4.3 Gibbsfunktionen ...49
4.4 Die Zerlegung von Systemen ... 50
4.5 Energieformen ...52
4.6 Zustandsgleichungen ...54
4.7 Lineare Approximation der Gibbsfunktion ...58
4.8 Kreisprozesse ... 59
4.9 Warum die Energieform Wärme nicht in einem System enthalten sein kann ... 60
4.10 Gleichgewichte ...62
4.11 Fließgleichgewichte ... 64
5. Spezielle Systeme und Prozesse
... 675.1 Das ideale Gas ...67
5.1.1 Die thermische Zustandsgleichung des idealen Gases ...67
5.1.2 Die p- und die V-Abhängigkeit von Energie, Entropie und chemischem Potential bei T = const ...68
5.1.3 Gelöste Stoffe als ideale Gase ...71
5.1.4 Das gravitochemische Potential ... 72
5.1.5 Gemische idealer Gase ...73
5.1.6 Das Massenwirkungsgesetz ... 74
5.1.7 Die zweite Zustandsgleichung: S = S(T, p, n) ... 75
5.1.8 Isentropen, Isobaren und Isochoren des idealen Gases ...77
5.1.9 Die dritte Zustandsgleichung: µ = µ(T, p, n) ... 78
5.1.10 Einfache Kreisprozesse mit idealen Gasen ... 79
5.2 Flüssigkeiten und Feststoffe ...80
5.2.1 Das chemische Potential ... 80
5.2.2 Die Entropie von Feststoffen ... 82
5.3 Strömungen ... 84
5.3.1 Strömungen ohne Energiefluß durch die Rohrwand ...85
5.3.2 Strömung eines idealen Gases ohne Energiefluß durch die Rohrwand ... 86
5.3.3 Isotherme Strömung des idealen Gases ... 87
5.3.4 Ideale Strömungen inkompressibler Flüssigkeiten ... 87
5.3.5 Flüssigkeitsströmungen im Schwerefeld ... 88
5.4 Phasenübergänge ...89
5.4.1 Phasen ... 89
5.4.2 Phasenübergänge ...89
5.4.3 ξ-X-Diagramme ...90
5.4.4 Die Clausius-Clapeyron-Gleichung ... 91
5.4.5 Verdunsten und Sieden ... 92
5.4.6 Lösungen ... 92 4
5.5 Reale Gase ...93
5.5.1 Der kritische Punkt ...93
5.5.2 Die Van-der-Waals-Gleichung ... 93
5.5.3 Adiabatische Strömung eines realen Gases – der Joule-Thomson-Effekt ... 93
5.6 Das Licht-Gas ... 95
5.6.1 Thermische Strahlung ... 95
5.6.2 Die Entropie des Lichts ...96
5.6.3 Die Temperatur des Lichts ... 96
5.6.4 Das chemische Potential des Lichts ... 97
5.6.5 Die Größe Strahldichte ...98
5.6.6 Das Stefan-Boltzmann-Gesetz ... 100
5.6.7 Druck und Entropie der schwarzen Strahlung als Funktion der Temperatur .... 100
5.6.8 Isotherme, isentrope und isoenergetische Expansion des Lichts ... 102
5.6.9 Die kosmische Hintergrundstrahlung ...102
5.6.10 Das Gas-Kondensat-Analogon ... 103
5.6.11 Licht, dessen chemisches Potential ungleich null ist ... 103
5.6.12 Energietransport mit thermischer Strahlung ... 103
5.6.13 Das Kirchhoffsche Strahlungsgesetz ...104
6. Thermische Maschinen
...1056.1 Überblick ... 105
6.2 Warum man Wärmekraftmaschinen benutzt ...105
6.3 Maschinen mit äußerer Verbrennung ... 106
6.3.1 Zyklisch arbeitende Maschinen – der Stirlingprozeß ...106
6.3.2 Strömungsmaschinen ... 107
6.4 Maschinen mit innerer Verbrennung ...109
6.4.1 Zyklisch arbeitende Maschinen – der Ottomotor ... 109
6.4.2 Strömungsmaschinen – die Gasturbine ... 109
6.5 Kältemaschinen ... 110
6.5.1 Umgekehrter Stirling- und Clausius-Rankine-Prozeß ...110
6.5.2 Das Linde-Hampson-Verfahren ... 110
7. Entropie und Wahrscheinlichkeit
...1117.1 Die Datenmenge ... 111
7.2 Verallgemeinerung des Zustandsbegriffs – das Gibbssche Ensemble ... 113
7.3 Die Entropie einer Verteilung ... 115
7.4 Die physikalische Entropie eines Systems ... 116
7.5 Entropie und Temperatur ... 117
7.6 Entropie und Datenmenge ... 118
Literatur...
... 119Register
... 1201. Mengenartige Größen und der Aufbau der Physik
Wir wollen damit beginnen, die Thermodynamik in den Rest der Phy- sik einzuordnen. Wir müssen dazu einen kleinen Anlauf nehmen.
Die Werte einer physikalischen Größe beziehen sich gewöhnlich auf ein bestimmtes geometrisches Gebilde. So beziehen sich die elektri- sche Feldstärke, die Temperatur und die Geschwindigkeit auf einen Punkt. Die Größen elektrische Spannung und Abstand beziehen sich auf zwei Punkte. Die Kraft oder Impulsstromstärke, die Leistung oder Energiestromstärke und die elektrische Stromstärke beziehen sich auf Flächen. Die Größen, um die es uns im Augenblick geht, die mengenartigen Größen, beziehen sich auf einen Raumbereich. Zu ihnen gehören die Energie, der Impuls, die elektrische Ladung, die Entropie, die Stoffmenge und noch einige andere.
Die mengenartigen Größen spielen eine besondere Rolle in der Phy- sik. Wir wollen einige ihrer Eigenschaften betrachten.
Für jede mengenartige Größe X kann man eine Gleichung der Form
schreiben. Auch diese Gleichung bezieht sich auf einen Raumbe- reich. Sie läßt folgende Interpretation zu, Abb. 1.1: X stellt man sich vor als die Menge von irgendetwas: die Energiemenge, die Bewe- gungsmenge (im Fall des Impulses), die Elektrizitätsmenge, die Wär- memenge (im Fall der Entropie) oder die Stoffmenge. Der Term dX/dt stellt dann die zeitliche Änderung der Menge von X im Innern des Raumbereichs dar. Die Größe IX bezieht sich auf die Oberfläche des Raumbereichs. Man kann sie daher interpretieren als eine Strom- stärke: die Stärke des Stroms der Größe X durch die Oberfläche des betrachteten Raumbereichs. Die Größe ΣX schließlich bezieht sich wieder auf das Innere des Raumbereichs und kann interpretiert wer- den als die Erzeugungsrate von X (wobei negative Erzeugung Ver- nichtung bedeutet).
Bei dieser Interpretation erscheint Gleichung (1.1) als eine Bilanz- gleichung. Sie sagt uns, daß sich die Menge X auf zweierlei Arten än- dern kann: 1. dadurch, daß ein Strom von X durch die Oberfläche des Gebiets in das Gebiet hinein oder aus ihm heraus fließt, und 2. da- durch, daß im Innern des Gebiets Erzeugung oder Vernichtung von X stattfindet.
Für manche mengenartigen Größen ist der Term ΣX immer gleich null. Diese Größen können ihren Wert nur durch Zu- oder Wegfluß ändern. Man nennt sie Erhaltungsgrößen. Zu ihnen gehören Energie, Impuls und elektrische Ladung. Beispiele für nicht erhaltene men- genartige Größen sind die Entropie S und die Stoffmenge n. So kann die Entropie zwar erzeugt, aber nicht vernichtet werden, während Stoffmenge sowohl erzeugt als auch vernichtet werden kann.
Die Interpretation, die wir hier vorstellen, wird allein durch die Ge- stalt von Gleichung (1.1) gerechtfertigt. Tatsächlich ist sie für man- che Größen üblich, für andere weniger. So ist jeder daran gewöhnt, sich die Größe Q als Elektrizitätsmenge oder “Ladungsmenge” vor- zustellen und entsprechend die Größe I als die Stärke des elektri- schen Stroms. Die Bilanzgleichung für die elektrische Ladung lautet
dQ dt =I dX
dt =IX +ΣX (1.1)
7
I
XdX/dt, Σ
XAbb. 1.1. Die Änderung dX/dt kommt auf zweier- lei Art zustande: durch Zu- oder Wegfluß und durch Erzeugung oder Vernichtung.
Die Bilanzgleichung für die Energie ist
und die für den Impuls
Zu der letzten Gleichung ist bekanntlich eine andere Interpretation üblich: Man sagt, auf den Raumbereich, oder einen Körper im Raum- bereich, wirke eine Kraft, und dadurch ändere sich der Impuls im In- nern des Bereichs. Es ist aber zweckmäßig, auch diese Beziehung so zu lesen wie die anderen Bilanzgleichungen: Die Änderung dp/dt des Impulses kommt zustande durch einen Impulsstrom der Stärke F.
Jedes der großen Teilgebiete der klassischen Physik wird durch eine mengenartige Größe charakterisiert. Die Mechanik ist der Teil der Physik, in dem es um den Impuls und dessen Ströme geht. Die Elek- trizitätslehre beschäftigt sich mit der elektrischen Ladung und mit elektrischen Strömen. Entsprechend kann man auch die reine Wär- melehre definieren als den Teil der Physik, in dem es um die Entropie und um Entropieströme geht. Die Stoffmenge und deren Ströme ge- hören in die Chemie.
Die Energie ist eine Größe, die für keines dieser Gebiete charakteri- stisch ist. Sie ist in allen Teilgebieten der Physik gleichermaßen wichtig.
Es ist eine Erfahrung, daß ein Energiestrom stets mit dem Strom einer anderen mengenartigen Größe verknüpft ist. Die Stromstärke der Energie ist dabei zur Stromstärke der anderen Größe proportional. Es gilt also allgemein:
P ∝ IX
Konkrete Beispiele für diese Beziehung sind P ∝ F,
die den Energietransport etwa durch einen Treibriemen beschreibt, oder
P ∝ I,
die für elektrische Energietransporte gilt. Man definiert über diese Proportionalitäten die sogenannten energiekonjugierten intensiven Größen:
So ist die elektrische Potentialdifferenz U definiert über
P = U · I (1.2)
und die Geschwindigkeit kann man definieren über
P = v · F. (1.3)
Wir werden sehen, daß für thermische Energietransporte die Bezie- hung
P ∝ IS
gilt, und daß man die Temperatur T definiert über
P = T · IS. (1.4)
d dt
p =F dE
dt =P 8
Entsprechend ist für chemische Energietransporte P ∝ In,
und man definiert das chemische Potential µ über
P = µ · In. (1.5)
Die einheitliche Form der Gleichungen (1.2) bis (1.5) zeigt, daß wir eine Analogie vor uns haben. Die angesprochenen Teilgebiete der Physik haben eine gemeinsame Struktur. Die Analogie besteht darin, daß man bestimmte physikalische Größen aufeinander abbildet. Aus einer Relation, die in einem der Teilgebiete gilt, erhält man eine Rela- tion in einem anderen Teilgebiet, indem man die einander entspre- chenden Größen einfach ersetzt. Energie, Energiestromstärke, Ort und Zeit werden dabei nicht mitübersetzt, oder in anderen Worten, sie gehen in sich selbst über. In der zweiten und dritten Spalte von Tabel- le 1.1 sind die mengenartigen bzw. intensiven Größen aufgeführt, die gegeneinander ersetzt werden. Die fünfte Spalte zeigt als Beispiel ei- ne Beziehung in ihren verschiedenen analogen Varianten.
Die durch die Gleichungen (1.2) bis (1.5) definierten intensiven Grö- ßen spielen eine wichtige Rolle bei Strömungen, die mit “Reibung” in einem allgemeineren Sinn, oder Dissipation, verbunden sind. Sol- che Vorgänge sind
– die mechanische Reibung;
– die “elektrische Reibung”, d. h. der Prozeß, der abläuft wenn ein elektrischer Strom durch einen Widerstand fließt;
– der Vorgang bei dem Entropie durch einen Wärmewiderstand fließt;
– Diffusion und chemische Reaktionen, die spontan ablaufen.
Für alle diese Strömungen gilt, daß die mengenartige Größe vom ho- hen zum niedrigen Wert der entsprechenden intensiven Größe fließt.
So fließt bei mechanischen Reibungsvorgängen Impuls stets vom Körper mit der höheren zum Körper mit der niedrigeren Geschwin- digkeit.
In elektrischen Widerständen fließt die elektrische Ladung stets vom hohen zum niedrigen elektrischen Potential.
Entropie fließt von Stellen hoher zu Stellen niedriger Temperatur.
Stoffe schließlich diffundieren immer von Stellen hohen zu Stellen niedrigen chemischen Potentials. Außerdem laufen chemische Re- aktionen spontan immer in die Richtung abnehmenden chemischen Potentials.
Wenn man irgendeinen dieser Prozesse in die entgegengesetzte Rich- tung laufen lassen möchte, muß man Energie aufwenden.
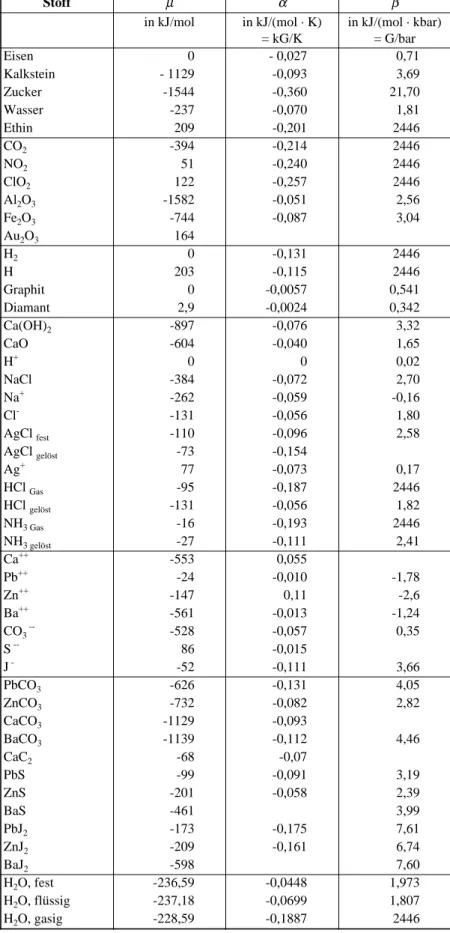
Tabelle 1.1. Zuordnung physikalischer Größen zu Teilgebieten der Physik und zur Chemie
Extensive Größe Intensive Größe Stromstärke P = ξ · IX
Mechanik Impuls p Geschwindigkeit v Kraft F P = v · F
Elektrizitätslehre elektrische Ladung Q elektrisches Potential ϕ elektrische Stromstärke I P = U · I Wärmelehre Entropie S Temperatur T Entropiestromstärke IS P = T · IS Chemie Stoffmenge n chemisches Potential µ Stoffstromstärke In P = µ · In
Um Impuls von einem Körper niedriger auf einen Körper hoher Ge- schwindigkeit zu befördern, kann man einen Motor benutzen. Elek- trizität bringt man vom niedrigen auf das hohe Potential mit Hilfe ei- ner Batterie oder eines Generators. Entropie pumpt man mit einer Wärmepumpe von der niedrigen zur hohen Temperatur. Und eine chemische Reaktion treibt man in die dem spontanen Antrieb entge- gengesetzte Richtung etwa in einer Elektrolysezelle.
Wir sind nun in der Lage zu sagen, um was es in der Thermodynamik geht. Die Thermodynamik ist mehr als nur reine Wärmelehre. Es geht also um mehr als nur die Zusammenhänge zwischen Entropie und Temperatur. Die Thermodynamik befaßt sich mit dem Zusammen- spiel von thermischen, chemischen und mechanischen Vorgängen.
Die Größen, mit denen wir es zu tun haben werden, sind daher neben der allgegenwärtigen Energie die thermischen Größen Entropie und Temperatur und die chemischen Größen Stoffmenge und chemi- sches Potential. Die Mechanik tritt in der Thermodynamik meist nicht mit ihren Größen Impuls und Geschwindigkeit auf, sondern mit den Stellvertretern Druck und Volumen.
2. Entropie und Temperatur
2.1 Die Entropie als Wärmemaß
Die Entropie S ist eine Größe, für die Nichtphysiker eine sehr gute Anschauung haben und mit der sie intuitiv richtig operieren. Es gibt wahrscheinlich keine andere Größe, bei der der physikalische Begriff mit einem umgangssprachlichen Begriff so gut übereinstimmt: Die meisten umgangssprachlichen Aussagen, in denen das Wort “Wär- me” oder “Wärmemenge” vorkommt, bleiben physikalisch korrekt, wenn man diese Wörter durch das Wort “Entropie” ersetzt.
Das Wort “Wärme” hat allerdings heute in der Physik eine andere Bedeutung, nämlich Wärme = TdS, und diese stimmt mit der um- gangssprachlichen Bedeutung schlecht überein. Wir werden daher das Wort Wärme nicht in diesem Sinn benutzen.
Im Folgenden sind einige Sätze wiedergegeben, in denen der umgangssprachliche Wärmebegriff vorkommt. Diese Sätze bleiben richtig, wenn man das Wort Wärme durch das Wort Entropie ersetzt.
Wir bekommen auf diese Weise ein qualitatives Verständnis für den Entropiebegriff:
Hält man einen Gegenstand, z.B. ein Stück Eisen, über eine Gasflamme, so wird er wärmer, seine Temperatur steigt. In den Gegenstand strömt Wärme (= Entropie) hinein. Je mehr Wärme man in das Eisenstück hineinfließen läßt, desto höher wird seine Temperatur. Nimmt man den Gegenstand von der Flamme weg und packt ihn in Styropor ein, so bleibt die Wärme (= Entropie) in ihm drin. Teilt man ihn in zwei gleich große Teile, so steckt in jedem Teil die Hälfte der Wärme (= Entropie), die im Gegenstand insgesamt enthalten war. Die Wärme (= Entropie) ist also mengenartig. Es gibt eine Wärmedichte (= Entropiedichte).
Bringt man einen warmen Gegenstand in Kontakt mit einem kalten, so fließt Wärme (= Entropie) vom warmen zum kalten, d. h. vom Gegenstand höherer zu dem niedrigerer Temperatur.
Die Wärme (= Entropie) fließt umso besser, je größer die Temperaturdifferenz ist. Ob sie gut von einem warmen zu einem kalten Gegenstand fließt, hängt aber auch noch von der Art des Kontakts, der Verbindung, ab. Sind die Gegenstände durch Holz verbunden, so fließt die Wärme (= Entropie) schlechter als wenn sie durch ein Metall verbunden sind. Es gibt also gute und schlechte Wärmeleiter (= Entropieleiter).
Hält man einmal einen Behälter mit Luft und einmal einen gleich- großen Behälter mit Wasser über eine Flamme, so stellt man fest, daß sich die Luft schneller erwärmt, d. h. schneller eine bestimmte Temperatur erreicht als das Wasser. Man muß also in das Wasser mehr Wärme (= Entropie) hineinstecken, um diese Temperatur zu erreichen. Wasser hat eine größere Wärmekapazi- tät (= Entropiekapazität) als Luft.
Man kann einem “System” auch Wärme (= Entropie) zuführen, ohne daß es sich erwärmt. Läßt man kochendes Wasser auf der Flamme stehen, so fließt dauernd Wärme (= Entropie) in das Wasser hinein. Seine Temperatur erhöht sich nicht mehr, aber da- für wird ständig Wasser verdampft. Der Dampf muß also die Wärme (= Entropie) forttragen. Ein Gramm Dampf enthält also (viel) mehr Wärme (= Entropie) als ein Gramm flüssiges Wasser.
Läßt man einen Gegenstand, den man vorher erwärmt hat, eine Weile stehen (ohne weiter zu heizen), so fließt die Wärme
(= Entropie) aus ihm heraus, sie verteilt sich in der Umgebung.
Dabei verdünnt sie sich so stark, daß man nicht mehr erkennt, wo sie sich genau befindet. Trotzdem ist sie irgendwo, sie ist nicht verschwunden im Sinn von “vernichtet”, sondern nur verschwunden im Sinn von “versteckt” oder “verstreut”.
Man kann Wärme (= Entropie) nicht vernichten, aber man kann sie erzeugen, z. B. in einer Flamme, in einem elektrischen Widerstand oder durch “Reibung”.
Um Wärme (= Entropie) zu erzeugen, braucht man Energie. Da wir an die Erhaltung der Energie glauben, schließen wir, daß mit der Wärme (= Entropie), die von einem elektrischen Widerstand wegfließt, auch Energie wegfließt.
2.2 Die Festlegung der Entropieskala
Um eine physikalische Größe zu definieren, muß die Skala der Größe festgelegt werden. Eine solche Festlegung soll es gestatten, Werte der Größe zu bestimmen. Zur Festlegung einer Skala gehört 1. die Angabe der Einheit und 2. ein Vorschrift für die Konstruktion der Vielfachen der Einheit.
Die Definition der Einheit ist im Wesentlichen ein technisches Pro- blem.
Die Festlegung der Vielfachen dagegen berührt die Substanz der Größe. Tatsächlich ist für viele Größen die Definition der Vielfachen ein delikates Problem. Es gibt Fälle, bei denen diese Definition im Laufe der Geschichte der Physik geändert wurde. Die Skala wurde im Laufe der Zeit also verzerrt, oder besser: entzerrt. Ein Beispiel hierfür ist die Temperaturskala.
Wir wollen uns überlegen, wie man Einheit und Skala der Entropie festlegen könnte. Wir beginnen mit der Einheit.
Die Maßeinheit der Entropie ist das Carnot, abgekürzt Ct. Wir wis- sen, daß man Entropie braucht, um Eis zu schmelzen. Mit 1 Ct schmilzt man bei Normaldruck gerade 0,893 cm3 Eis. Man hätte also gesetzlich festlegen können:
“1 Carnot ist diejenige Entropiemenge, mit der man bei Normaldruck 0,893 cm3 Eis schmilzt.”
Tatsächlich hat man als gesetzliche Definition ein anderes Verfahren vorgezogen. Dieses Verfahren ist begrifflich etwas komplizierter, gestattet aber eine genauere Festlegung der Einheit. Wir kommen später darauf zurück.
Nun zur Bildung von Vielfachen von Entropiewerten. Für mengenar- tige Größen ist die Bildung von Vielfachen trivial. Wenn ein System eine Einheit einer mengenartigen Größe enthält, so erhält man zwei Einheiten, indem man einfach ein gleiches System neben das erste setzt.
Zu unterscheiden vom Verfahren zur Festlegung von Einheit und Vielfachen der Werte einer physikalischen Größe sind die prakti- schen Meßverfahren. Um die Werte einer Größe praktisch zu bestim- men, braucht man ein Verfahren, das nicht zu umständlich ist. So könnte man Entropiemengen zwar im Prinzip dadurch messen, daß man Eis schmilzt und dessen Volumen mißt. Nur ist dieses Verfahren sehr unpraktisch. Warum? Die zu messende Entropie befindet sich in irgendeinem System: einem Behälter oder einem Körper. Von die- sem muß man sie in das zu schmelzende Eis übertragen. Es ist aber technisch sehr schwierig, Entropie von einem Körper auf einen ande- ren zu bringen, ohne dabei zusätzlich neue Entropie zu erzeugen. Es
ist besonders schwierig, wenn sich der Körper, von dem die Entropie entnommen wird, auf einer anderen Temperatur befindet als das Eis.
Man muß dann die Entropie behutsam (mit Hilfe einer Wärmekraft- maschine oder einer Wärmepumpe) hinaufpumpen oder herunterlas- sen. Es gibt ein viel praktischeres Meßverfahren für die Entropie.
Dieses macht sich die Erzeugbarkeit der Entropie gerade zu nutze.
Wir werden dieses Verfahren später kennenlernen.
2.3 Entropie und Energie, die Festlegung der Tem- peraturskala
Bevor wir uns der Definition der Temperaturskala zuwenden, müs- sen wir die Energie- und die Entropiebilanz einiger einfacher Geräte untersuchen.
Abb. 2.1 zeigt einen Tauchsieder. Zunächst die Entropiebilanz: Aus dem Tauchsieder kommt Entropie heraus, es fließt aber keine Entro- pie hinein. Die Entropie wird im Tauchsieder erzeugt.
Und die Energiebilanz: In den Tauchsieder fließt über das Kabel Energie hinein, und diese muß wieder herauskommen. Die einzige Möglichkeit hierfür ist, daß sie über die äußere Oberfläche zusam- men mit der Entropie herauskommt. Man sagt auch, die Energie kommt mit dem Energieträger “elektrische Ladung” in den Tauchsie- der hinein und mit dem Energieträger “Entropie” heraus. Wir schlie- ßen daraus, daß ein Entropiestrom von einem Energiestrom begleitet ist.
Wir suchen nun den Zusammenhang zwischen Entropiestromstärke IS und Energiestromstärke P. Da beide Größen Stromstärken men- genartiger Größen sind, muß der Zusammenhang lauten:
P ∝ IS (2.1)
(Man kann sich etwa vorstellen, man betreibt zwei Tauchsieder ne- beneinander. Dann sind sowohl der Energie- als auch der Entropie- strom für beide zusammen doppelt so stark wie für einen allein.) Wir betrachten als nächstes Entropie- und Energiebilanz eines Wär- memotors, oder einer “Wärmekraftmaschine”. Abb. 2.2 zeigt das Flußbild eines Wärmemotors, Abb. 2.3 zeigt den Wärmemotor etwas realistischer.
Wärmemotoren werden unter anderem in Kohle- und Kernkraftwer- ken eingesetzt. In die Maschine fließt Entropie auf hoher Temperatur hinein. Man beschafft sich diese Entropie durch Erzeugung: durch Verbrennung von Kohle oder durch Spaltung von Uran und Plutoni- um. Die Entropie wird von der Maschine im Dampferzeuger aufge- nommen. Der Dampf entspannt sich in einer Turbine. Dabei wird er kälter. Im Kondensator kondensiert der Dampf, wobei er die ganze vorher aufgenommene Entropie auf niedriger Temperatur wieder ab- gibt. Diese Entropie wird gewöhnlich an das Wasser eines Flusses ab- gegeben, manchmal auch – in einem Kühlturm – an die Luft.
Die Entropiestromstärke ist also am Eingang des Wärmemotors so groß wie am Ausgang. Wenn bei realen Maschinen, der Entropie- strom am Ausgang etwas stärker ist als am Eingang, so liegt das an Unvollkommenheiten der Maschine, die man aber im Prinzip belie- big klein machen kann.
Während die Entropie durch die Maschine fließt, gibt die Maschine über die Welle Energie ab. Diese Energie muß in die Maschine hin- eingekommen sein. Die einzige Möglichkeit hierfür ist, daß die her- ausfließende Entropie weniger Energie trägt als die hineinfließende.
Wärme- motor
ENERGIE ENERGIE
Drehimpuls Entropie
Abb. 2.2. Flußbild eines Wärmemotors
Turbine
Pumpe Dampferzeuger
Kondensator
Entropie Entropie
Abb. 2.3. Der Wärmemotor eines Kraftwerks be- steht aus Dampferzeuger, Turbine, Kondensator und Pumpe.
Entropie Energie
elektr.
Ladung
Abb. 2.1. Zur Energie- und Entropiebilanz eines Tauchsieders
Die Differenz zwischen dem Energiestrom, der mit der Entropie hin- einfließt und dem, der mit der Entropie wieder herausfließt, verläßt die Maschine über die Welle. Hinein- und herausfließender Entropie- strom müssen sich also unterscheiden. Genauer: Der Proportionali- tätsfaktor, der die Beziehung (2.1) zu einer Gleichung macht, muß für Ein- und Ausgang verschiedene Werte haben. Er muß von einer Grö- ße abhängen, die an Eingang und Ausgang verschiedene Werte hat.
Nun wissen wir, daß der Ausgang der Maschine kälter ist als der Ein- gang, daß die Temperatur des Ausgangs niedriger ist, als die des Ein- gangs, welches auch immer die Temperaturskala ist, die man zugrun- de legt.
Da wir die Temperaturskala bisher noch nicht definiert haben, legen wir fest: Der Proportionalitätsfaktor, der (2.1) zu einer Gleichung macht, heißt Temperatur. Die Temperatur T wird also definiert als:
Um T von der in ˚C gemessenen Temperatur zu unterscheiden, nennt man diese Größe auch absolute Temperatur.
Die Definition (2.2) ist analog zu der der elektrischen Spannung. Tat- sächlich wird die elektrische Spannung definiert als Quotient aus Energiestromstärke und elektrischer Stromstärke. (Diese Tatsache wird oft anders formuliert, etwa: Spannung gleich Energie pro La- dung. Solche Formulierungen sind aber zu unserer Version äquiva- lent.)
Wir wollen Gleichung (2.2) noch in der Form schreiben, in der man sie sich gewöhnlich merkt:
P = T · IS . (2.3)
2.4 Die Einheiten von Temperatur und Entropie
Da die Skalen, und damit die Vielfachen, von Energie und Entropie festliegen, sind mit Gleichung (2.2) auch die Vielfachen der Tempe- ratur festgelegt. Wir hatten aber die Festlegung der Entropieeinheit zunächst noch aufgeschoben. Wir können nun das Versäumte nach- holen. Würde man die Entropieeinheit festlegen, so läge mit Glei- chung (2.2) auch die Temperatureinheit fest (denn über die Energie- einheit ist schon in der Mechanik verfügt worden). Tatsächlich ver- fährt man nun aber umgekehrt: Man legt gesetzlich die Temperatu- reinheit fest und definiert die Entropieeinheit, das Carnot, über Glei- chung (2.2). Die Temperatureinheit ist folgendermaßen definiert:
Die Temperatur von Wasser am “Tripelpunkt” beträgt 273,16 Kel- vin.
Der Tripelpunkt ist diejenige Temperatur, bei der festes, flüssiges und gasförmiges Wasser koexistieren. Er ist zur Festlegung der Ein- heit besonders geeignet, weil keine zusätzlichen Angaben über die Werte anderer Größen gemacht werden müssen. Es muß also nicht et- wa gesagt werden: “bei dem und dem Druck”. Wenn Wasser sich am Tripelpunkt befindet, liegt der Druck zwangsläufig fest.
Wir fassen noch einmal das etwas komplizierte Verfahren der Festle- gung der Skalen von Entropie und Temperatur zusammen:
Die Vielfachen der Entropie ergeben sich einfach aus der Mengenar- tigkeit der Größe, die Vielfachen von Temperaturwerten sind über Gleichung (2.2) definiert. Die Einheit der Temperatur ist über den Tripelpunkt des Wassers definiert. Daraus folgt die Entropieeinheit über Gleichung (2.2). Es ist nämlich
T P
IS
= (2.2)
1 Ct = 1 J/K.
Noch eine Bemerkung zu dem “krummen” Wert bei der Definition der Temperatureinheit. Man hat diesen Wert gewählt, weil so eine Temperaturdifferenz von 1 Kelvin mit dem früher gültigen ˚C (Grad Celsius) übereinstimmt.
Für die Temperatur des Phasenübergangs zwischen festem und flüs- sigen Wasser bei Normaldruck (die Temperatur von schmelzendem Eis) ergibt sich 273,15 K. Für den Zusammenhang zwischen Celsiu- stemperatur ϑ und absoluter Temperatur T gilt demnach
2.5 Wärmemotor und Wärmepumpe
Wir können nun die Energiebilanz des Wärmemotors machen. (Die Entropiebilanz ist trivial: Es fließt genausoviel hinein wie heraus.) Mit der auf der hohen Temperatur T2 hineinfließenden Entropie (Stromstärke IS) fließt in die Maschine ein Energiestrom der Stärke P2 = T2 · IS
hinein, und mit dem auf der niedrigen Temperatur T1 herausfließen- den Entropie fließt aus der Maschine ein Energiestrom der Stärke P1 = T1 · IS
heraus. Netto fließt damit in die Maschine ein Energiestrom der Stär- ke
P = P2 – P1 = T2 · IS – T1 · IS also
P = (T2 – T1) IS (2.4)
hinein.
Man sieht, daß die Funktionsweise des Wärmemotors der eines Was- serrads ähnlich ist, vergleiche Abb. 2.4 mit Abb. 2.2. Der Entropie entspricht beim Wasserrad das Wasser, oder genauer, die Masse m des Wassers, und was beim Wärmemotor die Temperatur ist, ist beim Wasserrad das Gravitationspotential g · h (g = Ortsfaktor, h = Höhe).
Zum Wasserrad hin fließt ein Massenstrom auf großer Höhe, vom Wasserrad weg fließt ein Massenstrom derselben Stärke auf geringe- rer Höhe. Am Wasserrad geht die Masse von der großen auf die gerin- ge Höhe herunter und gibt dabei Energie ab. Der Energiestrom hat die Stärke:
P = P2 – P1 = g · h2 · Im - g · h1 · Im = g(h2 – h1) Im
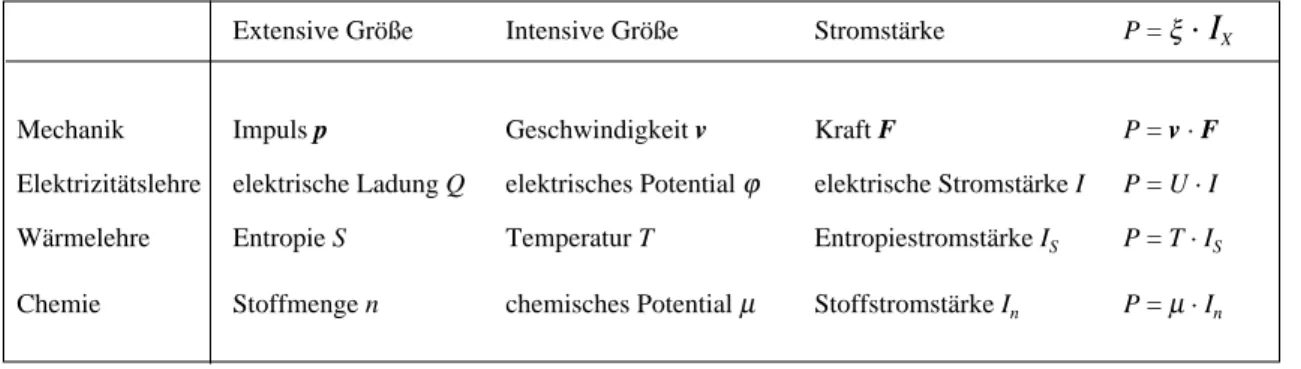
Nun zur Wärmepumpe. Die Wärmepumpe tut gerade das Umgekehr- te von dem, was ein Wärmemotor macht: Sie befördert Entropie von niedriger Temperatur auf hohe Temperatur. Da die wegfließende En- tropie auf der hohen Temperatur mehr Energie trägt als die auf der niedrigen Temperatur hinfließende, braucht die Wärmepumpe eine Energieversorgung. Die Energie, die sie zum Pumpen braucht, ist wieder durch die Gleichung
P = (T2 – T1) IS gegeben.
T
K=˚Cϑ + 273 15,
Wasser- rad
ENERGIE ENERGIE
Drehimpuls Masse
g·h2 g·h1
Abb. 2.4. Flußbild eines Wasserrades
In Analogie hierzu existiert auch zum Wasserrad eine Umkehrung:
die Wasserpumpe. Und deren Energiebedarf wird durch die Glei- chung
P = g(h2 – h1) Im
beschrieben. Abb. 2.5 zeigt die Flußbilder einer elektrischen Wärme- pumpe und einer elektrischen Wasserpumpe
2.6 Entropieerzeugung – reversible und irreversible Prozesse
Fließt Elektrizität durch einen elektrischen Widerstand – vom hohen zum niedrigen elektrischen Potential –, so wird der Widerstand warm, es wird Entropie erzeugt, Abb. 2.6. (Siehe auch Abb. 2.1.) Die zum Widerstand hinfließende Energie muß gleich sein der weg- fließenden. Es muß also gelten:
(ϕ2 – ϕ1) · I = T · IS erz (2.5)
Hier ist ϕ das elektrische Potential, I die elektrische Stromstärke und IS erz die pro Zeit erzeugte Entropie. Wir lesen die Gleichung fol- gendermaßen: Zum Widerstand fließt Energie hin mit dem Energie- träger elektrische Ladung und vom Widerstand weg fließt Energie mit dem Energieträger Entropie. Die Entropie, mit der die Energie den Widerstand verläßt, wurde im Widerstand erzeugt. Wenn U = ϕ2 - ϕ1, I und T bekannt sind, läßt sich die erzeugte Entropie leicht berechnen:
IS erz = U · I/T
Es ist eine wichtige Erfahrung, daß Entropie nicht vernichtet werden kann. Daraus folgt, daß Prozesse, bei denen Entropie erzeugt wird, nicht rückwärts ablaufen können, sie sind irreversibel.
Gleichung (2.3) sagt uns, daß zur Entropieerzeugung Energie ge- braucht wird. Man sagt, die zur Entropieerzeugung verbrauchte Energie werde dissipiert. Vorgänge, bei denen Entropie erzeugt wird, heißen dissipative Prozesse.
Es gibt einige dissipative Standardprozesse, die bestimmte Gemein- samkeiten haben. Einer davon ist der gerade diskutierte Prozeß, bei dem ein elektrischer Strom durch einen elektrischen Widerstand fließt.
Ein anderer solcher Standardprozeß ist die mechanische Reibung, Abb. 2.7: Es wird Entropie erzeugt, während Impuls von einem Kör- per auf einen anderen über einen “Impulswiderstand” fließt, d. h.
über die Berührungsfläche zwischen den beiden Körpern. Der Im- puls fließt von dem Körper mit der höheren Geschwindigkeit v2 zum Körper mit der niedrigeren Geschwindigkeit v1. Der Energiestrom, der zur Aufrechterhaltung des Vorgangs nötig ist, hat die Stärke P = (v2 – v1) · F,
die Energiebilanz lautet also:
∆ v · F = T · IS erz .
In Abb. 2.8 ist das Flußbild des Reibungsvorgangs dargestellt.
Impuls
Entropie
Abb. 2.7. Zur Impuls- und Entropiebilanz bei ei- nem Reibungsvorgang
elektrische Wärme-
pumpe
ENERGIE ENERGIE
Entropie Elektrizität
elektrische Wasser-
pumpe
ENERGIE ENERGIE
Masse Elektrizität
Abb. 2.5. Flußbilder einer elektrischen Wärme- pumpe und einer elektrischen Wasserpumpe
elektr.
Wider- stand
ENERGIE ENERGIE
Entropie Elektrizität
Abb. 2.6. Flußbild des elektrischen Widerstandes
Abb. 2.9 zeigt einen dritten dissipativen Prozeß. Hier fließt in einer Rutschkupplung Drehimpuls von der Welle mit der höheren zur Wel- le mit der niedrigeren Winkelgeschwindigkeit. Die Energiebilanz lautet:
∆ ω · M = T · IS erz .
(ω ist die Winkelgeschwindigkeit und M das Drehmoment oder die Drehimpulsstromstärke). Das Flußbild zeigt Abb. 2.10.
Einen Prozeßtyp, den wir erst im nächsten Kapitel betrachten, stellen frei ablaufende chemische Reaktionen dar. Auch hier wird Entropie erzeugt, und auch hierfür läßt sich eine Energiebilanzgleichung for- mulieren, die dieselbe Form hat, wie die des elektrischen Widerstan- des:
∆ µ · In = T · IS erz .
Hier ist µ das chemische Potential und In der Stoffumsatz (gemessen in mol/s). ∆ µ ist die Differenz der chemischen Potentiale von Eduk- ten und Produkten.
Alle Prozesse, die wir hier diskutiert haben, haben gemeinsam, daß eine mengenartige Größe über eine Art Widerstand von einer Stelle zu einer anderen fließt. Die entsprechende intensive Größe – elektri- sches Potential, Geschwindigkeit, Winkelgeschwindigkeit, chemi- sches Potential – hat an der ersten Stelle einen höheren Wert als an der zweiten. Die mengenartige Größe fließt also vom hohen Wert der in- tensiven Größe zum niedrigen.
Wir betrachten schließlich noch einen dissipativen Prozeß, der eine Besonderheit hat. Durch einen Wärmewiderstand, dessen Enden sich auf den unterschiedlichen Temperaturen T2 und T1 befinden, fließt ein Entropiestrom vom Ende mit der hohen Temperatur T2 zum Ende mit der niedrigen Temperatur T1, Abb. 2.11. Auch hierbei wird En- tropie erzeugt. Das bedeutet, daß am kalten Ende mehr Entropie an- kommen muß, als am warmen Ende in den Wärmewiderstand hinein- geflossen ist. Man kann die Energiebilanz zunächst so formulieren:
T2 · IS2 = T1 · IS1, (2.6)
denn die Stromstärken des hinein- und des herausfließenden Energie- stroms müssen gleich sein.
Man sieht an dieser Gleichung sofort, daß die Entropiestromstärke IS1 größer sein muß als IS2. Da sich der herausfließende Entropie- strom aus dem hineinfließenden Strom und der im Widerstand pro Zeit erzeugten Entropie zusammensetzt, läßt sich IS1 schreiben IS1 = IS2 + IS erz ,
Dies in (2.6) eingesetzt ergibt (T2 – T1) · IS2 = T1 · IS erz .
Lassen wir nun bei der Stärke des hineinfließenden Entropiestroms den Index “2” weg, so erhalten wir
(T2 – T1) · IS = T1 · IS erz , (2.7) d. h. wieder eine Gleichung des Typs von Gleichung (2.5).
Der Vorgang, den Gleichung (2.7) beschreibt, könnte man thermi- sche Reibung nennen. Die Besonderheit des Prozesses besteht darin, daß hier die strömende Größe von derselben Natur ist wie die erzeug- te.
schwächerer Entropiestrom
stärkerer Entropiestrom
Abb. 2.11. Entropiebilanz eines Wärmeleiters Kontakt-
fläche
ENERGIE ENERGIE
Entropie Impuls
Abb. 2.8. Flußbild eines Reibungsvorgangs
Entropie
Drehimpuls Entropie
Entropie
Abb. 2.9. Zur Drehimpuls- und Entropiebilanz bei einer Rutschkupplung
Rutsch- kupplung
ENERGIE ENERGIE
Entropie Drehimpuls
Abb. 2.10. Flußbild der Rutschkupplung
2.7 Der Wirkungsgrad
Viele Geräte und Maschinen dienen dem Zweck, Energie von einem Energieträger auf einen anderen “umzuladen”. Der Elektromotor be- kommt Energie mit dem Energieträger elektrische Ladung und gibt sie ab mit dem Energieträger Drehimpuls. In eine elektrische Wär- mepumpe fließt die Energie mit der Elektrizität hinein, und sie ver- läßt die Maschine mit der Entropie. Man nennt diese Geräte, etwas unzutreffend, Energiewandler. Tatsächlich wird in ihnen gar nichts verwandelt. Die Energie wechselt lediglich ihren Begleiter. Wir zie- hen daher den Namen “Energieumlader” vor. Wir sagen, die Energie werde von einem auf einen anderen Träger umgeladen.
Jeder Energieumlader hat Verluste. Die Ursache von Verlusten ist stets Entropieerzeugung. Ein Teil der ankommenden Energie wird dazu verbraucht, oder verschwendet, Entropie zu erzeugen. Nach Gleichung (2.3) wird zur Entropieerzeugung Energie gebraucht.
Der Transport irgendeiner mengenartigen Größe ist im Allgemeinen auch mit Entropieerzeugung verbunden. Auch hierfür wird Energie gebraucht, und auch diese ist als Verlust zu verbuchen.
Energie geht also immer verloren, wenn Entropie erzeugt wird. Die Devise “Spare Energie” kann man also ersetzen durch “Vermeide Entropieerzeugung”.
Tatsächlich läßt sich jede Aufgabe, bei deren Erledigung Entropie er- zeugt wird, auch durch einen Prozeß lösen, der ohne Entropieerzeu- gung abläuft. Das bedeutet, daß es keinen physikalischen Grund da- für gibt, daß wir überhaupt Energie verbrauchen. Im Prinzip könnten alle Produktions- und Transportleistungen ohne Energieaufwand be- wältigt werden. Es ist technisch wichtig, ein Gerät, eine Maschine, ei- ne Transportvorrichtung daraufhin zu beurteilen, ob viel Energie ver- schwendet wird. Wir definieren daher einen Wirkungsgrad η der entsprechenden Vorrichtung.
Zur Definition des Wirkungsgrades vergleicht man die zu beurteilen- de Maschine mit einer anderen Maschine, die dasselbe leistet, dabei aber keine Entropie erzeugt, also mit einer perfekten, idealen Ma- schine. Bei gleicher Leistung, worin diese auch bestehen mag, sei der Energieverbrauch der realen Maschine Preal und der der idealen Ma- schine Pideal. Als Wirkungsgrad definieren wir
Die Definition ist so beschaffen, daß sich für jedes Gerät, in dem kei- ne Entropie erzeugt wird, der Wirkungsgrad η = 1 ergibt.
Wir wollen den Wirkungsgrad eines notorischen Energieverschwen- ders, der Elektroheizung, berechnen. Die Leistung, die die Heizung erbringen soll, ist ein bestimmter Entropiestrom IS auf einer be- stimmten Temperatur T2. Falls die Heizung zum Heizen eines Hau- ses verwendet wird, ist IS die Stärke des Entropiestroms, der das Haus durch die Wärmelecks verläßt. T2 ist die Temperatur im Innern des Hauses.
η = P P
ideal real
(2.8)
Die reale Elektroheizung braucht hierfür einen Energiestrom von Preal = T2 · IS
Eine reversibel arbeitende Maschine zur Heizung des Hauses wäre eine Wärmepumpe, die die benötigte Entropie von außerhalb des Hauses ins Haus hineinpumpt. Wir nennen die Außentemperatur T1. Der Energieverbrauch der Wärmepumpe ist (siehe Abschnitt 2.5) Pideal = (T2 - T1) IS.
Für den Wirkungsgrad (2.8) der Elektroheizung ergibt sich damit:
Es ist interessant, daß sich der Wirkungsgrad allein durch zwei Tem- peraturen ausdrücken läßt. Die Tatsache, daß es sich um eine Wider- standheizung bzw. eine Wärmepumpe handelt, kommt in der Bezie- hung gar nicht mehr zum Ausdruck. Tatsächlich ergibt sich dieselbe Gleichung für jede andere Heizung, bei der die ganze benötigte En- tropie durch Erzeugung gewonnen wird. Wegen seiner universellen Bedeutung hat dieser Ausdruck einen eigenen Namen bekommen.
Man nennt den Ausdruck
den Carnot-Faktor.
2.8 Das thermische Gleichgewicht
Wenn Entropie über einen Wärmeleiter von einem Körper A höherer Temperatur in einen Körper B niedrigerer Temperatur fließt, so nimmt die Temperatur TA ab und die Temperatur TB zu, Abb. 2.12:
Die beiden Temperaturen gleichen sich an. Schließlich wird TA = TB.
Wenn dieser Zustand erreicht ist, ist kein Antrieb für den Entropie- strom mehr vorhanden, die Entropie hört auf zu fließen. Man nennt diesen Zustand thermisches Gleichgewicht.
Er ist analog zu anderen Gleichgewichtszuständen. Impulsgleichge- wicht stellt sich ein, wenn zwei aneinander reibende Körper A und B dieselbe Geschwindigkeit erreichen, Abb. 2.13, d. h. wenn
vA = vB.
Elektrisches Gleichgewicht stellt sich ein zwischen zwei Kondensa- toren, die über einen Widerstand miteinander verbunden sind, Abb.
2.14. Im elektrischen Gleichgewicht ist UA = UB.
η =T −T T
2 1
2
(2.9)
η = = −
⋅ = −
P P
T T I T I
T T
T
S S ideal
real
( 2 1)
2
2 1
2
A B
T
AT
BEntropie
Abb. 2.12. Zwischen den beiden Körpern stellt sich thermisches Gleichgewicht ein.
B A vA
vB
Impuls
Abb. 2.13. Zwischen den beiden Körpern stellt sich Impulsgleichgewicht ein.
A
UA UB
B
elektrische Ladung
Abb. 2.14. Zwischen den beiden Kondensatoren stellt sich elektrisches Gleichgewicht ein.
2.9 Die Messung von Temperatur und Entropie
2.9.1 Die Messung der Temperatur
Zur Messung der Temperatur eignen sich diejenigen Effekte, bei denen mechanische, elektrische oder optische Größen von der Tem- peratur abhängen, z. B.
– die thermische Ausdehnung eines Festkörpers: Bimetallstreifen (Verwendung in Thermostaten);
– die thermische Ausdehnung einer Flüssigkeit: Quecksilberther- mometer;
– die thermische Ausdehnung von Gasen: Gasthermometer;
– der thermoelektrische Effekt: ein Entropiestrom ist an einen Strom geladener Teilchen gekoppelt; bei offenem Stromkreis kann der Teilchenstrom nicht fließen, und eine Temperaturdifferenz verursacht eine Differenz des elektrochemischen Potentials (siehe S. 30 im Skriptum zur Physik II);
– der elektrische Widerstand eines Materials ist temperaturabhän- gig: bei Metallen nimmt der Widerstand mit T zu, bei Halbleitern ab;
– jeder Körper gibt elektromagnetische Strahlung ab; das Spektrum der Strahlung ist von der Temperatur abhängig: Strahlungspyro- meter;
– Manche Stoffe ändern beim Überschreiten einer bestimmten Temperatur ihre Farbe.
Bei den meisten Temperaturmeßverfahren wird das Meßinstrument mit dem System Y, dessen Temperatur bestimmt werden soll, ins thermische Gleichgewicht gebracht: Durch eine entropieleitende Verbindung ermöglicht man einen Entropiefluß von Y zum Meßge- rät. Die Entropie fließt solange, bis Meßinstrument und System Y dieselbe Temperatur haben. Die Entropiekapazität des Meßinstru- ments muß klein sein gegen die von Y. Außerdem soll das Meßinstru- ment kein thermisches Leck haben, sonst kommt der Entropiefluß zwischen Y und Meßinstrument nie zum Stillstand. Analoge Bemerkungen gelten für die Messung anderer intensiver Größen.
2.9.2 Die Messung der Entropie
Daß Entropie erzeugt werden kann, erschwert ihre Messung, wenn man Verfahren anwendet, die analog sind zu Verfahren, die man zur Messung von Erhaltungsgrößen, etwa der elektrischen Ladung, ein- setzt. Im Grunde erleichtert es aber die Messung, da man Methoden verwenden kann, die bei Erhaltungsgrößen nicht möglich sind.
Wir nehmen im Folgenden an, daß wir nicht die gesamte in einem Sy- stem enthaltene Entropie messen wollen, sondern nur den Betrag, um den sich der Entropieinhalt des Systems in zwei gegebenen Zustän- den unterscheidet. Die Meßaufgabe laute also z. B.: Wieviel mehr Entropie enthält eine bestimmte Flüssigkeitsmenge X bei 80˚C als bei 20°C, Abb. 2.15?
Verfahren ohne Entropieerzeugung
Wir orientieren uns an der Messung von elektrischer Ladung. Man leitet die zu messende Ladungsmenge auf ein Elektrometer, Abb.
2.16a. Das Elektrometer ist geeicht, d. h. der Zusammenhang zwi-
Abb. 2.16. (a) Messung von elektrischer Ladung.
Die zu messende Ladung wird auf das geeichte Elektrometer übertragen. (b) Messung von Entro- pie. Die zu messende Entropie wird wird auf das geeichte Entropiemeßgerät übertragen.
80 ˚C 20 ˚C
Abb. 2.15. Um wieviel Carnot unterscheidet sich der Entropieinhalt?
Flüssigkeit X
entropieleitende Verbindung
a
b
schen Ausschlag und Ladung ist bekannt. Entsprechend kann man ei- ne zu messende Entropiemenge in einen mit Wasser gefüllten Behäl- ter leiten, Abb. 2.16b. Das Wasser dehnt sich aus. Das Steigrohr ist geeicht, d. h. der Zusammenhang zwischen Steighöhe und Entropie- inhalt des Wassers ist bekannt. Das Verfahren ist aber sehr unpraktisch, denn im Allgemeinen befindet sich die Entropie, die man messen möchte, in einem System, dessen Temperatur einen an- deren Wert hat als die des geeichten Wasserbehälters. Befindet sich das System auf einer höheren Temperatur als das Meßgerät, so kann man zwar die zu messende Entropiemenge mit einem Wärmeleiter übertragen. Dabei wird aber zusätzliche Entropie erzeugt, und das Meßgerät zeigt zu viel an. Befindet sich das System auf niedrigerer Temperatur als das Meßgerät, so fließt die Entropie gar nicht in das Meßgerät hinein. Man muß also in jedem Fall zwischen System und Meßgerät eine Wärmepumpe oder einen Wärmemotor einbauen, so daß die Entropie auf die Temperatur des Meßgeräts gebracht wird.
Dieses Verfahren ist so unpraktisch und ungenau, daß man es nicht anwendet.
Verfahren mit Entropieerzeugung
Mit diesem Verfahren kann man nicht die Menge von bereits vorhan- dener Entropie bestimmen. Stattdessen transportiert man die Entro- pie, deren Wert man bestimmen will, in die Umgebung und erzeugt dann den gleichen Betrag neu.
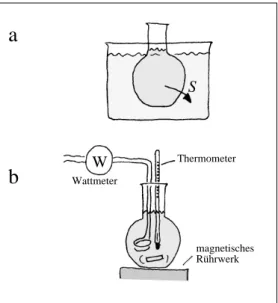
In unserem konkreten Fall werden wir aus unserer Flüssigkeit X, die sich auf 80 ˚C befindet, zunächst die ganze zu messende Entropie wegfließen lassen: Wir kühlen die Flüssigkeit auf 20 ˚C ab, Abb.
2.17a. Dann erzeugen wir die Entropie neu und messen dabei den zu- fließenden Energiestrom und die Temperatur, Abb. 2.17b. Die Stärke P des Energiestroms und die Stärke Is des Entropiestroms, die aus dem Heizwiderstand herausfließen, sind verknüpft über
P = T · IS .
Die Temperatur ist (dank dem Rührwerk) überall in der Flüssigkeit dieselbe. Es wird solange Energie zugeführt, bis die Temperatur von (273,15 + 20) K auf (273,15 + 80) K angestiegen ist. Die dabei zuge- führte, im Heizwiderstand erzeugte Entropie ist
2.10 Der erste und der zweite Hauptsatz
Aussagen darüber, ob eine mengenartige physikalische Größe erhalten ist oder nicht, wurden historisch häufig als wichtige physikalische Gesetze, wenn nicht sogar als die wichtigsten, aufge- faßt. Das äußert sich darin, daß diese Sätze oft einen eigenen, manch- mal recht prätentiöse Namen haben.
Newtonsche Axiome:
Impuls kann weder erzeugt noch vernichtet werden.
Erster Hauptsatz:
Energie kann weder erzeugt noch vernichtet werden.
Zweiter Hauptsatz:
Entropie kann zwar erzeugt, aber nicht vernichtet werden.
S I t dt P t
T t dt
S
t C
t C
t C
t C
=
∫
( ) =∫
( )( )( ˚ ) ( ˚ )
( ˚ ) ( ˚ )
20 80
20 80
Abb. 2.17. Man läßt die zu messende Entropie aus dem System herausfließen (a) und erzeugt dann denselben Betrag neu (b).
S
W
Wattmeter
Thermometer
magnetisches Rührwerk
a
b
Diese Namen deuten darauf hin, daß die Entdeckung des jeweiligen Satzes sehr mühsam war. Der Grund für diese Schwierigkeit ist wahrscheinlich, daß die Mengenartigkeit dieser Größen zunächst nicht erkannt wurde. So trägt der Satz von der Erhaltung der elektrischen Ladung z. B. keinen eigenen Namen, da man zuerst die Mengenartigkeit der Ladung (= Elektrizität) erkannte, und kurz darauf die Erhaltung entdeckte (Franklin 1747). Ähnlich steht es mit der Stoffmenge. Ihre Mengenartigkeit war von Anfang an klar, und ihre Nichterhaltung war so offensichtlich, daß man kein Bedürfnis verspürte, sie in einem gesonderten Lehrsatz zum Ausdruck zu bringen.
2.11 Entropieinhalt am absoluten Nullpunkt
Versucht man, mit einer sehr guten Wärmepumpe einem Körper im- mer mehr Entropie zu entziehen, so stellt man zweierlei fest:
- Man kommt der Temperatur 0 K beliebig nahe, kann sie aber nicht unterschreiten.
- Bei dieser Temperatur fördert die Pumpe keine Entropie mehr.
Man schließt daraus, daß, in dem Maße wie man sich der Temperatur 0 K nähert, der Entropieinhalt gegen Null geht. Es gilt also:
T→ 0 genau dann, wenn S→ 0.
In Worten: Absolut kalte Körper enthalten keine Entropie.
Es gibt aber Fälle, in denen dieser Satz scheinbar verletzt ist. Kühlt man flüssige Gläser schnell ab, so geben sie weniger Entropie ab, als wenn man sie langsam abkühlt. Beim schnellen Abkühlen scheint Entropie eingeforen oder eingeschlossen zu werden.
Wir werden diesen Vorgang später so erklären: das Glas läßt sich in Teilsysteme zerlegen, und eins dieser Teilsysteme kommt bei zu schnellem Abkühlen nicht ins thermische Gleichgewicht mit dem Rest. Obwohl ein Thermometer anzeigt, daß T → 0 geht, nehmen sowohl S als auch T dieses Teilsystems nicht mehr ab. Das Gesamtsystem hat also zwei voneinander verschiedene Temperatu- ren.
Man kann die Erscheinung auch so beschreiben: Die Entropie ist un- beweglich geworden, ähnlich wie es auch unbewegliche elektrische Ladung gibt.
2.12 Die Entropiekapazität
Ob ein System viel oder wenig Entropie enthält, erkennt man an ver- schiedenen Eigenschaften, genauer, an den Werten verschiedener anderer physikalischer Größen. Insbesondere wächst der Entropiein- halt mit zunehmender Temperatur. Wir nennen die Entropiezunah- me pro Temperaturzunahme die Entropiekapazität Cs eines Sy- stems:
Diese Größe ist gebildet in Analogie zur elektrischen Kapazität
und zur Masse, die man auch als Impulskapazität interpretieren kann
C Q
Q=U
C S
S = ∆T
∆
Im Unterschied zu CQ und Cp definiert man allerdings CS nicht als Quotienten, sondern als Differentialquotienten aus extensiver und intensiver Größe.
Wir wenden uns nun einem Problem zu, das einem normalerweise nur bei der Entropiekapazität begegnet. Die Entropie eines Systems hängt selbstverständlich nicht nur von T ab, sondern auch noch von anderen unabhängigen Variablen, z. B. vom Volumen V und der Stoffmenge n. Es ist also:
S = S(T, V, n).
Man kann aber bei demselben System andere unabhängige Variablen wählen, z. B. T, p und n. S ist eine andere Funktion dieser Variablen T, p und n. Will man nun – rechnerisch oder experimentell – die Ent- ropiekapazität bestimmen, das heißt, fragt man nach der Änderung des Entropieinhalts bei einer Temperaturerhöhung, so muß man ent- scheiden, was mit den anderen Variablen bei diesem Prozeß gesche- hen soll. Es wird einem am natürlichsten erscheinen, während der Temperaturerhöhung Volumen und Stoffmenge unverändert zu las- sen.
Die Entropiekapazität, die man so bestimmt, ist
Um zu betonen, daß das Volumen konstant ist, bezeichnen wir diese Größe mit CSV. Daß auch n konstant gehalten wird, ist eine still- schweigende Vereinbarung und wird in dem Symbol nicht zum Aus- druck gebracht.
Es ist also
Manchmal ist auch eine Entropiekapazität nützlich, die man durch Temperaturänderung bei konstantem Druck bestimmt:
Wir betonen, daß es sich bei S(T,V,n) und S(T,p,n) um unterschied- liche Funktionen handelt.
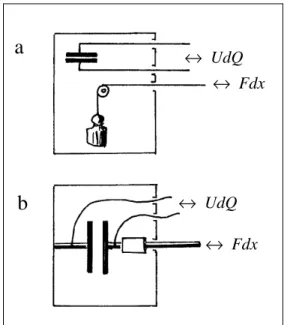
Bei der elektrischen Kapazität könnte man ganz analoge Unterschei- dungen treffen. Abb. 2.18 zeigt einen “Kondensator” der aus zwei Kugeln besteht. Wir können die Ladung Q wahlweise schreiben als Funktion der Variablen U und x (Abstand Kugeln): Q = Q(U, x) oder als Funktion von U und F (Impulsstrom von einer zur anderen Kugel): Q = Q(U, F).
Entsprechend kann man zwei Kapazitäten bilden
Um CQF zu messen, muß man beim Laden des Kondensators den Ab- stand x so vergrößern, daß F konstant bleibt. Dieser Fall hat aber kein praktisches Interesse. Wenn man von der (elektrischen) Kapazi- tät einer Anordnung spricht, meint man immer, daß die Geometrie der Anordnung beim Ändern der Spannung erhalten bleibt.
C Q U x
U C Q U F
Q U
x
Q
=∂ F =
∂
∂
∂
( , ) ( , )
und
C S T p n
S T
p = ∂
∂ ( , , )
C S T V n
S T
V = ∂
∂ ( , , )
∂
∂ S T V n
T ( , , )
C m p
p ≡ = v
Kraftmesser
Abb. 2.18. Man kann beim Laden des Kondensa- tors entweder den Abstand oder die Kraft konstant halten.
In der Thermodynamik verwendet man gern stoffmengenbezogene Größen. Wir kennzeichnen sie durch ein “Dach” über dem Größen- symbol. Für homogene Systeme hängt eine mengenbezogene Größe nur von intensiven und anderen mengenbezogenen Größen ab. Daher ist die Entropie pro Menge:
Eine dritte Variable taucht nicht mehr auf, denn die Menge pro Men- ge ist gleich 1.
Wir definieren also Entropiekapazitäten pro Stoffmenge
Die Werte von cSund cSV sind für einige Stoffe in Tabelle 2.1 wieder- gegeben. Diese molaren Entropiekapazitäten hängen nicht von der Größe des Ausschnitts aus einem System ab, den man betrachtet, son- dern nur noch von lokalen Größen: intensiven Größen und stoffmen- genbezogenen (= molaren) Größen. Auf ihre Temperaturabhängig- keit kommen wir später zu sprechen.
Statt der Entropiekapazitäten wird in Tabellen gewöhnlich das Pro- dukt cS · T angegeben, das, von der Dimension her, eine Energieka- pazität darstellt. Man nennt diesen Ausdruck molare Wärmekapazi- tät und bezeichnet ihn mit cV bzw. cp, also
cV = cSV · T und cp = cSp · T
Achtung: Es ist falsch zu sagen, ein System enthalte Wärme, wenn man das Wort Wärme im traditionellen Sinn benutzt, denn TdS ist keine mengenartige Größe. Daher ist die Bezeichnung Wärmekapa- zität etwas irreführend.
Abb. 2.19 zeigt den Verlauf der Temperatur über der Entropie für Kupfer. Er ist typisch für alle Stoffe, solange kein Phasenübergang stattfindet.
c C
n n
S T p n T
S T p
S T
p S
= p = 1∂ =
∂
∂
∂
( , , ) ˆ( , ) (2.11)
c C
n n
S T V n T
S T V
S T
V S
= V =1∂ =
∂
∂
∂
( , , ) ˆ( , ˆ) (2.10)
ˆ ˆ( , ˆ) ˆ ˆ( , )
S=S T V oder S=S T p
Stoff cSp (Ct · mol-1 · K-1) cSV (Ct · mol-1 · K-1)
Kalium 0,099
Eisen 0,087
Silber 0,086
Blei 0,091
Wasser 0,256
Benzol 0,450
Helium 0,077 0,046
Luft 0,107 0,076
Wasserstoff 0,104 0,074
CO2 0,101 0,092
Tabelle 2.1. Molare Entropiekapazitäten
bei 20 ˚C
bei 0 ˚C
0 100 200 300 400
0
0 2 0 4 0 6 0
0
Abb. 2.19. Temperatur über der Entropie für 100 g Kupfer
S (Ct) T (K)