„Experimentelle Hausaufgaben im
Chemieunterricht“
Hinweis
Bei dieser Datei handelt es sich um eine Wissenschaftliche Hausarbeit, die im Bereich Lehramt am Fachbereich Chemie der Uni Marburg verfasst wurde.
Weitere Hausarbeiten können auf der Seite www.chids.de unter http://www.chids.de/veranstaltungen/wiss_hausarbeit.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Experimentalvorträge bereit.
Dr. Ph. Reiß, im Januar 2007
Wissenschaftliche Hausarbeit im Rahmen der ersten Staatsprüfung für das Lehramt an Gymnasien im Fach Chemie,
eingereicht dem Amt für Lehrerbildung - Prüfungsstelle Gießen-.
Thema: Experimentelle Hausaufgaben im Chemieunterricht Verfasser/in: Daniela Heinrich
Magdeburgerstraße 45 35041 Marburg-Wehrda
Gutachter/in: Dr. P. Reiß
Inhaltsverzeichnis
1.
Vorwort
... 12. Das Experiment im Chemieunterricht
... 72.1 Das Experiment als Teil des Lernprozess... 7
2.2 Das Experiment als Hausaufgabe... 9
2.3 Organisation von experimentellen Hausaufgaben... 11
2.4 Rechtsgrundlagen... 13
3. Einführung von experimentellen Hausaufgaben in den Unterricht
... 184. Didaktische Überlegungen zu experimentellen Hausaufgaben
... 205. Experimenteller Teil
... 255.1 Die Experimentfolge... 25
5.2 Die Experimentiergruppen... 26
5.3 Die Experimente – Informationen für die Hand des Lehrers... 27
5.3.1 „Sicheres Arbeiten mit Chemikalien“... 27
(Einführungsaufgabe) 5.3.2 „Tanzende Pflanzen“... 30
5.3.3 „Erhitzen von Stoffen- verdunsten, schmelzen,
Reaktion“... 36
5.3.4 „Wie viel Sauerstoff ist in der Luft?“... 44
5.3.5 „Feuerlöschen mit Kaffee“... 56
5.3.6 „Löschpapier mit Rotkohl färben“... 66
5.3.7 „Untersuchen von Stoffen mit Rotkohlpapier“... 67
5.3.8 „Farbwechsel im Rotkohlsaft“... 73
5.3.9 „Herstellen von Kunsthonig“... 77
5.3.10 „Neuer Glanz für alte Münzen“... 84
5.3.11 „Verkupfern von Gegenständen“... 89
5.3.12 „Lösen von Kupferoxid, komplexieren, und verkupfern“... 94
5.3.13 „Eisen-Ionen sichtbar machen: Lösung, Feststoff und Komplex“... ... 103
6. Vorschriften, Arbeitsblätter und Kurzinformationen für Schüler und Eltern...
1197. Fazit
... 1908. Literatur
... ... 1918.1 Verzeichnis der verwendeten Texte und weiterführende Literatur... 191
8.2 Verzeichnis der Abbildungen... 192
8.3 Verzeichnis der Tabellen... 195
1. Vorwort
Von Pisa, TIMSS und anderen Kompetenzstudien, die nationale und inter- nationale Bildungsdiskussionen anregen, wird kaum danach gefragt, wie sich Schüler einen guten Unterricht vorstellen.
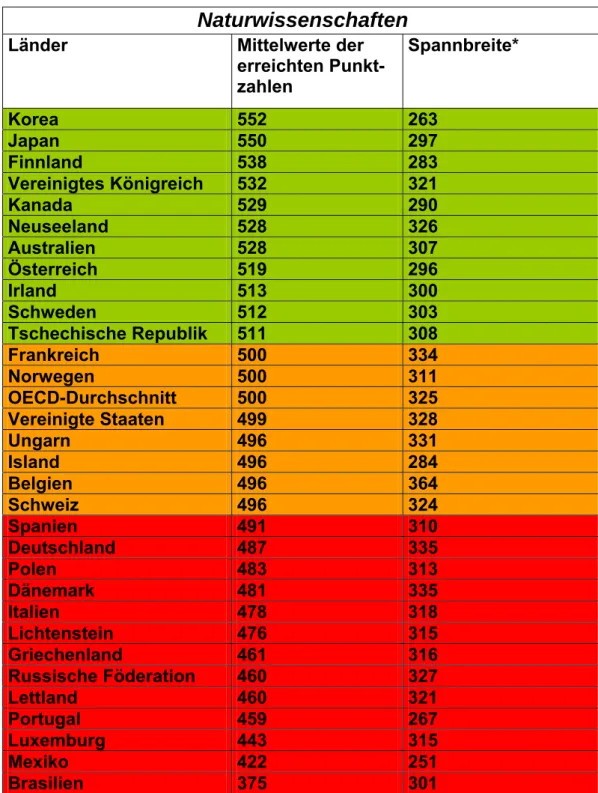
Schülerinnen und Schüler werden während ihrer kompletten Schullauf- bahn beurteilt und kategorisiert. Schon bei der Notengebung spiegelt das breite Mittelfeld den Klassendurchschnitt wieder, die Spitzengruppe ist leicht unterbesetzt und der unterdurchschnittliche Rest der Schülerschaft hofft auf eine gute mündliche Note. Aktuell müssen Schüler nicht nur in der Konkurrenz innerhalb der Klasse bestehen, sondern werden auch in internationalen Vergleichen der Bildungssysteme auf ihre Kompetenzen hin getestet. Die sind in Deutschland leider eher unterdurchschnittlich entwickelt. (vgl. Tabelle 1 Auswertung der Pisastudie 2000: Naturwissen- schaftliche Kompetenzen/ Deutschland)
Doch woran liegt das schlechte Abschneiden der deutschen Schüler?
Wenn nicht an der Schule, kann es nur am Lehrer liegen. Liegt es nicht an ihm, dann am Unterricht. Im schlimmsten Falle liegt es am Elternhaus oder gar am Schüler selbst. Denn auch dem besten Lehrer sind die Hände ge- bunden, wenn nicht alle Parteien an einem Strang ziehen. Schule, Lehrer, Eltern und Schüler müssen eine Einheit bilden, um etwas zu bewegen.
Vielleicht können sich die Eltern vermehrt am Schulgeschehen zu beteili- gen, indem auch für sie nachvollziehbare Inhalte in den Unterricht einge- bracht werden. Denn Lehrer beklagen (private Gespräche) immer wieder mangelnden Besuch beim Elternabend und Desinteresse der Schüler- schaft am Unterricht. Davon ist wohl hauptsächlich der naturwissenschaft- liche Unterricht betroffen, denn ein Abitur lässt sich auch leichter erlangen, als mit der Wahl der Fächer Chemie, Biologie oder Physik als Leistungs- kurs. Natürlich kann man diese Aussagen nicht pauschalisieren, da es Jahrgänge gibt, in denen gerade die naturwissenschaftlichen Kurse gut belegt sind.
Naturwissenschaften
Länder Mittelwerte der
erreichten Punkt- zahlen
Spannbreite*
Korea 552 263
Japan 550 297
Finnland 538 283
Vereinigtes Königreich 532 321
Kanada 529 290
Neuseeland 528 326
Australien 528 307
Österreich 519 296
Irland 513 300
Schweden 512 303
Tschechische Republik 511 308
Frankreich 500 334
Norwegen 500 311
OECD-Durchschnitt 500 325
Vereinigte Staaten 499 328
Ungarn 496 331
Island 496 284
Belgien 496 364
Schweiz 496 324
Spanien 491 310
Deutschland 487 335
Polen 483 313
Dänemark 481 335
Italien 478 318
Lichtenstein 476 315
Griechenland 461 316
Russische Föderation 460 327
Lettland 460 321
Portugal 459 267
Luxemburg 443 315
Mexiko 422 251
Brasilien 375 301
*Abstand zwischen den Leistungen der 5% leistungsschwächsten und 5% leis- tungsstärksten Schülerinnen und Schüler
Leistungen signifikant Leistungen unterscheiden sich
über dem OECD-Mittelwert nicht signifikant vom OECD-Mittelwert Leistungen signifikant unter dem OECD-Mittelwert
Tabelle 1: Auswertung von PISA 2000, Naturwissenschaften, Ländervergleich (Quelle: Max-Planck-Institut für Bildungsforschung, © 2002, Lentzeallee 94, 14195 Berlin)
Eine naturwissenschaftliche Grundbildung, sowie die damit verbundenen Kompetenzen und überfachlichen Qualifikationen (Schlüsselqualifikatio- nen), sind in der heutigen Berufswelt eine Mindestanforderung an die zu- künftigen Generationen.
Unter naturwissenschaftlicher Grundbildung versteht PISA: „ Zur natur- wissenschaftlichen Grundbildung gehören ein Verständnis grundlegender naturwissenschaftlicher Konzepte, wie etwa Energieerhalt, Anpassung oder Zerfall, Vertrautheit mit naturwissenschaftlichen Denk- und Arbeits- weisen sowie die Fähigkeit, dieses Konzept- und Prozesswissen vor allem bei der Beurteilung naturwissenschaftlich-technischer Sachverhalte anzu- wenden. Dies beinhaltet weiterhin die Fähigkeit, Fragen zu erkennen, die mit naturwissenschaftlichen Methoden untersucht werden können, sowie aus Beobachtungen und Befunden angemessene Schlussfolgerungen zu ziehen, um Entscheidungen zu verstehen und zu treffen, die sich auf die natürliche Welt und die durch menschliches Handeln verursachten Verän- derungen beziehen.“ [0]
Naturwissenschaftliche Bildung muss, wie jede andere Bildung, zunächst erworben werden und ist nicht von vornherein vorhanden. Genauso, wie man von einer unerfahrenen Klasse nicht von heute auf morgen eine ex- zellente Gruppenarbeit erwarten kann, muss der naturwissenschaftliche Bildungserwerb zuvor geübt werden, sodass der Schüler schließlich selbst in der Lage ist, eigene Fragen zu stellen. In diesem Zusammenhang wird häufig auf die Theorie der geistigen Entwicklung von Piaget1 hingewiesen, in der vor allem die als konkret-operationale und als formal-operationale Phase bezeichneten Entwicklungsstufen für den (Chemie-)Unterricht von Bedeutung sind. „Danach sind Schülerinnen und Schüler, die sich noch auf der Stufe der konkreten Operation befinden, bei ihren geistigen Tätig- keiten an die Anschauung gebunden, an konkrete Beobachtungen und Überprüfen von Fragestellungen.
1Piaget, Jean, *1896, † 1980, schweizer. Psychologe, hatte mit seinen Arbeiten u.a. über die Entwicklung der menschlichen Intelligenz bedeutenden Einfluss auf die moderne Erziehungswissenschaft.
Erst mit dem Erreichen der formal-operationalen Stufe entwickelt sich die Fähigkeit zur geistigen Auseinandersetzung mit nicht konkret vorhande- nen Dingen und zum hypothetisch-deduktiven Denken. [1]
Piaget zufolge sollten Jugendliche bereits im Alter von 12 Jahren, dazu fähig sein. So sollten Schülerinnen und Schüler mit Beginn des naturwis- senschaftlichen Unterrichts in der Lage sein, formal-operational zu den- ken. Andere Untersuchungen ergaben, dass selbst in „zehnten Klassen von Gymnasien sich häufig weniger als die Hälfte der Schülerinnen und Schüler in der formal-operationalen Phase befinden.“ [22]
Eine Veröffentlichung von Dr. Julia Freienberg und Prof. Dr. Alfred Flint zu
„Verbesserungsvorschlägen für einen erfolgreichen Unterricht“ [1] passt hier perfekt zur Definition, die PISA und Piaget vorgeben.
Freienberg und Flint behandeln sechs Thesen, die ihrer Meinung nach in stärkerem Maße berücksichtigt werden müssten, um gerade in der Sekun- darstufe I für eine höhere Akzeptanz des (Chemie)Unterrichtes und damit für seinen Erfolg zu sorgen.
Die sechs Thesen für einen erfolgreichen (Chemie)Unterricht:
These 1: „Der (Chemie)Unterricht soll einen erkennbaren Beitrag zur Allgemeinbildung leisten.“
Dieser soll auch für die Schüler erkennbar sein und die Aufgabe ha- ben, einen Beitrag zu ihrem Alltag zu leisten.
Diese Aufgaben und Ziele werden in bestimmten Abschnitten der Lehrpläne zwar gefordert, die vorgegebenen Themen und Inhalte ma- chen jedoch deutlich, dass im Wesentlichen die „komprimierte Vermitt- lung von Fachwissen im Vordergrund steht.“
These 2: „Ein Alltagsbezug sollte so oft wie möglich hergestellt werden.“
Der hohe motivationale Effekt durch die Beschäftigung mit Stoffen aus dem täglichen Umfeld der Schülerinnen und Schüler, zum Erwerb von Allgemeinbildung spielt hier eine Rolle.
Die Lehrpläne lassen jedoch kaum Raum, diese Anliegen und Wün- sche der Schüler zu erfüllen. Flint und Freienberg nennen dafür zwei Gründe:
• „Der Lehrplan sieht weiterhin die Trennung von allgemeiner, an- organischer und organischer Chemie vor. Viele alltägliche Stoffe sind aber der organischen Chemie zugeordnet. Sie passen somit nicht in das Konzept des Anfangsunterrichtes und können daher nicht zur Herstellung eines Alltagsbezugs herangezogen werden.“
• „Die Komplexität der alltäglichen Stoffe hinsichtlich ihrer Zusam- mensetzung und Wirkungsweise stellt ein Problem dar und ist in ihrer Vollständigkeit in der Sekundarstufe I nicht gründlich formal zu erfassen. So wird eine Beziehung zwischen Naturwissenschaft und Alltag erst in der gymnasialen Oberstufe entstehen, um nicht ganz auf eine formale Betrachtungsweise verzichten zu müssen.
Hier erreicht man jedoch nur einen Bruchteil der Schüler, die sich vorher noch für den (Chemie)Unterricht interessiert haben.“
These 3: „Der Unterricht soll aktuelle Themen und Inhalte mit ein- beziehen.“
Dies geschieht unter Verwendung regionaler und überregionaler Me- dien. „Der Lehrplan muss Spielraum für solche aktuellen Themen bie- ten, die Lehrkraft muss bereit sein, zugunsten des Themas den ge- planten Unterrichtsgang zu unterbrechen.“
These 4: „Es müssen im (Chemie)Unterricht wichtige, fachliche Inhalte vermittelt werden.“
„Die oben aufgeführten Thesen 1-3 dürfen nicht zu einem strukturie- renden Merkmal für Inhalte und deren Auswahl werden. Es muss im- mer wieder auf gefestigte Grundkenntnisse zurückgegriffen werden, denn einzelne Teilbereiche können nicht losgelöst voneinander be- handelt werden.“
These 5: „Die Schülerinnen und Schüler sollen so oft wie möglich selbst aktiv tätig werden.“
Hier sollen Schülerexperimente zu einem vertieften Verständnis und besseren Leistungen führen. „Die Schüler sind stärker motiviert und die psychomotorischen Fähigkeiten werden geschult.“
Leider steht vergleichsweise wenig Unterrichtszeit für Schülerexperi- mente zur Verfügung, die eher für Demonstrationsexperimente genutzt wird. Dafür sprechen die steigenden Klassenfrequenzen, begrenzte Zeit im Unterricht, bei der Vorbereitung und darüber hinaus materielle Probleme, schlechte Ausstattung und zuwenig Geld für Chemikalien.
Weiterhin besteht der Auftrag zur Vermeidung einer Gefährdung der Schülerinnen und Schüler durch die Gefahrstoffverordnung, die den Spielraum zur Verwendung einiger Chemikalien einschränkt.
These 6: „Die geistigen Fähigkeiten und Voraussetzungen der Schülerinnen und Schüler müssen berücksichtigt werden.“
Die Stufe der formalen Operation im Unterricht wird von den wenigsten Schülerinnen und Schülern der zehnten Klassen erreicht. Die formale Operation kann jedoch anhand von bekannten Stoffen, Aufbauten und Experimenten geübt werden, da hier „weniger geistige Kraft für die Er- fassung des Problems gebunden wird und eher zur formalen Deutung zur Verfügung steht.“
Diese Thesen von Freienberg und Flint und das Dilemma der Lehrer und Schulen, sich eingeschränkt in den Möglichkeiten ihrer Umsetzung zu füh- len, haben mich sehr fasziniert. So dachte ich über einen Weg nach, der die Forderung nach dem alltagsbezogenen Schülerexperiment unterstützt und ergänzt, denn im Wesentlichen sprechen die Thesen und auch PISA vom Schülerexperiment, welches all die wichtigen Funktionen erfüllen kann, die im Rahmen der sechs Thesen genannt sind.
2. Das Experiment im Chemieunterricht
Betrachtet man einerseits den hohen pädagogischen Stellenwert von Ex- perimenten im Chemieunterricht und andererseits die Argumente, welche die Durchführung von Experimenten einschränken, nämlich
• Zeit,
• Material und Chemikalien,
• finanzielle Mittel und
• Gefährlichkeit,
so muss man sich darüber Gedanken machen, wie der (Chemie)Unterricht (besser) organisiert werden kann, damit vermehrt Experimente durchge- führt werden können.
2.1 Das Experiment als Teil des Lernprozess
Gerade die Experimente in der Chemie sind meist sehr eindrücklich und werden weniger schnell, als in anderen Fächern vergessen. Farben, Ga- se, Rauch und Feuer beanspruchen das Gehirn deutlich mehr als Zahlen, Buchstaben und Rechenaufgaben (Eigenerfahrung).
An das Lithium, das wild auf dem Wasser tanzt, erinnert sich jede Schüle- rin und jeder Schüler, der/dem der Versuch jemals vorgeführt wurde. Das gleiche gilt für die Spannung, wenn klar wird, dass Kalium noch heftiger mit Wasser reagieren wird, als es das Natrium schon getan hat. Außerhalb der formalen Deutung lernt man als Schüler konkret-operational, dass die Reaktivität (mit Wasser) innerhalb der ersten Hauptgruppe von oben nach unten zunimmt. Es handelt sich dabei bereits um eine bedeutende wis- senschaftliche Erkenntnis, die zwar einer formalen Deutung entbehrt, für den Schüler zunächst jedoch eine wichtige und unvergessliche Erfahrung darstellt.
Um die Stufe des formalen Denkens zu erreichen, wird man die Reakti- onsgleichungen zunächst als Wortgleichungen und dann erst als Formel- gleichungen formulieren.
Diese Vorgehensweise ist in der Unterstufe nicht unüblich, da zum Bei- spiel Natrium und Wasser zu Natronlauge und Wasserstoff reagieren.
Geht man also zunächst phänomenologisch und dann formal an ein Expe- riment heran, ist der Lern-, Verständnis- und Übungseffekt bedeutend größer, als wenn die Schüler durch den überwiegend herrschenden For- malismus im (Chemie)Unterricht direkt abgeschreckt werden. Chemiestu- denten kennen die Reaktionen auf ihr Fach. „Wie kann man nur Chemie studieren, da blickt ja keiner durch. Die vielen Buchstaben und Zahlen, wie soll sich das einer merken?“
Chemie wird in großen Teilen der Bevölkerung als ein Fach angesehen, in dem ausschließlich hochintelligente Menschen etwas erreichen können, was natürlich so nicht stimmt. Ein wenig Fleiß und Spaß an der Sache ge- hört auch dazu. Fleiß und Verständnis bringt man zunächst mit, der Spaß kommt durch guten und anschaulichen Unterricht. Macht der Unterricht und der Inhalt dem Schüler Spaß, fällt es ihm auch leichter, die Aufgaben des Unterrichts zu erfüllen – der Kreis schließt sich.
Auch Bücher, wie z. B. „365 einfache Experimente für Kinder“ [12] oder
„Experimente mit Supermarktprodukten“ [2] können Kinder und Jugendli- che zum Experimentieren motivieren. Es ist wichtig, Kinder schon frühzei- tig mit Literatur dieser Art zu konfrontieren, um ihren Forscherdrang (der übrigens angeboren ist, wie z. B. das Fremdeln bei Säuglingen) zu we- cken und den Weg für eine fundierte, naturwissenschaftliche Grundbildung zu ebnen. (Bücherliste mit Experimenten für Kinder im Literaturverzeich- nis)
Diesen ersten Schritt in Richtung Chemie machen bisher überwiegend die Eltern, indem sie solche Bücher kaufen. Warum sollte nicht auch die Schule verstärkt, das Angebot an leichten, gut verständlichen Experimen- ten nutzen? Hier kommt man zur Organisation im (Chemie)Unterricht zu- rück.
2.2 Das Experiment als Hausaufgabe
Im Unterricht ist wenig Zeit vorhanden, um Experimente als Schülerexpe- rimente zu gestalten. Als Folge daraus ergibt sich die Überlegung Experi- mente in die Freizeit (Freistunden, nach Schulschluss) der Schüler zu in- tegrieren. Meiner Meinung nach sind experimentelle Hausaufgaben gut geeignet, um das Argument „fehlende Zeit“ zu umgehen. Es gilt dabei zu berücksichtigen, dass das Angebot an außerschulischen Aktivitäten immer größer wird. Üblich ist es, dass im Rahmen der Hausaufgabe z. B. die Stunde protokollarisch wiederholt wird, dass Übungsaufgaben gerechnet oder Reaktionsgleichungen aufgestellt werden. Manche Lehrer halten gar Hausaufgaben im Chemieunterricht für sinnlos, da nach ihrer Meinung der Lerneffekt bereits im Unterricht stark ausgeprägt sein sollte. Reproduktive Hausaufgaben sind meist für den Schüler typisch eintönige Hausaufga- ben, die mit forschend-entwickelndem, oder historisch-problemorientiertem Unterricht und anderen „didaktischen Meisterleistungen“ wenig zu tun ha- ben, die aber den Vorgaben der Lehrpläne entsprechen.
Experimente mit Alltagschemikalien machen aufwendige Apparaturen und gefährliche Chemikalien, sowie den entstehenden, meist problema- tischen Müll überflüssig. Die benötigten Materialien sind mit ein wenig Phantasie leicht zu beschaffen, herzustellen und vielleicht sogar schon vorhanden. Auch die notwendigen Chemikalien gibt es in fast jedem Su- permarkt für wenige Euro zu kaufen.
Der Vermeidung von chemischem Müll in der Schule und den damit ver- bundenen Kosten wird auf diese Weise zumindest ein wenig vorgebeugt.
Die entstehenden Kosten belaufen sich auf einige Kopien für Versuchsan- leitungen und weiteres Papiermaterial, die von Land, Schule (abhängig von der Finanzverteilung der Schule) und Elternpflegschaft getragen wer- den und für die „Chemikalien“, die auf die Schülergruppen (trotz Lernmit- telfreiheit, da es sich i. d. R. um Beträge von bis zu drei
Euro/Experiment/Gruppe handelt) umgelegt werden. Einzig bleibt noch der Punkt der Gefährlichkeit zu klären.
Sollte die Schule „grünes Licht“ für solche Hausaufgaben geben, trägt die Versicherung der Schule die Verantwortung für eventuelle Verletzungen, wenn die experimentelle Aufgabe auf dem Schulgelände (siehe 2.4 Rechtsgrundlagen) bearbeitet wird. Verletzt sich eines der Kinder durch heißes Wasser, Scherben oder Verbrennung ist dies eine Sache der Schulversicherung, da das Kind im Auftrag der Schule handelt und zusätz- lich ein zeitlicher und räumlicher Zusammenhang zum Unterricht besteht.
Man sollte bedenken, dass man sich genauso im Sportunterricht leicht verletzen kann, nicht zuletzt ist Sport deshalb ein besonderes Abiturfach, das im Verletzungsfall deshalb durch ein anderes Fach ausgeglichen wer- den muss.
Auch die Eltern spielen eine große Rolle bei Experimenten mit Alltags- chemikalien. Wie eingangs schon angeschnitten, bietet diese Variante des Chemieunterrichts zu Hause viele Möglichkeiten, um die Kommunikation zwischen Schule, Eltern, Lehrern und Schülern zu fördern und auf guten Unterricht zu konzentrieren. Viele Eltern, die sonst nicht die Möglichkeiten haben, ihren Kindern bei den Hausaufgaben in Chemie zu helfen, werden auf einfache, helfende Weise integriert, da Schülerinnen und Schüler Haushaltschemikalien einsetzen/benutzen. Die Schülerinnen und Schüler können ihr Wissen aus dem Unterricht nach Hause tragen, sinnvoll bei vielen Anwendungen des alltäglichen Lebens mitreden und auch Sicher- heitsaspekte bei der Verwendung von Haushaltschemikalien verantwor- tungsvoll einbringen, denn
„Um Kinder zu verantwortungsvollen Menschen zu erziehen, muss man ihnen Verantwortung geben.“
Richard P. Feynman [23]
2.3 Organisation von experimentellen Hausaufgaben
Das Projekt sieht das vermehrte Einbinden von chemischen Experimenten in den Chemieunterricht vor. Die Experimente finden im Idealfall (wenn keine Gefahr der Verletzung für die Schüler besteht, siehe dazu 2.4 Rechtsgrundlagen) zu Hause statt, werden aber in der Regel nach dem Unterricht in den normalen Klassenräumen durchgeführt. Verwendet wer- den nur solche Substanzen, die man in jedem Haushalt vorfindet. Die Schüler experimentieren ausschließlich in Gruppen mit einem ausführli- chen Versuchsprotokoll. Den Eltern stehen lexikonartige Kurzinformatio- nen zum Inhalt, Sinn und Verlauf des Experimentes zur Verfügung. Die Experimente stellen keinen Ersatz für konventionelle Aufgaben dar! Sie können lediglich dem Einstieg in ein neues Thema bzw., dem Abschluss einer Unterrichtseinheit dienen oder tragen zum allgemeinen Verständnis naturwissenschaftlicher Denkweisen bei. Der Haupteinsatzbereich der ex- perimentellen Hausaufgabe ist jedoch die Steigerung des motivationalen Effektes, während oder bei Beginn einer Lerneinheit. Die nötigen Materia- lien sind meist ebenfalls in der Küche zu finden. In seltenen Fällen, fallen geringe Kosten für „Chemikalien“ (Backpulver, Salz, Rotkohl) und Geräte (Messbecher, Teelicht) an. Die Finanzierung sollten die Schülergruppen organisieren, sie ist im Einzelnen noch zu diskutieren. Zu jedem Experi- ment wird ein Protokoll angefertigt oder ein Beobachtungsbogen ausge- füllt. Der Versuch wird von den Schülern in geeigneter Form (Fotos, Film, Ton, Referat, Vorführung, Zeitung) präsentiert. Der Sinn des Projekts be- steht im Erlernen von Schlüsselqualifikationen, wie sie im späteren berufli- chen Leben vorrausgesetzt wird. Einige werden im Folgenden genannt:
• Aneignung von experimentellen Kenntnissen
• Problemlösendes Denken
• Teamfähigkeit
• Selbstständiges Arbeiten
• Anfertigen von Protokollen
• Präsentation
Um die Ergebnisse des Projekts nachhaltig zu sichern, gibt es die Mög- lichkeit der schulischen und außerschulischen Präsentation. Eine Zusam- menarbeit mit der regionalen Zeitung wäre denkbar. Innerhalb von Pro- jektwochen könnten die Experimente von den Schülerinnen und Schülern vorgestellt werden.
Mögliches Beispiel für eine experimentelle Hausaufgabe
Die Aufgabe besteht im Züchten von Kristallen. Dies kann wahlweise mit Zucker, Salz oder Waschpulver geschehen. Dazu wird in einem Wasser- kocher etwas Wasser zum Kochen gebracht und in ein hitzebeständiges Glas (Teeglas) gefüllt, in dem sich ein Teelöffel befindet. Nun wird soviel der gewählten Substanz hineingefüllt, bis sich unter Rühren alles gelöst hat. Schließlich gibt man noch einen Teelöffel Substanz hinzu. Mit etwas Lebensmittelfarbe wird die Lösung angefärbt. Eine an einem Faden befes- tigte Büroklammer aus Metall wird zur Hälfte in die gefärbte Flüssigkeit gehängt. Das Glas bleibt unbewegt vier bis fünf Tage an einem warmen Ort stehen. In regelmäßigen Abständen werden die Ergebnisse protokol- liert. Ziel ist es einen Zucker-, Salz- oder Waschmittelkristall zu erhalten, der die Farbe des Rotkohlsaftes (wenn Rotkohl als Farbstoff verwendet wurde) aufweist. Die Form wird mit großen Exemplaren der ursprünglichen Substanz verglichen. Zum Beispiel ist Kandiszucker eine große Kristallva- riation des Haushaltszuckers. Im Unterricht wird die Löslichkeit von Stoffen im Lösungsmittel Wasser besprochen. Außerdem die Temperaturabhän- gigkeit der Löslichkeit und die Kristallbildung. Gefahren bestehen hier durch Verbrühen mit heißem Wasser. Das Experiment bedarf bei jüngeren Schülern einer Aufsicht. Der Versuch kann im Anschluss an den Unterricht (in der Schule) durchgeführt werden und unterliegt so der Lehreraufsicht.
2.4 Rechtsgrundlagen
Hausaufgaben - Kurzbeschreibung
„Die Erledigung von Hausaufgaben (im folgenden kurz HA) gehört zu den Pflichten der Schülerinnen und Schüler. HA ergänzen die schulische Ar- beit, müssen aus dem Unterricht erwachsen und können den nachfolgen- den Unterricht vorbereiten. Sie sind so zu gestalten, dass sie in einer an- gemessenen Zeit erledigt werden können. Die Lehrkräfte müssen die HA zumindest stichprobenartig überprüfen. Bei der Leistungsbewertung sind sie angemessen zu berücksichtigen. Die Schulkonferenz entscheidet über Grundsätze zum Umfang und zur Verteilung der HA.“[24]
Erläuterungen:
„Aufgaben sollen das in der Schule erarbeitete Wissen vertiefen und festi- gen (§ 28 Abs. 1 VO zur Gestaltung des Schulverhältnisses)
(...)
Die Befürworter von HA betonen den Wert der HA für den Lernprozess und für die Steigerung der Schulleistung. Außerdem werden dabei didakti- sche, methodische und pädagogische Vorteile genannt, wie die Ergän- zung, Erweiterung und Bereicherung der Schularbeit sowie die Förderung der Selbstdisziplin, die Gewöhnung an Pflichterfüllung und die Schulung der Zeiteinteilung bei Schülerinnen und Schülern. Sie sollen daher lernen:
- sich selbst Ziele zu setzen
- die Arbeits- und Freizeit sinnvoll zu gestalten
- die gestellten Aufgaben mit Ausdauer und Zielstrebigkeit zu bewäl- tigen
- gemeinschaftliche Aufgaben verantwortungsvoll zu lösen“[24]
Koordinierung:
„Die Schulkonferenz entscheidet über Grundsätze für HA (§ 129 Nr.4 Hessisches Schulgesetz). Die HA sollen so bemessen sein, dass sie ohne außerschulische Hilfe in angemessener Zeit bewältigt werden können.
Folgende Arbeitszeiten für die täglichen HA sollten nicht überschritten werden (Anlage 2 zur VO zur Gestaltung des Schulverhältnisses):
Jahrgangsstufe 1 und 2: bis zu einer ½ Stunde, Jahrgangsstufe 3 und 4: bis zu einer ¾ Stunde Jahrgangsstufe 5 und 6: bis zu einer 1 Stunde, Jahrgangsstufe 7 und 8: bis zu einer 1 ½ Stunden, Jahrgangsstufe 9 und 10: bis zu einer 2 Stunden.
In der Oberstufe müssen Art, Form, Umfang und Zielsetzung der häusli- chen Arbeiten der zunehmenden Selbstständigkeit oder Einzelverantwort- lichkeit der Schülerin oder des Schülers Rechnung tragen.“ [24]
Information der Erziehungsberechtigten:
„Die Lehrkräfte haben die Aufgabe, die Erziehungsberechtigten über den Bereich „HA“ zu informieren (z. B. bei einem Elternabend). Im Verlauf der Beratung sollte klargestellt werden, welche Ziele HA aus psychologisch- pädagogischer, didaktischer und methodischer Sicht verfolgen. Dabei ist zu empfehlen, dass die Erziehungsberechtigten etwas über sinnvolle Ar- beitstechniken und konkrete Hilfe für die Hausaufgabenpraxis erfahren.“
[24]
Kontrolle und Bewertung:
„(...)
HA werden in der Regel nicht zensiert, sollten jedoch unter pädagogi- schen Aspekten Anerkennung finden und sind daher bei der Leistungsbe- wertung angemessen zu berücksichtigen (§ 28 Abs. 1 der Verordnung zur Gestaltung des Schulverhältnisses vom 18. Juli 1993 i. d. Z. geltenden Fassung).“[24]
Versicherungsschutz:
SPE 878 Nr. 26 „ Arbeiten im häuslichen Bereich“
„Der Unfallversicherungsschutz für Schüler erstreckt sich grundsätzlich nicht auf die im häuslichen Bereich durchgeführten Arbeiten.
Dies gilt auch dann, wenn eine bestimmte Aufgabe nicht in der Schule zu- ende geführt werden kann und der Schüler die Aufgabe zu Hause weiter- führt. Es fehlt hierbei an dem erforderlichen räumlichen und zeitlichen Zu- sammenhang.“
BSG, Urteil vom 01.02.1997, 2 RU 107/77 SPE a. F. S. II J II/97
Parallelfundstellen: SPE II J II/97
SPE 878 Nr. 21 „Kauf eines Lernmittels“
„Ein Schüler, der ein Lernmittel kauft, das alsbald im Unterricht benötigt wird, steht dabei unter dem Schutz der gesetzlichen Unfallversicherung.
Alsbald meint, dass die Erneuerung des Arbeitsgerätes oder Lernmittels in einem verhältnismäßig engen zeitlichen Zusammenhang zu dem Schulbe- such stehen muss. Ob dieser enge zeitliche Zusammenhang mit dem Schulbesuch gegeben ist, muss anhand der konkreten Umstände des Einzelfalls beurteilt werden.“
BSG, Urteil vom 26.07.1977, 8RU 4/77 SPE a. F. S. II J II/10
Parallelfundstellen: SPE II J II/10
Siehe dazu SchulLINK - Luchterhand, Hessen; 9. Ausgabe, April 2006.
Als CD erhältlich, ohne Handbuch. © 2005 Wolters Kluwer Deutschland Außerdem: Avenarius, H., Heckel, H.: Schulrechtskunde: Ein Handbuch für Praxis, Rechtsprechung und Wissenschaft von Hans Heckel. 7. neu- bearb. Aufl. Von Hermann Avenarius, unter Mitarbeit von Hans-Christoph Loebel, Neuwied 2000.
Außerdem: Herff, E. E.: Hausaufgaben und das Recht des Schülers – Ein Vergleich auf Bundesebene. In: Recht der Jugend und des Bildungswe- sens, 4/1997, S. 309 ff.
Außerdem: Staupe, J., Schulrecht von A-Z. München: C.H. Beck 1996, S.88 ff
Weiterer Ansprechpartner:
Albert Sauer, Oberstudienrat
z. Zt. Hessisches Kultusministerium Edith-Stein-Str. 1
63801 Kleinostheim Telefon: 06027/5189
E-Mail: Sauer.Kleinostheim@t-online.de
Schlussfolgerung:
Experimentelle Hausaufgaben sollten in den Räumlichkeiten der Schule unter Aufsicht der Lehrperson stattfinden, wenn die Möglichkeit ernsthafter Gefährdungen der Schüler gegeben sind. Hausaufgaben sollten jedoch in der Regel im häuslichen Bereich durchgeführt werden, wobei für den Schüler immer ein „gewisses Lebensrisiko“ besteht. Diese Hausaufgaben sollten dann so gewählt sein, dass die Art der Gefährdung möglichst ge- ring ist. Die Versuchsvorschrift bietet alle Informationen, die notwendig sind um Unfälle zu vermeiden, so kann eine verantwortungsvolle Klasse diese Experimente durchaus zu Hause durchführen. Letztendlich ent- scheidet die Schulkonferenz über die Grundsätze dieser Art von Hausauf- gaben. Für eventuelle Regressansprüche gegenüber der Lehrperson bie- ten Versicherungsgesellschaften eine „Regresshaftpflicht für Lehrer“
(LVM/Münster), die jedoch nur greift, wenn der Lehrperson im Falle eines Zwischenfalls keine einfache oder grobe Fahrlässigkeit nachgewiesen werden konnte. Fahrlässig handelt eine Lehrperson, bei Verletzung der Aufsichtspflicht, oder bei Verschweigen ihr bekannter möglicher Gefahren.
Sollte diese Art von Hausaufgaben sich durchsetzen und nach Absprache mit der jeweiligen Versicherungsgesellschaft auch im häuslichen Bereich stattfinden, wäre zukünftig eine Versicherung im Rahmen der Privathaft- pflicht der Eltern möglich. Eine solche Versicherung gibt es bereits für Ausbildungsgegenstände (Computer/Laptop) aus dem Eigentum der Schule, die von Schülern im häuslichen Bereich genutzt werden.
Die Kosten belaufen sich für diese Aufstockung der Privathaftpflicht auf ca. 23 €/Jahr (LVM/Münster). Für weitere Versicherungsfragen steht die Gemeinde-Unfallversicherung/Wiesbaden zur Verfügung.
3. Einführung von Experimentellen Hausaufgaben in den Unterricht
Projekte, wie Hausaufgaben experimentell durchzuführen, bedürfen der Zustimmung aller beteiligten Parteien. Dazu gehört die Schule, die immer- hin die Trägerschaft der Versicherung darstellt. Im Regelfall wendet man sich zunächst an den Schulleiter. Das Projekt wird dann dem Lehrerrat in der Schulkonferenz vorgestellt. Findet es dort Zustimmung, kann an eine Befragung von Eltern und Schülern gedacht werden. Wichtig ist, dass eine Einführung solcher Projekte viel Zeit beansprucht und eine gute Vorberei- tung braucht. Gerade am Anfang einer neuen Idee und ihrer Umsetzung bedarf es sicherlich starker Nerven, Überzeugungskraft und guter Argu- mente. Daher ist bestimmt ein Zusammenschluss von Lehrern verschie- dener Fächer ratsam. So wird Geschlossenheit und Motivation demonst- riert, was wiederum dem Schulprofil zugute kommt.
Das enge Zusammenarbeiten zwischen Schule, Lehrern und Eltern kann ein Vorteil sein, es können aber auch Nachteile entstehen. Um eventuelle Missverständnisse aus dem Weg zu räumen, ist eine umfassende Aufklä- rung aller Parteien notwendig, was einen enormen Aufwand in der Organi- sation darstellt.
Einholen von Stimmungen
Man sollte zunächst die Eltern befragen, um die allgemeine Stimmung unter der Elternschaft zu prüfen. Hier können Fragen zur Unterrichtbe- schaffenheit und den Hausaufgaben gestellt werden. Dies geschieht, um das Interesse der Eltern für Hausaufgaben und Schul-/ Unterrichtsge- schehen zu erfahren, vielleicht kann man auch Wünsche und Anregungen einholen. Stößt der Fragebogen auf sehr viel Kritik von Seiten der Eltern, wird es sich wahrscheinlich nicht lohnen, experimentelle Hausaufgaben einzuführen. Kritik kann schon ein hoher Prozentsatz an nicht beantworte- ten Bögen sein. Hat man dagegen Erfolg, sprich: eine positive Rückmel- dung, kann man daran gehen, auch die Meinungen der Schülerschaft ein- zuholen.
Auch hier kann ein Fragebogen eingesetzt werden. So werden die Schüle- rinnen und Schüler nicht übergangen und haben die Gelegenheit, den Un- terricht aktiv (demokratische Unterrichtskultur) zu gestalten. Die Schüle- rinnen und Schüler könnten einen „Hausaufgabenwunsch“ äußern und Stellung dazu nehmen, welche Form von Hausaufgaben sie bevorzugen.
Die Fragebögen sollten sprachlich auf das Schüleralter abgestimmt sein.
Man kann die Bögen also als eine Art Evaluation der bisherigen Situation betrachten. Der nächste Schritt wäre die Zusammenkunft des Elternrates, dem das Projekt vorgestellt wird. Mit Handzetteln, die Angaben zur Pla- nung, Durchführung und möglichen Gefahren enthalten, sorgt man für Klarheit. Ein Beispiel eines Hausaufgabenexperimentes könnte ebenfalls angegeben werden, damit man sich ein Bild von der Durchführung ma- chen kann. Die Eltern haben die Gelegenheit, aktiv am Schülerleben mit- zuwirken, indem sie mit Hilfe der Kurzinformationen (per Post) die Hausaufgabe bereits kennen und so bei der schriftlichen Bearbeitung hel- fen können. Hierbei sollte beachtet werden, dass die Schülerinnen und Schüler eventuell Zugang zu den Kurzinformationen der Eltern haben.
Daher sollten diese nicht zu detailliert sein und bereits die Lösungen bzw.
Erklärungen zu den Versuchen enthalten.
„Hausaufgabenausbeute“
Bei dieser Art von Hausaufgaben ist es schwer, eine hohe „Hausaufga- benausbeute“ (Anzahl der eigenhändig gemachten Hausaufgaben) zu er- reichen, da ein Experiment von mehreren Schülerinnen und Schülern be- arbeitet wird. Eine gewisse Zuverlässigkeit der Klasse ist deshalb eine der wichtigen Vorraussetzungen. Präsentationen, in denen die Aufgaben der Gruppenmitglieder sichtbar werden, können helfen dieses Problem zu umgehen. Man beginnt mit der Einteilung der Schülergruppen, die sich möglichst bis zum Ende des Projektes nicht ändern sollte, damit die Grup- pe schließlich ein funktionierendes System darstellt.
4. Didaktische Überlegungen zu experimentellen Hausaufgaben
„Unterricht ist so gut wie die Wirkung die er erzielt.“[25]
Was man als Wirkung verstehen kann, ist unterschiedlich. Meist wird die Qualität von Unterricht an Lerneffekten (PISA, TIMSS) festgemacht. Die Beurteilung dieser kurzfristigen Wirkungen wird dem breiten Aufgaben- spektrum der Schule jedoch nicht gerecht. Nach Hans Brügelmann (1999)
„müssen die Kriterien für guten Unterricht und dessen Wirkung in ver- schiedenen Dimensionen beleuchtet werden.“[26]
1. „Die inhaltliche Dimension“:
Allgemeinbildung über eine Auseinandersetzung mit „epochaltypischen Schlüsselproblemen“. Speziell im Chemieunterricht sind das Umweltprob- leme (saurer Regen, Ölpest, Müll) und die Wirtschaftlichkeit chemischer Prozesse.
Schon Klafki bezeichnet die „Bildung als Prozess, der durch inhaltliche Fragen bestimmt wird.“[26]
2. „Die Ziel-Dimension“:
- Handeln können (Wissen) - Verstehen und erklären (Können)
- Persönlichen Sinn finden und soziale Normen akzeptieren 3. „Die Prozess-Dimension“:
Hier spielen die Arbeits- und Sozialformen des Unterrichts eine Rolle, die die Ausbildung bestimmter Schlüsselqualifikationen fördern sollen.
4. „Die institutionelle Dimension“:
Diese Dimension beschreibt pädagogische Prozesse und ihre Bedingun- gen, wie Fachkompetenz, Teamqualität, und Familienorientierung.
All dies muss Schule und Unterricht leisten um die Kinder und Jugendliche zu selbstständig denkenden und handelnden Menschen zu erziehen und heranzubilden, die in der Gesellschaft erfolgreich bestehen zu können.
Comenius gebrauchte erstmals den Begriff Didaktik für die Wissenschaft von der Bildungsvermittlung und der Unterrichtslehre. Um die Dimensio- nen Bildung zu erfüllen, muss sich Schule immer wieder Gedanken dar- über machen, wie Bildung am besten vermittelt werden kann.
Die Frage nach dem Wie?
Erfolgreiche Didaktische Modelle (Lehrkunst/Berg, demokratische Unter- richtskultur/Meyer, Bildungstheoretische Didaktik/Klafki, Lerntheoretische Didaktik/Hamburger Modell, offener Unterricht) legen das Hauptaugen- merk auf verschiedene Aspekte. Alle Modelle sprechen jedoch mehr oder weniger intensiv von handlungsorientiertem Unterricht. Das heißt, Schüler brauchen Anschauungs- und Handlungsmaterial um einen nachhaltigen Lerneffekt zu erzielen, denn „um zu lernen, wie man Fahrrad fährt, braucht man ein Fahrrad.“ (Prof. Dr. Rainer Lersch) [27]
Dabei ist es wichtig, dass der Lern- und Verstehensprozess vom Schüler selbst initiiert wird. Die Schülerinnen und Schüler sollten schließlich nur noch auf bestimmte Hilfestellungen, bzw. Lernhilfen angewiesen sein, nicht aber den Lerninhalt vom Lehrer komplett und völlig untätig vermittelt bekommen.
Intelligenter Umgang mit Fehlern
Ein sehr erfolgreiches und nachhaltiges Modell ist das der Japaner. Hier wird die Lernsituation von der Leistungssituation getrennt, wobei innerhalb einer Unterrichtsreihe ausschließlich gelernt wird und Fehler gemacht werden dürfen. Eine Aufgabe wird von den Schülern selbstständig bear- beitet und nach eigenen Vorstellungen von der Lösung vorgetragen. So werden problemlösende Prozesse vom Schüler selbst initiiert und geübt.
Durch das Vortragen der möglichen, vom Schüler selbst entwickelten Lö- sung werden Fehler bereits in der Genese beseitigt. So wird auch der Lernprozess vom Schüler (durch die Klasse) selbst initiiert.
In diesem Modell wird der Erwerb von Schlüsselkompetenzen und Fach- wissen erfolgreich verbunden. In Tabelle 1 des Vorwortes ist das Ergebnis der japanischen Lernmethode eindrucksvoll gezeigt.
Japan liegt sowohl bei der Überprüfung der Lesekompetenz, als auch bei den mathematischen- und naturwissenschaftlichen (Tabelle 1 Vorwort) Kompetenzen weit über dem OECD-Durchschnitt.
In Deutschland ist das anders. Hier herrscht überwiegend die Meinung vor, solche Methoden kosteten zu viel Zeit, als dass sie verwendet werden könnten. Dabei ist der nachhaltige Lerneffekt für Schülerinnen und Schüler viel größer, wenn wie in Japan, „das Lernen“ und „das Leisten“ getrennt gewichtet werden. Es besteht die Gefahr, dass aufgrund der Zeitprobleme überwiegend Frontalunterricht, der zu prüfungsorientierten, kurzfristigen Lerneffekten führt, unterrichtet wird.
Verknüpfen von Gelerntem
Um etwas lernen zu können, muss es im Gehirn der Schülerinnen und Schüler mit konkreten Situationen verknüpft werden. Solche lernverknüpf- ten Situationen werden leider zu selten geschaffen, dabei kann es schon helfen, zu bestimmten Inhalten ein Standbild zu kreieren und kurz zu ver- weilen. Viele Methoden sind in dieser Hinsicht sehr effektiv. Die Hausauf- gaben (experimentelle Hausaufgaben), als „eigenständigen Unterricht“ zu nutzen, kann sicherlich dazu beitragen, Schlüsselqualifikationen wie ei- genverantwortliches Arbeiten und Lernen, Teamfähigkeit, Verantwortlich- keit und problemlösendes Denken zu fördern.
Aber bleibt dabei die Fachwissenschaftlichkeit auf der Strecke?
Auch hier gilt: „Spannst du die Seite der Gitarre zu fest, wird sie reißen. Ist sie zu locker, so kannst du nicht auf ihr spielen. Also finde ein Mittel- maß.“(Buddha)[28] Man sollte also die Schlüsselkompetenzen ernst neh- men ohne dabei eine solide fachliche Wissensbasis zu vernachlässigen.
Das Ziel ist das intelligente Wissen. Dazu müssen die außerunterrichtli- chen „Lerneinheiten“ im Unterricht gründlich nachbereitet werden, um Er- gebnisse und Lerninhalte nachhaltig zu sichern. So geht im Unterricht, gerade in inhaltsreichen Sequenzen keine Zeit für Aufbau und Durchfüh- rung verloren. Diese Zeit kann genutzt werden, um den Lerneffekt auszu- bauen. Diese Art von Hausaufgaben werden von den Schülern sicherlich eher mit dem jeweiligen Inhalt verknüpft als das traditionelle Anfertigen von Unterrichtsprotokollen und Aufgaben.
Die lernverknüpfenden Situation sind hier das Arbeiten in der Gruppe, die Beobachtungen, über die man sich gemeinsam gewundert und die man besprochen hat. Wichtig ist, dass die Lehrperson hier die Möglichkeit hat, sich zurück zu ziehen. Die Denkarbeit wird primär von den Schülern über- nommen. Die Schülerinnen und Schüler bleiben dabei zunächst sich selbst überlassen, einen Rückhalt bietet die Gruppe, in der Not bietet die Klasse Rückhalt und schließlich kann noch der Lehrer bei Problemen hel- fen. Alle didaktischen Methoden dienen nicht zuletzt dazu, lernverknüp- fende Situationen zu schaffen. Gruppenarbeit, Partnerarbeit und Klassen- gespräch fördern Kommunikation und Motivation und schaffen einprägsa- me Momente. Stillarbeit fördert die Konzentration und Projektunterricht ermöglicht die Erklärung des Gelernten und damit ein besseres Verständ- nis. Die Methode der experimentellen Hausaufgabe im naturwissenschaft- lichen Unterricht (nicht nur im Fach Chemie möglich) vereint die Vorteile aller gängigen Methoden innerhalb des Unterrichts. Hier wird der Unter- richt in die Freizeit verlagert, sodass Schülerinnen und Schüler die Mög- lichkeit haben, sich in einem größeren Rahmen als den üblichen 45 Minu- ten mit Inhalten zu beschäftigen. Die Leistungssituation wird von der Lern- situation getrennt.
Zusammenfassung der Vorteile von experimentellen Hausaufgaben - Hohe Handlungsorientierung, durch eigenständiges Arbeiten - Starker Alltagsbezug durch Umgang mit alltäglichen Stoffen
- Erwerb problemlösender und verständnisorientierter Kompetenzen - Vielfalt von Arbeits- und Sozialformen (Gruppenarbeit, Partnerarbeit
und Klassengespräch)
- Demokratische Unterrichtskultur (Schülerinnen und Schüler dürfen entscheiden, ob experimentelle Hausaufgaben eingeführt werden) - Erwerb wichtiger Schlüsselkompetenzen (Teamfähigkeit, eigenver-
antwortliches Arbeiten und Lernen, Verantwortungsgefühl)
- Offener Unterricht (Schüler planen die Zeiteinteilung, die Beschaf- fung der Materialien und die Durchführung der Experimente selbst) - Passive Lehrerhaltung (fördert Denk- und Lernprozesse bei Schüle-
rinnen und Schülern)
- Verlagerung des Unterrichts auf eine häusliche Ebene (ruhige Lernumgebung)
- Erleichterung einer Sinnfindung für den Schüler - Motivationaler Effekt durch Experimente
5. Experimenteller Teil
5.1 Die Experimentfolge
Die Experimente, die sich als Hausaufgaben zur Betrachtung auf phäno- menologischer Ebene eignen, sind von niedrigem zu hohem Anspruch geordnet. Die erste Hausaufgabe sollte dabei immer die sein, bei der es um sicheres Arbeiten und verantwortungsvollen Umgang mit Haushalts- chemikalien geht. Die Klasse wird so mit einigen Stoffen und Substanzen vertraut gemacht, die eventuell gefährlich sein könnten. Dabei handelt es sich im wesentlichen um Reinigungs- und Lösungsmittel und deren Gefah- renhinweise und Gefahrensymbole. Diese Hausaufgabe kann z. B. bereits in der Klasse acht durchgeführt werden. Folgende, leichte Experimente ermöglichen es, sich an den Protokollstil des Lehrers zu gewöhnen. Es sollte sich dabei um Experimente handeln, die eventuell keiner Aufsicht bedürfen, folglich zu Hause durchgeführt werden können und Spaß ma- chen. Als Einstieg könnte man einen „Zaubertrick“ wählen, mit dem die Schülerinnen und Schüler Verwandte und Bekannte verblüffen können. Im besten Falle liefern sie gleich die gelernte Erklärung dazu. Gerade junge Schüler sollen so für naturwissenschaftlichen Unterricht motiviert werden.
Weiter geht es mit dem Üben von experimentellen Fertigkeiten, indem in der Schule selbst eine Apparatur zum Erhitzen von Flüssigkeiten gebaut wird. Beobachtungen und Annahmen werden direkt am Versuch in einem Beobachtungsbogen festgehalten. Einfache experimentelle Untersuchun- gen folgen mit Bezug zum Mathematikunterricht. Die Schüler lernen, wie man Beobachtungen mathematisch umsetzen kann und auswertet. Wei- terhin werden einfache Versuche zur Säure/Base-Chemie durchgeführt, die ebenfalls mit einem leicht durchführbaren Versuch beginnen. Dabei lernen die Schüler alltägliche Stoffe und deren Beziehungen zur Chemie kennen. Zum Thema organische Chemie ist ein Versuch zur sauren Hyd- rolyse vorhanden, auch hier gibt es einen Bezug zum Leben der Schüle- rinnen und Schüler.
Der Themenblock „Redoxreaktionen“ hat einen besonders hohen Stellen- wert innerhalb des Projektes. Hier werden Beziehungen zwischen Metal- len und deren Fähigkeit als Reduktions- oder Oxidationsmittel aufzutreten behandelt. In der Versuchsreihe Kupferchemie bauen die Experimente aufeinander auf und unterstützen so die geistigen Fähigkeiten der Schüle- rinnen und Schüler bis hin zur formalen Denkweise. Auch die Eisenchemie hat einen wichtigen Alltagsbezug und behandelt die grundlegenden Kenntnisse über Redoxreaktionen. Die Experimente sind wie folgt einge- teilt: Lehrerprotokoll mit Erläuterungen und Verwendung im Unterricht, sowie Beobachtungen und Versuchsvorschrift. Vorschriften, Arbeitsblätter, Folien- und Kopiervorlagen zur Verwendung für die Schülerinnen und Schüler, befinden sich gesondert im darauffolgenden Kapitel. Ebenso die Kurzinformationen für die Eltern, die lexikonartige Beschreibungen der Versuche sowie mögliche Gefahrenhinweise enthalten.
5.2 Die Experimentiergruppen
Bei einer Experimentiergruppe sollte es sich nicht um mehr als drei Schü- lerinnen und Schüler handeln. Den einzelnen Mitgliedern der Gruppe kommen spezielle Aufgaben zu, die natürlich von Experiment zu Experi- ment getauscht werden müssen, da sonst sehr schnell eine Adaption an die jeweiligen Aufgaben stattfindet. Diese Aufgaben müssen vorher fest- gelegt werden und stützen sich auf die sogenannte „Expertenstrategie“.
So übernimmt ein Gruppenmitglied die Rolle des „Experimentators“. Seine Aufgabe ist es, sich um die „Chemikalien und Materialien“ zu kümmern, sodass diese zu Versuchsbeginn vorliegen. Ein anderes Gruppenmitglied ist „die/der Sicherheitsbeauftragte“, die/der überwacht, ob alle Bedingun- gen (geeigneter Arbeitsplatz, Schutzbrillen, Gefährlichkeit der eingesetz- ten Chemikalien) zur Durchführung beachtet werden. Der dritte Schüler führt das Beobachtungsprotokoll und ist für die „Organisation der Gruppe zuständig“. Wenn ein Experiment zum Beispiel über mehrere Tage läuft, plant er die Beobachtungsphasen und die Gruppentreffen.
5.3 Die Experimente – Informationen für die Hand des Lehrers
5.3.1 „Sicheres Arbeiten mit Chemikalien“
(Einführungshausaufgabe)
Erläuterung:
Chemikalien, auch solche, die im Haushalt verwendet werden, dürfen nur in Behältern aufbewahrt werden, die eindeutig und dauerhaft gekenn- zeichnet sind. Gefährliche Stoffe werden zusätzlich durch leicht verständ- liche und international gebräuchliche Warnsymbole markiert.
Die Schülerinnen und Schüler werden durch diese kleine Einführung mit der Gefährlichkeit mancher Stoffe (Flüssigkeiten, Feststoffe) vertraut ge- macht. Mit dem Wissen um die Wirkung und Toxizität der Alltagssubstan- zen (z. B. Reiniger, Bremsreiniger, Farben, Lösemittel, Säuren und Lau- gen), kann dazu beigetragen werden, Unfälle und schlimme Verletzungen zu vermeiden. Dem verantwortungslosen Umgang mit „Chemikalien“ wird so vorgebeugt. Eine Sammlung von Informationen über bestimmte Stoffe kann ins Heft überführt werden und ist so für die weitere Verwendung ge- sichert.
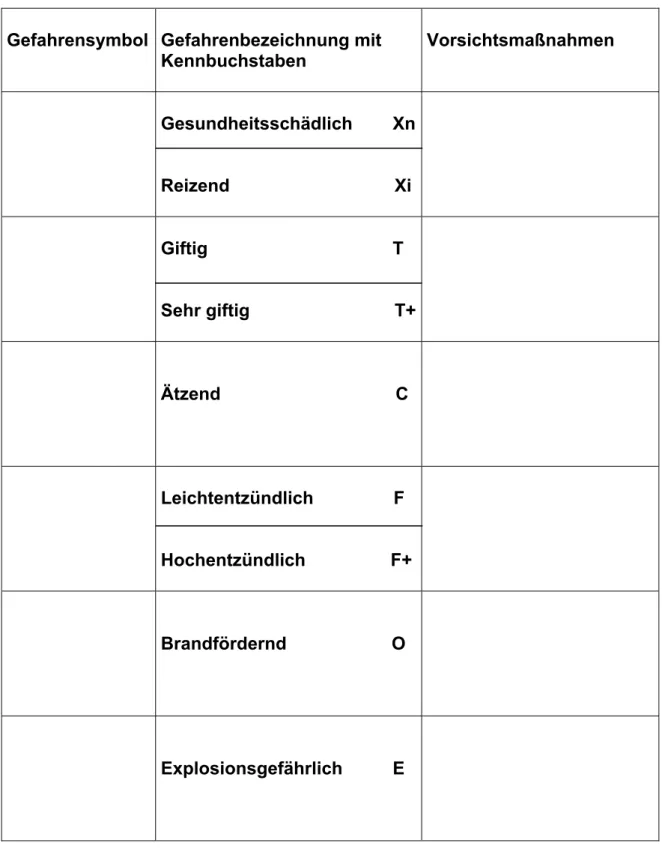
Gefahrensymbole:
Kleine Bilder warnen mit einer einfachen Zeichnung vor der Gefahr, die von der Chemikalie ausgeht. Der Totenkopf ist z. B. das Symbol für Gift, die Flammen warnen vor der Entzündlichkeit eines Stoffes. Ein Stoff, der giftig für Gewässer, Umwelt und darin lebende Tiere ist, wird mit einem See, einem Baum und einem toten Fisch gekennzeichnet. Die Gefahren- symbole werden zunächst auf ihre Bedeutung hin besprochen.
Die Schülerinnen und Schüler diskutieren die möglichen Bedeutungen der Gefahrensymbole. Die Anwendung des Wissens besteht darin, die Sym- bole einigen Chemikalien zu zuordnen.
Kennbuchstabe und Gefahrenbezeichnung:
Jedem Gefahrensymbol ist ein Kennbuchstabe zugeordnet, der die Gefahr, die vom Stoff ausgeht, näher bezeichnet. Der Kennbuchstabe lei-
tet sich häufig von einem englischen Begriff ab.
X: gesundheitsschädlich / reizend T (toxic): giftig
C (corrosive): ätzend
F (flammable): leicht entzündlich O (oxidising): brandfördernd
E (explosive): explosionsgefährlich N: umweltgefährlich Vorsichtsmaßnahmen:
Aus den Gefährlichkeitsmerkmalen leiten sich Vorsichtsmaßnahmen ab, die einen sicheren Umgang mit der Chemikalie ermöglichen. Diese Vor- sichtsassnahmen sollten im Einzelfall ebenfalls im Unterricht besprochen werden.
Auswertung:
Die Gefahrensymbole werden ausgeschnitten und in der Tabelle (siehe Arbeitsblatt (6.1) richtig eingeklebt. Die Schülerinnen und Schüler infor- mieren sich in ihrem Chemiebuch und gegebenenfalls im Internet über die Gefährlichkeitsmerkmale. Welche Vorsichtsmaßnahmen sind erforderlich?
Sie werden stichwortartig in der Tabelle ergänzt.
Die Schülerinnen und Schüler suchen Stoffe im Haushalt, die mit einem Gefahrensymbol gekennzeichnet sind und notieren ihren Namen, den Kennbuchstaben mit dem Gefährlichkeitsmerkmal und ihre Verwendung Beispiel:
W5 Kalkreiniger, Xi reizend
Der Kalkreiniger entfernt hartnäckigen Belag, Kalk-, Rost- und Seifenrück- stände und enthält z. B. Amidosulfonsäure.
Gefahrensymbole:
Abbildung 1
Gefahrensymbole (Quelle: AG Naturwissenschaft und Technik, BASF, Arbeits- blätter zur Unterrichtsgestaltung)
5.3.2 „Tanzende Pflanzen“
A. Material:
Kamm aus Plastik, Wolltuch oder Schal aus Baumwolle, Pflanze mit lan- gen dünnen Blättern, Buchseiten, Kopfhaar, Luftballon
B. Durchführung:
Der Kamm aus Plastik wird in ganz nah an das Blatt einer Pflanze gehal- ten, die Beobachtung wird notiert. Jetzt wird er mit einem Wolltuch oder Schal gut und fest abgerieben und wiederum in die Nähe eines Blattes gebracht. Ein dünner Wasserstrahl aus dem Wasserhahn wird ebenfalls mit dem Kamm in gleicher Weise untersucht. Weiterhin können Haare, Textilien und Buchseiten mit dem elektrisierten Kamm (Zauberkamm) ge- testet werden. Mit einem aufgeblasenen Luftballon funktioniert das Expe- riment auch, indem man ihn an einem Teppich reibt.
C. Dauer:
Ca. 10 Minuten
D. Erläuterung:
Pflanzen, Haare, Textilien und Buchseiten bewegen sich auf „magische Art und Weise“, wenn man einen mit Wolle geriebenen Kamm in ihre Nähe hält. Der Kamm wird durch das Reiben mit dem Wolltuch elektrisch aufge- laden. Auf seiner Oberfläche befinden sich dann viele kleine, negative La- dungen. In der Pflanze sind im Gewebe hauptsächlich Wasser und gelöste Stoffe vorhanden. Das Wassermolekül weist aufgrund seiner gewinkelten Struktur einen Dipol auf, man kann es wie einen Magneten in ein positives und negatives Ende einteilen. Dabei fungiert das Sauerstoffatom im Mole- kül als negativer Pol, die Wasserstoffatome stellen den negativen Pol dar.
Abbildung 2
Dipol des Wassers (Quelle privat)
Der Dipol entsteht aus der unterschiedlichen 1Elektronegativität der betei- ligten Atome Sauerstoff und Wasserstoff. Der Sauerstoff mit einer Elektro- negativität von 3,5 hat eine größere Affinität zu den Bindungselektronen als Wasserstoff mit einer Elektronegativität von 2,2 [13]. Da das Molekül gewinkelt vorliegt und beide Pole frei zugänglich sind, entsteht eine Art Magnet. Jede Seite wird von der entsprechenden Gegenladung angezo- gen und von der eigenen Ladung abgestoßen.
Abbildung 3
Anziehung und Abstoßung (Quelle: privat)
Kommt nun der elektrisch aufgeladene Kamm mit dem, in den Pflanzen enthaltenem, Wasser in Berührung, richten sich die Wassermoleküle ent- sprechend aus, nachdem sie zunächst abgelenkt wurden.
1Fähigkeit von Atomen, Bindungselektronen von benachbarten Atomen an sich zu ziehen.
Die Blätter der Pflanze bewegen sich auf „magische Art und Weise“. Man stellt sich vor, dass sich die Wassermoleküle in der Flüssigkeit ungeordnet bewegen.
O H H
H H
O
O H H O
H H
H H O
Abbildung 4
Ausgerichtete Wassermoleküle (Quelle: Privat)
E. Ideen für den folgenden Unterricht
Beim näheren Betrachten der Eigenschaften des Wassers (Siede- und Gefrierpunkt, Dichte), kann man annehmen, dass die Wasserstoffatome zu den Sauerstoffatomen eines benachbarten Moleküls ausgerichtet sind.
Es entstehen kleinere Cluster (Anordnungen aus mehr als drei Atomen oder Molekülen), in denen die Moleküle durch die elektrostatische Anzie- hung zwischen Sauerstoff- und Wasserstoffatom (Wasserstoffbrückenbin- dung ca. 20 kJ/mol) zusammengehalten werden.
O H H
H H
O
H H
O H H
O
O
H H
O H
H H
O H
H O H H
O H H HO
Abbildung 5
Wassercluster und Wasserstoffbrückenbindung (Quelle: privat)
„Dies erklärt unter anderem den hohen Siedepunkt des Wassers, im Ge- gensatz zu den anderen Wasserstoffverbindungen aus der 6. Hauptgrup- pe. Erwartungsgemäß müsste das Wasser einen Siedepunkt noch unter- halb von Schwefelwasserstoff haben. Da dies nicht zutrifft, spricht man auch von der Siedepunkt-Anomalie des Wassers.“ [6]
Siedepunkte der Wasserstoffverbindungen der 6.
Hauptgruppe
H2O
H2S
H2Se
H2Te H2O
H2S
H2Se
H2Te H2O
H2S
H2Se
H2Te
-80 -60 -40 -20 0 20 40 60 80 100 120
Perioden
Siedetemperatur in Grad Celsius (°C)
Abbildung 6
Siedepunkte der Wasserstoffverbindungen der sechsten Hauptgruppe (Quelle:
privat)
F. Verwendung im Unterricht:
Das Wasser ist aufgrund seiner Eigenschaften Lösemittel für viele Stoffe in der Natur, unter anderem auch im Menschen. Ohne das Wasser könnte kein Stofftransport stattfinden, die Zellen wären schlaff, der Mensch könn- te ohne Wasser nicht aufrecht gehen. Wir könnten nicht existieren.
Den großen Nutzen, den die Welt aus dem Wasser aufgrund seiner che- mischen und physikalischen Eigenschaften zieht, sollte besonders im Chemieunterricht behandelt werden.
Da es sich bei Wasser um eine absolut ungefährliche Chemikalie handelt, ausgenommen heißes Wasser, kann der Schüler viele grundlegende Un- tersuchungen zu Hause durchführen. Die Betrachtung der Polarität ist da- bei nur ein Aspekt.
Weiterhin können Lösevermögen für verschiedene Stoffe und physikali- sche Daten selbst ermittelt werden. Rückschlüsse auf die Polarität anderer Materialien können durch die genaue Betrachtung des Stoffes Wasser gezogen werden. Neben polaren Verbindungen, wie dem Wasser, finden sich auch unpolare (ohne eindeutige Pole) Stoffe. Lässt man zum Beispiel Pentan aus einer Bürette in ein Becherglas fließen und versucht es mit dem „Zauberkamm“ abzulenken, wird dies nicht gelingen. n-Pentan be- steht aus fünf Kohlenstoffatomen, die von Wasserstoffatomen umgeben sind. Es liegt keine Polarität vor.
C C C C C H
H
H H
H H
H H
H H
H
H oder einfach
Abbildung 7
Moleküldarstellungen von n-Pentan (Quelle: privat)
Das Experiment eignet sich gut um den Dipolbegriff einzuführen.
Außerdem ist es eine kleine Anregung um selbst weiter zu forschen.
Die Motivation steckt im Experiment selbst. Die Schüler können mit der Chemie und den Naturwissenschaften Zaubertricks vorführen, die sie chemisch erklären können. Den Einstieg in das Thema wählt man, indem man vorgibt, eine Anleitung für einen Zaubertrick zu haben. Gerade jünge- re Schüler werden diese Art von Hausaufgaben dankend annehmen.
Nach der Betrachtung des Phänomens, erfolgt die Aufklärung in der nächsten Unterrichtsstunde. Didaktisch ist es ratsam, nach den Erfahrun- gen mit dieser Hausaufgabe zu fragen. Das ist für die Schüler keine direk- te, schulübliche Wiederholung des Stoffes, sondern ein lockerer Einstieg ins Thema.
Manche Schülerinnen und Schüler haben damit vielleicht die Eltern oder Geschwister erschreckt oder ganz ungewöhnliche Stoffe getestet. Viel- leicht weckt man über diese Schiene das Interesse an Naturwissenschaf- ten unter dem Motto: „Mit der Chemie die Welt erklären!“
G. Fachlicher Anspruch:
Anwendbar in der Jahrgangsstufe 8: Wasser und Wasserstoff, Eigen- schaften und Bedeutung des Wassers.
Jahrgangsstufe 9: Atome, Moleküle, Atomverbände, bildliche Darstellung von Molekülen (Wasser, Ammoniak usw.), Oxidationszahlen als Wertigkeit mit Vorzeichen
Jahrgangsstufe 10: Lewisformeln, Ladungsschwerpunkte, Dipolbegriff, Wasserstoffbrückenbindungen
5.3.3 „Erhitzen von Stoffen – verdunsten, schmelzen, reagieren“
(Esslöffelexperimente)
A. Material: B. Chemikalien:
Wasser Salz Zucker Backpulver Cola
(von allem ca. einen Tee- löffel voll, also sehr wenig) 4 – 5 Frühstücksbrettchen aus Holz
einen Topfdeckel
4 - 5 ältere Esslöffel aus Metall Teelicht
Feuerzeug Stift
Papier Stoppuhr
C. Durchführung:
Die Holzbrettchen werden aufeinander gestapelt. Versuchsweise wird der Esslöffel daraufgelegt, sodass er mit der breiten Seite übersteht.
Abbildung 8
Aufsicht, der Topfdeckel sorgt dafür, dass der Löffel sich nicht bewegen kann.
(Quelle privat)
Unter den Löffel wird das Teelicht gestellt sodass die Flamme den Löffel- boden nicht berührt. Durch ein weiteres Holzbrettchen legt man den Löffel etwas höher, nimmt man eines weg, liegt er etwas tiefer.
Abbildung 9
Seitenansicht, die Flamme darf den Löffel nicht berühren.
Abbildung 10
Aufbau zum Esslöffelexperiment (Quelle: privat)
Von Zucker, Salz und Backpulver wird jeweils ein Teelöffel Stoff in drei Esslöffeln Wasser in einem Glas gelöst. Nun können die verschiedenen Lösungen auf dem Esslöffel erhitzt werden. Der Löffel wird jeweils etwa halb gefüllt, sodass nichts heraus laufen kann. Mit einer Stoppuhr kann besonders markantes Verhalten wie Sieden, Kochen, Bräunung und Ver- dunstung zeitlich festgehalten werden. In die Tabelle wird das Verhalten beim Erhitzen und das Aussehen nach dem Erhitzen eingetragen. Erhitzt wird mindestens 3 Minuten, höchstens 8 Minuten. Wenn einer der Stoffe anfängt schwarz zu werden oder raucht, wird der Versuch abgebrochen, indem die Kerze ausgeblasen oder entfernt wird.
D. Sicherheit:
Der Löffel wird nicht nur an seiner breiten Seite heiß, sondern auch am anderen Ende. Bevor man ihn in die Hand nehmen kann, sollte er ca. 5 Minuten abkühlen. Die Flüssigkeiten können, gerade wenn nur noch ein Rest vorhanden ist, aus dem Löffel herausspritzen. Deshalb nicht direkt in den Löffel schauen und ca. ½ Meter Abstand halten. Brennbare Gegens- tände, wie Haushaltsrolle, Taschentücher, Zeitungen oder Spraydosen dürfen nicht in die Nähe der Kerze gelangen. Um das Experiment herum deshalb viel Platz schaffen und einen Eimer Wasser bereit stellen, um e- ventuell zu löschen. Lange Haare zusammenbinden. Schutzbrille tragen!!!
E. Dauer:
Ca. 30 Minuten F. Erläuterung:
Flüssigkeiten zeigen beim Erhitzen ein unterschiedliches Verhalten, das abhängig ist von ihrem Schmelzpunkt, Siedepunkt, deren Zersetzungs- temperatur und den darin gelösten Stoffen.
Das Wasser, eine klare Flüssigkeit, siedet oberhalb von 90°C und kocht bei knapp 100°C kochen, bis alles schließlich völlig verdampft. Es wech- selt den Aggregatzustand von flüssig zu gasförmig.
Chemisches Zeichen:
Flüssig:
H
2O
(l) Gasförmig:H
2O
(g) Fest:H
2O
(s)Aus weißen Salzkörnern entsteht mit Wasser ebenfalls eine klare Lösung, die viel festes Salz aufnehmen kann. Die Salzlösung fängt später an zu sieden als das reine Wasser. Langsam setzen sich kleine Kristalle am Bo- den des Löffels ab, der Flüssigkeitspegel nimmt ab und das Salz kommt wieder zum Vorschein. Es wechselt seinen Aggregatzustand von fest über gelöst zu fest.
Chemisches Zeichen:
Fest:
NaCl
(s)Gelöst:
Na
+(aq)Cl
-(aq)Die Zuckerlösung ist zu Anfang ebenfalls klar und fängt nach kurzer Zeit an zu sieden. Zucker und Salz unterscheiden sich zunächst nicht vonein- ander. Man kann sie als Feststoff und als Lösung leicht verwechseln. Eine Zuckerlösung verfärbt sich beim Erhitzen nach hellbraun und mit abneh- mendem Flüssigkeitspegel nach dunkelbraun. An dieser Stelle hat man primitiven (ohne Zusätze) Zuckercouleur, den Farbstoff (E150 c) für Süß- getränke und Soßen, hergestellt. Zuckercouleur färbt auch in großer Ver- dünnung noch und ist wasserlöslich.
Abbildung 11
Zuckercouleur (Quelle: privat)
Erhitzt man die Zuckerlösung weiter, erhält man eine schwarze feste Mas- se, die raucht und verbrannt riecht. Hier handelt es sich um Zuckerkohle, das Zersetzungsprodukt von Haushaltszucker. Der Haushaltszucker liegt also nach der Wasserzugabe als gelöster Stoff vor und reagiert bei Er- wärmen unter Dehydrierung zu einem schwarzen Produkt.
Chemisches Zeichen:
Feststoff:
C
12H
22O
11 (s) Gelöst:C
12H
22O
11 (aq)Reaktion:
C
12H
22O
11 (l)Umwandlung in schwarzes Produkt
C
12H
22O
11 (l)C
xH
yO
z (s)+ n H
2O
(g)∆
Das Backpulver löst sich in Wasser unter leichtem Sprudeln. Ist alles Wasser verdunstet, verändert der Rückstand seine Farbe von weiß zu leicht gelblich, wird erst nach langem Erhitzen bräunlich und verflüchtigt sich nicht. Hier wird die Zersetzungstemperatur nicht erreicht. Bei Back- pulver handelt es sich im wesentlichen um Natriumcarbonat und Natrium- hydrogencarbonat, welches beim Erhitzen leicht Kohlenstoffdioxid abspal- tet und so den Teig des Kuchens aufgehen lässt. Das Hydrogencarbonat wird dabei in das Natriumcarbonat umgewandelt. Bei längerem Erhitzen färbt sich schließlich auch das Backpulver braun, da Stärke enthalten ist.
Stärke ist ein Polysaccharid, das aus vielen hundert Glucose-Bausteinen besteht.
Chemisches Zeichen:
Feststoff:
NaHCO
3(s)Reaktion:
2 NaHCO
3 (s)Na
2CO
3 (s)+ CO
2 (g)+ H
2O
Abbildung 12
Rückstand des Backpulvers nach Erhitzen (Quelle: privat)
Die Cola siedet relativ schnell, wobei das enthaltene Wasser verdampft.
Zurück bleiben die vorher gelösten Inhaltsstoffe.
Dies sind Phosphorsäure und Phosphate, Zucker und Zuckercouleur, Farbstoffe und verschiedene Salze (Angaben von Etikett). Der Rückstand ist aufgrund des hohen Zuckergehaltes und dem enthaltenen Zuckercou- leur schwarz gefärbt. Diese Stoffe waren vormals gelöst und bleiben nun als schwarzer Feststoff zurück.
Abbildung 13
Rückstand von Cola nach dem Erhitzen (Quelle: privat)
G. Verwendung in der Schule:
Diese Versuchsreihe soll den Schülern den Unterschied zwischen festem, flüssigem, gelösten und gasförmigem Zustand eines Stoffes klar machen.
Die dazugehörigen Begrifflichkeiten werden besprochen, sowie die Um- wandlungen, die der Stoff vollzieht. Dazu stehen verschiedene Arbeitsblät- ter zur Verfügung.
Man könnte Ionenbindungen und kovalente Bindungen charakterisieren und verschiedene Stoffklassen untersuchen. Ein wichtiger Aspekt ist, dass die Schüler lernen, wie man Vorgänge beobachtet und beschreibt. Dabei beginnt man mit dem einfachsten Stoff, dem Wasser. Mit seiner großen Lebensnähe ist es für Schüler im Chemieunterricht sehr gut zugänglich. In einer Erweiterung der „Esslöffel-Experimente“ kann man auch die entste- henden gasförmigen Produkte mit einem weiteren Teelöffel auffangen. Da kondensiert zum Beispiel Wasser beim Erhitzen von trockenem Zucker und auch das scheinbar trockene Backpulver enthält offensichtlich Feuch- tigkeit. Es kondensiert kein Wasser beim Erhitzen von trockenem Salz.
Abbildung 14
Erweiterung der Esslöffelexperimente
Seitenansicht: Mit einem weiteren Esslöffel wird geprüft, ob gasförmige Stoffe entweichen und wieder kondensieren. (Quelle: privat)
Abbildung 15
Diagramm mit Aggregatzuständen (Quelle: W. Botsch, E. Höfling, J. Mauch, Chemie - in Versuch und Übung, Otto Salle Verlag, Frankfurt a. M., Berlin, Mün- chen, 1977, S. 6)
Mit Hilfe des Diagramms, in dem fast alle Aggregatzustände aufgeführt sind, lernen die Schüler die verschiedenen Fachbegriffe für die verschie- denen Übergänge zu benutzen. Um die Sublimation, den Übergang von Feststoff zum Gas (ohne vorheriges Schmelzen) und zurück (Resublimati- on), zu zeigen, erhitzt man Kaffeepulver vorsichtig auf einem Löffel. Nach etwa drei Minuten zeigen sich kleine weiße Kristallnadeln. Es handelt sich dabei um Coffein, einen organischen Stoff.