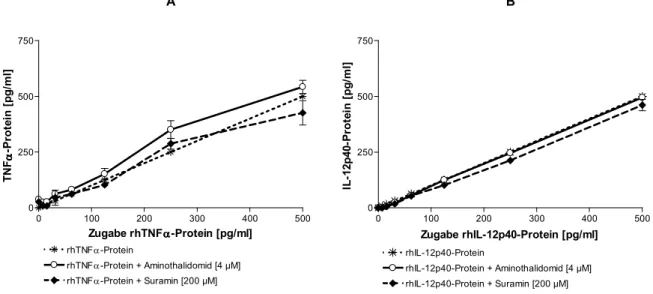
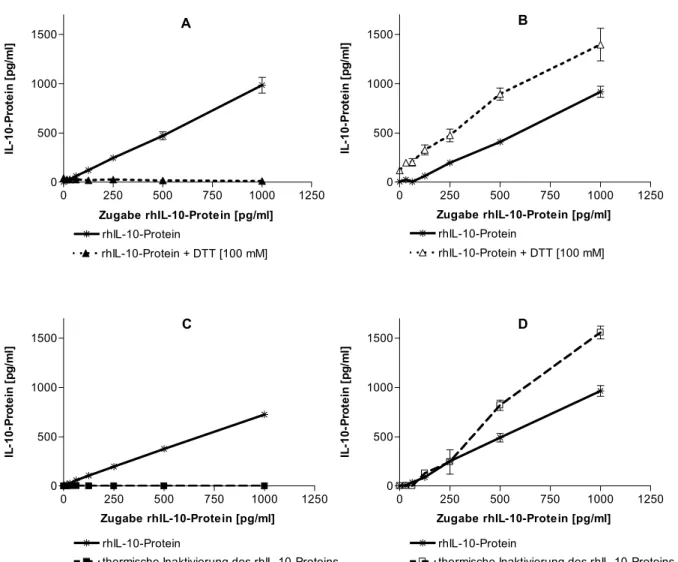
Wirkungen von Aminothalidomid und Suramin auf die LPS-induzierte Zytokinbildung von TNFα, IL-12p40 und IL-10 in CD-14
Volltext
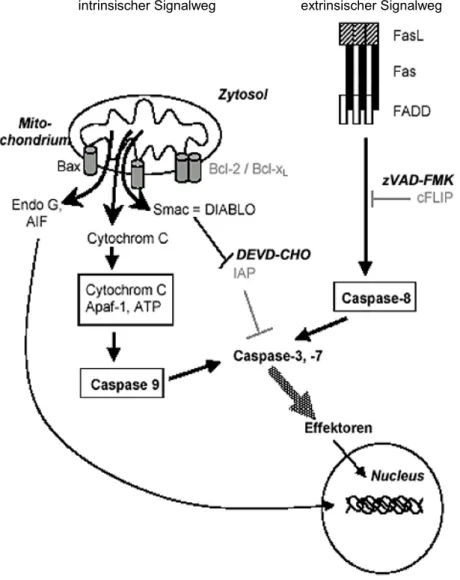
Abbildung

ÄHNLICHE DOKUMENTE
Das Projektteam setzte sich aus Bruno Nideröst (Projektleitung), Virginie Gaspoz sowie Ueli Luginbühl (wissenschaft- liche Mitarbeit) zusammen. Es arbeitete unter der Supervision
Finalement, avec la réforme – surtout dans le cadre du nouveau service pénal crée en 2013 – moins de dix équivalents plein temps ont ainsi été transférés vers la division
Zwar sprechen sich mittlerweile die G20, die G8, die EU, die OECD und andere internationale Organisationen für mehr internationale Zusammenarbeit und Regulierung in diesem
#$ & ; $ < - dener Anbausysteme nicht möglich ist. Auch die menschliche und tierische Gesundheit ist gefährdet, denn neben den anvisierten neuen Eigenschaften
a) Die bisherigen Möglichkeiten der Agrarumweltförderung auch im Ackerbau und des Vertragsnaturschutzes werden fortentwickelt, damit diese in deutlich größerem Um- fang als
Darüber hinaus gibt es auch für beide Lerninhalte Nervenzellen, die ihre Aktivität nicht ändern (gelb dargestellt).Der Gedächtnisinhalt (hier der belohnte Duft bzw. der nicht
Menzel von der Freien Universität Berlin zeigen, dass der Orientierungssinn von Bienen durch Insektizide und auch Glyphosat stark beeinträchtigt werden kann – Der BUND
167 Anknüpfungspunkt: Anwendung eines Medizinprodukts aus Eigenherstellung entsprechend der neu festgelegten Zweckbestimmung.. 167 Nicht mehr vertretbare, unmittelbare

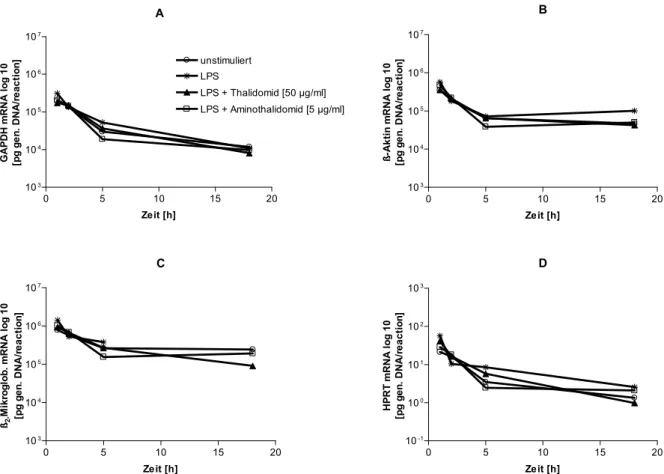
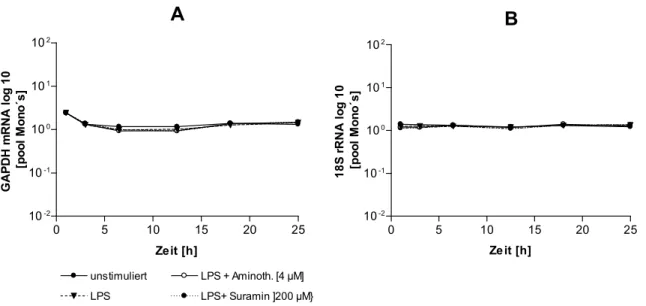
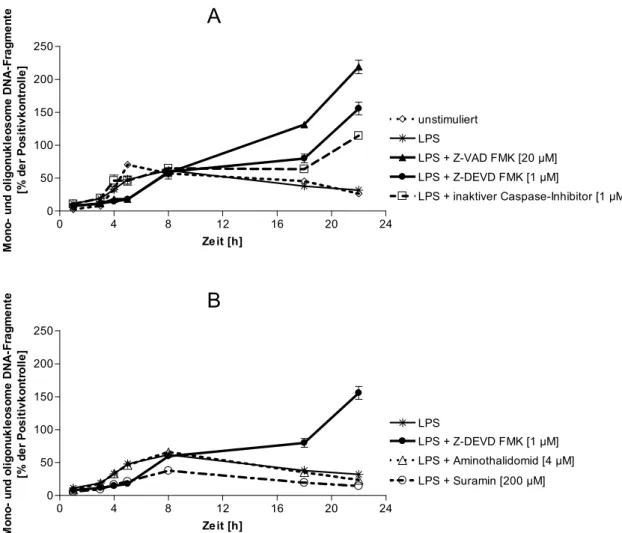
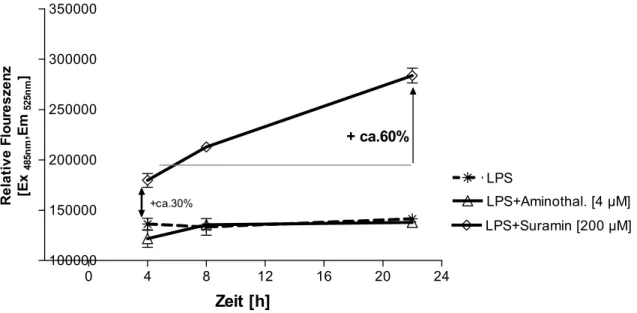
![Abb. 30: TNFα-mRNA-Menge unter Einwirkung von Aminothalidomid [4 µM] in LPS-stimulierten CD14 + - -Monozyten](https://thumb-eu.123doks.com/thumbv2/1library_info/3660922.1503742/47.892.141.683.847.1082/abb-tnfα-mrna-menge-einwirkung-aminothalidomid-stimulierten-monozyten.webp)