Philipps-Universität Marburg Fachbereich Chemie
Übungen im Experimentalvortrag
Leitung: Prof. Dr. B. Neumüller, Dr. P. Reiß
Protokoll zum Experimentalvortrag
„Kochsalz
Chemie, Eigenschaften und Bedeutung“
Vortrag vom 12.01.2006
erstellt und vorgelegt von:
Andrea Bontjer Am Zehntenstein 3
65549 Limburg
Hinweis:
Dieses Protokoll stammt von der Seite www.chids.de (Chemie in der Schule).
Dort können unterschiedliche Materialien für den Schulunterricht heruntergeladen werden, unter anderem hunderte von Experimentalvorträgen so wie der vorliegende:
http://online-media.uni-
marburg.de/chemie/chids/veranstaltungen/uebungen_experimentalvortrag.html
Inhalt
1. Einleitung 2
2. Was ist Kochsalz? 4
3. Chemie und Struktur 7
4. Bedeutung und Verwendung des Kochsalzes im Laufe der Geschichte
9
4.1 In vorindustrieller Zeit 9
4.2 Beginn der Industrialisierung 11
4.3 Aktuelle Bedeutung 12
5. Kochsalzgewinnung 15
6. Funktionen des Kochsalzes im menschlichen Körper 17
7. Schulrelevanz des Themas 19
8. Literatur 19
1. Einleitung
„Salz ist unter allen Edelsteinen, die uns die Erde schenkt, der Kostbarste.“, sagte Justus von Liebig über das eigentlich doch eher alltägliche Kochsalz. Und auch Cassiodor, ein römischer Staatsmann aus dem 6. Jahrhundert, meinte: „Auf Gold kann man verzichten, nicht aber auf Salz.“
Kochsalz wurde lange als das „weiße Gold“ bezeichnet, denn es war bis ins 19.
Jahrhundert ein wertvolles und knappes Gut. Städte mit Salzvorkommen waren mit Macht und Wohlstand ausgestattet und noch heute erkennt man die „Salzstädte“ an ihren Namen, die die Wortteile „Salz“ oder „Hall“ (von keltisch hal: Salz) enthalten, z.B. Halle, Bad Reichenhall, Salzburg oder Hallstatt. Auch unser etwas altmodisches Wort für Lohn/ Gehalt „Salär“ lässt sich vom Salz ableiten: Früher wurde römischen Legionären ein Teil ihres Soldes in Form von Salzgeld (salarium) ausgezahlt.
Der Salzhandel war lange Zeit ein wichtiger Motor für die Wirtschaft. Es wurden Salzstraßen angelegt, auf denen das Salz z.B. von Halle nach Köln oder von Bad Reichenhall über München nach Augsburg transportiert wurde. Auch internationaler Salzhandel wurde betrieben: So wurde Meersalz vom Mittelmeer ins ferne Asien, Persien und Arabien exportiert.
Wie alle knappen Ressourcen war auch das Kochsalz früher heftig umkämpft und es wurden sogar Salzkriege geführt – z.B. im 17. Jahrhundert der Salzkrieg Salzburgs gegen Bayern. Bereits im 13. Jahrhundert wurden an den Salzabbaustätten Befestigungsanlagen gebaut, um sie vor Raub zu schützen.
Auch wenn die Verwendung des Kochsalzes heute eine andere ist als zu früheren
Zeiten und auch wenn es heute durch verbesserte Abbaumöglichkeiten in
ausreichendem Maße zur Verfügung steht, ist die Bedeutung des Kochsalz in Alltag
und Industrie nach wie vor groß. Deshalb soll ein Schwerpunkt des Vortrages auf der
Bedeutung und Verwendung des Kochsalzes im Laufe der Geschichte liegen. Auch
die Kochsalzgewinnung und die Funktionen des Natriumchlorids im menschlichen
Körper sollen behandelt werden. Zunächst soll aber auf die Chemie und Struktur des
Natriumchlorids eingegangen werden.
2. Was ist Kochsalz?
Der chemische Name des Kochsalzes, im alltäglichen Sprachgebrauch oft auch nur als Salz bezeichnet, ist Natriumchlorid, die Summenformel lautet NaCl. Tatsächlich kann es aus den Elementen Natrium und Chlor dargestellt werden, was im ersten Versuch gezeigt werden soll.
Versuch 1: Darstellung von Natriumchlorid aus den Elementen
Geräte: Küchenmesser, Krepppapier, Pinzette, kleines Reagenzglas mit passender Reagenzglasklammer, Filmdöschen mit passendem Gummistopfen, Kanülen, Einmalspritzen (20 ml, 10 ml), Bunsenbrenner, Hammer o.ä., 2 Reagenzgläser, Pipetten, Blumenspritze
Chemikalien: Natrium, Kaliumpermanganat KMnO
4, Salzsäure HCl
(aq)(w = 0,35), Silbernitratlösung AgNO
3(aq)(w = 0,01), Salpetersäure HNO
3(aq)(w = 0,65), Natriumcarbonat Na
2CO
3, Aktivkohleadsorber (Spritze ohne Kolben, gefüllt mit Glaswolle und gekörnter Aktivkohle)
Durchführung: Zunächst wird das Chlorgas hergestellt (um evt. austretendes
Chlorgas niederzuschlagen, bereitet man eine Blumenspritze mit gesättigter
Natriumcarbonatlösung vor). Dazu gibt man eine Spatelspitze Kaliumpermanganat in
das Filmdöschen und verschließt dieses mit dem Gummistopfen, durch den man
zwei Kanülen gesteckt hat. In die eine Kanüle steckt man die 20 ml-Spritze, deren
Kolben man vorher eingefettet hat, damit dieser gut beweglich ist. In die zweite
Kanüle steckt man die 10 ml-Spritze, in die man 2 ml Salzsäure eingezogen hat
(danach Spitze gut abwischen). Dann tropft man langsam die Salzsäure in das
Filmdöschen. Es folgt eine Gasentwicklung im Filmdöschen. Das entstehende
Chlorgas drückt sich in die leere Spritze, so dass 20 ml Chlorgas aufgefangen
werden. Dann entfernt man die Spritze und steckt eine neue, verschlossene Kanüle
auf die Spritze. Das Chlorgas lässt sich so mehrere Stunden bis zur Verwendung
lagern. Auf die Kanüle im Gummistopfen steckt man den Kohleadsorber, um nicht
benötigtes Chlorgas aufzufangen.
Zur Natriumchloriddarstellung entrindet man ein kleines Stück Natrium, so dass ein etwa reiskorngroßes Stück Natrium erhalten wird. Dieses gibt man in das kleine Reagenzglas und schmilzt es über der Bunsenbrennerflamme. Dann drückt man das Chlorgas aus der Spritze mit Kanüle in das Reagenzglas hinein. Sobald es zu einem intensiven Leuchten kommt, nimmt man das Reagenzglas aus der Flamme. Wenn die Reaktion abgeklungen ist, legt man das Reagenzglas zwischen zwei Schichten Krepppapier und zerschlägt es vorsichtig. Man gibt ein Stückchen Glas, an dem die entstandene weiße Substanz haftet, in ein Reagenzglas mit entionisiertem Wasser.
Die Substanz löst sich auf und die Lösung wird in ein zweites Reagenzglas abdekantiert. Dann prüft man auf Chloridionen: Die Lösung wird mit wenig Salpetersäure angesäuert und mit einigen Tropfen Silbernitratlösung versetzt. Es fällt ein weißer Niederschlag aus, der auf Chloridionen hinweist.
Auswertung:
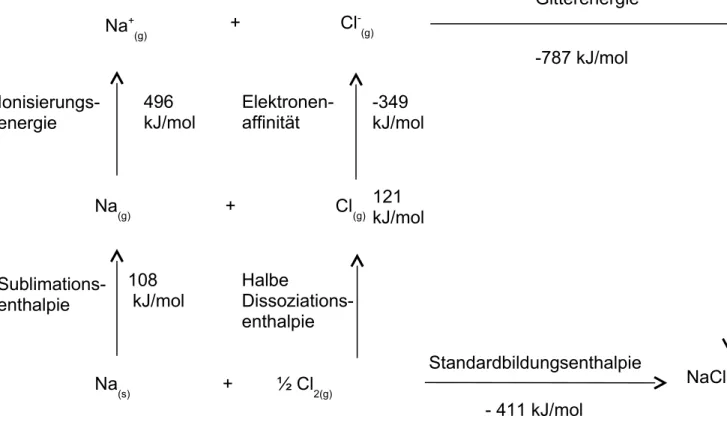
Energetisch kann die Reaktion und die Bildung des festen Ionenkristalls folgendermaßen beschrieben werden:
Es muss Energie aufgebracht werden, um das feste Natriummetallgitter zu zerstören und einzelne, gasförmige Na-Atome zu erhalten (Sublimationsenergie) und um die Chlormoleküle zu spalten (Dissoziationsenergie). Die Na-Atome geben unter Zufuhr von Energie (Ionisierungsenergie) je ein Atom an die Chloratome ab, die das Elektron unter Energieabgabe aufnehmen (Elektronenaffinität). Es entstehen also Natrium- und Chlorid-Ionen. Bildet sich schließlich aus den entstandenen Ionen ein festes Ionengitter wird Energie (Gitterenergie) frei, dessen Wert höher ist als die Summe der vorher zugeführten Energiebeträge.
Natrium und Chlor reagieren unter Wärme- und Lichtentwicklung zu Natriumchlorid. Es wird also ein großer Energiebetrag dabei frei.
0 G NaCl Cl
2 / 1
Na
(s)
2(g)
(s)
Dies deutet darauf hin, dass die entstehende Verbindung sehr energiearm und daher sehr stabil ist. Wie in der Versuchsbeschreibung zu sehen, muss jedoch zunächst Energie aufgebracht werden, um die Reaktion zu starten.
Abb. 1: Reaktion von Natrium und Chlor (Aufbau entspricht nicht dem im Versuch) (aus:
www.theochem.uni-duisburg.de)
Der reale Vorgang der Bildung eines Ionenkristalls aus den Elementen stimmt in seiner zeitlichen Abfolge nicht mit den hier beschriebenen Schritten überein. Bei energetischen Betrachtungen ist aber der Weg, auf dem man vom Ausgangs- zum Endzustand gelangt, ohne Bedeutung.
Die Energiebeträge sind folgendem Schema zu entnehmen:
Abb. 2: Born-Haber-Kreisprozess für Natriumchlorid
Die freiwerdende Gitterenergie ist für die Wärme- und Lichtentwicklung bei der NaCl- Synthese verantwortlich. Sie führt zur Bildung eines energiearmen und damit stabilen Ionenkristalls. Die Triebkraft für die Reaktion ist die Bildung stabiler Ionenkristalle und nicht die Tendenz zur Erreichung der Edelgaskonfiguration. Der Kristall wird durch starke elektrostatische Kräfte (Coulombkraft) zusammen gehalten. Zum Auflösen der Kristallstruktur sind hohe Energiebeträge nötig. Der Schmelzpunkt des Natriumchlorids beträgt ca. 800°C.
Als Beweis, dass sich tatsächlich Ionen gebildet haben, wurde Chlorid nachgewiesen. Dieses fällt in salpetersaurer Lösung mit Silbernitrat zum schwerlöslichen Silberchlorid aus, das als weißer Niederschlag sichtbar ist:
121 kJ/mol
- 411 kJ/mol
Standardbildungsenthalpie Gitterenergie -787 kJ/mol
108 kJ/mol Sublimations-
enthalpie Ionisierungs- energie
496 kJ/mol
Elektronen- affinität
-349 kJ/mol
Halbe
Dissoziations- enthalpie
Na
+(g)+ Cl
-(g)Na
(g)+ Cl
(g)Na
(s)+ ½ Cl
2(g)
NaCl
(s)) s ) (
aq ( ) aq
(
Cl AgCl
Ag
3. Chemie und Struktur des Natriumchlorids
Die Anionen bilden eine dichtgepacktes kubisch-flächenzentriertes Gitter, die Kationen füllen dabei die Oktaederlücken auf. Umgekehrt bilden auch die Natrium- Kationen ein kubisch-flächenzentriertes Gitter, dessen Oktaederlücken durch Chlorid-Anionen aufgefüllt werden.
.
Wie oben beschrieben sind zum Aufbrechen der Kristallstruktur hohe Energiemengen nötig. Im täglichen Leben hat aber jeder die Erfahrung gemacht, dass die Salzkristalle leicht zerstörbar sind, indem man sie in Wasser gibt - sie lösen sich auf. Warum ist dies auch ohne Energiezufuhr von außen möglich?
Natriumchlorid bildet ein Ionengitter, dessen Plätze von den negativ geladenen Chlorid- und den positiv geladenen Natrium-Ionen eingenommen werden. Jedes Chlorid-Ion ist dabei oktaedrisch von sechs Natrium-Ionen
umgeben und umgekehrt. Die
Koordinationszahl beträgt für beide Ionenarten also sechs.
Abb. 3: Elementarzelle des Natriumchlorids (aus: www.theochem.uni-duisburg.de)
Abb. 4: Kubisch-
flächenzentriertes Gitter (aus: www.wikipedia.org)
Beim kubisch-flächenzentrierten Kristallgitter sind acht Atome (bzw. hier Ionen) so angeordnet, dass sie die Ecken eines Würfels bilden. Zusätzlich sind insgesamt sechs weitere Atome mittig auf den Würfelflächen so angeordnet, dass bei Verbindung dieser ein Oktaeder entsteht. Im Zentrum dieses Oktaeders befindet sich das Ion des Bindungspartners.
Die Chlorid-Ionen sind etwa doppelt so groß wie die Natrium-Ionen.
Chlorid-Ion Natrium-Ion
Abb. 5: Struktur des NaCl unter Berücksichtigung der
Ionenradien (aus: www.quarks.de)
Gibt man Kochsalz in Wasser, lösen sich die Kristalle auf, sie dissoziieren zu Ionen:
) aq ( ) aq O (
) H s
(
Na Cl
Cl
Na
2
Anmerkung: Die Abbildung entspricht nicht ganz den wirklichen Verhältnissen in der Lösung, obschon dies in den Lehrbüchern meist so dargestellt wird. Die Natrium- Ionen sind oktaedrisch von sechs Wassermolekülen umgeben, wobei sich kovalente Bindungen mit ionischem Anteil ausbilden, während die Wassermoleküle um die Chlorid-Ionen durch Wasserstoffbrücken angelagert sind.
Der Lösevorgang ist auch umkehrbar, das heißt, dass aus einer Salzlösung durch Wasserentzug (Verdunstung) wieder Kristalle entstehen können:
Demonstration 1: Kristallbildung aus einer gesättigten Kochsalzlösung
Geräte: 250 ml-Becherglas, Glasstab, Faden oder Kordel Chemikalien: gesättigte Natriumchloridlösung
Durchführung: In das zur Hälfte mit NaCl-Lösung gefüllte Becherglas lässt man einen Faden, der am Glasstab befestigt ist, reinhängen. Nach einigen Tagen beginnen am Faden außerhalb der Lösung NaCl-Kristalle zu wachsen.
Auswertung: Die Kochsalzlösung wird von dem Faden wie von einem Docht aufgesogen. Das Wasser verdunstet, die Lösung wird übersättigt und Kristallbildung tritt ein.
Abb. 6: Lösevorgang eines Ionengitters (aus: www.chempage.de)
Beim Lösevorgang lagern sich Wassermoleküle mit
den entgegengesetzt geladenen Enden des
Wasserdipols um die Ionen an, die Ionen werden
hydratisiert. Dabei wird Hydratationsenthalpie frei,
die die Energie zum Aufbrechen der Ionenbindung
liefert.
Ob eine Kochsalzlösung den elektrischen Strom leitet, soll im nächsten Versuch geklärt werden.
Versuch 2: Leitfähigkeit einer Natriumchloridlösung
Geräte: Wechselstromquelle, Steckkabel, Amperemeter, 2 Graphitelektroden mit Klemmen, kleines Becherglas, Glasstab, Hebebühne, Stativmaterial
Chemikalien: entionisiertes Wasser, Natriumchlorid NaCl
Durchführung: Man füllt das Becherglas mit ca. 50 ml entionisiertem Wasser und befestigt die Elektroden so am Stativ, dass sie in das Wasser ragen. Dann legt man eine Wechselspannung von etwa 5 V an. Das Amperemeter (Messbereich 3 A) schlägt nicht aus, das heißt, dass keine elektrische Leitfähigkeit messbar ist. Man schaltet die Stromquelle ab und gibt einen großen Spatel NaCl in das Wasser und rührt bis es sich löst. Wieder legt man eine Spannung an. Diesmal zeigt das Amperemeter eine Stromstärke von etwa 2 A an, die Natriumchloridlösung leitet also den elektrischen Strom.
Auswertung: Im entionisierten Wasser liegen durch die geringe Eigendissoziation des Wassers nur wenige H
3O
+- und OH
--Ionen vor. Deshalb leitet entionisiertes Wasser den elektrischen Strom kaum (die geringe Leitfähigkeit ist mit den hier verwendeten Geräten nicht messbar, weshalb es zu keinem Ausschlag kommt).
In der Natriumchloridlösung liegen die Ionen hydratisiert vor und können als bewegliche Ladungsträger fungieren. Legt man eine Spannung an, wandern die Ionen (von griech. ion: der Wanderer) zu den Elektroden: die Kationen zur Kathode, die Anionen die Anode. Dort nehmen sie ein Elektron auf bzw. geben eines ab. Auf diese Weise leiten sie Elektronen durch die Lösung von einer Elektrode zur anderen und halten so den Stromfluss aufrecht. Die Kochsalzlösung leitet also den elektrischen Strom.
Auch eine NaCl-Schmelze leitet den elektrischen Strom, da in der Schmelze das Ionengitter zerstört ist und die Ionen frei beweglich vorliegen.
4. Bedeutung des Kochsalzes im Laufe der Geschichte
4.1 Vorindustrielle Zeit
In vorindustrieller Zeit wurde das Kochsalz zum Würzen von Speisen und – noch wichtiger – zum Konservieren von Lebensmitteln wie Fleisch, Fisch und Gemüse verwendet: „Bey dem Einsalzen bestreut man den einzusalzenden Körper mit Salz, welches sich dann in den wässrigen Theilen desselben auflöst und ihn durchdringt, oder man legt ihn in Salzlösung, von der er auf ähnliche Art durchdrungen wird, und dann weit weniger freywilliger Zersetzung unterworfen ist.“, schrieb J.C. Leuchs in
„Die Lehre der Aufbewahrung und Erhaltung aller Körper“ aus dem Jahr 1820. Aber natürlich war dieser Effekt auch schon sehr viel früher bekannt. Die Konservierung besteht in erster Linie darin, dass durch das Salz bzw. durch eine konzentrierte Salzlösung das Wasser aus den Bakterienzellen, die die Lebensmittel angreifen und zu ihrem Verderb führen können, heraustritt und diese dadurch absterben. Dies lässt sich anhand eines einfachen Modellversuchs zeigen:
Demonstration 2: Osmotische Aktivität einer Kochsalzlösung
Geräte: Becherglas, Schweinedarm, Bindfaden
Chemikalien: Leitungswasser, gesättigte Natriumchloridlösung
Durchführung: Ein Stück Schweinedarm wird mit Leitungswasser gefüllt und an beiden Enden mit Bindfaden fest zugebunden. Dann legt man ihn in die Kochsalzlösung. Man sieht, dass das Wasser aus dem Darm in die Salzlösung fließt (Schlierenbildung). Nach einiger Zeit (1-2 Stunden) ist das Wasser aus dem Darm weitgehend heraus diffundiert.
Auswertung: Das Wasser strömt zu der Lösung mit der höheren Salzkonzentration, die „Bakterienzelle“ verliert Wasser. Dieses Phänomen bezeichnet man als Osmose.
Sie ist definiert als einseitig gerichtete Diffusion eines Lösungsmittels durch eine selektiv permeable Membran (für Wasser durchlässig, für Salz-Ionen undurchlässig).
Dabei wird immer ein Konzentrationsausgleich angestrebt.
Dies geschieht so lange bis sich die Konzentrationen angeglichen haben. Dieser Prozess läuft freiwillig ab, man bezeichnet ihn als passiven Transport. Die Triebkraft der Diffusion ist die Zunahme der Entropie. Die Steighöhe in den beiden Schenkeln des U-Rohres unterscheidet sich. Durch die Gewichtskraft baut sich bei zunehmender Höhendifferenz ein hydrostatischer Druck auf, der schließlich ein weiteres Eindiffundieren von Lösungsmittel verhindert. Diese Druckdifferenz bezeichnet man als osmotischen Druck.
4.2 Beginn der Industrialisierung
Mit Beginn der Industrialisierung war das Salz als Konservierungsmittel immer noch sehr wichtig, aber es kam eine neue, für die sich entwickelnde chemische Industrie viel bedeutendere Verwendung hinzu: Die Synthese von Soda (Natriumcarbonat) aus Kochsalz. Die Soda wurde in großen Mengen zur Herstellung von Seife und Glas benötigt und hatte deshalb eine Schlüsselfunktion in der damaligen Zeit inne. So stellte Justus von Liebig um 1850 fest: „Die Fabrikation der Soda aus gewöhnlichem Kochsalz kann als Grundlage des außerordentlichen Aufschwunges betrachtet werden, welche die moderne Industrie nach allen Richtungen genommen hat.“ Die historische Synthese der Soda aus Kochsalz erfolgte über ein Zwischenprodukt, das Natriumsulfat: Natriumchlorid Natriumsulfat Natriumcarbonat .
Versuch 3: Darstellung von Natriumsulfat
Geräte: Reagenzglas, Reagenzglashalter, Pipette, pH-Papier
Abb. 7: Osmose
(aus:www.ustboniface.mb.ca, verändert)
Im U-Rohr befindet sich links von der Membran eine schwach konzentrierte Lösung, rechts davon eine stark konzentrierte Lösung. Ein Angleichen der Konzentrationen ist nur möglich, indem das Lösungsmittel in die konzentrierte Lösung diffundiert.
Dadurch nimmt das Volumen der zuvor stärker
konzentrierten Lösung zu, das der zuvor schwächer
konzentrierten Lösung ab.
Chemikalien: Natriumchlorid NaCl, Schwefelsäure H
2SO
4(konz.)Durchführung: Man gibt etwas Natriumchlorid in das Reagenzglas und gibt einige Tropfen konz. Schwefelsäure dazu. Es setzt eine heftige Gasentwicklung ein. Hält man ein angefeuchtetes pH-Papier über die Reagenzglasöffnung, färbt es sich rot.
Auswertung: Beim dem entstandenen Gas handelt es sich um HCl-Gas, das mit Wasser sauer reagiert. Die Reaktion verläuft nach der folgenden Gleichung:
) g ( ) solv ( 4 2 )
l ( 4 2 ) s
(
H SO Na SO HCl
NaCl
2
Das hier entstandene Natriumsulfat lässt sich im Rahmen des Vortrages nicht nachweisen. Durch das HCl-Gas lässt sich aber darauf schließen, dass die Reaktion so abgelaufen ist.
Das Verfahren zur Herstellung von Natriumsulfat wurde von Johann Rudolf Glauber (1604-1670) entwickelt.
In der historischen Synthese wurde das gewonnene Natriumsulfat mithilfe des Leblanc-Verfahren (1790 von Nicolas Leblanc entwickelt) zum Natriumcarbonat, der Soda:
) g ( 2 ) s ) (
s 3( 2 )
s ( ) s ( 3 )
s ( 4
2
SO CaCO 2 C Na CO CaS CO
Na
Problematisch waren bei diesem Verfahren der hohe Energieverbrauch und das Auftreten von Calciumsulfid, das deponiert wurde und dann bei Wasserzufuhr das giftige H
2S entwickelte. Das Leblanc-Verfahren wird deshalb heute nicht mehr angewandt.
4.3 Aktuelle Bedeutung
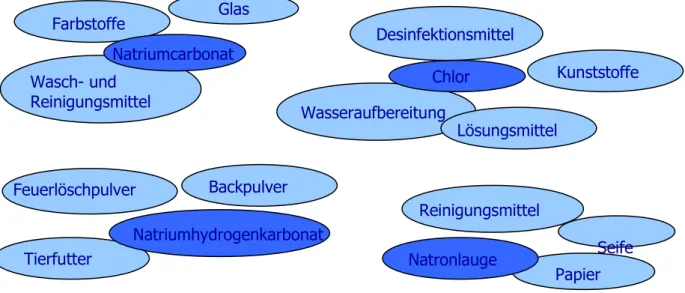
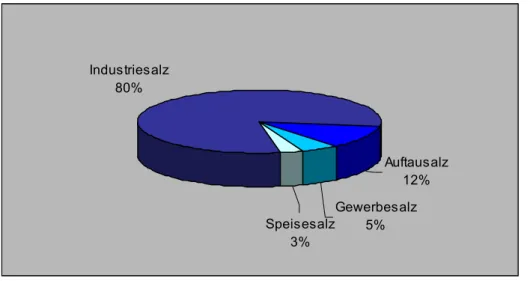
Auch heute hat das Kochsalz, neben seiner Verwendung als Speisesalz, viele
Einsatzmöglichkeiten: in der Medizin (Herstellung physiologischer Kochsalzlösung),
als Streusalz und zur Wasserenthärtung (Ionenaustauscherregenerierung, z.B. in
Spülmaschinen). In der chemischen Industrie wird es bei der Darstellung von
Natriumcarbonat (Soda) und Natriumhydrogencarbonat und von Chlor und
Natronlauge benötigt, die jeweils wichtige Ausgangsstoffe für weitere Produkte sind:
Abb. 8: Verwendungsmöglichkeiten von Natriumcarbonat, Natriumhydrogencarbonat, Chlor und Natronlauge
Zur Darstellung von Natriumcarbonat wird heute das Solvay-Verfahren angewendet, bei dem Ammoniak und Kohlendioxid in eine Kochsalzlösung geleitet werden. Das relativ schwerlösliche Natriumhydrogencarbonat fällt dabei aus. NaHCO
3wird bei 200°C erhitzt, wobei Natriumcarbonat entsteht. Das Kohlendioxid wird wieder dem Prozess zugeführt.
) g ( 2 ) g ( 2 ) s ( 3 2 )
s ( 3
) aq ( ) 4
aq 3( )
g ( 2 ) g ( 3 2
) aq (
CO O
H CO Na NaHCO
2
Cl NH NaHCO
CO NH
O H NaCl
Die beiden anderen Produkte, Chlor und Natronlauge, werden beide bei der Elektrolyse von wässriger NaCl-Lösung gewonnen. Die Gesamtgleichung lautet:
mol / kJ 224 H
Cl H
NaOH 2
O H 2 NaCl
2
(aq)
2
(aq)
2(g)
2(g)
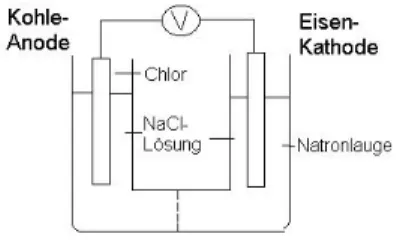
Versuch 4: Darstellung von Chlor und Natronlauge durch Elektrolyse einer Natriumchloridlösung
Natronlauge Seife
Reinigungsmittel
Papier Chlor Kunststoffe Wasseraufbereitung
Lösungsmittel Desinfektionsmittel
Natriumhydrogenkarbonat Feuerlöschpulver
Tierfutter
Backpulver Natriumcarbonat
Farbstoffe
Wasch- und Reinigungsmittel
Glas
Geräte: U-Rohr aus Glas, Eisenelektrode, Graphitelektrode, Krokodilklemmen, Steckkabel, Gleichstromquelle, Pinzette, Stativmaterial, Kaliumiodid-Stärke-Papier Chemikalien: gesättigte Natriumchloridlösung NaCl
(aq), Phenolphthaleinlösung
Durchführung: Das U-Rohr wird mit der gesättigten NaCl-Lösung, der man etwas Phenolphthaleinlösung als Indikator zugibt, gefüllt. In die eine Öffnung des U-Rohrs ragt die Eisen-, in die andere Öffnung die Graphitelektrode. Dann legt man eine Spannung von 5 Volt an. Bald setzt an beiden Elektroden eine Gasentwicklung ein.
Die Lösung im Kathodenraum (Eisenelektrode) färbt sich rot. Das Gas, das an der Graphitelektrode aufsteigt, färbt ein angefeuchtetes Kaliumiodid-Stärke-Papier blau.
Auswertung:
Abb. 9: Elektrolyse von Natriumchloridlösung
Die Eisenelektrode ist die Kathode. An ihr wird Wasserstoff abgeschieden. Dieser bildet sich durch Reduktion aus H
3O
+-Ionen:
O H 2 H e
2 O
H
2
3 (aq)
2(g)
2Die H
3O
+-Ionen stammen aus der Eigendissoziation des Wassers:
) aq ( )
aq 3 (
2
O H O OH
H
2
Dadurch, dass die H
3O
+-Ionen dem Gleichgewicht entzogen werden, verschiebt sich das Gleichgewicht nach rechts, die Konzentration der OH
-- Ionen nimmt zu, es bildet sich Natronlauge (Natriumionen sind bereits in der NaCl-Lösung enthalten). Die Natronlauge (bzw. die basische Reaktion) wird mit Phenolphthalein nachgewiesen.
Es kommt zu einer Rotfärbung.
An der Graphitelektrode, der Anode, werden Chlorid-Ionen zu Chlor oxidiert, das als Gas entweicht.
Cl 2 e
Cl
2 ( aq ) 2 ( g )
Der Nachweis von Chlor wird mit Kaliumiodid-Stärke-Papier durchgeführt. Chlor oxidiert das Iodid zu Iod. Dieses bildet mit der Stärke eine blaue Einschlussverbindung.
Warum scheidet sich an der Kathode kein Natrium ab, sondern Wasserstoff? Dies ist auf die hohe Abscheidungsspannung für Natrium an einer Eisenelektrode zurückzuführen. Wasserstoff hat eine wesentlich niedrigere Abscheidungsspannung und wird deshalb gebildet.
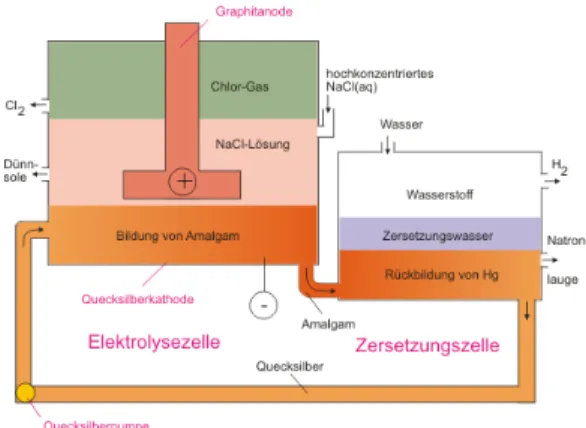
In der Technik werden drei Verfahren zur Darstellung von Chlor und Natronlauge durch Elektrolyse angewandt: Amalgam, Diaphragma- und Membranverfahren.
Beim Amalgamverfahren wird anstelle einer Eisenelektrode eine Quecksilberelektrode verwendet, an der sich bei der Elektrolyse Natrium abscheidet.
Im Gegensatz zur Eisenelektrode bildet sich hier an der Kathode also Natrium und kein Wasserstoff. Die Abscheidungsspannung für Natrium ist hier geringer als für Wasserstoff. Das Natrium löst sich im Quecksilber und bildet ein Amalgam.
Abb. 10: Amalgamverfahren
Das Diaphragmaverfahren ähnelt dem Aufbau im obigen Versuch, die Elektrodenräume sind durch eine ionendurchlässige Membran aus Keramik oder Asbest getrennt. Der Nachteil dieses Verfahren ist, dass eine nur 5%ige Natronlauge erhalten wird, die mit NaCl verunreinigt ist.
Eine reine, wenn auch nicht sehr hochprozentige Natronlauge erhält man durch das Membranverfahren, bei dem eine kationendurchlässige Membran verwendet wird. In Das Amalgam wird in hochreines Wasser geleitet, wo das Natrium mit dem Wasser reagiert und Natronlauge bildet:
) g ( 2 ) aq ( 2
) s
(