Magnetische Flüssigkeiten - Herstellung und Untersuchung von Ferrofluiden
ZfP-Sonderpreis der DGZfP beim Regionalwettbewerb Jugend forscht
I MMENSTAAD
Manfred Günther Schäfer
Schule:
Claude-Dornier-Schule Steinbeisstraße 26 88046 Friedrichshafen
Jugend forscht
Magnetische Flüssigkeiten
Herstellung und Untersuchung von Ferrofluiden
Manfred Günther Schäfer 20. Februar 2010
Claude-Dornier-Schule Friedrichshafen
Inhaltsverzeichnis
1 Kurzfassung 3
2 Einleitung 4
3 Magnetische Flüssigkeiten 5
3.1 Was sind magnetische Flüssigkeiten? . . . 5
3.2 Wozu können sie verwendet werden? . . . 6
4 Herstellung durch den Sol-Gel-Prozess 7 4.1 Erster Ansatz . . . 8
4.2 Zweiter Ansatz . . . 8
4.3 Dritter Ansatz . . . 10
4.4 Vierter Ansatz . . . 11
5 Untersuchung 12 5.1 Hysteresemessung . . . 12
5.1.1 Versuchsbeschreibung und Versuchsaufbau . . . 12
5.1.2 Versuchsablauf . . . 13
6 Fazit und Diskussion 14 6.1 Herstellung . . . 14
6.2 Untersuchung . . . 14
6.3 Ausblick . . . 14
7 Danksagungen 15
8 Anhang 16
Literaturverzeichnis 21
1 Kurzfassung
Flüssigkeiten, die von einem Magneten beeinflusst und dabei z.B zu einem Igel geformt werden, sind faszinierend. Bei diesen so genannten Ferrofluiden handelt es sich um eine Trägerflüssigkeit, die spezielle beschichtete magnetische Nanopartikel enthält. Diese be- sonderen Flüssigkeiten können mit dieser Eigenschaft recht vielseitig eingesetzt werden:
Es gibt Verwendungsmöglichkeiten von der Unterhaltungselektronik (Lautsprecher) bis zur Medizin (Krebstherapie).
So kam ich zu der Fragestellung zu diesem Projekt: Kann ich im Schul-Labor eine ferromagnetische Flüssigkeit herstellen sowie deren Eigenschaften untersuchen?
In diesem Projekt stellte ich in unterschiedlichen Ansätzen durch die Fällung von Ei- sensalzen magnetische Nanopartikel her, deren Oberfläche ich in weiteren Schritten be- schichtete und in einem geeigneten Lösemittel löste. Dabei optimierte ich diesen Vorgang.
Von den hergestellten Ferrofluiden sowie von magnetisch hartem und weichen Eisen untersuchte ich die Magnetisierungskurven (Hysterese). Die Magnetisierungskurve des Ferrofluids war mit normaler Wechselspannung nicht messbar, weshalb hier noch eine Messung mit hochfrequenten magnetischen Feldern aussteht.
2 Einleitung
Den ersten Kontakt mit dem Fachgebiet Nanotechnologie hatte ich bei der Präsentati- on des Wahlfaches Sondergebiete der Technik (Mikrosystemtechnik/Nanotechnologie) für die 12. Jahrgangsstufe. Diese Präsentation faszinierte mich so, dass ich dieses Fach wählte.
Während des Unterrichts zeigte sich, dass ich mich besonders für den Nano-Bereich interessierte. Da die Nanotechnologie ein Fachgebiet mit Zukunft ist, begann ich mich in meiner Freizeit über dieses Thema zu informieren. Dabei stieß ich des Öfteren auf Ferrofluide. Es faszinierte mich sehr, dass es möglich ist, Flüssigkeiten herzustellen, die von einem Magneten angezogen werden. Weitere Informationen zu diesem Thema er- hielt ich, als der NanoTruck an meiner Schule zu Gast war. Dort sah ich auch zum ersten Mal ein Ferrofluid, eine Flüssigkeit, die von einem Magneten zu einem Igel geformt wurde.
So stellte ich mir die Frage: Kann ich hier, im Schullabor, ein Ferrofluid herstellen?
Und wie groß ist der Aufwand?
Daraus ergab sich dieses Jugend-forscht-Projekt, in dem ich zuerst Ferrofluide herge- stellt habe, um diese später zu untersuchen.
Da ich in der 12. Jahrgangsstufe das Fach Chemie als Naturwissenschaft gewählt habe und deswegen leider Physik nicht mehr habe liegt der Schwerpunkt dieser Arbeit bei der Herstellung der Ferrofluide sowie bei der Optimierung dieses Vorgangs. Da es bei der Herstellung des ersten Präparats Verzögerungen gab, konnte ich nur ein Experiment mit dem Ferrofluid durchführen.
3 Magnetische Flüssigkeiten
3.1 Was sind magnetische Flüssigkeiten?
Magnetische Flüssigkeiten (Ferrofluide) sind flüssige Substanzen, die auf magnetische Felder reagieren. Sie bestehen aus einer Trägerflüssigkeit, z.B. Wasser oder Öl, die ma- gnetische Nanopartikel (Magnetit F e3O4)enthalten. Diese Partikel haben einen Durch- messer von etwa 10 nm. Aufgrund dieser kleinen Größe besitzt jeder Partikel nur eine einzige magnetische Domäne (Weiss’schen Bezirk), die unabhängig von anderen den Par- tikeln ist. Das Magnetit (ein Kristall) mit der SummenformelF e3O4 besitzt zudem eine besondere Spinellstruktur. In einer Kugelpackung der Sauerstoffionen sind an bestimm- ten Positionen im Kristallgitter (in den Oktaeder- und Tetraederlücken der Sauerstoff- Kugelpackung) dieF e2+ und F e3+-Ionen eingelagert (siehe Abbildung 3.1).
Abbildung 3.1: Struktur eines Magnetit-Kristalls (Sauerstoff in grau, F e2+ in grün und F e3+ in blau) mit markiertemF e2+-Ion in der Lücke des grauen Tetra- eder und und markiertem F e3+-Ion in der Lücke des blauen Oktaeder (Bild aus [Sch06])
Damit die Nanopartikel nicht in der Trägerflüssigkeit verklumpen und aus ihr ausfallen, sind sie mit einer Schutzschicht überzogen, die aber keinen Einfluss auf die magnetischen Eigenschaften des Magnetit hat.
Diese Flüssigkeiten reagieren sehr schnell auf angelegte Felder, da die einzelnen magne- tischen Momente sich sehr schnell an die Felder anpassen können. Aufgrund dieser vielen, sich schnell anpassenden magnetischen Momente kann ein Ferrofluid nicht magnetisiert werden.
3.2 Wozu können sie verwendet werden?
Ferrofluide können sehr vielseitig eingesetzt werden, z.B. als reibungsarme Dichtungen für Wellen, zur Dosierung der Tinte in Tintenstrahldruckern, zur Wärmeableitung in Lautsprechern und in der Medizin. Das Beispiel der Medizin möchte ich hier etwas näher erläutern. Bei der Chemotherapie gegen Krebs wird dem Patienten ein Medikament ge- spritzt, das den Krebszellen schadet, aber auch dem restlichen Körper. Nun muss versucht werden, das Medikament nur in die Zellen kommen zu lassen, die vom Krebs befallen sind.
Das ist üblicherweise kaum möglich. Hängt man aber das Medikament an die Nanopar- tikel eines Ferrofluids, spritzt es nun in eine zum Krebs führende Blutbahn und legt an der infizierten Stellen ein Magnetfeld an, so wird das Medikament nur in der Nähe des Magnetfeldes wirken. Somit wird der restliche Körper geschont und der Krebs kann kon- zentrierter bekämpft werden. Das übrige Ferrofluid kann im Körper wie Eisen abgebaut werden.
In eine andere Variante der Krebstherapie wird das Ferrofluid so modifiziert, dass es in die Krebszelle eingeschleust werden kann und durch Magnetfelder von außen so angeregt wird, dass die Krebszellen durch die so erzeugte Wärme absterben. Außerdem werden zur Krebs-Erkennung Ferrofluide als Kontrastmittel verwendet.
4 Herstellung durch den Sol-Gel-Prozess
Zur Herstellung eines Ferrofluids nach der Beschreibung der NanoBoX [Nan08] müssen vereinfacht gesagt folgende drei Schritte durchgeführt werden:
• Fällung:Herstellung von magnetischen Nanopartikeln
• Sol-Gel-Prozess: Wandlung des Nanopartikel-Sols zum Gel (Beschichtung der Oberfläche der Nanopartikel)
Sol:
Sole sind kolloidale Lösungen in der Partikel oder Makromoleküle fein verteilt sind.
Die Wechselwirkungen zwischen den einzelnen Teilchen sind sehr gering. Diese Lö- sungen müssen deshalb stabilisiert werden, da die Teilchen sonst verklumpen.
Gel:
Gele kommen in der Natur vor, können aber auch künstlich hergestellt werden.
Kennzeichnend ist, dass sie eine geringe mechanische Stabilität besitzen und aus mindestens zwei Phasen bestehen, von denen die eine fest und die andere flüssig oder gasförmig ist.
• Dispergierung:Auflösen des Nanopartikel-Gels in einem geeigneten Lösungsmit- tel
Zur Herstellung der Nanopartikel werden zwei Eisensalzlösungen, in denen das Ei- sen als F e(II) bzw. F e(III) vorliegt, gemischt und über ein geeignetes Fällungsmittel gefällt. Dabei fällt Eisenoxid in Form von Magnetit-Nanopartikel (F e3O4) aus (siehe Reaktionsgleichung 4.1).
8N aOH + 2F eCl3 + F eCl2 → F e3O4↓ + 8N aCl + 4H2O (4.1) Nun müssen die Nebenprodukte (N aCl und H2O) entfernt werden, damit die Na- nopartikel weiter reagieren können. Dazu werden die Nano-Partikel mehrfach mit voll entsalztem Wasser versetzt, die Nano-Partikel zum Sedimentieren gebracht und das über- stehende Wasser abdekandiert. Die nun gereinigten Magentit-Nanopartikel sind das Sol.
Im nächsten Schritt muss das Sol (gereinigte Nanopartikel) so behandelt werden, dass das Magnetit aus dem Lösemittel, in dem es später gelöst werden soll, nicht ausfällt.
Dazu wird die Oberfläche der Nanopartikel mit einem im späteren Lösemittel löslichen Stoff beschichtet. Dabei entsteht das so genannte Gel.
Nun wird das Gel getrocknet. Das getrocknete Gel wird in einem Lösemittel dispergiert.
Die nun vorliegende magnetische Flüssigkeit ist das Ferrofluid.
4.1 Erster Ansatz
Beim ersten Ansatz wollte ich das Ferrofluid so herstellen, wie es in der Versuchsanlei- tung der NanoBoX beschrieben wird. Jedoch färbte sich beim Fällen der beiden Eisen- salzlösungen über Natronlauge der Inhalt des Becherglases anders als in der Anleitung beschrieben nicht schwarz, sondern rostbraun und es fielen keine magnetischen Partikel aus. Dadurch war dieser Ansatz gescheitert.
Der Grund hierfür liegt vermutlich im Alter des verwendetenF eCl2·4H2O. Das Eisen, das in diesem Salz als F e(II) vorliegt, ist wahrscheinlich im Laufe der Zeit zuF e(III) oxidiert. Dadurch ist dieses Salz zur Herstellung eines Ferrofluids ungeeignet.
Somit war klar, dass für die nächsten Ansätze entweder das SalzF eCl2 durch reineres oder es durch ein vergleichbares Salz (dasF e(II) enthält) ersetzt werden muss.
4.2 Zweiter Ansatz
Im zweiten Ansatz ersetze ich dasF eCl2 durch F eSO4. Somit ergibt sich folgende Fäl- lungreaktion:
8N aOH + 2F eCl3 + F eSO4 → F e3O4 ↓ + 6N aCl + N a2SO4 + 4H2O (4.2) Mit dieser Veränderung der Rezeptur verlief die Fällung erfolgreich und die Suspension färbte sich tief schwarz. Die nun sedimentierenden Partikel konnten von einem Magneten angezogen werden, was zeigt, dass die Fällung erfolgreich war (siehe Abbildung 4.1).
Zum Reinigen wandte ich die Vakuum-Filtration an. Dazu nutzte ich eine Nutsche mit einem Blaubandfilter, die sich auf einer Saugflasche befand. Das Vakuum wurde von einer Wasserstrahlpumpe erzeugt (Versuchsaufbau siehe Abbildung 4.2).
Nun wurde die gesamte Suspension mit den Nanopartikeln langsam in die Nutsche gegeben. Das Magnetit blieb in der Nutsche zurück, während die Nebenprodukte in die Saugflasche kamen. Um den pH-Wert der Nano-Partikel, der noch stark alkalisch war, zu neutralisieren, wurden die Nano-Partikel mehrfach durch Zugabe von VE-Wasser ge- waschen. Nach der ersten Waschung lag der pH-Wert des Filtrat noch bei ca. 11 – 12.
Außerdem wurden im Filtrat nochSO4−−- undCl−-Ionen nachgewiesen. Nach sechs Wa- schungen war der pH-Wert des Filtrat unter 10 gesunken und es wurden keine SO−−4 - undCl−-Ionen mehr nachgewiesen.
Die Nano-Partikel wurden vom Filterpapier abgeschabt und in einem Becherglas mit VE-Wasser suspendiert. Diese Suspension wurde über Nacht stehen gelassen. Am nächs- ten Tag wurde das Wasser abdekandiert und der pH-Wert von diesem gemessen (pH-Wert
Abbildung 4.1: Die gefällten Nanopartikel sind bereits magnetisch. Zum Testen wird ein Magnet von außen an das Becherglas gehalten, zu dem sich die Nanopar- tikel bewegen.
Abbildung 4.2: Versuchsaufbau zur Vakuumfiltration
war neutral).
Zu den Nano-Partikeln wurde nochmals VE-Wasser gegeben und die Suspension (Sol) unter Rühren auf ca. 80◦C erhitzt. Bei dieser Temperatur wurde Ölsäure hinzugegeben und ca. 15 Minuten gerührt. Nach wenigen Minuten bildet sich am Boden des Becher- glases eine schwarze Paste. Das nun klare überstehende Wasser wurde abgeschüttet. Nun wurde nochmals Wasser hinzugegeben und einige Minuten gerührt. Das Wasser wurde abgeschüttet und die schwarze Paste (Gel) aus dem Becherglas gekratzt und in eine klei- ne Glasschale gegeben. Das Gel wurde im Trockenschrank bei etwa 50◦C ca. eine Stunde getrocknet und danach zur weiteren Trocknung in einen Exsiccator über Kieselgel im Vakuum gelagert.
Zur Dispergierung gab ich das Gel mit Octan, dem Lösemittel, in einen Erlenmeyer- kolben mit Normschliff und verschloss diesen mit einem Stopfen. Der Kolben wurde nun so lange geschüttelt, bis sich das Gel gleichmäßig im Octan verteilt hat. Nun war das Ferrofluid fertig.
Die Flüssigkeit reagierte deutlich auf Magnete, jedoch konnte kein Rosensweig-Effekt festgestellt werden. Ich vermutete, dass es daran lag, dass ich keinen Magneten hatte, der stark genug war. Aber auch nach dem Kauf stärkerer Magnete konnte ich keinen Rosensweig-Effekt erzeugen, sondern das Ferrofluid bildete nur einen Hügel aus. Das führte mich zu der Vermutung, dass das Ferrofluid sich nicht richtig zusammensetze.
4.3 Dritter Ansatz
Im dritten Ansatz nutzte ich das im zweiten Ansatz entwickelte Verfahren bis zur Reini- gung, die ich diesmal wie folgt modifizierte.
Ich beschleunigte das Absinken der Nanoparikel dadurch, dass ich einen starken Magne- ten unter das Becherglas legte. Das hatte den Vorteil, dass die überstehende Flüssigkeit leichter abgegossen werden konnte, da die Nanopartikel vom Magneten unten am Be- cherglasboden gehalten wurden. Die folgenden Waschungen führte ich durch Zugabe von VE-Wasser und wieder Abgießen nach dem oben beschriebenen Verfahren durch.
Nach dem der pH-Wert der überstehenden Flüssigkeit den neutralen Bereich erreicht hatte, ging ich zur Oberflächenbehandlung über. Diese führte ich wie im zweiten Ansatz, durch Zugabe von Ölsäure bei 80◦C, durch. Das entstandene Gel wurde über Nacht im Exsiccator über Kieselgel im Vakuum getrocknet. Am nächsten Tag dispergierte ich mit dem im zweiten Ansatz beschriebenen Verfahren einen Teil des Gels in Petroleum, den anderen in Hexan.
Die nun entstandene Ferrofluide reagierten auf einen Magneten, bildete jedoch keinen für den Rosensweig-Effekt charakteristischen Igel aus.
4.4 Vierter Ansatz
Im nächsten Ansatz veränderte ich die Fällungsreaktion nochmals. Die Fällung sollte nun, wie ich in der Dokumentation des Regensburger Schülerpraktikums las [JCF08], über Amoniak statt Natronlauge durchgeführt werden. Dadurch ergab sich folgende Re- aktionsgleichung für die Fällung:
8N H3 + 4H2O + 2F eCl3 + F eSO4 → F e3O4↓ + 6N H4Cl + [N H4]2SO4 (4.3) Aufgrund der giftigen Gase des Ammoniaks führte ich die Fällung in einem Abzug durch. Nach dem Zusammenführen des Ammoniak-Wasser-Gemisch mit den Eisensalz- Lösungen rührte ich die Lösung noch ca. 15 Minuten. Dabei bildete sich an der Oberfläche ein Schaum.
Nach dem Rühren lies ich die Nanopartikel sedimentieren. Die überstehende Flüssig- keit (pH-Wert war alkalisch) und den Schaum saugte ich mit einer Wasserstrahlpumpe ab. Zur weiteren Waschung füllte ich mehrfach mit VE-Wasser auf, ließ die Nanopartikel sedimentieren und saugte die überstehende Flüssigkeit ab. Nach 3 Waschungen hatte der pH-Wert den neutralen Bereich erreicht. Ich füllte das Becherglas mit den Nanopartikeln mit VE-Wasser auf und ließ es über Nacht stehen. Am nächsten Tag führte ich die Ober- flächenbeschichtung wie im zweiten Ansatz beschrieben durch und trocknete das Gel im Exsiccator.
Das getrocknete Gel dispergierte ich nach bewährter Methode im Erlenmeyerkolben in Decan. Die nun entstandene Flüssigkeit war deutlich magnetisch, jedoch bildete sich ebenfalls kein Igel aus.
5 Untersuchung
5.1 Hysteresemessung
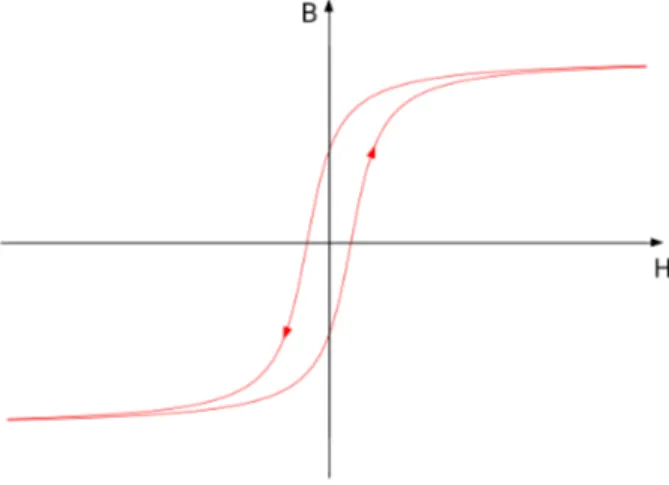
Die magnetische Flußdichte in einem ferromagnetischen Stoff wird von der Stärke des umgebenden Magnetfeldes bestimmt. Geht das äußere Magnetfeld zurück, so nimmt die Flußdichte ab. Die magnetische Flußdichte erreicht bei gleichem Betrag der Feldstärke, die abnimmt, einen höheren Wert als während der Zunahme. Ein Umkehren (negativer Wert) des magnetischen Feldes führt dazu, dass der obere Ast der Hysteresekurve (siehe Abbildung 5.1) durchlaufen wird. Dieser Hysteresevorgang lässt sich gut am Verlauf der Hysteresekurve verdeutlichen. Ein vollständiges Durchlaufen der Hysteresekurve wird als Hysteresezyklus bezeichnet.
Abbildung 5.1: Skizze einer Hysteresekurve (H ist die Feldstärke, B ist die Remanenz)
5.1.1 Versuchsbeschreibung und Versuchsaufbau
In diesem Experiment führte ich zunächst die Hysteresemessung von magnetisch hartem bzw. weichem Eisen durch, um mich mit der Materie auseinander zu setzen und um diese Messergebnisse dann mit denen des Ferrofluids zu vergleichen. Zu dieser Messung baute ich die in Abbildung 5.2 gezeigte Schaltung auf. Das angeschlossene Oszilloskop wurde auf x/y-Betrieb eingestellt und die zu untersuchende Probe in den beiden Spulen plat- ziert.
R
R
L1 L2 C
y
Masse
x U∼
Abbildung 5.2: Schaltung zur Hysteresemessung nach [Ric72]
5.1.2 Versuchsablauf
Für die ersten Messungen nutzte ich eine Stativstange bzw. einige Drähte für Magnet- versuche. Nach einigen Veränderungen der Einstellungen am Oszilloskop war eine Hys- teresekurve zu sehen (Abbildung 5.3).
Abbildung 5.3: Die mit einer Stativstange gemessene Hysteresekurve (die Schleifen an den Enden der Hysteresekurve werden laut [Ric72] durch Phasenverschie- bung im X-Verstärker des Oszilloskop erzeugt)
Um die Hysterese des Ferrofluids zu messen, füllte ich es in ein an einem Ende zu- geschmolzenen Glasrohr. Dieses Glasrohr nahm nun die Probe im oben beschriebenen Versuchsaufbau ein. Der Graph des Oszilloskop stellte das Gleiche dar wie wenn keine Probe in den Spulen sich befindet. Das bedeutet, dass sich das Ferrofluid sehr schnell an das umgebende Feld anpasst. Um hier die Hysterese zu messen, muss die Frequenz der anliegenden Spannung erhöht werden.
Aufgrund von Zeitmangel und durch Verzögerungen bei der Herstellung konnte ich bisher diese Messung mit der höheren Frequenz noch nicht durchführen.
6 Fazit und Diskussion
6.1 Herstellung
Grundsätzlich ist die Herstellung eines Ferrofluids einfach, sofern die verwendeten Che- mikalien nicht verunreinigt sind. Jedoch konnte ich bei keinem der Ferrofluid-Ansätze den Rosensweig-Effekt nachvollziehen. Das kann unterschiedliche Gründe haben: Eine Möglichkeit ist, dass die Zusammensetzung der Ferrofluide nicht richtig ist und somit die Oberflächenspannung der Trägerflüssigkeit nicht überwunden werden kann. Eine an- dere Möglichkeit ist, dass die verwendeten Magnete kein homogenes Magnetfeld besitzen.
Bei der Herstellung gibt es einzelne Punkte, die optimiert werden können. Zum Beispiel kann die Reinigung optimiert werden, in dem das Sedimentieren der Nanopartikel durch einen Magneten beschleunigt wird. Zudem wäre es sinnvoll, anstatt eines Magnetrührers ein Rührwerk (was ich leider nicht zur Verfügung stehen hatte) zu verwenden.
6.2 Untersuchung
Beim Ferrofluid konnte bei einer Frequenz von ca. 50 Hz keine Hysterese gemessen wer- den. Da das Ferrofluid aber magnetisch ist wird sie trotzdem existieren. Um sie zu messen, muss die angelegte Frequenz wohl sehr stark erhöht werden, da wie anfangs beschrieben die magnetischen Momente der Nanopartikel sich sehr schnell an einem angelegten Feld ausrichten können. Aufgrund dieser geringen Hysterese könnte eine weitere Verwendungs- möglichkeit des Ferrofluids in einem Transformator sein. Anstatt eines Metallkerns würde ein Ferrofluid eingesetzt, wodurch der Transformator noch effizienter funktionieren könn- te. Hierzu müsste aber auch geprüft werden, wie stark sich das Ferrofluid durch das sich ständig ändernde Magnetfeld erhitzt.
6.3 Ausblick
Aufgrund der Verzögerungen bei der Herstellung der Ferrofluide konnte die Messung mit den höher frequenten Magnetfeldern bisher nicht durch geführt werden. Diese Messung werde ich sobald wie möglich durchführen. Außerdem wäre eine Messung der Tempera- tur bei wechselnden Feldern eine interessante Möglichkeit dieses Projekt weiter zu führen.
Zudem möchte ich herausfinden, woran es liegt, dass ich den Rosensweig-Effekt nicht beobachten konnte. Falls es am Ferrofluid liegen sollte, ist die Frage zu beantworten, wie die Rezeptur verändert werden muss.
7 Danksagungen
Ich möchte mich an dieser Stelle besonders bei Herrn Dr. Beister, meinem Chemie- und ST-Lehrer, und der Claude-Dornier-Schule bedanken, ohne die ich dieses Projekt nicht hätte durch führen können. Außerdem danke ich meiner Familie für ihre Unterstützung.
8 Anhang
A Versuchsaufbau zur Hysteresemessung und Hysteresekurve des Stativstabs (magne- tisch hartes/weiches Eisen)
Abbildung 8.1: Versuchsaufbau der Schaltung zur Hysteresemessung
Abbildung 8.2: Foto der mit einer Stativstange gemessenen Hysteresekurve
B Versuchsanleitung der NanoBox (auf den nächsten drei Seiten)
NanoBoX Versuchsanleitung
________________________________________________________
V[1]: Herstellung magnetischer Flüssigkeiten (Ferrofluide) Benötigtes Material:
• FeCl3 · 6 H2O (270.3 g/mol)
• FeCl2 · 4 H2O (198.8 g/mol)
• NaOH (40 g/mol)
• VE-Wasser
• Ölsäure
• n-Decan
• Waage (Genauigkeit mindestens ± 0,01 g)
• 1 Trockenschrank
• Spatel; 1 Becherglas 50 ml
• 2 Bechergläser 50 ml
• 1 Becherglas 100 ml
• 1 Becherglas 400 ml
• 1 Heizplatte mit Magnetrührer
• 1 Magnetrührer
• 2 kleine Magnetrührfische (ca. 2 cm Länge)
• 1 Magnetrührfisch (ca. 5 cm Länge)
• 1 Thermometer
• pH-Papier
• Papierfilter (möglichst fein)
• Stabmagnet (Neodyn)
Bitte tragen Sie bei allen Arbeiten Kittel, Handschuhe und Schutzbrille!
Bitte entsorgen Sie das Ferrofluid als nicht halogenhaltigen organischen Abfall und
beachten Sie im Zweifelsfall die Vorschriften Ihres kommunalen Abfallentsorgers.
Durchführung:
1) Fällung
In das 100-ml-Becherglas werden 5,43 g FeCl3 · 6 H2O (orange) eingewogen und 30 ml VEWasser
zugegeben.
In das 50-ml-Becherglas werden 2,0 g FeCl2 · 4 H2O (hellgrün) eingewogen und 20 ml VEWasser
zugegeben.
Unter Rühren lösen sich nach ein paar Minuten die Salze. Danach werden die beiden klaren
Lösungen im-100 ml-Becherglas vereinigt und gut vermischt. Das 50-ml-Becherglas wird mit
wenig VE-Wasser nachgespült.
8 g NaOH werden in das 400-ml-Becherglas eingewogen und 200 ml VE-Wasser
zugegeben. Unter kräftigem Rühren (großer Magnetrührfisch) wird das NaOH aufgelöst.
(Vorsicht: die Lösung wird warm!)
2) Reinigung
Nach Ablauf der 15 Minuten wird das Becherglas von der Rührplatte genommen und der schwarze Niederschlag zum Sedimentieren gebracht:
Dazu wird die Suspension stehen gelassen, bis der Feststoff sich vollständig abgesetzt hat.
Die überstehende Flüssigkeit wird abdekantiert. Dieser Vorgang dauert etwa 30 Minuten.
Anschließend werden zu dem schwarzen Niederschlag 200 ml VE-Wasser gegeben, die Suspension aufgeschlämmt und kräftig gerührt. Die Abtrennvorgänge werden so oft wiederholt, bis der pH-Wert der überstehenden Flüssigkeit etwa 10 beträgt (die Zugabe von Wasser sollte mindestens viermal erfolgen).
3) Oberflächenbehandlung
Zu dem schwarzen, gewaschenen Niederschlag werden 200 ml VE-Wasser gegeben, die Suspension wird kräftig gerührt. Das Thermometer wird nun so befestigt, dass es einige cm
in die (immer noch gerührte) Lösung eintaucht. Die Suspension wird auf ca. 80 °C erhitzt. Bei
dieser Temperatur werden 2,8 g Ölsäure zugegeben und weitere 15 Minuten gerührt. Es bildet sich eine zähe Paste, die sich vom Wasser trennt.
Die überstehende Flüssigkeit (oft dunkelbraun) wird abdekantiert. Die verbleibende schwarze
Paste wird noch einmal mit ca. 200 ml VE-Wasser gewaschen.
Abschließend wird die hergestellte Paste im Trockenschrank (idealerweise unter Vakuum) bei maximal 55 °C getrocknet, um Restwasser zu entfernen. (Falls kein Trockenschrank vorhanden ist, wird das Wasser soweit wie möglich entfernt).
4) Dispergierung (unter dem Abzug)
Die schwarze Paste wird mit 25 ml n-Decan versetzt. Nach 15 Minuten hat sich ein großer Teil der modifizierten Partikel redispergiert.
Das Ferrofluid wird durch einen Papierfilter filtriert und in einem 50-ml-Becherglas aufgefangen.
Falls die Trocknung in Schritt 3 nicht vollständig ist, bilden sich zwei unmischbare Phasen:eine organische Decanphase und darunter ein paar Wassertropfen. Nur das obere organische Ferrofluid wird filtriert.
5) Test: Verhalten des Ferrofluids im Magnetfeld
Nähern Sie einen Permanentmagneten dem Ferrofluid von der Unterseite des Becherglases
und bewegen Sie den Magneten horizontal und vertikal.
Beobachtung:
Das Ferrofluid bildet im Magnetfeld eine Halbkugel und lässt sich mit dem Magneten bewegen. Bei Verwendung eines starken Neodyn-Magneten bildet das Ferrofluid so genannte „Rosensweig-Stacheln“ aus.
Erklärung:
1) Fällung
Die zugrunde liegende chemische Reaktion hat folgende Reaktionsgleichung:
8 NaOH + 2 FeCl3 + FeCl2 Fe3O4 + 8 NaCl + 4 H2O
Das Eisenoxid fällt in Form von ca. 10 Nanometer großen Magnetit-Primärpartikeln aus.
NaOH liegt im Überschuss vor, während die Eisensalze im stöchiometrischen Verhältnis eingesetzt werden.
Der hergestellte Magnetit (Fe3O4), besitzt die Struktur des so genannten inversen
Spinelltyps, und lässt sich als Fe(II)(Fe(III))2O4 beschreiben. Die Fe(II)- und Fe(III)- Ionen
besetzen verschiedene Gitterplätze (Tetraeder- oder Oktaeder-Lücken) im Kristall. Die 15 Minuten Reifungszeit nach der Fällung sind erforderlich, um diese Ordnung im Kristall zu erzielen.
2) Reinigung
In diesem Syntheseschritt werden das als Nebenprodukt anfallende NaCl sowie
überschüssiges NaOH abgetrennt. Dies ist wichtig, damit die Partikeloberflächen frei sind und weiter reagieren können.
3) Oberflächenbehandlung
Die reaktiven Eisenoxidteilchenoberflächen werden mit Ölsäure versetzt. Dies ermöglicht nicht nur eine Umpolung (bzw. Hydrophobierung für organische Umgebungen) der Partikel.
Viel wichtiger ist die Trennung der Partikel untereinander durch die organische Umhüllung.
So wird verhindert, dass die Nanopartikel in größeren Brocken agglomerieren und ihre spezifischen „Nano“-Eigenschaften verlieren.
Wenn die überstehende Flüssigkeit nach der Oberflächenbehandlung eine dunkelbraune Farbe besitzt, ist dies ein Zeichen dafür, dass der Waschvorgang nicht hinreichend gründlich
war. Das Produkt lässt sich in diesem Fall aber dennoch zum Ferrofluid weiterverarbeiten.
4) Dispergierung
Die Oberflächenbehandlung ermöglicht eine Redispergierung in unpolaren Lösungsmitteln,
z. B. n-Decan, n-Heptan, Toluol, verschiedenen Ölen etc. Dabei entsteht eine scheinbar homogene, magnetische Flüssigkeit, ein so genanntes Ferrofluid. Diese magnetische Flüssigkeit wird von einem Magnetfeld angezogen, ohne dass die Partikel sich absetzen.
5) Test: Verhalten des Ferrofluids im Magnetfeld
Die magnetischen Nanoteilchen ordnen sich entlang der magnetischen Feldlinien an.
Nebeneinander liegende Teilchen stoßen sich wie parallel nebeneinander liegende Stabmagneten ab. Die Verteilung der Partikel beeinflusst wiederum das einwirkende
Magnetfeld und führt bei starken Magnetfeldern zur Bildung der so genannten
„Rosensweig- Stacheln“.
Literaturverzeichnis
[JCF08] Skript zum Schülerpraktikum des JungChemikerForums Regensburg 2008.
http://www.chemie.uni-regensburg.de/jcf/Schuelerpraktikum/Skript2008.pdf (abgerufen am 10. Januar 2010), 2008
[Nan08] Versuch 3: Herstellung Magnetischer Flüssigkeiten (Ferrofluide). Versuchsan- leitung der NanoBoX, 2008
[Ric72] Kapitel 3.1.12 Aufnahme von Magnetiesierungskurven. In:Richter, Heinz:
Hilfsbuch für Elektronenstrahl-Oszillografie. Franzis-Verlag München, 1972, S.
153–155
[Sch06] Schrupp, David: Einheitszelle von Magnetit, Sauerstoff (grau), di- valentes Eisen (grün), trivalentes Eisen (blau), Eisenion in Oktaederlü- cke (hellblauer Oktaeder), Eisenion in Tetraederlücke (grauer Tetraeder).
http://de.wikipedia.org/wiki/Magnetit (abgerufen am 10. Januar 2010), 2006
![Abbildung 3.1: Struktur eines Magnetit-Kristalls (Sauerstoff in grau, F e 2+ in grün und F e 3+ in blau) mit markiertem F e 2+ -Ion in der Lücke des grauen Tetra-eder und und markiertem F e 3+ -Ion in der Lücke des blauen Oktaeder (Bild aus [Sch06])](https://thumb-eu.123doks.com/thumbv2/1library_info/3923581.1529328/6.892.265.636.528.826/abbildung-struktur-magnetit-kristalls-sauerstoff-markiertem-markiertem-oktaeder.webp)

![Abbildung 5.2: Schaltung zur Hysteresemessung nach [Ric72]](https://thumb-eu.123doks.com/thumbv2/1library_info/3923581.1529328/14.892.247.690.84.344/abbildung-schaltung-zur-hysteresemessung-nach-ric.webp)

