AUS DEM LEHRSTUHL FÜR CHIRURGIE
Volltext
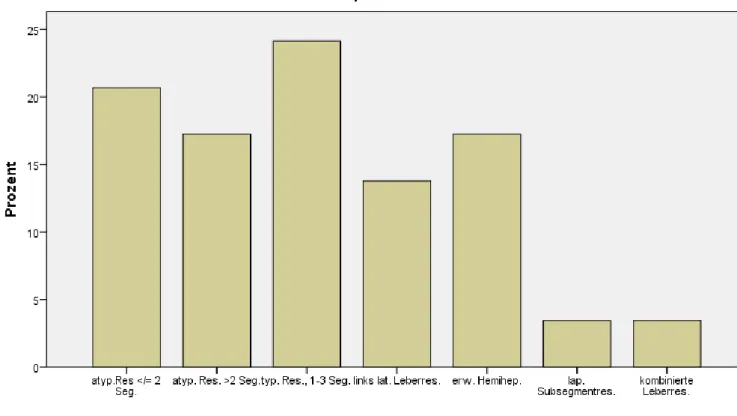
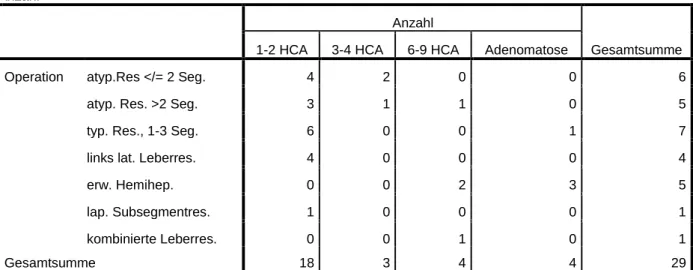
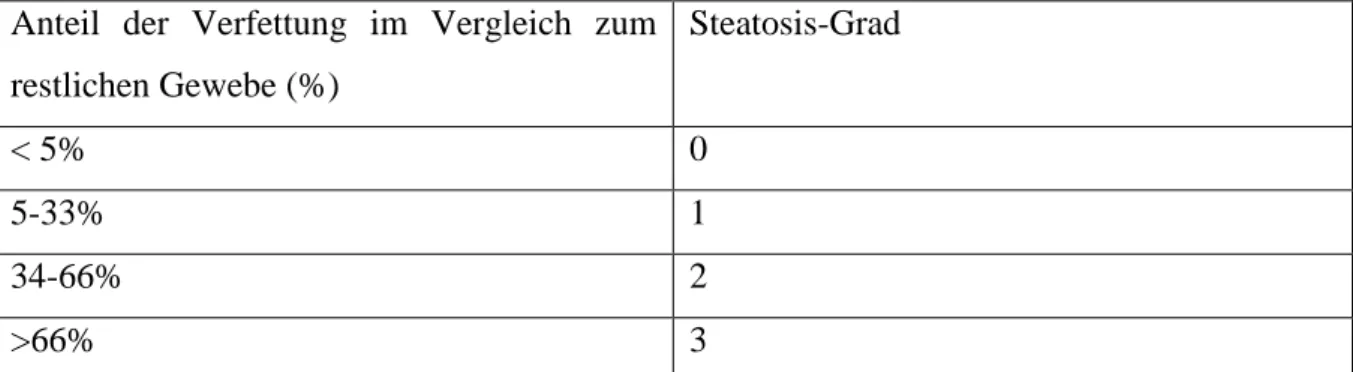
Abbildung
![Tabelle 1: Sensitivität und Spezifität von IHC- Markern bei der Subtypisierung von Leberadenomen [4,18]](https://thumb-eu.123doks.com/thumbv2/1library_info/4133154.1552202/28.892.102.799.585.742/tabelle-sensitivität-spezifität-ihc-markern-subtypisierung-leberadenomen.webp)
![Tabelle 2: Immunhistochemische Charakteristika der HCA-Subtypen [4,18]](https://thumb-eu.123doks.com/thumbv2/1library_info/4133154.1552202/29.892.109.787.103.514/tabelle-immunhistochemische-charakteristika-der-hca-subtypen.webp)
![Tabelle 3: Grundprinzip der Fixation und Einbettung zur histologischen Diagnostik [114]](https://thumb-eu.123doks.com/thumbv2/1library_info/4133154.1552202/34.892.105.790.464.940/tabelle-grundprinzip-fixation-einbettung-histologischen-diagnostik.webp)
ÄHNLICHE DOKUMENTE
In mehreren Publikationen beschäftigte sich auch der Verein für Socialpolitik mit der Thematik, wobei die argumentative Palett e von der Befürchtung „einer Beeinträchtigung
Zusammenfassend wurde in dieser Arbeit gezeigt, dass mesenchymale Stammzellen nach syngener Transplantation in einem Rattenmodell, in dem durch kontinuierliche
«Wenn 50 Personen das Medikament nehmen, wird innert zehn Jahren eine Person weniger eine Herzkrankheit bekommen» oder «Wenn 50 Perso- nen das Medikament nehmen, werden diese in-
A large part of the talk will be occupied by a survey of the currently three most common types of accelerators and details on their performance charac- teristics: Manycore units
This talk contains joint work with Florian Luca, Atsushi Murase, Markus Neuhauser, Florian Rupp and Alexander Weisse. Alle Interessenten sind
los. Im gleichen Augenblick fährt ein Radfahrer mit konstanter Geschwindigkeit v R am Auto vorbei. b) Nach welcher Zeit und in welcher Entfernung von der Ampel überholt das Auto den
direkt in Richtung des Affen. Genau zu der Zeit des Abwurfs lässt sich der Affe zu Boden fallen. a) Stellen Sie jeweils die Gleichungen x(t) und y(t) für den Ort von Banane und
Obwohl Atg21 nicht essentiell für Autophagie ist, jedoch eine Rolle bei selektiven Prozessen wie dem Cvt-Weg oder PMN spielt, ist denkbar, dass während des Abbaus von Ribosomen