2 CHEMIE UND WERKSTOFFKUNDE
11. Dezember 2014 www.ibn.ch
Version 3
Kapitel 2
Chemie und Werkstoffkunde
Verfasser:
Hans-Rudolf Niederberger Elektroingenieur FH/HTL Vordergut 1, 8772 Nidfurn
055 - 654 12 87
Ausgabe:
Juni 2010
2 CHEMIE UND WERKSTOFFKUNDE
2 Chemie und Werkstoffkunde
SÄUREN UND BASEN
sauer neutral alkalisch
PH-Wert
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Eine wichtige Aufgabe der Chemie besteht darin, aus Rohstoffen (natürlichen Stoffen) neue Stoffe mit möglichst grossen Rein- heitsgrad herzustellen.
Recycling
Bearbeitet durch:
Niederberger Hans-Rudolf dipl. Elektroingenieur FH/HTL/STV dipl. Betriebsingenieur HTL/NDS Vordergut 1
8772 Nidfurn
Telefon 055 654 12 87 P Telefax 055 654 12 88 P E-Mail hn@ibn.ch
Web www.ibn.ch
3. Auflage 19. November 2010
2 CHEMIE UND WERKSTOFFKUNDE
11. Dezember 2014 www.ibn.ch
Version 3
Inhaltsverzeichnis
2 CHEMIE UND WERKSTOFFKUNDE 2.1 Einteilung der Stoffe
2.1.1 Stoffarten
2.1.2 Chemische Gruppen, chemische Elemente, Atome 2.1.3 Periodentafel der Elemente
2.1.4 Borsches Atommodell 2.1.5 Reinstoffe – Elemente 2.1.6 Halbmetalle
2.1.7 Nichtmetalle
2.1.8 Reinstoffe - Verbindungen 2.1.9 Natürliche Stoffe
2.1.10 Gemische 2.1.11 Legierungen
2.1.12 Widerstandsmaterial 2.1.13 Isolierstoffe
2.2 Begriffe der Chemie und Werkstoffkunde 2.2.1 Unterschied Physik und Chemie 2.2.2 Materie
2.2.3 Das Molekül
2.2.4 Zellulose-Kunststoffe
2.2.5 Begriffslexikon der Kunststoffe 2.2.6 Freie Elektronen
2.2.7 Stoffumwandlungsvorgang 2.2.8 Elektronegativität
2.2.9 Oktettregel 2.2.10 Ionen
2.2.11 Ionenverbindung
2.2.12 Atom- oder Elektronenpaarbindung 2.2.13 Metallbindung
2.2.14 Atomeinheit u
2.2.15 Klassifikation der Orbitale 2.2.16 Synthese
2.2.17 Analyse 2.2.18 Isotope
2.3 Gewinnung und Bearbeitung der Stoffe 2.3.1 Rohstoffabbau
2.3.2 Eisenmetalle
2.3.3 Nichteisen-Metallgewinnung
2.3.4 Bearbeitungsverfahren von Metallen 2.3.5 Gefügeaufbau der Metalle
2.3.6 Halbmetalle 2.3.7 Nichtmetalle
2.4 Bedeutung und Wert der Stoffe 2.4.1 Erde als Rohstofflieferant 2.4.2 Umweltschutz
2.4.3 Materialkreislauf im eigenen Betrieb beschreiben 2.5 Eigenschaften der Werkstoffe
2.5.1 Festigkeit 2.5.2 Elastizität 2.5.3 Plastizität
BiVo
Probleme umfassend bearbeiten Verstehen und anwenden Erinnern
TD Technische Dokumentation
BET Bearbeitungstechnik 2.1 Werkstoffet 2.1.1 Einteilung der Stoffe
- Reine Stoffe - Gemische - Chemische Elemente - Verbindungen - Metalle - Nichtmetalle - natürliche Stoffe - Kunststoffe
2.1.1 Bedeutung und Wert der Stoffe - Erde als Rohstofflieferant - Stoffkreisläufe, Ressourcen 2.1.2 Mechanische Eigenschaften
- Verhalten bei Krafteinwirkung: Festigkeiten, Härte, Sprödigkeit, Elastizität, Plastizität - Dichte
- Eignung für technologische Verfahren: (For- men, Fügen, Vergüten, Veredeln) 2.1.2 Elektrische Eigenschaften
- Leitfähigkeit - Durchschlagsfestigkeit - Magnetische Eigenschaften - Dielektrische Eigenschaften 2.1.2 Thermisches Verhalten
- Schmelzpunkt - Siedepunkt - Hitzebeständigkeit - Wärmekapazität - Wärmeleitfähigkeit
2.1.2 Chemische und ökologische Eigenschaften - Korrosionsbeständigkeit
- Oxidations- und Reduktionsverhalten Heizwert
- Brennbarkeit - Spannungsreihe - UV-Beständigkeit Giftigkeit - Abbaubarkeit 2.1.2 Verwendung
- Metalle - Metalllegierungen - Nichtmetalle - Kunststoffe
2.1.3 Chemische Grundbegriffe
- Abgrenzung zu physikalischen Vorgängen - Chemische Grundstoffe (Elemente) - Periodensystem
- Atome, Elektronen, Moleküle, Ionen 2.1.3 Chemische Prozesse
- Chemische Prozesse als Stoffumwandlungs- vorgang
- Chemische Verbindungen: Elektronenpaar-, Ionen-, Metallbindung
- Sauerstoff- und Kohlenstoffverbindungen:
Entstehung, Eigenschaften - Oxidations- und Reduktionsvorgänge - Elektrochemische Korrosion: Elektrolyte,
Spannungsreihe
2.1.4 Kennzeichnung der Gefahrenstoffe - Gefahrenstoffsymbole und Bezeichnungen 2.1.4 Umgang mit Gefahrenstoffen
- Risiko- und Sicherheitssätze (R + S) - Asbest
- Leuchtstofflampen - Chemikalien
2 CHEMIE UND WERKSTOFFKUNDE
2.5.4 Dichte 2.5.5 Die Härte 2.5.6 Bearbeitbarkeit
2.5.7 Korrosionsbeständigkeit 2.5.8 Isolationswiderstand 2.5.9 Durchschlagfestigkeit 2.5.10 Die Dielektrizitätszahl 2.5.11 Wärmebeständigkeit 2.6 Oxidation und Reduktion
2.6.1 Die Stärke von Oxidations- und Reduktionsmittel 2.7 Korrosion und Korrosionsschutz
2.8 Die Elektrolyse
2.9 Säure- und Basen-Reaktion 2.9.1 Definitionen
2.9.2 Der pH-Wert
2.9.3 Berechnung des pH-Wertes
2.10 Vorträge „Verwendung Berufsrelevanter Stoffe“
2.11 Kennzeichnung der Gefahrenstoffe 2.11.1 Gesetzliche Grundlage
2.11.2 Warnschilder
2.11.3 Aufbewahrung von Giften 2.11.4 Entsorgung von giftigen Stoffen 2.11.5 Bezug von Giften
2.11.6 Arbeiten mit giftigen Stoffen 2.12 Widestandsmaterial
2.12.1 Präzisionswiderstände 2.12.2 Belastungswiderstände 2.12.3 Heizwiderstände
2.12.4 Nichtmetall-Legierungen 2.12.5 Technische Widerstände
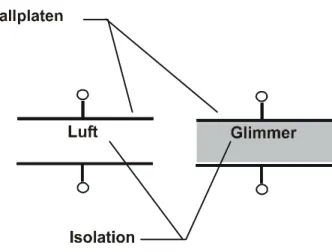
2.12.6 Aussehen von Widerstandsmaterial 2.12.7 Anwendungen Widerstandsmaterial 2.12.8 Anwendungen Leitungswiderstände 2.12.9 Farbschlüssel für Festwiderstände 2.13 Isolierstoffe
2.13.1 Gruppierung der Isolierstoffe 2.13.2 Zweck der Isolierstoffe
2.13.3 Unterscheidung der Isolierstoffe 2.13.4 Kenngrössen der Isolierstoffe 2.13.5 Anforderungen an Isolierstoffe 2.13.6 Anorganische Isolierstoffe
2.13.7 Natürliche organische Isolierstoffe 2.13.8 Zellulose-Kunststoffe
2.13.9 Kunststoffe / Plaste
2.14 Geschichte des Periodensystems
2.15 Geschichte der berufsrelevanten Werkstoffe
2.1.5 Reihenfolge aller Umweltschutzmassnahmen - Vermeiden – Vermindern – Verwerten – Ent-
sorgen
- Recycling-Verfahren und -Organisation: Alt- metall; Batterien; Geräte; Lampen - Entsorgung von Elektrogeräten nach VREG)
TG Technologische Grundlagen
EST Elektrische Systemtechnik
KOM Kommunikationstechnik
2 CHEMIE UND WERKSTOFFKUNDE
11. Dezember 2014 www.ibn.ch
Version 3
2.1 Einteilung der Stoffe
2.1.1 Stoffarten
Wir kommen täglich mit einer Vielzahl von Stoffen in Berührung. Manche Soffe liefert uns die Natur direkt, andere werden chemisch hergestellt.
natürliche Stoffe : Holz, Wasser, Milch, Zucker, Kochsalz künstliche Stoffe : Leim, Cola, Kaugummi, Assugrin, Zement
In der Chemie werden die Stoffe nach ihrer Zusammensetzung und ihren chemischen Eigenschaften in Stoffklassen eingeteilt:
Stoffe
Reinstoffe
Elemente
Metalle
Beispiele
edel Gold, Silber, Platin halbedel Kupfer, Quecksilber unedel Aluminium, Eisen, Zink Halbmetalle Silizium, Germanium Nichtmetalle Schwefel, Iod
Verbin- dungen
Säure
Salzsäure, SchwefelsäureLauge
NatronlaugeHydroxid
NatriumhydroxidOxid
SchwefeldioxidSalz
KochsalzAlkan
Methan, Propan, ButanEther
SchwefeletherFett
KokosfettEiweiss
HühnereiKunststoff
Plexiglas, NylonStoff- Gemische
heterogen
Gemenge
GeröllhaufenPaste
ZahnpastaSuspension
TuscheEmulsion
FettsauceSchaum
SchlagrahmRauch
ZigarettenrauchNebel
Kühlflüssigkeithomogen
Legierungen
Messing, Bronce, MünzenLösungen
ZuckerwasserGasgemisch
Luft, Furz, Knallgas2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE
2.1.2 Chemische Gruppen, chemische Elemente, Atome
Periode Schale
Periodensystem der Atome
1 2 Tabelle 2 3 4 5 6 7 8
1 Erdalkali- Übergangs- 4
1 H Halogene Metalle Metalle Metalle He
Wasserstoff Helium
K 1 1 2 2
7 2 9 11 12 14 16 19 20
2 K 2 Li 2 Be 2 B 2 C 2 N 2 O 2 F 2 Ne
Lihium Berylium Innere Bor Kohlenstoff Stickstoff Sauerstoff Fluor Neon
L 1 3 4 Übergangs- 3 5 4 6 5 7 6 8 7 9 8 10
K 2 23 2 24 Nichtmetall Edelgase Alkalimetalle Metalle 2 27 2 28 2 31 2 32 2 35 2 40
3 L 8 Na 8 Mg 8 Al 8 Si 8 P 8 S 8 Cl 8 Ar
Natrium Magnesium Aluminium Silizium Phosphor Schwefel Chlor Argon
M1 11 2 12 3 13 4 14 5 15 6 16 7 17 8 18
1a 2a 3b 4b 5b 6b 7b 8 1b 2b 3a 4a 5a 6a 7a
L 8 39 8 40 8 45 8 48 8 51 8 52 8 55 8 56 8 59 8 58 8 63 8 64 8 69 8 72 8 75 8 80 8 79 8 84
4 M 8 K 8 Ca 9 Sc 10 Ti 11 V 13 Cr 13 Mn 14 Fe 15 Co 16 Ni 18 Cu 18 Zn 18 Ga 18 Ge 18 As 18 Se 18 Br 18 Kr
Kalium Kalzium Scandium Titan Vanadium Chrom Mangan Eisen Kobalt Nickel Kupfer Zink Gallium Germanium Arsen Selen Brom Krypton
N 1 19 2 20 2 21 2 22 2 23 1 24 2 25 2 26 2 27 2 28 1 29 2 30 3 31 4 32 5 33 6 34 7 35 8 36
M 18 85 18 88 18 89 18 90 18 93 18 98 18 99 18 102 18 103 18 106 18 107 18 114 18 115 18 120 18 121 18 130 18 127 18 132
5 N 8 Rb 8 Sr 9 Y 10 Zr 12 Nb 13 Mo 13 Tc 15 Ru 16 Rh 18 Pd 18 Ag 18 Cd 18 In 18 Sn 18 Sb 18 Te 18 I 18 Xe
Rubidium Strontium Yttrium Zirkon Niob Molybdän Technikum Rutherium Rhodium Palladium Silber Cadmium Indium Zinn Antimon Tellur Jod Xenon
O 1 37 2 38 2 39 2 40 1 41 1 42 2 43 1 44 1 45 0 46 1 47 2 48 3 49 4 50 5 51 6 52 7 53 8 54
N 18 133 18 138 18 139 32 180 32 181 32 184 32 187 32 192 32 193 32 195 32 197 32 202 32 205 32 208 32 209 32 210 32 210 32 222
6 O 18 Cs 8 Ba 9 La 58 10 Hf 11 Ta 12 W 13 Re 14 Os 15 Ir 17 Pt 18 Au 18 Hg 18 Tl 18 Pb 18 Bi 18 Po 18 At 18 Rn
Cäsium Barium Lanthan bis Hafnium Tantal Wolfram Rhenium Osmium Iridium Platin Gold Quecksilber Thallium Blei Bismuth Polonium Astat Radon
P 1 55 2 56 2 57 71 2 72 2 73 2 74 2 75 2 76 2 77 1 78 1 79 2 80 3 81 4 82 5 83 6 84 7 85 8 86
O 18 223 18 226 18 227 32 261 32 161
7 P 8 Fr 8 Ra 9 Ac 90 10 Ku 10 Ha
Francium Radium Actinium bis Kutschatowium Hanium
Q 1 87 2 88 2 89 103 2 104 3 105 106
N 19 140 21 141 22 142 23 145 24 152 25 151 25 158 26 159 27 164 28 165 29 166 31 169 32 174 32 177
6 O Lanthaniden 9 Ce 8 Pr 8 Nd 8 Pm 8 Sm 8 Eu 9 Gd 9 Tb 9 Dy 9 Ho 9 Er 8 Tm 8 Yb 9 Lu
(Metalle der seltenen Erden) Cer Praseodym Neodym Promethium Samarium Europium Gadolinium Terbium Dysprosium Holmium Erbium Thulium Ytterbium Lutetium
P 2 58 2 59 2 60 2 61 2 62 2 63 2 64 2 65 2 66 2 67 2 68 2 69 2 70 2 71
O 18 232 20 231 21 238 22 237 24 242 25 243 25 247 27 249 28 251 29 255 30 253 31 256 32 251 32 247
7 P Actiniden 10 Th 9 Pa 9 U 9 Np 8 Pu 8 Am 9 Cm 8 Bk 8 Cf 8 Es 8 Fm 8 Md 8 No 9 Lr
(Uran-Metalle) Thorium Pratactinium Uran Neptunium Plutonium Americium Cerium Berkelium Californium Einsteinium Fermium Mendelevium Nobelium Lawrencium
Q 2 90 2 91 2 92 2 93 2 94 2 95 2 96 2 97 2 98 2 99 2 100 2 101 2 102 2 103
Chemisches Ele- ment ist die Sam- melbezeichnung für alle Atomarten mit derselben Anzahl an Protonen im Atomkern.
Somit haben alle Atome eines che- mischen Elements dieselbe Kernla- dungszahl (auch Ordnungszahl).
Die Elemente wer- den im Perioden- system nach stei- gender Kernla- dungszahl angeord- net.
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE
www.ibn.ch
13. November 2008 Version 2
2.1.3 Periodentafel der Elemente
Periode Schale
Periodensystem der Atome
1 2 Tabelle 1 3 4 5 6 7 8
1 4
1 H He
Wasserstoff Helium
K 1 1 Halbmetall Schwermetall Metalle Edelmetalle 2 2
7 2 9 11 12 14 16 19 20
2 K 2 Li 2 Be 2 B 2 C 2 N 2 O 2 F 2 Ne
Lihium Berylium Bor Kohlenstoff Stickstoff Sauerstoff Fluor Neon
L 1 3 4 3 5 4 6 5 7 6 8 7 9 8 10
K 2 23 2 24 Nichtmetall Edelgase Leichtmetall Halbedel 2 27 2 28 2 31 2 32 2 35 2 40
3 L 8 Na 8 Mg 8 Al 8 Si 8 P 8 S 8 Cl 8 Ar
Natrium Magnesium Aluminium Silizium Phosphor Schwefel Chlor Argon
M 1 11 2 12 3 13 4 14 5 15 6 16 7 17 8 18
1a 2a 3b 4b 5b 6b 7b 8 1b 2b 3a 4a 5a 6a 7a
L 8 39 8 40 8 45 8 48 8 51 8 52 8 55 8 56 8 59 8 58 8 63 8 64 8 69 8 72 8 75 8 80 8 79 8 84
4 M 8 K 8 Ca 9 Sc 10 Ti 11 V 13 Cr 13 Mn 14 Fe 15 Co 16 Ni 18 Cu 18 Zn 18 Ga 18 Ge 18 As 18 Se 18 Br 18 Kr
Kalium Kalzium Scandium Titan Vanadium Chrom Mangan Eisen Kobalt Nickel Kupfer Zink Gallium Germanium Arsen Selen Brom Krypton
N 1 19 2 20 2 21 2 22 2 23 1 24 2 25 2 26 2 27 2 28 1 29 2 30 3 31 4 32 5 33 6 34 7 35 8 36
M 18 85 18 88 18 89 18 90 18 93 18 98 18 99 18 102 18 103 18 106 18 107 18 114 18 115 18 120 18 121 18 130 18 127 18 132
5 N 8 Rb 8 Sr 9 Y 10 Zr 12 Nb 13 Mo 13 Tc 15 Ru 16 Rh 18 Pd 18 Ag 18 Cd 18 In 18 Sn 18 Sb 18 Te 18 I 18 Xe
Rubidium Strontium Yttrium Zirkon Niob Molybdän Technikum Rutherium Rhodium Palladium Silber Cadmium Indium Zinn Antimon Tellur Jod Xenon
O 1 37 2 38 2 39 2 40 1 41 1 42 2 43 1 44 1 45 0 46 1 47 2 48 3 49 4 50 5 51 6 52 7 53 8 54
N 18 133 18 138 18 139 32 180 32 181 32 184 32 187 32 192 32 193 32 195 32 197 32 202 32 205 32 208 32 209 32 210 32 210 32 222
6 O 18 Cs 8 Ba 9 La 58 10 Hf 11 Ta 12 W 13 Re 14 Os 15 Ir 17 Pt 18 Au 18 Hg 18 Tl 18 Pb 18 Bi 18 Po 18 At 18 Rn
Cäsium Barium Lanthan bis Hafnium Tantal Wolfram Rhenium Osmium Iridium Platin Gold Quecksilber Thallium Blei Bismuth Polonium Astat Radon
P 1 55 2 56 2 57 71 2 72 2 73 2 74 2 75 2 76 2 77 1 78 1 79 2 80 3 81 4 82 5 83 6 84 7 85 8 86
O 18 223 18 226 18 227 32 261 32 161
7 P 8 Fr 8 Ra 9 Ac 90 10 Ku 10 Ha
Francium Radium Actinium bis Kutschatowium Hanium
Q 1 87 2 88 2 89 103 2 104 3 105 106
N 19 140 21 141 22 142 23 145 24 152 25 151 25 158 26 159 27 164 28 165 29 166 31 169 32 174 32 177
6 O Lanthaniden 9 Ce 8 Pr 8 Nd 8 Pm 8 Sm 8 Eu 9 Gd 9 Tb 9 Dy 9 Ho 9 Er 8 Tm 8 Yb 9 Lu
(Metalle der seltenen Erden) Cer Praseodym Neodym Promethium Samarium Europium Gadolinium Terbium Dysprosium Holmium Erbium Thulium Ytterbium Lutetium
P 2 58 2 59 2 60 2 61 2 62 2 63 2 64 2 65 2 66 2 67 2 68 2 69 2 70 2 71
O 18 232 20 231 21 238 22 237 24 242 25 243 25 247 27 249 28 251 29 255 30 253 31 256 32 251 32 247
7 P Actinoiden 10 Th 9 Pa 9 U 9 Np 8 Pu 8 Am 9 Cm 8 Bk 8 Cf 8 Es 8 Fm 8 Md 8 No 9 Lr
(Uran-Metalle) Thorium Pratactinium Uran Neptunium Plutonium Americium Cerium Berkelium Californium Einsteinium Fermium Mendelevium Nobelium Lawrencium
Q 2 90 2 91 2 92 2 93 2 94 2 95 2 96 2 97 2 98 2 99 2 100 2 101 2 102 2 103
Unterteilung der Metalle:
- Schwermetalle - Leichtmetalle - Edelmetalle - Halbedelmetalle - Unedle Metalle
Definition Halbedelmetalle:
Im chemischen Sinne sind Halb- edelmetalle und also alle Metalle, die in der elektro- chemischen Span- nungsreihe ein positives Standard- potential gegenüber Wasserstoff besit- zen.
Liste der elektro- chemischen Poten- tiale siehe Kap. 3.6.1 St. 81
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE 3 PERIODENTAFEL DER ELEMENTE
2.1.3.1 Tabellenform des Periodensystems der Elemente
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE 3 PERIODENTAFEL DER ELEMENTE
11. Dezember 2014 www.ibn.ch
Version 3
2.1.3.2 Wertigkeiten der Elemente des Periodensystems
Die chemischen Grundstoffe, welche nicht mehr trennbar sind, nennt man
Atome
Element Kurz-
zeichen Wertig-
keit relative Atommasse
Ar
Ordnungs- zahl
Z
Element Kurz-
zeichen Wertig-
keit relative Atommasse
Ar
Ordnungs- zahl
Z
Actinium Ac 3 (227) 89 Molybdän Mo 3,4,6 95,94 42
Aluminium Al 3 26,9815 13 Natrium Na 1 22,9898 11
Americum Am 3 (243) 95 Neodym Nd 3 144,24 60
Antimon Sb 3,5 121,75 51 Neon Ne 0 20,179 10
Argon Ar 0 39,948 18 Neptunium Np 3,4,5,6 237,0482 93
Arsen As 3,5 74,9216 33 Nickel Ni 2,3 58,71 28
Astat At 7 (210) 85 Niob Nb 5,3 92,9064 41
Barium Ba 2 137,34 56 Nobelium No 3 (255) 102
Berkelium Bk 3,4 (247) 97 Osmium Os 2,3,4,8 190,2 76
Beryllium Be 2 9,01218 4 Palladium Pd 2,4 106,4 46
Blei Pb 2,4 207,19 82 Phosphor P 3,5 30,9738 15
Bor B 3 10,811 5 Platin Pt 2,4 195,09 78
Brom Br 1,5 79,904 35 Plutonium Pu 3,4,5,6 (244) 94
Cadmium Cd 2 112,40 48 Polonium Po 2,6 (210) 84
Calcium Ca 2 40,08 20 Praseodym Pr 3 140,9077 59
Californium Cf 3 (251) 98 Promethium Pm 3 (145) 61
Cäsium Cs 1 132,9055 55 Protactinium Pa 3 231,0359 91
Cer Ce 3,4 140,12 58 Quecksilber Hg 1,2 200,59 80
Chlor Cl 1,5,7 35,453 17 Radium Ra 2 226,0254 88
Chrom Cr 2,3,6 51,996 24 Radon Rn 0 (222) 86
Curium Cm 3 ((247) 96 Rhenium Re 1,4,7 186,2 75
Dysprosium Dy 3 162,50 66 Rhodium Rh 8 102,9055 45
Einsteinium Es 3 (254) 99 Rubidium Rb 1 85,4678 37
Eisen Fe 2,3,6 55,847 26 Ruthenium Ru 3,4,6,8 101,07 44
Erbium Er 3 167,26 68 Samarium Sm 3 150,35 62
Europium Eu 3 151,96 63 Sauerstoff O 2 15,9994 8
Fermium Fm 3 (257) 100 Scandium Sc 3 44,9559 21
Fluor F 1,7 18,9984 9 Schwefel S 2,4,6 32,064 16
Francium Fr 1 (223) 87 Selen Se 2,4,6 78,96 34
Gadolinium Gd 3 157,25 64 Silber Ag 1,2 107,868 47
Gallium Ga 3 69,72 31 Silizium Si 4 28,086 14
Germanium Ge 4 72,59 32 Stickstoff N 2,3,5 14,0067 7
Gold Au 1,3 196,9665 79 Strontium Sr 2 87,62 38
Hafnium Hf 4 178,49 72 Tantal Ta 5 180,9479 73
Hahnium Ha 5 (261) 105 Technetium Tc 7 98,9062 43
Helium He 0 4,00260 2 Tellur Te 2,6,4 127,60 52
Holmium Ho 3 164,9303 67 Terbium Tb 3 158,9254 65
Indium In 3 114,82 49 Thallium Tl 1,3 204,37 81
Iridium Ir 3,4,6 192,22 77 Thorium Th 4 232,0381 90
Jod J 1,3,5,7 126,9045 53 Thulium Tm 3 168,9342 69
Kalium K 1 39,102 19 Titan Ti 2,3,4 47,90 22
Kobalt Co 2,3 58,9332 27 Uran U 3,4,5,6 238,029 92
Kohlenstoff C 2,4 12,01115 6 Vanadium V 2,3,4,5 50,9414 23
Krypton Kr 0 83,80 36 Wasserstoff H 1 1,00797 1
Kupfer Cu 1,2 63,546 29 Wismut Bi 3,5 208,9806 83
Kurschatowium Ku 4 (261) 104 Wolfram W 2,3,4,5,6 183,85 74
Lanthan La 3 138,9055 57 Xenon Xe 0 131,30 54
Lawrencium Lr 3 (256) 103 Ytterbium Yb 2,3 173,04 70
Lithium Li 1 6,941 3 Yttrium Y 3 88,9059 39
Lutetium Lu 3 174,97 71 Zink Zn 2 65,37 30
Magnesium Mg 2 24,305 12 Zinn Sn 2,4 118,69 50
Mangan Mn 2,3,4,6,7 54,9380 25 Zirkon Zr 4 91,22 40
Mendelevium Md 3 (258) 101
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE 3 PERIODENTAFEL DER ELEMENTE
2.1.3.3 Wertigkeitsbegriffe
Die Wertigkeit eines Stoffes sagt aus, wie das Element eine Verbindung ein- geht in Bezug auf seine Valenzelekt- ronen (Elektronen der äussersten Schale).
Oxidation
Eine Oxidation ist eine chemische Reaktion, bei der ein Atom, Ion oder Molekül Elektronen abgibt. Ihre Oxi- dationszahl wird dabei erhöht.
Reduktion
Ein anderer Stoff nimmt die Elekt- ronen auf und wird reduziert.
Redoxreaktion
Beide Reaktionen zusammen wer- den als Teilreaktionen einer Redox- reaktion betrachtet.
Beispiel
Reaktion Metallatom mit einem Sauerstoff-Atom ( FeO , Eisenoxid) Oxidation
Metall ( Fe ) gibt zwei Elektronen ab.
Fe Fe
2++ 2 e
−Reduktion
Sauerstoff (O) nimmt zwei Elektro- nen auf.
O + 2 e
−O
2−Redoxreaktion
Fe + O Fe
2++ O
2−Sauerstoff oxidiert das Metall und
wird dabei selbst reduziert.
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE
11. Dezember 2014 www.ibn.ch
Version 3
2.1.4 Borsches Atommodell
2.1.4.1 Protonen, Neutronen und Elektronen
Die Anzahl Protonen und Neutronen bestimmen Art
und Gewicht des Stoffes, denn die Elektronen sind ca. 2000 mal leichter. Die Anzahl Elektronen auf der
äussersten Hülle sind entscheidend für das chemische und elektrische Verhalten des Stoffes.
Da die Zahl der Protonen gleich gross wie die Zahl der Elektronen ist, ist das Atom nach aussen neutral.
Atommodell
Atomhülle
Elektron Ladung e = -1,602x10-19 As
Masse m = 9,109x10
-28g Atomkern
Proton Ladung e = 1,602x10
-19As
Masse m = 1,672x10
-24g
Neutron Ladung keine
Masse m = 1,675x10
-24g
Warum fällt der Atomkern nicht auseinander?
Die Atomrümpfe der Metallatome bilden ein Kristallgitter. Metalle sind Kristallin.
Zwischen den Atomrümpfen befindet sich das „Elektronengas“, bestehend aus den Valenzelektronen der Metallatome.
Damit der Kern nicht auseinander fällt gibt es die Neutronen. Sie bilden den so genannten Kernkitt.
Der Kern heisst Nukleus – Die Nukleo-
nenzahl ist die Summe der Protonen
und Neutronen.
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE 4 BORSCHES ATOMMODELL
2.1.4.2 Beispiel: Kupfer
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE 4 BORSCHES ATOMMODELL
11. Dezember 2014 www.ibn.ch
Version 3
2.1.4.3 Beispiel: Aluminium
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE
2.1.5 Reinstoffe – Elemente 2.1.5.1 Definition Reinstoffe
Als Metalle oder Leiter werden Werkstoffe verwendet, bei welchen schon bei Zimmertemperatur sehr viele freie Elektronen vorhanden sind.
Als Reinstoff bezeichnet man in der Chemie einen Stoff, der einheitlich zusammengesetzt ist und da- mit aus nur einer "Teilchensorte" besteht.
Reinstoffe bestehen nur aus einer Sorte Atome (Atomos = unteilbar).
REINSTOFFE KÖNNEN MIT PHYSIKALISCHEN TRENNVERFAHREN NICHT WEITER AUFGETEILT WERDEN.
Eine weitere Aufteilung gelingt jedoch bei vielen Reinstoffen mit chemischen Zerlegungsverfahren.
Reinstoffe können Elemente oder Verbindungen sein. Reinstoffe haben klar definierte physikalische Eigenschaften, die zur Charakterisierung verwendet werden, z. B.
SCHMELZPUNKT (SCHMELZTEMPERATUR) SIEDEPUNKT (SIEDETEMPERATUR)
DICHTE
DIE ELEKTRISCHE LEITFÄHIGKEIT DIE WÄRMELEITFÄHIGKEIT
LÖSLICHKEIT IN EINEM LÖSUNGSMITTEL
Einige Reinstoffe:
KUPFER
DESTILLIERTES WASSER
Reinstoffe bestehen aus Teilchen, die
stets gleich bleibende (also konstan-
te) Eigenschaften haben.
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE 5 REINSTOFFE UND ELEMENTE
11. Dezember 2014 www.ibn.ch
Version 3
2.1.5.2 Metalle
Als Metalle oder Leiter werden Werkstoffe verwendet, bei welchen schon bei Zimmertemperatur sehr viele freie Elektronen vorhanden sind.
Die chemischen Elemente der Metalle zeichen sich durch vier Eigenschaften aus:
2.1.5.2.1 Eigenschaften Metalle
ELEKTRISCHE LEITFÄHIGKEIT WÄRMELEITFÄHIGKEIT
METALLISCHE GLANZ PLASTISCH FORMBAR (DUKTILITÄT)
Wolframwendel
Schmelzleiter aus Silber oder Silberlegierung
Kabelrolle Kupferkabel
2.1.5.2.2 Wichtige berufsrelevante Metalle
Edle Metalle:
GOLD SILBER PLATIN WOLFRAM
Halbedle Metalle:
KUPFER
QUECKSILBER
Unedle Metalle:
ALUMINIUM
EISEN, ZINK, CHROM NICKEL, MANGAN MAGNESIUM
Die elektrische Leitfähigkeit, auch Konduktivität genannt, nimmt bei allen Metallen mit steigender Temperatur ab. Silber hat die beste elektrische Leitfähigkeit.
Die Wärmeleitfähigkeit λ, auch Wärmeleitzahl genannt, beschreibt die Fähigkeit ther- mische Energie (Wärme) zu transportieren. Leicht verschiebbare Elektronen sind Be- standteil dieser Wärmebewegung.
Die Duktilität beschreibt die Eigenschaft eines Werkstoffes sich erst plastisch zu ver- formen ohne sofort zu brechen. Einige Stahlsorten können sich bis zu einem viertel plastisch verformen bis der Werkstoff schliesslich reißt. Diese Eigenschaft ist in erster Linie von de Gittertyp abhängig. Diese Eigenschaft der Duktilität ermöglicht ein vorzeiti- ges erkennen einer zu hohen Belastung des Materials. Auch die Automobil-Industrie nutzt diese Eigenschaft der plastischen Verformung - Die Knautschzone. Hierbei wird Energie durch Verformung absorbiert.
Der metallische Glanz, auch Reflexion genannt, wird durch frei bewegliche Elektronen ermöglicht. Diese können die eingestrahlte oder besser die aufgenommene Energie in allen Wellenlängen unverändert wiedergeben.
Den höchsten Schmelzpunkt aller Metalle besitzt Wolfram, welcher als Spezialstahl in Glühbirnen zur Verwendung kommt.
Rohrheizkörper
Opfer-Anode aus Magnesium Opferanode für den Korrosionsschutz von Wassererwärmern (Boiler) Zusatzeigenschaften von unedlen Metallen
Geben leicht Elektronen ab unter Bildung von Kationen.
Reagieren mit Säuren unter Wasserstoffentwicklung.
Reagieren mit Sauerstoff leicht zu Oxiden.
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE
2.1.6 Halbmetalle
Halbleiter bzw. Halbmetalle sind Stoffe, deren Valenzelektronen fest im Atomgitter eingebunden sind und nicht zum Ladungstransport beitragen können und deshalb schlecht leiten.
2.1.6.1 Berufsrelevante Merkmale der Halbmetalle SIND WEDER LEITER NOCH ISOLATOREN
LEITFÄHIGKEIT NIMMT BEI TEMPERATURERHÖHUNG ZU ES ENTSTEHEN FREIE ELEKTRONEN
ERSCHEINUNG WIRD ALS EIGENLEITUNG BEZEICHNET SIE HABEN VIER VALENZELEKTRONEN
DIE LEITFÄHIGKEIT WIRD DURCH DOTIEREN ERHÖHT P-LEITFÄHIGKEIT ODER N-LEITFÄHIGKEIT
2.1.6.2 Berufsrelevante Halbmetalle
SILIZIUM GERMANIUM SELEN
Silizium-
Brückengleichrichter aus vier Dioden
(Graetzschaltung)
Leistungselektronik Transistor als Schalter
TO 254 npn-Silizium-Transistoren
Grenztemperatur 170 °C
Unterhaltungs- und Hochfrequenz-
Elektronik
Germanium-Transistor TO-3 – Gehäuse Grenztemperatur
100 °C
2 CHEMIE UND WERKSTOFFKUNDE 1 EINTEILUNG DER STOFFE
11. Dezember 2014 www.ibn.ch
Version 3
2.1.7 Nichtmetalle
Als Nichtmetalle bzw. Nichtleiter werden Werkstoffe bezeichnet, die als Isoliermaterialien in der Elekt- roindustrie verwendet werden. Sie besitzen im normalen Zustand wenig freie Elektronen. Es werden heute häufig Kunststoffe für die Isolierung eingesetzt.
2.1.7.1 Berufsrelevante Eigenschaften der Nichtmetalle
LEICHTER ALS METALLE
WENIG WÄRMELEITFÄHIGKEIT WÄRMEISOLIEREND
ELEKTRISCH NICHTLEITEND, ISOLIEREND CHEMISCH BESTÄNDIG, KORROSIONSFEST NICHT HYGROSKOPISCH
LEICHT FÄRBBAR
SCHLECHT WÄRMEBESTÄNDIG (<120 °C)
Schwefel
Hygroskopisch
In der Chemie und Physik die Eigen- schaft, Feuchtigkeit aus der Umge- bung (meist in Form von Wasser- dampf aus der Luftfeuchtigkeit) zu binden.