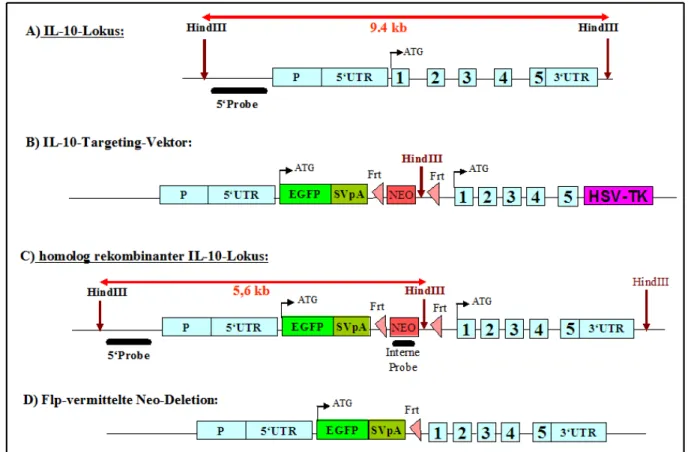
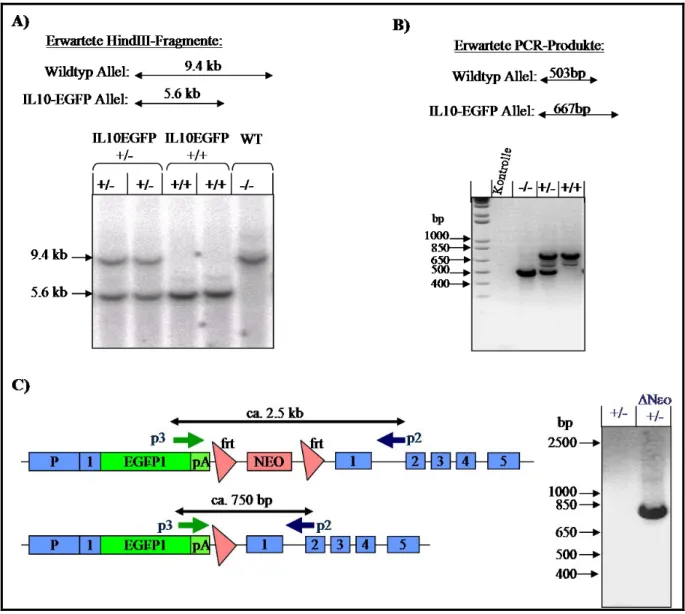
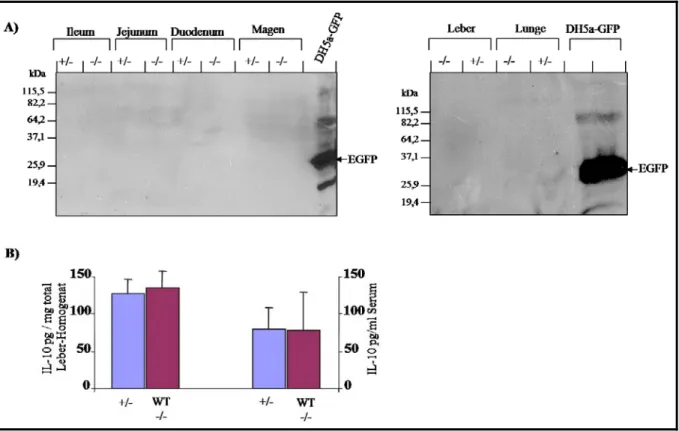
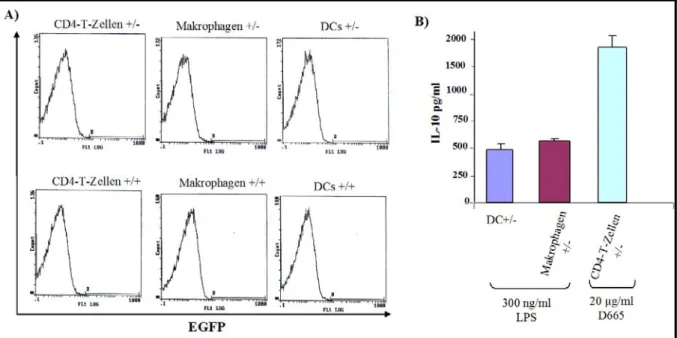
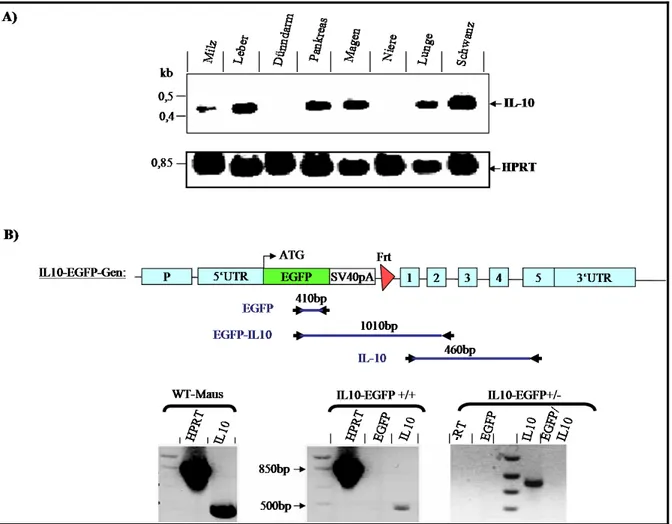
Etablierung von Interleukin-10 (IL-10)-Reportermäusen zur Identifizierung der IL-10-produzierenden Zellen in vivo
Volltext
Abbildung

ÄHNLICHE DOKUMENTE
In den Ergebnissen dieser Arbeit konnte kein Einfluss von CD80 oder CD86 auf die NK- Zell-Aktivierung durch sowohl TLR-DZ als auch cc-DZ nachgewiesen werden. Ob neben IL-12 noch
Interleukin-8 (IL-8) preferable to IL-6 as a marker for clinical infection. Clin Diagn Lab Immunol. Endothelial cell "memory" of inflammatory stimulation: human
Diese Ergebnisse zeigen, dass die Aktivierung von ERK1/2 für die Induktion der IL-10 Produk- tion auch in B-Zellen eine wichtige Rolle spielt und zur gesteigerten IL-10
Auch Kokulturen muriner Gefäßmuskelzellen, Fibroblasten oder Kardiomyozyten mit humanen mononukleären Zellen zeigten eine synergistische IL-6-Sekretion. Somit konnte
Neben ihrer Entstehung wurde auch die Funktion von IL10-produzierenden B-Zellen (B10) im Mausmodell untersucht. B10-Zellen sind in der Lage sowohl die Entstehung
Die Gene, die IL-1 α , IL-1 β und IL-1Ra kodieren, liegen beim Mensch in einem Genlocus auf dem Chromosom 2 und für einige Kombinationen dieser Gene wurde bereits
Neugeborene mit symptomatischer kongenitaler Toxoplasmose hatten signifikant erhöhte IL-18 Werte im Vergleich zu asymptomatischen Neugeborenen; lediglich tendenziell höhere IL-18 und
Weiterhin konnte mittels ELISA in T-Zell-Kokulturen mit PGN-stimulierten MoLC oder MoDC eine erhöhte Sekretion von IFN γ sowie IL-17, nicht jedoch von dem T