Leseprobe
Vorwort
Erfahrungsgemäß bereiten zwei grundlegende thermodynamische Größen besondere Ver- ständnisschwierigkeiten: die Entropie und das chemische Potenzial – die Entropie S als Part- nergröße zur Temperatur T und das chemische Potenzial ȝ als Partnergröße zur Stoffmenge n.
Während das Größenpaar S und T für alle Arten von Wärmeeffekten zuständig ist, regelt das Paar ȝ und n das stoffliche Geschehen, alles was mit der Umsetzung, Verteilung und Um- wandlung von Stoffen zu tun hat. Es zeigt sich, dass beide Größen durchaus auf der Grundla- ge unserer Alltagsvorstellungen definiert werden können.
Als ein auch für den Studienanfänger leicht nachvollziehbarer Einstieg in die physikalische Chemie wird daher in diesem Buch eine vollständige phänomenologische Charakterisierung der zentralen Größen, neben der Energie hier insbesondere S und ȝ, etwa in der Art eines Steckbriefes gewählt. Ergänzend wird ein direktes Messverfahren angegeben, eine Vorge- hensweise wie sie bei den Basisgrößen Länge, Zeit und Masse seit langem üblich ist.
Allein schon mit einer dieser zentralen Größen, dem chemischen Potenzial, befindet man sich bereits mitten im Herzen der Stoffdynamik. Von hier aus stehen die Zugänge zu einer Viel- zahl von Anwendungsgebieten des täglichen Lebens bis hin zur Quantenstatistik offen. Viele traditionell genutzte Größen wie Enthalpie H, Freie Enthalpie G und Aktivität a werden bei dieser Herangehensweise nicht mehr benötigt. Damit vereinfacht sich die Berechnung des Verhaltens der Stoffe erheblich und wird zugleich anschaulich nachvollziehbar.
Da in diesem Buch der Zugang zur Stoffdynamik direkt über das chemische Potenzial ge- wählt wird, beschränkt sich die Nutzung der Größe Entropie auf die Beschreibung der Wär- meeffekte. Für diesen Bereich behält die Entropie ihre grundlegende Bedeutung und wird dementsprechend ausführlich behandelt.
Schlüsselstellung des chemischen Potenzials ȝ
Entropie
Spektroskopie und Photochemie Mittelbare
Massenwirkung Gemische und Gemenge
Wärmeeffekte Grenzflächen-
erscheinungen
Reaktionskinetik Ionische Wechselwirkung Atome und Atomverbände
Molekularstatistik
Stofftransport
Galvanische Zellen Einfluss von Druck
und Temperatur
Säure-Base-Reaktionen Redox-Reaktionen
Antrieb chemischer Reaktionen Massenwirkung
ȝ
Das Buch vermittelt die Grundzüge der Stoffdynamik in drei Teilen
• Grundbegriffe und chemische Gleichgewichte (Statik)
• zeitlicher Ablauf von Stoffumbildungen (Kinetik)
• Mitwirkung elektrischer Felder (Elektrochemie)
und gibt damit gleichzeitig einen Überblick über wichtige Teilgebiete der physikalischen Chemie. Dabei wird konsequent an Beispiele aus dem Alltag und vor allem an eine Vielzahl ausgewählter Demonstrationsexperimente angeknüpft, da gerade die physikalische Chemie oft als sehr abstrakt und wenig alltagstauglich empfunden wird.
Der Adressatenkreis sind Studienanfänger mit Chemie im Haupt- und Nebenfach. Wir haben uns bemüht, sowohl in der Auswahl als auch in der Darstellung des Lehrstoffes diese Ziel- gruppe stets im Auge zu behalten. Für die meisten Abschnitte genügt mathematisches Grundwissen. Um die Strenge der Herleitungen zu wahren, wird bei darüber hinaus gehenden Anforderungen dem Leser entsprechende Hilfestellung gegeben (gekennzeichnet durch einen grauen Balken am Rand). Das Buch liefert auch das Rüstzeug für einführende Praktika der physikalischen Chemie.
Übungsaufgaben mit den zugehörigen Lösungen werden im Internet über die OnlinePLUS- Funktion auf der Verlagswebseite www.viewegteubner.de zur Verfügung gestellt. Detaillierte Beschreibungen zu einer Auswahl an Demonstrationsexperimenten (z.T. mit Videos) können unter www.job-stiftung.de/Lehrmaterialien abgerufen werden; diese Sammlung wird laufend ergänzt. Auch weiterführende Informationen zu den Themenbereichen Quantenstatistik, sta- tistische Behandlung der Entropie und Zusammenhang mit den üblichen Größen der Ther- modynamik, die den Rahmen dieser Ausgabe sprengen würden, sind ebenfalls auf der Web- seite der Job-Stiftung zu finden.
Unser besonderer Dank gilt Eduard J. Job†, dem Gründer der Job-Stiftung, der stets mit gro- ßem Engagement die Ziele der Stiftung verfolgt und damit insbesondere auch die Abfassung dieses Buches unterstützt hat. Geprägt durch eigene Erfahrungen mit den Schwierigkeiten des Faches – während seines Studiums, aber auch während der sich anschließenden beruflichen Tätigkeit als Unternehmer im Bereich des Brandschutzes –, war es sein spezielles Anliegen, durch eine vereinfachte Darstellung der Thermodynamik einen schnelleren Lernerfolg und damit erhöhten Nutzungsgrad zu erzielen.
Beim Vorstand der Job-Stiftung möchten wir uns herzlich für die stete Unterstützung und die große Geduld bedanken. Dem Vieweg+Teubner-Verlag, insbesondere Herrn Sandten und Frau Hoffmann, sind wir für die gute Zusammenarbeit sehr dankbar.
Über Diskussionsbeiträge sowie Anmerkungen zu Korrekturen würden wir uns sehr freuen.
Hamburg, im Juni 2010 Georg Job, Regina Rüffler
Inhaltsverzeichnis
1 Einführung und erste Grundbegriffe 1
1.1 Stoffdynamik . . . 1
1.2 Stoffe und Grundstoffe . . . 3
1.3 Messung und Metrisierung . . . 7
1.4 Stoffmenge . . . 13
1.5 Gemisch, Gemenge und Zusammensetzungsgrößen . . . 15
1.6 Zustand . . . 17
1.7 Stoffumbildung . . . 24
2 Energie 29 2.1 Zur Energie auf indirektem Wege . . . . 29
2.2 Direkte Metrisierung der Energie . . . 30
2.3 Energieerhaltung . . . . 35
2.4 Energie einer gespannten Feder . . . . 36
2.5 Druck . . . 38
2.6 Energie eines bewegten Körpers . . . . 40
2.7 Impuls . . . 41
2.8 Energie eines gehobenen Körpers . . . 43
3 Entropie und Temperatur 45 3.1 Vorüberlegung . . . 45
3.2 Makroskopische Eigenschaften der Entropie . . . 46
3.3 Molekularkinetische Deutung der Entropie . . . 48
3.4 Entropieerhaltung und –erzeugung . . . 50
3.5 Wirkungen wachsender Entropie . . . 53
3.6 Entropieübertragung . . . 56
3.7 Direkte Metrisierung der Entropie . . . 59
3.8 Temperatur . . . 62
3.9 Anwendungsbeispiele zur Entropie . . . 65
3.10 Temperatur als „thermische Spannung“ . . . 71
3.11 Energie zur Erzeugung und zur Zufuhr von Entropie . . . 72
3.12 Energie kalorimetrisch bestimmt . . . . 76
3.13 Wärmepumpen und Wärmemotoren . . . 78
3.14 Entropieerzeugung in einem Entropiestrom . . . 81
4 Chemisches Potenzial 85
4.1 Vorüberlegung . . . 85
4.2 Grundmerkmale des chemischen Potenzials . . . 87
4.3 Wettstreit der Stoffe . . . . 89
4.4 Bezugszustand und Werte des chemischen Potenzials . . . 92
4.5 Vorzeichen des chemischen Potenzials . . . . 96
4.6 Anwendung in der Chemie und Begriff des Antriebs . . . 99
4.7 Direkte Messung von Antrieben . . . 109
4.8 Indirekte Metrisierung des chemischen Potenzials . . . 114
5 Einfluss von Temperatur und Druck auf Stoffumbildungen 119 5.1 Einleitung . . . 119
5.2 Temperaturabhängigkeit von chemischem Potenzial und Antrieb . . . . 119
5.3 Druckabhängigkeit von chemischem Potenzial und Antrieb . . . 129
5.4 Gleichzeitige Temperatur- und Druckabhängigkeit . . . 134
5.5 Verhalten von Gasen unter Druck . . . 137
6 Massenwirkung und Konzentrationsabhängigkeit des chemischen Potenzials 141 6.1 Der Begriff der Massenwirkung . . . 141
6.2 Konzentrationsabhängigkeit des chemischen Potenzials . . . . 142
6.3 Konzentrationsabhängigkeit des Antriebs . . . . 146
6.4 Das Massenwirkungsgesetz . . . . 152
6.5 Spezielle Fassungen der Massenwirkungsgleichung . . . 157
6.6 Anwendungen des Massenwirkungsgesetzes . . . 158
6.7 Potenzialdiagramme gelöster Stoffe . . . . 167
7 Konsequenzen der Massenwirkung: Säure-Base-Reaktionen 172 7.1 Einführung . . . 172
7.2 Der Säure-Base-Begriff nach BRØNSTED und LOWRY . . . . 172
7.3 Das Protonenpotenzial . . . 174
7.4 Pegelgleichung und Protonierungsgleichung . . . 184
7.5 Säure-Base-Titrationen . . . . 188
7.6 Puffer . . . . 192
7.7 Säure-Base-Indikatoren . . . . 197
Inhaltsverzeichnis IX
8 Begleiterscheinungen stofflicher Vorgänge 200
8.1 Vorüberlegung . . . 200
8.2 Raumanspruch . . . . 200
8.3 Umsatzbedingte Volumenänderungen . . . 207
8.4 Entropieanspruch . . . . 208
8.5 Umsatzbedingte Entropieänderungen . . . 212
8.6 Energieumsätze bei Stoffumbildungen . . . 214
8.7 Wärmeeffekte . . . . 217
8.8 Kalorimetrische Antriebsmessung . . . 225
9 Querbeziehungen 228 9.1 Hauptgleichung . . . 228
9.2 Mechanisch-thermische Querbeziehungen . . . 233
9.3 Querbeziehungen für chemische Größen . . . 236
9.4 Weitere Anwendungen im mechanisch-thermischen Bereich . . . 243
10 Dünne Gase aus molekularkinetischer Sicht 248 10.1 Einleitung . . . 248
10.2 Allgemeines Gasgesetz . . . . 248
10.3 Molekularkinetische Deutung des allgemeinen Gasgesetzes . . . 252
10.4 Anregungsgleichung und Geschwindigkeitsverteilung . . . 259
10.5 Barometrische Höhenformel und BOLTZMANN-Verteilung . . . 268
11 Übergang zu dichteren Stoffen 270 11.1 Die VAN DER WAALS-Gleichung . . . 270
11.2 Kondensation . . . 274
11.3 Die kritische Temperatur . . . 277
11.4 Die Siededruckkurve (Dampfdruckkurve) . . . 278
11.5 Das vollständige Zustandsdiagramm . . . . 282
12 Stoffausbreitung 288 12.1 Vorüberlegung . . . 288
12.2 Diffusion . . . . 290
12.3 Mittelbare Massenwirkung . . . 292
12.4 Osmose . . . . 295
12.5 Dampfdruckerniedrigung . . . 300
12.6 Gefrierpunktserniedrigung und Siedepunktserhöhung . . . 302
12.7 Kolligative Eigenschaften und Molmassenbestimmung . . . 305
13 Gemische und Gemenge 308
13.1 Einführung . . . 308
13.2 Chemisches Potenzial in Gemischen . . . . 310
13.3 Zusatzpotenzial . . . . 314
13.4 Chemisches Potenzial von Gemischen und Gemengen . . . 315
13.5 Mischungsvorgänge . . . 320
13.6 Weitere Phasenreaktionen . . . . 324
14 Zweistoffsysteme 326 14.1 Zweistoffzustandsdiagramme . . . . 326
14.2 Zustandsdiagramme flüssig-flüssig (Mischungsdiagramme) . . . 327
14.3 Zustandsdiagramme fest-flüssig (Schmelzdiagramme) . . . . 330
14.4 Zustandsdiagramme flüssig-gasig (Dampfdruck- bzw. Siedediagramme) . . . . 337
15 Grenzflächenerscheinungen 348 15.1 Oberflächenspannung, Oberflächenenergie . . . 348
15.2 Oberflächeneffekte . . . 351
15.3 Adsorption an Flüssigkeitsoberflächen . . . . 356
15.4 Adsorption an Feststoffoberflächen . . . . 358
15.5 Anwendung der Adsorption . . . 364
16 Grundzüge der Kinetik 365 16.1 Einführung . . . 365
16.2 Umsatzgeschwindigkeit einer chemischen Reaktion . . . . 368
16.3 Geschwindigkeitsdichte . . . 370
16.4 Messung der Geschwindigkeitsdichte . . . 372
16.5 Geschwindigkeitsgesetze einstufiger Reaktionen . . . . 377
17 Zusammengesetzte Reaktionen 388 17.1 Einführung . . . 388
17.2 Gegenläufige Reaktionen . . . . 388
17.3 Parallel- oder Nebenreaktionen . . . . 392
17.4 Folgereaktionen . . . 395
Inhaltsverzeichnis XI
18 Theorie der Reaktionsgeschwindigkeit 400
18.1 Temperaturabhängigkeit der Reaktionsgeschwindigkeit . . . . 400
18.2 Stoßtheorie . . . 402
18.3 Theorie des Übergangszustandes . . . . 405
18.4 Molekulare Deutung des Übergangszustandes . . . 410
19 Katalyse 414 19.1 Einführung . . . 414
19.2 Wirkungsweise eines Katalysators . . . 416
19.3 Enzymkinetik . . . 419
19.4 Heterogene Katalyse . . . . 426
20 Transporterscheinungen 430 20.1 Diffusionskontrollierte Reaktionen . . . 430
20.2 Geschwindigkeit der Stoffausbreitung . . . 431
20.3 Fließfähigkeit . . . 439
20.4 Entropieleitung . . . 443
20.5 Vergleichender Überblick . . . . 447
21 Elektrolytlösungen 450 21.1 Elektrolytische Dissoziation . . . . 450
21.2 Elektrisches Potenzial . . . . 454
21.3 Ionenwanderung . . . 456
21.4 Leitfähigkeit von Elektrolytlösungen . . . 460
21.5 Konzentrationsabhängigkeit der Leitfähigkeit . . . . 464
21.6 Überführungszahlen . . . 469
22 Elektrodenreaktionen und Galvanispannungen 475 22.1 Galvanispannung und elektrochemisches Potenzial . . . 475
22.2 Elektronenpotenzial in Metallen und Berührspannung . . . 477
22.3 Galvanispannung zwischen Metall und Lösung . . . 480
22.4 Redoxreaktionen . . . 484
22.5 Galvanispannung von Halbzellen . . . 487
22.6 Galvanispannung an Flüssigkeitsgrenzflächen . . . 494
22.7 Galvanispannung an Membranen . . . 496
23 Redoxpotenziale und galvanische Zellen 501
23.1 Messung von Redoxpotenzialen . . . 501 23.2 Zellspannung . . . 510 23.3 Technisch wichtige galvanische Elemente . . . . 515
Anhang 521
A1 Mathematische Grundlagen . . . 521 A2 Tabellen . . . . 534
Sachverzeichnis 549
3 Entropie und Temperatur
Gegenstand: Grundzüge der Thermodynamik („Wärmekraftlehre“) als Schwesterwissen- schaft der Stoffdynamik („Stoffkraftlehre“).
3.1 Vorüberlegung
Kernbegriffe der Wärmelehre sind Entropie S und Temperatur T. Während die Temperatur jedoch jedermann geläufig ist, gilt die Entropie als beson- ders schwierig, sozusagen als „schwarzes Schaf“ unter den physikochemi- schen Begriffen. Schulbücher haben sie früher ganz übergangen, einfüh- rende Physikbücher haben sie oft nur erwähnt und selbst Fachleute umge- hen sie gern.
Doch warum meidet man eigentlich die Entropie? Denn an sich ist sie etwas ganz Einfaches:
recht genau das, was man sich im Alltag unter Wärme vorstellt! Sie ist, grob gesagt, das Et- was, was man in einem Suppentopf anreichern muss, um das Kochgut zu erwärmen, was der Kaffee verliert, wenn er in der Tasse erkaltet, was in der elektrischen Herdplatte, dem Mikrowellenherd, dem Ölofen erzeugt wird oder was im heißen Wasser befördert, über die Heizkör- per verteilt und durch wärmedämmende Wände in der Wohnung und wollene Kleidung im Leib zusammengehalten wird. Leider wurde früher der Name „Wärme“ in der Wissenschaft an eine andere Größe vergeben und damit S einer natürlichen Deutung beraubt. So wurde die Entropie nur abstrakt einführbar, d.h. indirekt durch Integration eines aus Energie und Tem- peratur gebildeten Quotienten definiert, und damit begrifflich schwer zu handhaben. Sehr gebräuchlich ist auch die atomistische Deutung der Entropie als ein Maß für die Wahrschein- lichkeit des Zustandes eines Systems aus vielen Teilchen. Doch muss in der Chemie aus den atomistischen Vorstellungen auf das Handeln im Labor geschlossen werden, d.h., man muss die auf einer Ebene gewonnenen Einsichten auf die andere übertragen können – und das möglichst direkt. Wie das machbar ist, soll im Folgenden dargestellt werden.
Zur Illustration wollen wir die Entropie zunächst – ähnlich wie schon die Energie – anhand einiger typischer, leicht beobachtbarer Eigenschaften charakterisieren, ganz so, wie man eine gesuchte Person mit Hilfe einiger gut erkennbarer, für sie bezeichnender („phänomenologi- scher“) Merkmale beschreibt (z.B. Körpergröße, Haarfarbe, Augenfarbe usw.). Das Bündel dieser Merkmale ist im Grunde das, was eine Person ausmacht, ihr Name nur ein Kürzel für dieses Bündel. Der Steckbrief einer gesuchten Person stellt ein Beispiel für ein solches, aller- dings stark gekürztes Merkmalsbündel dar. Ziel ist also eine Art „Steckbrief“ der Entropie zu entwerfen, der ausreicht, um sie als messbare physikalische Größe zu definieren. Diese Be-
G. Job, R. Rüffler, Physikalische Chemie, DOI 10.1007/978-3-8348-9834-0_3,
© Vieweg+Teubner Verlag | Springer Fachmedien Wiesbaden GmbH 2011
schreibung werden wir anschließend untermauern und begründen, indem wir auf atomisti- sche, nur in Gedanken konstruierte und der Thermodynamik als ursprünglich rein makrosko- pischer Theorie eigentlich fremde Vorstellungen zurückgreifen. Als zusätzliche Verständnis- stütze sollten wir jedoch die Denkmöglichkeit „Entropie ≈ Alltagswärme“ im Auge behalten.
Nach der phänomenologischen Charakterisierung wollen wir erörtern, wie man für diesen Begriff ein Maß einführen kann, und zwar direkt, d.h. ohne Rückgriff auf andere Größen (direkte Metrisierung) (Abschnitt 3.7).
3.2 Makroskopische Eigenschaften der Entropie
Beginnen wir also mit den Merkmalen, die für unsere Alltagserfahrungen bedeutsam sind.
Man kann sich die Entropie als ein gewichtsloses, strömungsfähiges Etwas vorstellen, das in jedem Ding unserer Umwelt in größerer oder kleinerer Menge enthalten ist. Im physikali- schen Kalkül stellt sie wie Masse, Energie, Impuls, elektrische Ladung, Stoffmenge eine mengenartige Größe dar, das heißt, sie ist wie die anderen Größen ein Maß für die Menge von etwas, was man sich im Raum verteilt denken kann, wobei es nicht darauf ankommt, ob dieses Etwas materiell oder immateriell, ruhend oder strömend, unvergänglich oder veränder- lich ist. Man kann sie in einem Materiebereich verteilen, anhäufen, einschließen oder umge- kehrt daraus herauspumpen, ausquetschen, an einen anderen Gegenstand abschieben. Die Entropiedichte ist hoch, wenn viel Entropie auf engem Raum zusammengedrängt ist, und niedrig, wenn sie dünn verteilt ist.
Die Entropie verändert den Zustand eines Gegenstandes in auffälliger Weise. Wenn Materie, etwa ein Stück Wachs oder ein Stein, wenig Entropie enthält, empfindet man es als kalt, ent- hält dasselbe Stück dagegen viel bzw. sehr viel Entropie, fühlt es sich warm oder sogar heiß an. Vergrößert man die Entropiemenge ständig, dann beginnt das Stück zu glühen, erst dun- kelrot, dann leuchtend weiß, schmilzt anschließend und verdampft schließlich wie etwa ein Eisenklotz oder es wandelt und zersetzt sich auf andere Weise wie z.B. ein Holzkloben. Man kann die Entropie auch aus einem Gegenstand herausholen und in einen anderen hineinbrin- gen; dann wird der erste Gegenstand kälter und der andere wärmt sich auf. Kurz gesagt: Die Entropie ist bei allen Wärmeeffekten im Spiele und kann als deren eigentliche Ursache be- trachtet werden. Ohne Entropie gibt es kein warm und kalt und keine Temperatur. Durch diese augenfälligen Wirkungen können wir auch ohne Messgerät Verbleib und Verhalten der Entropie recht gut beobachten.
Die Entropie hat die Neigung, sich auszubreiten. In einem gleichförmigen Körper verteilt sie sich von selbst mehr oder weniger schnell gleichmäßig über das ganze Volumen, indem sie von Stellen mit hoher Entropiedichte, an denen der Körper besonders warm ist, in entropie- ärmere, kühlere Gebiete abströmt (Abb. 3.1).
3.2 Makroskopische Eigenschaften der Entropie 47
Abb. 3.1: Entropieausbreitung
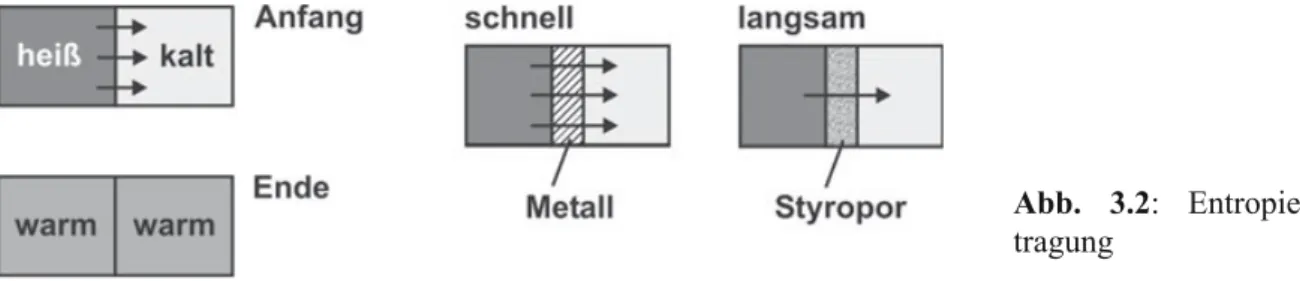
Berühren sich zwei verschieden warme Körper, dann fließt Entropie von dem wärmeren auf den kälteren Körper. Es gibt Stoffe, die die Entropie gut leiten, wie Silber, Kupfer, Alumini- um oder auch Diamant, und andere, die die Entropie nur recht langsam hindurchlassen, wie etwa Holz, Schaumstoffe oder Luft (Abb. 3.2). Gute Entropieleiter benutzt man, um Entropie zu übertragen, schlechte, um sie einzudämmen.
Abb. 3.2: Entropieüber- tragung
Die Entropie lässt sich leicht erzeugen. So entsteht sie z.B. in großen Mengen in der Heiz- wicklung einer Herdplatte, in der Flamme eines Ölbrenners, auf den reibenden Oberflächen einer Scheibenbremse, in den Muskeln eines Läufers, im Gehirn eines denkenden Menschen, ja praktisch überall, wo sich etwas in der Natur verändert (Abb. 3.3).
Abb. 3.3: Entropieerzeugung
Die bemerkenswerteste Eigenschaft der Entropie ist jedoch, dass sie zwar praktisch bei allen Vorgängen in kleinerer oder größerer Menge entsteht, dass man aber keine Mittel kennt, eine einmal entstandene Entropiemenge wieder zu zerstören. Der gesamte Vorrat an Entropie kann also nur zunehmen, niemals abnehmen! Wenn bei einem Vorgang Entropie entstanden ist,
dann kann er folglich nicht umgekehrt werden, also wie in einem zurückgespulten Film rückwärts laufen. Der Vorgang ist unumkehrbar oder irreversibel, wie man sagt. Das heißt jedoch nicht, dass sich der Ausgangszustand der beteiligten Körper nicht wieder einstellen lässt. Das kann auf Umwegen durchaus gelingen, aber nur unter der Bedingung, dass die entstandene Entropie irgendwohin abgeführt werden kann. Ist keine solche Deponie verfüg- bar oder nicht zugänglich, weil das System von entropiedichten (= wärmedichten oder adia- batischen) Wänden eingeschlossen ist, dann ist der Ausgangszustand in der Tat unerreichbar.
Da es Energie kostet, Entropie zu erzeugen, diese aber nicht wieder verschwinden kann, hat es den Anschein, als ginge hier Energie verloren. So dachte man auch noch bis zur Mitte des 19. Jahrhunderts. Erst in der zweiten Hälfte setzte sich die Erkenntnis allmählich durch, dass die Energie auch unter diesen Umständen erhalten bleibt (vgl. Abschnitt 2.3). Diese Einsicht bildet seitdem unter dem Namen 1. Hauptsatz der Wärmelehre einen der Grundpfeiler des ganzen Lehrgebäudes.
Die Aussage, dass Entropie erzeugt, aber nicht zerstört werden kann, ist der Inhalt des soge- nannten 2. Hauptsatzes der Wärmelehre, mit dem wir uns in Abschnitt 3.4 noch ausführlicher auseinandersetzen werden.
Fassen wir zusammen:
Energie kann weder erschaffen noch vernichtet werden (1. Hauptsatz).
Entropie kann zwar erzeugt, aber nicht zerstört werden (2. Hauptsatz).
3.3 Molekularkinetische Deutung der Entropie
Was ist das nun für ein Etwas, welches in der Materie strömt und diese, wenn es in größerer Menge darin enthalten ist, beim Berühren mit der Hand warm oder heiß erscheinen lässt? Seit mehr als zwei Jahrhunderten bemüht man sich, die Wärmeerscheinungen auf Bewegungen der Atome zurückzuführen und darauf aufbauend zu verstehen. Je wärmer ein Körper ist, desto heftiger und regelloser schwingen, kreiseln, wirbeln die Atome – so die Vorstellung –, desto größer ist die Unruhe und desto höher die atomare Unordnung.
Die Größe Entropie ist aus atomistischer Sicht ein Maß für
• die Menge der atomaren Unordnung in einem Körper
• und zwar hinsichtlich Art, Lage und Bewegung der Atome, genauer gesagt, hinsichtlich jedweden Merkmals, durch das sich Atomgesamtheiten voneinander unterscheiden kön- nen.
Hier stellen sich nun zwei Fragen:
• Was bedeutet Unordnung hinsichtlich Art, Lage und Bewegung?
• Was hat man sich unter Menge von Unordnung vorzustellen?
Zur Verdeutlichung der ersten Fragestellung denke man an eine Spielwiese im Stadtpark an einem heiteren Sonntag im Sommer: Tobende Kinder, Fußballspieler, Joggerinnen, aber auch Menschen, die sich ausruhen oder gar schlafen, mithin ein wildes Gewimmel rennender,
3.3 Molekularkinetische Deutung der Entropie 49
sitzender, liegender Leute ohne Ordnung in ihrer Verteilung oder ihren Bewegungen (Abb.
3.4). Das Gegenstück hierzu ist eine Tanzgruppe einer Revue – oder eine Kolonne Soldaten im Gleichschritt. Hier sind Stellung, Bewegung und Kostümierung im ganzen Verband wohl- geordnet. Die Unordnung wächst, wenn die Bewegung regellos wird, sie wächst aber auch, wenn die Ausrichtung nach Reih’ und Glied verloren geht oder die Art der Personen unein- heitlich wird. Alle drei, Regellosigkeit von Art, Stellung und Bewegung der Individuen, bestimmen die gesamte Unordnung.
Abb. 3.4: Beispiele aus dem Alltag für Personengruppen, die nach Art, Lage und Bewegung zunehmend ungeordnet sind
Gleiches gilt für die Welt der Atome (Abb. 3.5). Nicht nur die Unordnung in der Art und Verteilung der Atome, sondern auch die in ihrer Bewegung, die sich in einer mehr oder min- der starken Unruhe äußert, liefert einen wichtigen Beitrag zur Entropie. So sind die Atome in einem heißen Gas vergleichbar mit einer tobenden Schulklasse auf dem Schulhof. Die Bewe- gung ist völlig frei und regellos und die Unruhe, d.h. die Unordnung hinsichtlich der Bewe- gung, damit groß. Die Atome in einem kühlen Kristall kann man hingegen mit einer müden Schulklasse im Reisebus vergleichen. Die Bewegung ist mehr oder minder an feste Plätze gebunden und die Unordnung und Unruhe damit klein.
Um eine Vorstellung zu gewinnen, was mit Menge an Unordnung gemeint ist, denke man sich eine häusliche Büchersammlung von vielleicht hundert Bänden, die ein Besucher durchstö- bert und dabei völlig durcheinander gebracht hat. Das Ausmaß der Unordnung scheint groß, doch in wenigen Stunden ist der alte Zustand wiederhergestellt; d.h. trotz hoher Unord- nungsdichte ist die Menge der Unordnung klein. Vergleichen wir damit den Zustand einer großen Universitätsbibliothek in dem Falle, dass nur jeder hundertste Band falsch eingeord- net ist. Auf den ersten Blick wäre von einer Unordnung kaum etwas zu sehen, und doch wäre das Ausmaß der Unordnung, gemessen etwa an der Mühe, die verstellten Bücher an ihre Plätze zurückzuschaffen, unvergleichlich größer. Die Dichte der Unordnung ist zwar gering, ihre gesamte Menge aber sehr groß.
Abb. 3.5: Teilchenverband in Zuständen wachsender Entropie: a) Verband in jeder Hinsicht wohlgeord- net, b), c) Lagen zunehmend gestört, d), e) Bewegung zunehmend ungeordnet, f), g) Teilchen zuneh- mend verschieden (Art, Ausrichtung, Anregung ...). Der Pfeil kennzeichnet Betrag und Richtung des Impulses (und nicht der Geschwindigkeit) (diese Unterscheidung ist wichtig, wenn man die Entropie von Teilchen verschiedener Masse vergleichen will).
3.4 Entropieerhaltung und -erzeugung
Die atomare Unordnung in einem warmen Gegenstand und damit seine Entropie hat nun bemerkenswerte und wohlbestimmte Eigenschaften, von denen wir schon einige erwähnt haben und mit denen wir uns im Folgenden ausführlicher befassen wollen.
In einem thermisch isolierten, sich selbst überlassenen, ungestörten Körper bleibt die atomare Unordnung und Unruhe unvermindert und zeitlich unbegrenzt erhalten. Jeder Gegenstand enthält Entropie, können wir sagen, deren Menge S nicht abnehmen kann, wenn er entropie- dicht (wärmedicht, adiabatisch) umhüllt ist (Abb. 3.6).
Abb. 3.6: Entropieerhaltung in einem thermisch isolierten System.
Die Entropie wird durch die regellose Schraffur veranschaulicht. Die Menge an Druckerschwärze versinnbildlicht dabei die Entropiemenge, die Dichte der Schraffur die Entropiedichte. Betrachtet man Körper aus gleichem Material, so ist eine höhere Entropiedichte auch mit einer höheren Temperatur verbunden.
3.4 Entropieerhaltung und -erzeugung 51
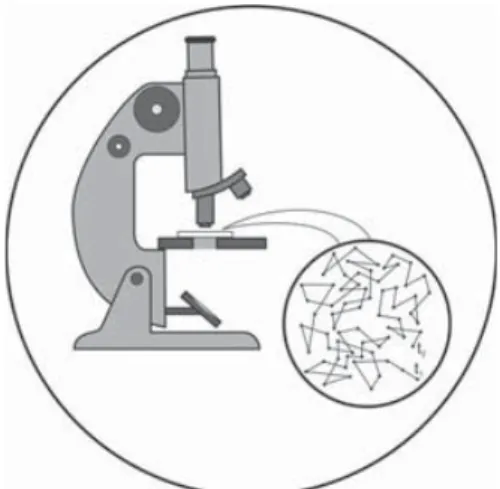
Die Unruhe äußert sich direkt sichtbar in der BROWNschen Bewegung, einer zittrigen, regel- losen Wanderung winzigster, in einer Flüssigkeit aufgeschwemmter (z.B. Fetttröpfchen in Milch) oder in einem Gas aufgewirbelter Teilchen (z.B. Rauchteilchen in Luft). Man kann dieser Bewegung beliebig lange unter dem Mikroskop zusehen, ohne dass sie irgendwie nachlässt (Versuch 3.1).
Versuch 3.1: BROWNsche Bewegung
Ein Körper enthält je nach seinem Zustand mehr oder weniger Entropie. Nach Art und Zu- stand gleiche Körper enthalten gleiche Entropiemengen. Die Entropie eines zusammengesetz- ten Körpers ist die Summe der Entropien seiner Teile, was unmittelbar aus dem mengenarti- gen Charakter der Größe folgt. Zusammenfassend können wir auch sagen: Die Entropie in einem Körper ist eine mengenartige (oder auch extensive) Größe, die neben anderen Größen dessen Zustand bestimmt (Abb. 3.7).
Abb. 3.7: Entropie als mengenartige Zustandsgröße (es gilt: S1
≈ S2≈ S3≈ S4 sowie Sges= S1 + S2 + S3 + S4)
Wenn wir ein entropiedicht eingeschlossenes Stück Materie vorsichtig verdichten, z.B. einen Eisenklotz mit Hilfe einer hydraulischen Presse oder ein Gas in einem Zylinder mit einem Kolben, dann nimmt die Unruhe im Innern zu, die Teilchenbewegung wird schneller. Das ist leicht zu verstehen: Ein Atom, das auf ein ihm entgegenkommendes Teilchen stößt, prallt – wie ein Tennisball vom Schläger getroffen – beschleunigt zurück. Während des Verdichtens spielt sich dieser Vorgang an unzähligen Stellen im Innern gleichzeitig ab, so dass die Unruhe überall gleichmäßig wächst. Entlasten wir das Stück Materie danach allmählich, dann beruhi- gen sich die Atome wieder und es stellt sich der ursprüngliche Zustand wieder ein. Auch dies ist verständlich, da der Stoß auf ein zurückweichendes Teilchen den Rückprall mindert. So
oft man auch Verdichtung und nachfolgende Entspannung wiederholt – behutsames Vorgehen vorausgesetzt −, immer findet man am Ende die anfängliche Unruhe wieder.
Die atomare Unordnung bleibt bei Vorgängen dieser Art erhalten. Im verdichteten Zustand ist zwar die Unruhe, wie beschrieben, stärker und die Bewegung folglich ungeordneter. Zugleich ist aber der Bewegungsspielraum der Atome eingeengt, so dass sie hinsichtlich ihrer Lage erzwungenermaßen besser geordnet sind als vorher. Daher ist es einleuchtend, wenn wir unterstellen, dass der Umfang der atomaren Unordnung beim vorsichtigen Zusammendrücken oder Dehnen nicht zu- und dann wieder abnimmt, sondern unverändert bleibt, und zwar auch in allen Zuständen dazwischen (Abb. 3.8). Das ist ein wichtiger Tatbestand, den wir aus- drücklich festhalten wollen: Die Entropie bleibt bei umkehrbaren oder reversiblen Vorgängen erhalten.
Abb. 3.8: Entropieerhaltung bei vorsichtigem Verdichten und Entspannen (reversibler Vorgang)
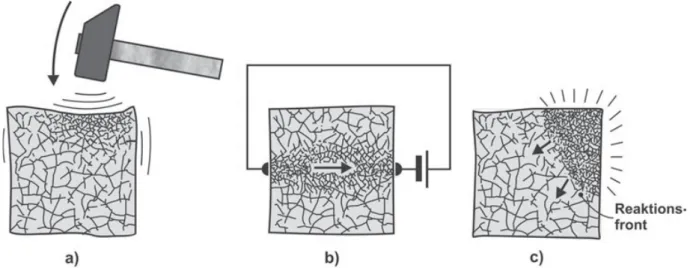
Die Unordnung wächst jedoch in einem entropiedicht eingeschlossenen Körper, wenn man das atomare Gefüge nachhaltig stört. Das kann grob mechanisch geschehen durch den Schlag mit einem Hammer oder etwas sanfter, in dem man zwei Gegenstände gegeneinander reibt.
Wenn der Gegenstand elektrisch leitend ist, kann man auch einen Ladungsstrom hindurch- schicken, d.h. Elektronen, die man durch Anlegen einer Spannung beschleunigt hat, auf die Atome prallen lassen. Weitere Mittel sind der Stoß schneller Teilchen, die bei vielen chemi- schen oder kernchemischen Umsetzungen gebildet werden, die Bestrahlung mit Licht, die Behandlung mit Ultraschall und vieles andere mehr (Abb. 3.9).
Abb. 3.9: Entropieerzeugung beispielsweise a) mechanisch durch Schlag mit einem Hammer, b) elekt- risch durch Elektronenstoß, c) chemisch durch den Aufprall bei Reaktionen fortgeschnellter Atome
3.5 Wirkungen wachsender Entropie 53
Die Entropie verteilt sich dabei mehr oder weniger schnell vom Ort der Entstehung über den ganzen Körper. Auch hierbei entsteht Entropie, wenn dies auch nicht so leicht erkennbar ist.
Alle diese entropieerzeugenden Vorgänge sind unumkehrbar oder irreversibel. Wenn also Entropie auf diese Weise entstanden ist, dann werden wir sie nicht wieder los, es sei denn, es gelingt uns, sie in die Umgebung abzuschieben. Aber gerade das sollte ja die Wärmedäm- mung verhindern.
Halten wir fest: In einem entropiedicht umhüllten Körper kann die Entropie zwar zunehmen, aber nie abnehmen; allenfalls bleibt ihre Menge erhalten. Dies ist, wie gesagt, der Inhalt des 2. Hauptsatzes der Thermodynamik. Wir können auch formulieren: Die Entropie in einem thermisch isolierten System nimmt bei irreversiblen Vorgängen stets zu. Bei reversiblen Pro- zessen bleibt sie hingegen konstant. Formaler ausgedrückt:
irrev.
2 1
rev.
S =S t( )−S t( ) ≥ 0 für t2 > t1 in einem thermisch isolierten System. (3.1) Dabei bedeutet t die Zeit. Das gilt natürlich erst recht für ein sogenanntes abgeschlossenes System, bei dem jeder Kontakt mit der Außenwelt unterbunden ist, sei es durch Entropie-, Energie- oder Stoffaustausch.
3.5 Wirkungen wachsender Entropie
Wenn man die Entropie und damit die atomare Unordnung im Innern eines Materiestückes laufend erhöht, dann macht sich dies bald in bestimmten äußeren Wirkungen bemerkbar.
Als Hauptwirkung wird das Materiestück wärmer (Abb. 3.10).
Abb. 3.10: Erwärmung als Hauptfolge eines Entropiezuwachses
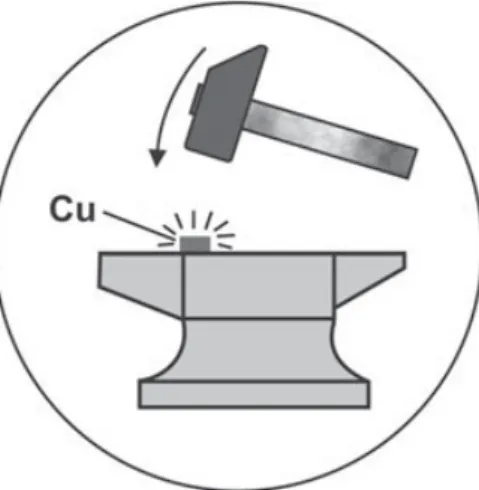
Ein Kupferklotz von einigen cm3 Größe wird nach 15 bis 20 kräftigen Schlägen mit einem schweren Hammer auf einem Amboss so heiß, dass es zischt, wenn man den Klotz in Wasser taucht (Versuch 3.2). Ein kräftiger Geselle kann ein Stück Eisen in wenigen Minuten sogar bis zur Rotglut schmieden.
Versuch 3.2: Kupferstück durch Schmieden erhitzen
Man kann auch formulieren: Von sonst gleichen Gegenständen ist der entropiereichste der wärmste, ein entropieleerer absolut kalt (Abb. 3.11).
Abb. 3.11: Ansonsten glei- che Gegenstände mit unter- schiedlichem Entropieinhalt
Die Entropie wandert dabei, wie erwähnt, freiwillig stets von wärmeren zu kälteren Orten (Abb. 3.12). Denn wenn schnell bewegte Atome auf langsamere prallen, dann werden sie selbst verzögert, während sie ihre Stoßpartner beschleunigen. Die Unruhe und damit die gesamte Unordnung an den wärmeren Stellen des Körpers klingt folglich allmählich ab, wäh- rend sie an den kälteren stetig zunimmt. In einem homogenen Körper läuft der Vorgang so- lange ab, bis die Unruhe überall den gleichen Pegel erreicht hat, der Körper mithin überall gleich warm ist. Man spricht dann auch von thermischem Gleichgewicht.
Abb. 3.12: Ausbreitung der Entropie in einem homogenen Körper
Ein Entropiezuwachs kann auch zahlreiche Nebeneffekte verursachen: Änderung des Volu- mens, der Gestalt, des Aggregatzustandes, der Magnetisierung usw. Schauen wir uns an, wie sich die fortlaufende Zunahme der Entropie auf einen Stoff in der Regel auswirkt:
3.5 Wirkungen wachsender Entropie 55
a) Die Materie dehnt sich immer weiter aus (Abb. 3.13). Diese Eigenschaft scheint uns ver- ständlich, da bewegte Atome umso mehr Platz beanspruchen, je stärker und regelloser ihre Bewegung ist. Man nennt diesen Vorgang thermische Ausdehnung.
Abb. 3.13: Ausdehnung durch Entropiezufuhr. Der Ausgangs- zustand wird durch die gestri- chelten Linien angedeutet.
So dehnt sich z.B. ein mit einem Gewicht gespannter Draht bei Stromfluss merklich aus, was durch die Absenkung des Gewichtes leicht beobachtet werden kann (Versuch 3.3). Wird der Strom wieder abgeschaltet, so entweicht die Entropie aus dem Draht in die Luft und der Draht spannt sich wieder.
Versuch 3.3: Ausdehnung eines stromdurchflossenen Drahtes
Ein Stoff, der sich bei Entropiezufuhr ausdehnt, wird umgekehrt beim Verdichten wärmer, wie wir im vorigen Abschnitt besprochen haben. Eiswasser ist eine der wenigen Ausnahmen, bei denen das Volumen mit wachsender Entropie abnimmt. Es wird daher noch kälter (< 0 °C), wenn man es presst.
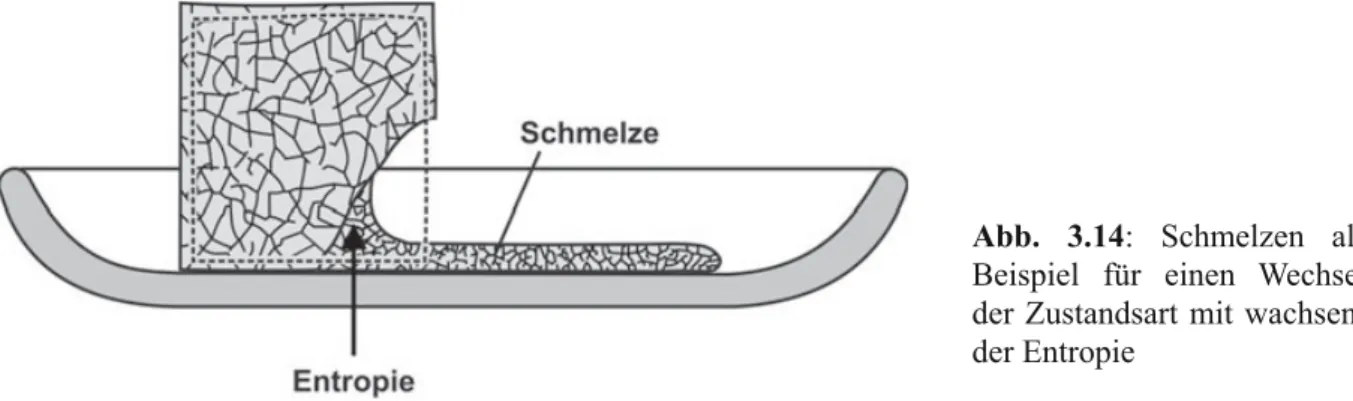
b) Das Materiestück schmilzt, verdampft oder zersetzt sich schließlich (Abb. 3.14). Das tritt ein, wenn die Unordnung und damit die Bewegung einen Grad erreicht hat, bei dem die Ato- me nicht mehr durch die Bindungskräfte in einem Gitter oder Teilchenverband zusammen- gehalten werden können, sondern aus diesem auszubrechen beginnen. Eine auf diese Weise entstehende Schmelze aus zwar noch zusammenhaltenden, aber gegeneinander leicht ver- schiebbaren Atomen oder Atomgruppen ist weit ungeordneter als der Kristallverband vorher, in dem die Atome weitgehend an feste Plätze gebunden waren. Die Schmelze ist folglich
entropiereicher als der gleich warme Feststoff. Solange noch Feststoff vorhanden ist, sammelt sich die hinzukommende Entropie in der entstehenden Flüssigkeit, so dass der schmelzende Stoff nicht wärmer wird. In diesem Fall wird also die Hauptwirkung der Entropie nicht spür- bar. Wechselt eine Stoffprobe an ihrem Schmelzpunkt vollständig vom festen in den flüssigen Zustand über, dann nimmt die Entropie im Innern um einen ganz bestimmten Betrag zu. Die- se Eigenschaft können wir, wie wir noch sehen werden, ausnutzen, um einen Entropiebetrag als Maßeinheit für Entropiemengen festzulegen.
Abb. 3.14: Schmelzen als Beispiel für einen Wechsel der Zustandsart mit wachsen- der Entropie
Ganz analog nimmt am Siedepunkt der gebildete Dampf die zusätzliche Entropie auf, was verhindert, dass die siedende Flüssigkeit heißer wird.
3.6 Entropieübertragung
Entropie kann auch von einem Gegenstand auf einen anderen übertragen werden. Berühren sich zwei Körper mit unterschiedlich heftiger Atombewegung, dann nimmt die Unruhe in dem einen Körper durch Verzögerung der Atome ab, im anderen durch ihre Beschleunigung zu. Die Unordnung fließt gleichsam von dem einen Körper in den anderen. Auch dieser Vor- gang läuft solange ab, bis die Unruhe überall den gleichen Pegel erreicht hat, d.h. thermi- sches Gleichgewicht erreicht ist (Abb. 3.15).
Abb. 3.15: Entropieleitung von einem wärmeren Körper, in dem sich die Atome schnell bewegen, auf einen kälteren, in dem die Atombewegung nur langsam ist
In absolut kalter Umgebung entweicht alle bewegliche Entropie, d.h., jegliche Bewegung der Atome kommt zum Stillstand. Dies ist der Inhalt des 3. Hauptsatzes der Thermodynamik. Die
3.6 Entropieübertragung 57
in Gitterfehlern gefangene Entropie ist bei tiefen Temperaturen jedoch nahezu unbeweglich.
Sie kann daher weder entweichen noch zur Warmheit eines Gegenstandes beitragen. Wer es versäumt, ein Gebäude oder einen Park, der nachts abgeschlossen wird, rechtzeitig zu verlas- sen, läuft Gefahr, eingesperrt zu werden. So kann die in den Gitterfehlern steckende Entropie auch nur entweichen, solange die Atombewegung noch stark genug ist, dass sich die Atome umlagern können. Beruhigt sich die Atombewegung in einer kalten Umgebung hingegen zu rasch, dann bleibt den Atomen keine Zeit, sich zu einem geordneten Gitterverband umzula- gern, zu kristallisieren, wie man sagt, und der Gegenstand erstarrt in einem mehr oder weni- ger amorphen Zustand. Diese unbewegliche, auch in absolut kalter Umgebung nicht abgege- bene Entropie heißt „Nullpunktsentropie“. Die Entropie jedes reinen (strenggenommen auch isotopenreinen), ideal kristallisierten Stoffes nimmt jedoch am absoluten Nullpunkt den Wert null an.
Doch kehren wir zur Entropieübertragung zurück: Selbst, wenn die Atombewegung in der oben beschriebenen Weise überall ausgeglichen ist, kann man erreichen, dass Unordnung von einem Gegenstand in einen anderen übertritt. Dazu braucht man nur einen der Körper zu- sammenzudrücken, um dort die Unruhe der Atome zu erhöhen, und der gewünschte Fließ- vorgang setzt ein. Je weiter man den Körper zusammenpresst, desto mehr Unordnung „fließt aus“ (ganz so, als ob man Wasser aus einem Schwamm ausdrückt). Entspannt man den Kör- per allmählich wieder, dann beruhigen sich die Atome mehr und mehr und die Unordnung beginnt wieder langsam zurückzufließen (der „Entropieschwamm“ „saugt sich voll“) (Abb.
3.16).
Abb. 3.16: Gelenkter Entropieaustausch zwischen zwei sich berührenden Körpern
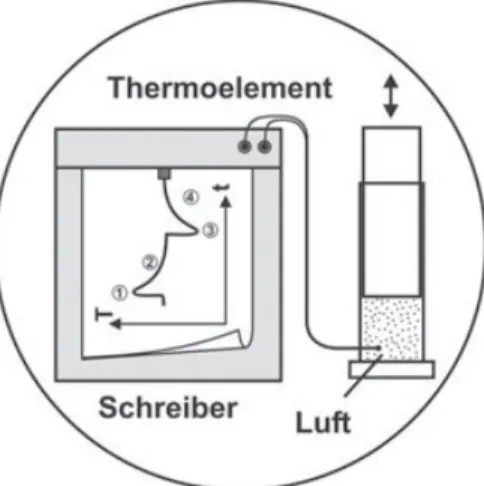
Diese Vorgänge beim elastischen Verdichten und Dehnen lassen sich besonders gut bei leicht zusammendrückbaren Stoffen wie Gasen beobachten. Verdichtet man Luft in einem Plexi- glaszylinder mit eingebautem Thermoelement mittels eines Kolbens (Versuch 3.4), so werden die Atome beschleunigt und das Gas somit wärmer (Phase 1). Wartet man etwas, dann kühlt sich das Gas wieder auf den Ausgangswert ab, da es gegen die Zylinderwände nicht isoliert ist (Phase 2). Die Expansion des Kolbens führt zu einer weiteren Abkühlung (Phase 3). Beim anschließenden Warten fließt jedoch wieder Entropie zu und das Gas wärmt sich auf (Phase 4). Je langsamer man dabei vorgeht, desto mehr verschwindet der Unterschied zwischen Hin- und Rückweg.
Versuch 3.4: Verdichten und Entspannen von Luft
Freiwillig fließt die Entropie stets von einem Gegenstand mit höherem Unruhepegel zu einem solchen mit geringerem, wie wir gesehen haben. Aber man kann sie auch unschwer in umge- kehrter Richtung befördern (Abb. 3.17). Dazu verwendet man am besten einen Hilfskörper, eine Art „Entropieschwamm“, der sich leicht zusammendrücken und wieder entspannen lässt, zum Beispiel ein Gas in einer dehnbaren Hülle. Wenn man einen solchen Hilfskörper, der im Kontakt mit einem Gegenstand steht, ausdehnt, nimmt er Unordnung aus diesem auf. Die aufgenommene Unordnung kann man nun auf einen beliebigen anderen Gegenstand übertra- gen, indem man den Hilfskörper zusammendrückt, nachdem man ihn in Berührung mit die- sem Gegenstand gebracht hat. Wenn man den Vorgang wiederholt, lassen sich beliebige Ent- ropiemengen übertragen.
Abb. 3.17: Entropieübertragung mittels eines Hilfskörpers. Auf der linken Seite wird der Hilfs- körper entspannt und nimmt dabei Entropie aus dem Gegenstand auf, auf der rechten Seite wird er zusammengedrückt und gibt dabei Entropie an einen anderen Gegenstand ab.
Jeder Kühlschrank pumpt nach diesem Prinzip Entropie aus dem Kühlfach in die warme Zimmerluft (Abb. 3.18). Das niedrigsiedende Kühlmittel (in der Funktion des Hilfskörpers) zirkuliert dabei in einem geschlossenen Kreislauf. Der Entropieübergang erfolgt durch eine Rohrschlange aus einem gut leitendem Material wie Kupfer oder Aluminium, die sich im Innern des Kühlschranks befindet (Wärmetauscher). Bei älteren Modellen ist diese Rohr- schlange noch gut zu sehen, bei modernen ist sie in die Wand des Gefrierfachs eingelassen.
Die Flüssigkeit verdampft und nimmt dabei Entropie auf. Der Verdichter saugt das gasige Kühlmittel an und presst es zusammen, wobei es warm wird. Die Entropie wird über eine
3.7 Direkte Metrisierung der Entropie 59
zweite Rohrschlange, die einen großen Teil der Rückseite des Kühlschrankes einnimmt, an die Luft abgegeben. (Dies kann man leicht daran feststellen, dass diese Rohrschlange warm ist, so lange der Kühlschrank läuft.) Das Kühlmittel kondensiert dabei, wird also wieder flüs- sig. Über das Entspannungsventil wird die Flüssigkeit schließlich auf den Ursprungsdruck entspannt, wobei sie zum Teil verdampft und sich dadurch abkühlt. Der Kreislauf ist ge- schlossen.
Abb. 3.18: a) Funktionsprinzip eines Kühlschranks und b) technische Realisierung (nach: E. Leitner, U. Finck, F. Fritsche, www.leifiphysik.de)
Mit einigem Geschick und der nötigen Behutsamkeit während des Verdichtens und Entspan- nens, d.h. bei (nahezu) reversibler Prozessführung, lässt sich erreichen, dass die Unordnung bei der Übertragung nicht nennenswert vermehrt wird, so dass sie auf diese Weise wie eine Art Substanz von einem Körper in einen anderen umgefüllt werden kann. Man könnte etwa die Entropie aus einem Stück Kreide herausholen und auf Eiswürfel übertragen. Dabei würde sich die Kreide abkühlen, während die Eiswürfel zu schmelzen anfingen.
Zusammenfassend können wir festhalten: Der Entropieinhalt S eines Raumbereiches kann auf verschiedene Weisen zunehmen, etwa durch Erzeugung im Innern, Se(rzeugt) (vgl. Abschnitt 3.4) oder durch Austausch mit der Umgebung, Sa(usgetauscht) (und zwar konduktiv durch „Lei- tung“ in ruhender Materie, S oder konvektiv, mitgeführt in einem Materiestrom, Sk(onvektiv)):
e a e k
S =S +S =S +S +S . (3.2)
3.7 Direkte Metrisierung der Entropie
Die Übertragbarkeit der Entropie eröffnet eine gedanklich einfache Möglichkeit, die Menge, die davon in einem Körper enthalten ist, direkt zu messen. Eine Größe zu messen, heißt ja festzustellen, wie viel mal größer sie ist als eine vorgegebene Einheit. Als Einheit können wir irgendeine Entropiemenge wählen, z.B. diejenige, die nötig ist, um eine bestimmte Wasser-
masse um 1 °C zu erwärmen (z.B. 14,5 → 15,5 °C), ein vorgegebenes Ethervolumen zu verdampfen oder einen Eiswürfel zu schmelzen (Abb. 3.19). Damit diese Einheit genau be- stimmt ist, muss man Maße und Zustände der zu benutzenden Körper genau vorschreiben.
Wir hätten z.B. festzulegen, dass der zu schmelzende Eiswürfel 1 cm3 groß, blasenfrei und nicht unterkühlt sein soll und dass das entstehende Schmelzwasser nicht angewärmt werden darf. Statt 1 cm3 bietet es sich an, den etwas kleineren Wert 0,893 cm3 zu wählen, weil dies gerade die Entropiemenge ergibt, die der international vereinbarten Einheit entspricht. Diese Einheit wird auf eine besondere Weise festgelegt, auf die wir noch zurückkommen. Eine in einem Körper enthaltene Entropiemenge nennen wir z Einheiten groß, wenn sich damit z Einheits-Eiswürfel auftauen lassen. Diese Vorgehensweise ist vergleichbar mit dem „Aus- scheffeln“ von Getreide (Abschnitt 1.4) oder der Bestimmung einer Wassermenge durch Ausschöpfen mit einem Messgefäß.
Abb. 3.19: Entropiemes- sung durch Auszählen der
„Einheits“-Eiswürfel, die sich durch Übertragung der Entropie auf die Wür- fel schmelzen lassen
Statt Eiswürfel zu zählen, ist es einfacher, die beim Schmelzen des Eises entstandene Was- sermenge als Maß zu verwenden. Dies lässt sich zum Bau eines einfachen „Entropiemessge- rätes“ nutzen. Das Schmelzwasser nimmt nämlich ein geringeres Volumen ein als das Eis.
Dieser Volumenschwund wird zur Anzeige eingesetzt. So kann bei einer Flasche mit aufge- setzter Kapillare, die mit einem Eis-Wasser-Gemenge gefüllt ist (Eis-Wasser-Flasche) (Abb.
3.20 a), die Volumenänderung unmittelbar anhand der Absenkung des Wasserspiegels ver- folgt werden. Den ungewollten Austausch von Entropie kann man dabei durch eine gute Isolation verhindern, die ungewollte Erzeugung, indem man auf Umkehrbarkeit achtet.
Dieses Prinzip nutzt auch das „BUNSENsche Eiskalorimeter“ (Abb. 3.20 b). Das Glasgefäß wird mit reinem Wasser gefüllt, das U-Rohr mit Quecksilber. Das Innenrohr wird unter den Gefrierpunkt des Wassers z.B. durch Eingießen einer Kältemischung abgekühlt, so dass sich ein Eismantel bildet. Anschließend wird die zu vermessende Probe eingeführt. Infolge der Volumenverminderung durch das Schmelzen von einem Teil des Eismantels steigt der Queck- silberspiegel im Glasgefäß und der Quecksilberfaden in der Kapillare zieht sich zurück.
Wenn dafür gesorgt wird, dass während der Messung keine Entropie entweicht, hinzukommt oder erzeugt wird, dann ist die Flüssigkeitsverschiebung in der Kapillare der Entropieände- rung des Probekörpers proportional und die Ableseskale kann direkt in der Entropieeinheit kalibriert werden.
3.7 Direkte Metrisierung der Entropie 61
Abb. 3.20: a) Prinzip der direkten Entropiemessung mit der Eis-Wasser-Flasche und b) BUNSENsches Eiskalorimeter
Alternativ kann auch das Volumen der entstandenen Wassermenge bestimmt werden, indem man sie in einen Messzylinder abfüllt. Beispielsweise kann so die bei der chemischen Reakti- on von Eisen mit Schwefel zu Eisensulfid abgegebene Entropie mit Hilfe eines einfachen Eiskalorimeters gemessen werden (Versuch 3.5). Dabei entsprechen 0,82 mL Schmelzwasser der Entropieeinheit.
Versuch 3.5: Messung der während einer Umsetzung abge- gebenen Entropie mittels eines „Eiskalorimeters“
Bemerkenswert dabei ist, dass wir zwar das ganze Verfahren an Hand atomistischer Vorstel- lungen entwickelt haben, die auszuführenden Handlungen selbst aber vom Atomismus gar keinen Gebrauch machen. Tatsächlich werden nur makroskopische Körper bewegt – in Kon- takt gebracht und getrennt, verdichtet und entspannt und am Ende werden Eiswürfel gezählt, alles Handhabungen, die man sinnvoll auch ausführen kann, wenn man von Atomen nichts weiß. Für ein gezieltes Vorgehen genügt die eingangs erwähnte Vorstellung (Abschnitt 3.2), dass alle Dinge ein bewegliches, erzeugbares, aber unzerstörbares Etwas enthalten, das einen Gegenstand in der Regel umso wärmer erscheinen lässt, je mehr er davon enthält. Was man
sich sonst dabei denkt und wie man dieses Etwas nennt, ist für dessen Messung und Handha- bung ohne großen Belang. Auf einen Vorschlag von Rudolf CLAUSIUS hin war dieses Etwas Entropie genannt und die Größe mit dem Formelzeichen S bezeichnet worden.
3.8 Temperatur
Temperatur und Entropie hängen eng zusammen. Während die Entropie ein Maß für die Menge der in einem Körper vorhandenen atomaren Unordnung darstellt, beschreibt die Tem- peratur die Stärke der atomaren Unruhe, also die Heftigkeit der regellosen Atombewegung.
Die Temperatur stellt so etwas wie einen Unruhepegel dar, der niedrig ist, wenn die Atome und Moleküle sanft schwingen und rotieren, und höher, wenn die Atombewegung hektisch und turbulent wird. Die Temperatur in einem Körper ist somit vergleichbar mit der Windstär- ke in der Atmosphäre, wobei bei niedrigen Werten lediglich die Blätter wippen, während bei höheren bereits die Äste schwanken. Wie bei hohen Windstärken ganze Bäume brechen, werden bei hohen Temperaturen die Atome aus den Bindungen gerissen.
Doch wie können wir die Temperatur nun definieren? Dazu wollen wir von folgender Über- legung ausgehen: Je mehr Unordnung man in einem Körper schafft, d.h. je größer die Entro- pie ist, desto höher ist im Allgemeinen auch die Temperatur. Um z.B. Entropie zu erzeugen, also die Unordnung in einem Körper um den Betrag Se zu vermehren, ist eine gewisse Ener- gie W nötig. Das ist verständlich, wenn man bedenkt, dass man dazu z.B. Gasteilchen be- schleunigen, Teilchenschwingungen anstoßen, Rotationen verstärken oder Bindungen zwi- schen Atomen aufbrechen muss. Die verbrauchte Energie W ist um so größer, je mehr Atome zu bewegen, je mehr Bindungen zu zerreißen sind, d.h.,
e
W S .
Man muss aber auch um so mehr Energie aufwenden, je heißer der Körper bereits ist. Es soll versucht werden, das an einem Beispiel einsichtig zu machen. Denken wir uns einen Körper, der aus verschiedenen, teils locker, teils fest gebundenen Teilchen besteht. Man kann nun die atomare Unordnung vermehren, indem man die Teilchen zerstückelt und die Bruchstücke zerstreut. Wenn der Körper kalt und damit der Unruhepegel niedrig ist, die Teilchen sich also nur langsam bewegen, dann brechen bei irgendwelchen Zusammenstößen nur die schwächs- ten Bindungen, zu deren Spaltung nur wenig Energie nötig ist. Unter diesen Umständen kann man die Unordnung mit wenig Aufwand vergrößern, indem man durch eine gewisse Steige- rung der Unruhe weitere schwache Bindungen zerreißt. Ist der Körper hingegen warm, herrscht also bereits eine starke Unruhe, dann sind alle schwachen Bindungen längst gebro- chen. Will man jetzt die Unordnung weiter vergrößern, dann müssen nun die noch vorhande- nen festen Bindungen getrennt werden, was viel Energie kostet.
Halten wir also fest: Die Vermehrung der Entropie in einem Körper erfordert auch umso mehr Energie, je höher der Unruhepegel ist, d.h. je heißer der Körper uns erscheint. Diesen Tatbe- stand kann man zu einer allgemeinen Definition der Temperatur ausnutzen, einer Definition, die unabhängig von jeder Thermometersubstanz (wie z.B. Quecksilber oder Alkohol) bleibt.
3.8 Temperatur 63
Man setzt diese Größe der aufzuwendenden Energie proportional und nennt sie die thermo- dynamische Temperatur (oder auch absolute Temperatur), bezeichnet mit dem Buchstaben T:
W T .
Da der Aufwand ja auch wächst, je mehr Entropie man erzeugt, bezieht man die verbrauchte Energie auf die gebildete Entropiemenge. Man definiert:
e
T W
= S . (3.3)
Den Zusammenhang verdeutlicht noch einmal Abb. 3.21.
Abb. 3.21: Zusammenhang zwischen aufzuwendender Energie, erzeugter Entropie und thermodynamischer Temperatur
Weil die erzeugte Entropie die Temperatur des Körpers im Allgemeinen verändert, dürfen bei Anwendung der Definition nur sehr geringe Mengen Entropie erzeugt werden, um die Stö- rung vernachlässigen zu können. Den genauen Temperaturwert erhält man, wenn man zu verschwindend kleinen Entropiebeträgen übergeht:
e
d d T W
= S . (3.4)
Der Energieerhaltungssatz bürgt übrigens dafür, dass der Aufwand W nicht davon abhängt, mit welchen Mitteln wir die Entropie vermehren, so dass T stets einen eindeutigen Wert hat.
Da sowohl Energie als auch Entropie messbare Größen sind, und zwar unabhängig von jeder atomistischen Vorstellung, lässt sich auch die Temperatur T berechnen. Der Nullpunkt der Temperaturskale ist also nicht willkürlich wählbar, die Temperatur ist absolut bestimmbar.
Weil erfahrungsgemäß Entropie nur unter Verbrauch, nie unter Gewinn von Energie erzeugt wird, folgt aus W > 0 und Se > 0, dass auch T > 0 sein muss. Es gibt demnach keine negativen Temperaturen. Als konkretes Beispiel wollen wir die Bestimmung der Schmelztemperatur des Eises erörtern (Versuch 3.6). Nehmen wir ein Becherglas mit Eisstücken, in dem ein Tauch- sieder steckt. Wenn man den Tauchsieder einschaltet, entsteht in der Heizwicklung durch Elektronenstoß Entropie, die durch den Metallmantel an das Eis abgegeben wird. Das Eis schmilzt und an dem entstandenen Schmelzwasservolumen ist erkennbar, wie viel Entropie dem Eis zugeflossen ist. Die Energie, die zur Erzeugung der Entropie notwendig war, lässt sich aus der Leistungsangabe für den Tauchsieder und der gestoppten Zeit bestimmen. Der Quotient aus gemessenem Energie- und Entropiewert liefert den Wert der Temperatur.
Im internationalen Einheitensystem wurde nicht die Entropieeinheit als Basiseinheit gewählt, sondern die Temperatureinheit, die man Kelvin, abgekürzt K, nennt. Das geschieht dadurch,
dass man der Schmelztemperatur von reinem, luftfreiem Wasser, über dem sich in einem abgeschlossenen Gefäß keine Luft, sondern nur reiner Wasserdampf befindet, einfach einen Wert zuordnet, nämlich
0 273,16 K
T = . (3.5)
Versuch 3.6: Absolutbestimmung der Schmelztemperatur von Eis
Man bezieht sich also auf den sog. Tripelpunkt des Wassers, bei dem alle drei Aggregatzu- stände koexistieren, da dann der Druck nicht berücksichtigt werden muss. (Wenn Wasser sich am Tripelpunkt befindet, liegt der Druck zwangsläufig fest (vgl. Abschnitt 11.5).) Der Zah- lenwert wurde so krumm gewählt, damit der Temperaturunterschied zwischen normalem Gefrier- und Siedepunkt des Wassers wie in der Celsiusskale möglichst genau 100 Einheiten beträgt. Ein Kelvin ist damit der 273,16te Teil der thermodynamischen Temperatur des Tri- pelpunktes von Wasser. Der Nullpunkt der Kelvinskale liegt beim absoluten Nullpunkt, der durch die Entropieleere des Körpers gekennzeichnet ist. Will man den Zusammenhang zwi- schen thermodynamischer Temperatur T und Celsius-Temperatur ϑ herstellen, so ist zu be- achten, dass sich der Nullpunkt der Celsius-Skale auf den Gefrierpunkt von Wasser bei Nor- maldruck bezieht. Dieser liegt gerade 0,01 K unterhalb der Temperatur des Wasser- Tripelpunktes, so dass gilt:
273,15
K C
T = +
°ϑ . (3.6)
Durch obige Vereinbarung (Gleichung (3.5)) und unsere Definitionsgleichung für T wird mittelbar auch die Entropieeinheit festgelegt. Da die Einheit der Energie Joule (J) heißt, die Temperatureinheit Kelvin (K), ergibt sich für die Entropieeinheit 1 Joule/Kelvin (J/K). Das ist gerade die Entropiemenge, die 0,893 cm3 Eis bei der Temperatur T0 schmilzt. Wegen der grundlegenden Rolle, die die Entropie in der Thermodynamik spielt, ist jedoch die Verwen- dung einer eigenen Einheit gerechtfertigt. Nach einem Vorschlag Hugh Longbourne CAL- LENDARs (Proc. Phys. Soc. (London) 23 (1911) 173) wird sie zu Ehren S. CARNOTs „Carnot“
genannt, abgekürzt Ct = J/K. Der französische Ingenieur Nicolas Léonard Sadi CARNOT
(1796 – 1832) hat mit seinen Arbeiten über Wärmekraftmaschinen wesentlich zur Entwick- lung der Wärmelehre beigetragen.
3.9 Anwendungsbeispiele zur Entropie 65
3.9 Anwendungsbeispiele zur Entropie
Molare Entropie. Um einen Eindruck von den Werten der Entropie zu geben, betrachten wir einige Beispiele: Ein Stück Tafelkreide enthält etwa 8 Ct an Entropie. Bricht man es in der Mitte auseinander, dann enthält jede Hälfte etwa 4 Ct, da es sich bei der Entropie ja um eine mengenartige Größe handelt (beim Zerbrechen entsteht etwas Entropie, aber das ist so wenig, dass wir diese Menge nicht zu beachten brauchen).
Ein Eisenwürfel von 1 cm3 enthält ebenfalls rund 4 Ct, obwohl das Stück deutlich kleiner ist;
die Entropiedichte im Eisen ist also größer. Wird die Entropiemenge in einem solchen Würfel verdoppelt (Abb. 3.22), z.B. durch Hämmern oder Reiben oder durch Bestrahlen, dann be- ginnt das Eisen zu glühen. Verdreifacht man schließlich den Entropievorrat, dann fängt das Eisen an zu schmelzen.
Abb. 3.22: Auswirkungen einer Erhöhung des Entropieinhalts am Beispiel eines Eisenwürfels von 1 dm3 Rauminhalt
In 1 L Zimmerluft sind etwa 8 Ct enthalten, soviel wie in einem Stück Kreide. Dass es so wenig ist, trotz des über 100 mal größeren Volumens, liegt daran, dass die Luftprobe viel weniger Atome enthält als das Kreidestück mit seiner dichten Atompackung. Drückt man die Luft auf 110 des Volumens zusammen, dann wird sie glühend heiß (Abb. 3.23). Dieser Ef- fekt wird in Dieselmotoren ausgenutzt, um das Treibstoff-Luft-Gemisch zu zünden. Die Kompression muss schnell erfolgen, weil die Entropie aus dem erhitzten Gas sofort in die kalten Zylinderwände abfließt und sich das Gas so rasch wieder abkühlt. Beim Zusammen- drücken verliert 1 L Gas knapp eine Entropieeinheit. Wenn man das Gas auf 1100 des Aus- gangsvolumens verdichtet, kann man auf die gleiche Weise eine weitere Entropieeinheit her- ausdrücken.
Chemiker pflegen Entropien auf die jeweilige Stoffmenge zu beziehen, also anzugeben, wie viel Entropie auf 1 mol des betrachteten Stoffes entfällt. Diese Größe nennt sich molare En- tropie:
m S
S ≡ n molare Entropie für reine Stoffe. (3.7)
S und n bezeichnen Entropie und Menge der betrachteten Stoffprobe. Stoffformel oder -name werden als Argument in Klammern gesetzt, z.B. Sm(Fe) = 27,3 Ctmol−1.
Abb. 3.23: Änderung des Entropieinhalts mit steigendem Druck am Beispiel von Luft (1 dm3) (die Gasmoleküle werden durch Punkte angedeutet.)
Die molare Entropie hängt aber noch von der Temperatur und auch vom Druck ab. Will man die Werte tabellieren, ist daher eine Zusatzvereinbarung erforderlich. Im Allgemeinen bezieht man sich auf die chemischen Normbedingungen, d.h. 298 K (genauer gesagt 298,15 K) und 100 kPa (das entspricht der Zimmertemperatur von 25 °C und normalem Luftdruck). Zur Kennzeichnung des Normwertes fügen wir das Symbol an, also z.B.
m(Fe)=27, 3 Ct mol−1
S bei 298 K und 100 kPa.
Einige Werte sind in Tabelle 3.1 zusammengefasst.
Stoff Formel Sm
Ctmol−1
Graphit C|Graphit 5,7
Diamant C|Diamant 2,4
Eisen Fe|s 27,3 Blei Pb|s 64,8
Wassereis H2O|s 44,8
Wasser H2O|l 70,0
Wasserdampf H2O|g 188,8
Zusätzlich hängt die molare Entropie vom Aggregatzustand des Stoffes ab, wie am Beispiel des Wassers leicht zu ersehen ist. Um eindeutige Angaben zu erhalten, sollte man daher die entsprechenden Zusätze |s, |l, |g, ... (vgl. Abschnitt 1.6) an die Formel anfügen, also z.B.
H2O|l für flüssiges Wasser schreiben. Um die Ausdrücke jedoch nicht zu überfrachten, ver- einbaren wir, dass bei fehlenden Angaben immer der normalste Fall gemeint ist. Das Zeichen H2O steht also in der Regel für die Flüssigkeit und nicht für Wasserdampf oder Wassereis.
Die Entropie hängt auch von der Kristallstruktur ab. Die Modifikationen können dabei durch die entsprechenden Bezeichnungen wie Graphit, Diamant ... charakterisiert werden.
Als Faustregel kann man sich merken, dass bei gleichem Druck, gleicher Temperatur und Atomzahl die Entropie eines Körpers um so größer ist, je schwerer die Atome und je schwä- cher die Bindungskräfte sind.
Tab. 3.1: Molare Entropien einiger reiner Stoffe unter Normbedingungen (298 K, 100 kPa). Der Wert für Was- sereis wurde von tieferen Temperaturen auf 298 K extrapoliert.