21 Die Gasgesetze
Vertiefung und Kompetenzüberprüfung Martin Apolin (Stand September 2011)
Der Gasdruck
A1 Zum Befüllen von Luftballons verwendet man manchmal Helium. Nimm an, eine solche Flasche hat einen Durchmesser von 20 cm. Das Helium in der Fl sche hat 100 bar. Mit welcher Kraft drückt die Luft auf die Bodenfläche der Flasche? Gib zuerst einen Tipp ab. Hilf dir mit Tab. 1, um die Druckgrößen u zurechnen.
Tab. 1: Vergleich verschiedener Druckangaben.
A2 Stelle mit Hilfe der Druckgleichung
(Kap. 21.1, S. 98) und der allgemeinen Gasgleichung
(Kap. 21.3) einen Zusammenhang zwischen Temperatur und mittlerer kinetischer Energie der Gasteilchen her.
A3 a Du pumpst an der Tankstelle einen Autoreifen auf. Nachher zeigt das Gerät einen Druck von 2 an. Wie groß ist der Druck im Reifen?
b Der Blutdruck wird auch heute noch in der Einheit mmHg gemessen (siehe Tab. 1). Was versteht man darunter? Was bedeuten die Begriffe diastolischer und systolischer Blutdruck? Wie funktioniert eine Blu druckmessung? Weißt du, welche Werte für den Blu druck bei einem gesunden Menschen normal sind?
c Der Luftdruck beträgt 760 Torricelli (torr
mmHG; siehe Tab. 1), ein normaler Blutdruckwert bei Herzschlag liegt bei rund 130 torr, also viel niedriger Wieso strömt bei einer Verletzung dann nicht die Luft in die Adern, sondern das Blut heraus?
Kompetenzüberprüfung
Zum Befüllen von Luftballons verwendet man Flasche hat Helium in der Fla- drückt die Luft
zuerst einen 1, um die Druckgrößen um-
ener Druckangaben.
und der allgemeinen Gasgleichung
Zusammenhang zwischen kinetischer Energie der
Du pumpst an der Tankstelle einen Autoreifen auf. Nachher zeigt das Gerät einen Druck von 2 bar
auch heute noch in der Einheit . Was versteht man
diastolischer und Wie funktioniert eine Blut- Weißt du, welche Werte für den Blut- einem gesunden Menschen normal sind?
Torricelli (torr oder normaler Blutdruckwert bei
, also viel niedriger!
nicht die Luft
A4 a Schätze die Masse der Atmosphäre ab über 1 m
2der Erdoberfläche befindet.
Normaldruck der Atmosphäre
ge dazu, welcher Zusammenhang zwischen Masse und Gewicht besteht.
A4 b: Die Hautoberfläche eines Me
1,6 bis 1,8 m
2. Nimm den höheren Wert an und b rechne mit Hilfe des Ergebnisses
durch den Luftdruck auf den Menschen und welcher Masse das umgerechnet
kann man diese Masse vergleichen? Warum hält der Mensch diese Kraft aus?
A4 c Berechne mit Hilfe von A4
mosphäre. Der Erdradius beträgt 6,37∙10 geloberfläche berechnet sich durch
A5 Eine Quecksilbersäule steht bei Normaldruck 760 mm hoch (Abb. 1).
Wie hoch würde eine Was- sersäule stehen? Wie hoch würde eine Luftsäule sein, wenn wir annehmen, dass diese in der Dichte von oben bis unten gleich ist (siehe auch A6)? Verwen- de dazu Tab. 2.
Abb. 1: Schematische Darstel- lung eines Flüssigkeitsbarome- ters (Grafik: A. Schierwagen;
Quelle: Wikipedia).
Tab. 2: Beispiele für Dichten von
Schätze die Masse der Atmosphäre ab, die sich der Erdoberfläche befindet. Hilf dir mit dem Normaldruck der Atmosphäre in Pascal (Tab. 1). Überle-
Zusammenhang zwischen Masse und
Die Hautoberfläche eines Menschen beträgt etwa . Nimm den höheren Wert an und be-
des Ergebnisses von A4 a, welche Kraft auf den Menschen in Summe wirkt
umgerechnet entspricht. Womit vergleichen? Warum hält der
A4 a die Masse der Erdat- adius beträgt 6,37∙10
6m, die Ku-
sich durch O = 4 r
2π.
von Flüssigkeiten und Gasen
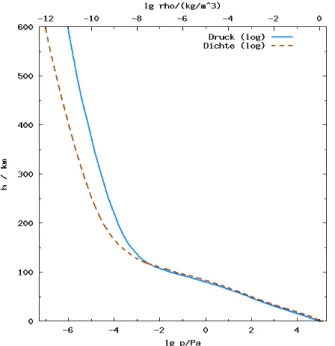
A6 Die Luftsäule, die sich über einem Quadratmeter Erdoberfläche befindet, hat nicht überall die gleiche Dichte (siehe auch A5). Warum wird die Luft nach un- ten hin dichter? Welche Dichte hat Luft über den Daumen auf Meeresniveau? Um welchen Faktor ist sie in einer Höhe von 350 km dünner? In dieser Höhe be- findet sich in etwa die internationale Raumstation ISS.
Was bedeutet das für den Luftwiderstand? In welcher Höhe endet die Atmosphäre?
Abb. 2: Dichte und Druck der Erdatmosphäre bis 600 km Höhe.
Auf der unteren x-Achse ist der dekadische Logarithmus des Drucks p in Pascal angegeben, auf der oberen x-Achse der de- kadische Logarithmus der Dichte ρ in kg/m
3(Gafik: SiriusB;
Quelle: Wikipedia).
A7 In Abb. 3 siehst du ein Bild eines altes Barometers, das nach dem Prinzip in Abb. 1 funktio- niert. Das erste Quecksilberba- rometer wurde 1643 von E
VANGELISTAT
ORRICELLIerfunden, nach dem auch eine Einheit des Drucks benannt ist. Warum ver- wendete man Quecksilber, ob- wohl diese Flüssigkeit giftig ist?
Warum ist es wesentlich, dass das U-Rohr am oberen Ende links geschlossen ist?
Abb. 3: Ein altes Barometer mit Queck- silbersäule (Quelle: Wikipedia).
A8 Nimm an, du hast einen wirklich seeehr langen Strohhalm. Wie hoch kannst du damit Wasser maximal saugen? Wie hängt diese Höhe von der Wetterlage ab?
A9 Heutzutage verwendet man als Barometer keine Quecksilbersäulen mehr, sondern meistens Dosenbaro- meter (Abb. 4). Beschreibe anhand der schematischen Darstellung, wie diese Barometerart funktioniert. Wel- che Messfehler können dabei allgemein auftreten? Wa- rum muss man die Geräte vorher kalibrieren, wenn man damit nicht nur die Druckänderung richtig messen will, sondern auch den absoluten Druck?
Abb. 4: Schemati- sche Darstellung der Funktionsweise eines Dosenbaro- meters (Grafik:
Alex.sch.th; Quelle:
Wikipedia).
A10 Wie funktioniert ein Höhenmesser (siehe Abb. 5)?
Abb. 5: Ein Höhenmesser für Fallschirmspringer mit einer Skala bis 4000 m Höhe (Foto: Srvban; Quelle: Wikipedia).
Isobare Zustandsänderung
A11 Ein Gasthermometer (Abb. 6 nächste Seite) besteht
aus einem Gefäß mit einem dünnen Glasrohr, in das ein
bestimmtes Gasvolumen eingeschlossen ist, etwa durch
einen Quecksilbertropfen. Das Gasthermometer wird
nun in ein Glasgefäß mit Wasser gestellt, so dass das
Gas dessen Temperatur annimmt. Die Höhe des Trop-
fens ist ein Maß für die Temperatur.
Abb. 6: Schema- tische Darstellung
der Funktion ei- nes Gasthermo- meters.
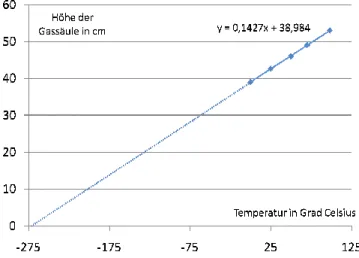
a In Tabelle 3 siehst du Messwerte bei verschiedenen Temperaturen. Trage diese Werte in ein Diagramm ein. Wo wird die Gerade, die du durch diese Punkte legst, die x-Achse schneiden? Überlege zuerst, bevor du grafisch löst. Kann man das Gas tatsächlich so weit abkühlen, dass es das Volumen 0 bekommt?
Temperatur °C 0 25 50 70 98 h in cm 39 42,6 46 49 53
Tab. 3 zu A11 b
b Die Gleichung einer Regressionsgeraden (Trendlinie), die du in Excel durch die Daten legst (siehe Abb. 14 im Anhang), hat die Form y = 0,1427x + 38,984. Berech- ne den Schnittpunkt mit der x-Achse und vergleiche mit deiner grafischen Lösung.
A12 Leite allgemein ab, um welchen Faktor sich eine ideales Gas ausdehnt, wenn man es von 0 K auf 1 K unter isobaren Bedingungen erwärmt. Gehe vom Zu- sammenhang V ~ T bei konstantem Druck aus.
Isochore Zustandsänderung
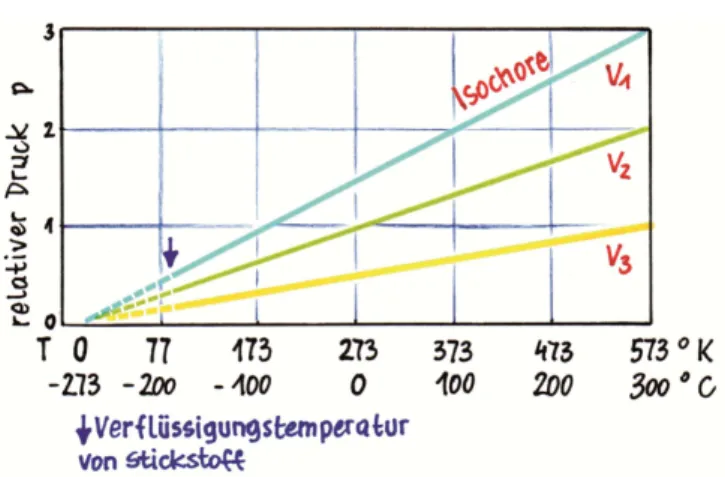
A13 Bei gleichem Volumen gilt für ein ideales Gas p ~ T . Wenn man die Temperatur von 20 °C auf 40 °C er- höht, verdoppelt sich dann der Druck des Gases?
A14 Ein Autoreifen wird bei 20 °C so aufgepumpt, dass das Gerät 2 bar anzeigt! Im Reifen befindet sich daher ein Druck von 3 bar (siehe A3 a). Durch das Fahren erhöht sich die Temperatur auf 50 °C. Welcher Druck herrscht nun im Reifen?
A15 In Abb. 7 siehst du die 4 Takte eines Otto-Motors in einem p - V -Diagramm dargestellt (siehe dazu auch
Kap. 22.4, BB6): 1) Ansaugen, 2) Verdichten und Zün- den, 3) Arbeitstakt und 4) Ausblastakt. In einem der vier Takte kommt - zumindest in einer Näherung – eine iso- chore Zustandsänderung vor. In welchem? Versuche zu begründen, warum das so ist.
Abb. 7: Die 4 Takte eines Otto-Motors in einem p-V-Diagramm (Grafik: Janosch Slama; siehe auch Abb. 22.3, S. 110, BB6).
A16 Nimm an, ein Gurkenglas wird beim Abfüllen auf 70 °C erhitzt. Mit welcher Kraft wird der Deckel (5 cm Radius) auf das Glas gedrückt, wenn sich dieses wieder auf Zimmertemperatur abgekühlt hat? Womit kann man diese Kraft vergleichen?
Isotherme Zustandsänderung
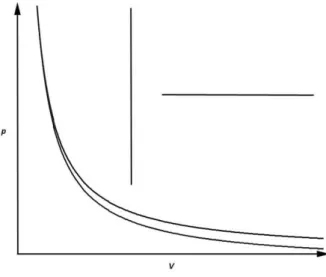
A17 Begründe, warum es sich im p - V -Diagramm in Abb. 8 um eine isotherme Zustandsänderung handelt.
Abb. 8 zu A17; Druck und Volumen sind in relativen Einheiten aufgetragen (Grafik: Martin Apolin).
0 0,5 1 1,5 2 2,5 3 3,5 4
0 1 2 3 4
p
V
A18 In Abb. 7 siehst du die 4 Takte eines Otto-Motors in einem p - V -Diagramm dargestellt. Zeigt eine der dargestellten Phasen eine isotherme Zustandsände- rung? Begründe!
Adiabatische Zustandsänderung
A19 Das „pneumatische Feuerzeug“ (Abb. 9) wurde bereits um 1770 erfunden. Es besteht aus einem un- ten verschlossenen Hohlzylinder, in dem sich oben ein Kolben niederdrücken lässt. Wieso kann man mit einer solchen Konstruktion Feuer erzeugen? Welcher Effekt wird dabei ausgenutzt? Wie muss man den Kolben niederdrücken? Was muss sich im Inneren befinden?
Abb. 9: Ein pneumatisches Feuerzeug in Aktion (Foto: Chocola- teoak; Quelle: Wikipedia).
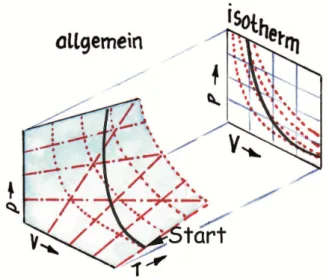
A20 Zeichne in Abb. 10 exemplarisch eine adiabati- sche Zustandsänderung eines idealen Gases ein. Fange mit der Linie am markierten Punkt an und erkläre ih- ren Verlauf.
Abb. 10 zu A20 (Grafik: Janosch Slama)
A21 a Die Temperatur ist ein indirektes Maß für die mittlere kinetische Energie der Teilchen, denn es gilt E
k=(3/2)∙ k ∙ T . Die spezifische Wärme ist ein Maß dafür, wie viel Joule man in ein System stecken muss, um es um 1 °C zu erwärmen, also c = Q /( m ∙∆ T ). Weil E
kin~ T gilt, ist die spezifische Wärme aber auch ein Maß dafür, wie viel Joule man in ein System stecken muss, um die kinetische Energie der Teilchen um 1 J zu erhöhen. Wie ist es aber möglich, das du z. B. 1 Joule in ein System steckst, sich aber die Wärme nur um 0,5 Joule erhöht?
Wo bleibt der Rest der Energie?
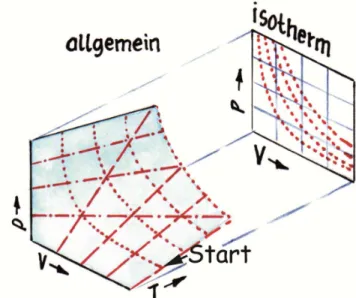
A21 b Wenn man das Gesetz von Boyle-Mariotte ( p ∙ V = const.), das für isotherme Vorgänge gilt, modifi- ziert, kann man damit adiabatische Vorgänge beschrei- ben. Die Gleichung lautet dann p ∙ V
γ= const., wobei Druck und Volumen als relative Größen angegeben werden. γ hängt von der Wärmekapazität des Gases ab.
Warum? Für ein einatomiges Gas hat γ den Wert 5/3.
Stelle die Isotherme und Adiabate in einem Diagramm dar. Wähle die Bereiche von p und V zwischen 0 und 4.
Starte beide Kurven beim Punkt 1/1 und stelle Kompri- mierung und Expansion dar. Überlege vorher, wie die Adiabate im Vergleich zur Isothermen verlaufen muss.
A22 In Abb. 11 siehst du, wie es bei einem Flugzeug über den Tragflächen zu einer Nebelbildung kommt.
Versuche den Effekt qualitativ zu erklären.
Abb. 11: Nebelbildung über den Tragflächen einer Verkehrsma-
schine (Foto: Cyron Ray Macey; Quelle: Wikipedia).
Die allgemeine Gasgleichung
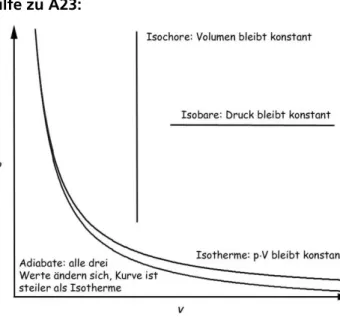
A23 Ordne folgende Kurven, die in Abb. 12 schema- tisch dargestellt sind, richtig zu: Isobare, Isochore, Iso- therme und Adiabate.
Abb. 12 zu A19 (Grafik: Martin Apolin)
A24 a Überprüfe mit Hilfe der allgemeinen Gasglei- chung die Einheit der Boltzmann’schen Konstante.
A24 b Überlege mit Hilfe der allgemeinen Gasglei- chung, in welcher Größenordnung die Boltz- mann’sche Konstante liegen muss.
A25 Erstelle ein Diagramm, in dem du den Zusam- menhang zwischen der Temperatur und dem Volu- men von einem Mol Gas im Bereich von 0 bis 100 °C und bei Normaldruck darstellst. Gib das Volumen da- bei in dm
3(Litern) an, weil man sich das besser vor- stellen kann. Berechne, welcher Seitenlänge das ent- spricht, wenn sich das Gas dabei in einem würfelför- migen Bereich aufhalten würde.
Hilfe zu A1: Ein Kreis mit einem Durchmesser von 0,2 m hat eine Fläche von A = r
2π ≈ 0,03 m
2. Tab. 1 kannst du entnehmen, dass 1 bar 1013 hPa entspricht.
Die Vorsilbe „hekto“ steht für 100. 1 bar entsprechen daher 101.300 Pa ≈ 10
5Pa. 100 bar entsprechen daher 10
7Pa oder 10
7N/m
2. Am Boden der Flasche wirkt da- her eine Kraft von 10
7∙0,03 N = 300.000 N. Das ent- spricht dem Gewicht eines 30-t-Sattelschleppers – und das auf dieser winzigen Fläche!
Hilfe zu A2: Wenn man die Druckgleichung
in die allgemeine Gasgleichung
ein- setzt, erhält man
. Die Teilchen- zahl fällt natürlich weg, weil die kinetische Energie eines einzelnen Teilchens nicht von der Gesamtzahl der Teil- chen abhängen kann. Man bekommt
. Die mittlere kinetische Energie ist also proportional zur ab- soluten Temperatur. Die absolute Temperatur ist ein Maß für die ungeordnete Bewegungsenergie der Tei- chen. Das ist bei einem Gas besonders schön zu sehen.
Hilfe zu A3 a: Überlege zuerst, was das Gerät anzeigt, wenn du einen „Patschen“ hast. Es zeigt null bar. Wie groß ist der Druck in einem „leeren“ Reifen? Er ent- spricht dem Umgebungsdruck, also 1 bar. Es ist ja kein Vakuum im Reifen. Das Gerät zeigt daher den Über- druck an. Daher ist der Druck in einem Reifen mit 2 bar tatsächlich 3 bar.
Hilfe zu A3 b: Der Blutdruck wird mit zwei Werten an- gegeben. Der erste Wert gibt den systolischen Blutdruck an. Dies ist der Druck, der bei der Kontraktion (Systole) des Herzens erreicht wird. Der zweite Wert beschreibt den diastolischen Blutdruck. Darunter versteht man den Druck, der in den Adern herrscht, während sich das Herz mit Blut füllt (Diastole). Die Angabe des Blutdrucks erfolgt in mmHg, also in Millimetern Quecksilbersäule.
Das hat historische Gründe, weil der Druck früher mit
Hilfe einer Quecksilbersäule gemessen wurde (siehe
Abb. 13 nächste Seite). Ein Blutdruck von 130 mmHg
entspricht also dem Druck einer Quecksilbersäule mit
130 mm Höhe. Die Normalwerte nach WHO (World
Health Organisation) liegen bei < 130 mmHg systolisch
und bei < 90 mmHg diastolisch.
Abb. 13: Ein altes Blutdruckmessgerät mit Quecksilbersäule aus dem Jahr 1910 (Quelle: Wikipedai).
Die häufigste Art der Blutdruckmessung erfolgt heute mittels Druckmanschette. Diese wird über den zu er- wartenden systolischen Wert aufgeblasen. Dadurch wird die Armarterie komplett abgedrückt. Beim lang- samen Auslassen der Luft sinkt der Druck irgendwann unter den systolischen Wert (Abb. 14 A). Dann be- ginnt ein wenig Blut durch die Arterie zu fließen. Die- ser Druck entspricht dem systolischen Wert. Wenn man ein Stethoskop auf die Armarterie legt, hört man ein Geräusch, das Korotkow-Geräusch, das durch den behinderten Blutfluss entsteht. Wird der Druck weiter abgelassen, unterschreitet er irgendwann den diastoli- schen Druckwert. Dann kann das Blut wieder völlig ungehindert fließen, und das Geräusch verschwindet vollständig (B). Moderne Druckmessgeräte messen den Druck vollautomatisch.
Abb. 14: Schematische Darstellung der Blutdruckmessung mit Druckmanschette (Grafik: PhilippN; Quelle: Wikipedia).
Hilfe zu A3 c: Es ist wie beim Autoreifen (A3 a): Das Gerät zeigt dir den Druckunterschied an und nicht den absoluten Wert. Wenn der äußere Luftdruck 760 torr beträgt und das Blutdruckmessgerät 130 torr anzeigt, dann beträgt der Blutdruck absolut 890 torr. Deshalb
strömt das Blut aus den Adern und nicht die Luft hinein.
Hilfe zu A4 a: Der Normaldruck beträgt 101.300 Pa oder 101.300 N/m
2. Gewicht ist Masse mal Erdbe- schleunigung, also G = m ∙ g . Oder in Einheiten: [N] = [kg∙m∙s
-2]. Umgekehrt ist daher die Masse Gewicht durch Erdbeschleunigung ( m = G / g ). In Einheiten [kg] = [N]/[m∙s
-2] = [kg∙m∙s
-2]/[m∙s
-2] = [kg]. Man kann daher aus dem Normaldruck sofort ausrechnen, dass pro m
2eine Masse von 101.300 N/9,81m/s
2= 10326 kg Luft lastet.
Hilfe zu A4 b: Die Gesamtkraft, die auf den Menschen wirkt, beträgt 101.300 N/m
2∙1,8 m
2= 182.340 N. Das entspricht der Gewichtskraft einer Masse von etwa 18,6 Tonnen oder rund 19 Klein-PKWs oder
4 Elefanten. Warum ist das auszuhalten? Weil diese Kraft von allen Seiten wirkt und sich gleichmäßig auf den Körper verteilt. 4 Elefanten am Kopf würde man natürlich nicht aushalten.
Hilfe zu A4 c: Die Oberfläche der Erde beträgt O = 4 r
2π = 5,1∙10
14m
2. Über jedem dieser Quadratmeter liegt eine Luftmasse von 10326 kg (A4 a). Die Gesamt- masse der Atmosphäre beträgt daher etwa 5,3∙10
18kg.
Hilfe zu A5: Quecksilber hat eine etwa 13,5-mal so große Dichte wie Wasser. Damit die Wassersäule den- selben Druck erzeugt, muss sie daher 0,76 m∙13,5 = 10,26 m hoch sein.
Quecksilber ist rund 11300-mal so dicht wie Luft. Daher müsste die Säule, gleiche Dichte vorausgesetzt, rund 8600 m hoch sein.
Hilfe zu A6: Flüssigkeiten sind praktisch nicht kompri- mierbar. Daher nimmt zwar im Wasser mit zunehmen- der Tiefe der Druck zu, aber die Dichte bleibt so gut wie gleich. Gase sind aber sehr leicht zu komprimieren. Je weiter man in die Atmosphäre eintaucht, desto mehr Luft befindet sich über einem, die die unteren Luft- schichten zusammendrückt. Daher wächst die Dichte an.
Auf Meeresniveau hat Luft eine Dichte von rund
1 kg/m
3. Es gilt log (1) = log (10
0)= 0. Daher beginnt die
Dichte-Kurve auf Meeresniveau bei 0 (siehe obere x-
Achse in Abb. 2). Die x-Achse ist logarithmisch aufge-
tragen und zeigt daher direkt den Exponenten an. In
350 km Höhe ist der log der Dichte der Luft auf etwa
-11 abgesunken. Das heißt, dass dort die Dichte um den Faktor 10
-11geringer ist. Der Luftwiderstand wird so berechnet:
0,5 ∙ ρ ∙ ∙ !
"∙ #
~ ρ (siehe Kap. 6.5, BB5). In 350 km Höhe ist er daher ebenfalls um den Faktor 10
-11abgesunken. Trotzdem verliert die ISS durch diesen geringen Luftwiderstand jeden Tag etwa 100 m an Höhe und muss hin und wieder von einem Raumschiff angeschoben werden.
Die Atmosphäre hat keine fixe Grenze, sondern dünnt sich immer mehr aus. Der Übergang zum Weltraum ist daher fließend, und alle angegebenen Grenzen sind daher immer Definitionen.
Hilfe zu A7: Man verwendete Quecksilber, weil es von allen Flüssigkeiten die größte Dichte hat. Würde man statt dessen Wasser verwenden, müsst
re etwa 10 m lang sein (siehe A5) und wäre schwerlich in einem Labor unterzubringen
verdunstet Quecksilber auch im Vakuum sehr schlecht.
Wäre das Rohr auch links offen, würde dort der no male Luftdruck wirken. Du hättest dann eine normales U-Rohr, in dem das Quecksilber auf beiden Seiten gleich hoch steht.
Hilfe zu A8: Beim Saugen erzeugst du einen Unte druck im Strohhalm. Der äußere Luftdruck drückt dann die Flüssigkeit in den Strohhalm hinein, so wie in Abb. 1, nur dass du den Unterdruck durch Saugen e zeugst. Im theoretischen Extremfall, der in der Praxis aber unmöglich ist, kann man den Druck im Stro halm auf null absenken. Dann kannst du die Flüssi keit etwa 10,3 m hoch saugen (Siehe A5), aber dann ist wirklich Schluss. Bei Hochdruckwetter würde es ein bisschen höher gehen, bei Tiefdruck etwas weniger hoch, weil der „Motor“ für das Aufsteigen der Flü sigkeit der Luftdruck ist.
Hilfe zu A9: Bei Dosenbarometern wird durch die Änderung des Luftdrucks eine Dose verformt, und di se Verformung wird auf einen Zeiger übertragen. Ein Problem dabei sind Temperaturänderungen.
standteile der Dose selbst zeigen eine thermische V lumenausdehnung und für ihren Bau werden daher spezielle Legierungen verwendet, bei denen mehrere Komponenten sich nach ihrem Temperaturverhalten her gegenseitig kompensieren und auf diese Weise den störenden Effekt einer Wärmeausdehnung
11 abgesunken. Das heißt, dass dort die Dichte um geringer ist. Der Luftwiderstand wird
(siehe km Höhe ist er daher ebenfalls abgesunken. Trotzdem verliert die ISS durch diesen geringen Luftwiderstand jeden m an Höhe und muss hin und wieder von einem Raumschiff angeschoben werden.
Die Atmosphäre hat keine fixe Grenze, sondern dünnt zum Weltraum ist daher fließend, und alle angegebenen Grenzen sind
Man verwendete Quecksilber, weil es rößte Dichte hat. Würde statt dessen Wasser verwenden, müsste die Röh-
wäre nur ch in einem Labor unterzubringen. Außerdem verdunstet Quecksilber auch im Vakuum sehr schlecht.
Wäre das Rohr auch links offen, würde dort der nor- male Luftdruck wirken. Du hättest dann eine normales
das Quecksilber auf beiden Seiten
en erzeugst du einen Unter- druck im Strohhalm. Der äußere Luftdruck drückt
sigkeit in den Strohhalm hinein, so wie in 1, nur dass du den Unterdruck durch Saugen er-
Im theoretischen Extremfall, der in der Praxis möglich ist, kann man den Druck im Stroh-
Dann kannst du die Flüssig- m hoch saugen (Siehe A5), aber dann ist wirklich Schluss. Bei Hochdruckwetter würde es ein bisschen höher gehen, bei Tiefdruck etwas weniger hoch, weil der „Motor“ für das Aufsteigen der Flüs-
Bei Dosenbarometern wird durch die Änderung des Luftdrucks eine Dose verformt, und die- se Verformung wird auf einen Zeiger übertragen. Ein Problem dabei sind Temperaturänderungen. Die Be- standteile der Dose selbst zeigen eine thermische Vo- lumenausdehnung und für ihren Bau werden daher spezielle Legierungen verwendet, bei denen mehrere
nten sich nach ihrem Temperaturverhalten her gegenseitig kompensieren und auf diese Weise
Wärmeausdehnung redu-
zieren. Trotzdem gibt es temperatu ler.
Wenn man den absoluten Druck richtig messen will muss man bedenken, dass dieser sich mit der Höhe ve ändert (siehe Abb. 2). Der Hersteller des Geräts weiß ja nicht, auf welcher Seehöhe das Gerät später benutzt wird. Man muss das Gerät daher für die richtige Seeh he kalibrieren. Dazu müsste man den aktuellen Druc wert für den jeweiligen Ort aus dem Internet ermitteln und mit einer Stellschraube, die sich auf der Rück des Geräts befindet, den Wert richtig einstellen.
Hilfe zu A10: Ein Höhenmesser
Barometer, das allerdings den Druck in Höhe „übe setzt“. Damit der Fallschirmspringer nicht aufprallt, muss der Höhenmesser vorher jedoch
(siehe auch A9), weil sich die angezeigte Höhe natürlich auch ändert, wenn sich der Luftdruck durch einen We terumschwung ändert.
Hilfe zu A11 a: Bei gleichem Druck ist
lumen eines (idealen) Gases ist proportional zu seiner absoluten Temperatur (siehe Abb.
das Gesetz von Charles. (Anm.: In manchen heißt es auch Gesetz von Gay
Kap. 21.2.1, BB6). Die Gerade wird die x
beim absoluten Nullpunkt schneiden. Kann man das Gas tatsächlich so weit abkühlen, dass es das Volumen 0 bekommt? Nein! Es wird vorher flüssig oder fest und wenn nicht, dann werden die Moleküle einander beei flussen. Der wichtige Gedanke ist jedoch der, dass sich bei Zimmertemperatur alle Gase so verhalten, al ihr Volumen bei 0 K verschwinden würde.
Abb. 14 zu A11 a (Gr
temperaturbedingte Messfeh-
Wenn man den absoluten Druck richtig messen will, muss man bedenken, dass dieser sich mit der Höhe ver-
Hersteller des Geräts weiß ja , auf welcher Seehöhe das Gerät später benutzt wird. Man muss das Gerät daher für die richtige Seehö- he kalibrieren. Dazu müsste man den aktuellen Druck- wert für den jeweiligen Ort aus dem Internet ermitteln und mit einer Stellschraube, die sich auf der Rückseite des Geräts befindet, den Wert richtig einstellen.
Ein Höhenmesser ist vom Prinzip her ein Barometer, das allerdings den Druck in Höhe „über- setzt“. Damit der Fallschirmspringer nicht aufprallt, muss der Höhenmesser vorher jedoch kalibriert werde (siehe auch A9), weil sich die angezeigte Höhe natürlich auch ändert, wenn sich der Luftdruck durch einen Wet-
Bei gleichem Druck ist V ~ T . Das Vo- ist proportional zu seiner (siehe Abb. 14). Das nennt man das Gesetz von Charles. (Anm.: In manchen Büchern heißt es auch Gesetz von Gay-Lussac; siehe auch
Die Gerade wird die x-Achse daher beim absoluten Nullpunkt schneiden. Kann man das
tsächlich so weit abkühlen, dass es das Volumen 0 bekommt? Nein! Es wird vorher flüssig oder fest und wenn nicht, dann werden die Moleküle einander beein- flussen. Der wichtige Gedanke ist jedoch der, dass sich bei Zimmertemperatur alle Gase so verhalten, als wenn
K verschwinden würde.
rafik: Martin Apolin)
Hilfe zu A11 b: x = 38,984/0,1427 = 273,189. Das kommt dem tatsächlichen Wert des absoluten Null- punkts schon sehr nahe.
Hilfe zu A12: Bei einem isobaren Vorgang gilt V ~ T.
Daraus folgt V/T = const . und somit V
1/ T
1= V
0/ T
0. Da- raus folgt wiederum V
1= T
1∙ V
0/ T
0und
∆ V = ∆ T ∙ V
0/273. Bei 0 °C (273 K) und ∆ T = 1 K be- trägt daher die Volumenänderung ∆ V 1/273. Dieser Wert entspricht 0,0037 oder 3,7∙10
-3. Das ist auch die relative Volumenausdehnung γ für Gase (siehe
Kap. 20.1, BB6).
Hilfe zu A13: Nein! Die Temperatur wird ja absolut in Kelvin angegeben und erhöht sich daher von 293 K auf 313 K. Daher erhöht sich der Druck nur um etwa 7 %.
Hilfe zu A14: Das Stahlgewebe der Autoreifen ver- hindert eine Dehnung. Das Volumen bleibt konstant und es gilt p ~ T. Daraus folgt p / T = const. und somit p
1/ T
1= p
0/ T
0. Daraus folgt wiederum p
1= p
0∙T
1/ T
0. Wenn sich die Temperatur von 293 K (20 °C) auf 323 K (50 °C) erhöht, beträgt der Druck p
1nachher 3 bar∙323 K/293 K = 3,3 bar. Der Druck ist also um 10 % gestiegen, weil auch die absolute Temperatur um 10 % gestiegen ist.
Abb. 15: Eine isochore Zustandsänderung im p-T-Diagramm (Grafik: Janosch Slama).
Hilfe zu A15: Bei einer isochoren Zustandsänderung bleibt das Volumen unverändert. Deshalb muss diese Zustandsänderung im p - V -Diagramm eine senkrechte Linie ergeben. Verwechsle diese Darstellung nicht mit der im p - T -Diagramm (siehe Abb. 15). In diesem ergibt sich eine Linie, die durch den Nullpunkt geht. Im zwei- ten Takt siehst du nach der Zündung eine solche senk-
rechte Linie. In dieser Phase befindet sich der Kolben am oberen Totpunkt und steht praktisch für einen kur- zen Augenblick still. Das Benzin-Luft-Gemisch wird ent- zündet (oder entzündet sich von selbst) und verbrennt ohne Volumenänderung. Weil sich dabei die Tempera- tur erhöht, liegt hier eine isochore Zustandsänderung vor.
Hilfe zu A16: Es gilt p ~ T . Wenn die Temperatur nach der Abfüllung von 70 °C (343 K) auf Zimmertemperatur (20 °C, 293 K) sinkt, haben sich die absolute Tempera- tur und somit auch der Druck um 14,6 % verringert.
Wenn der Dosendeckel einen Radius von 5 cm hat, dann ist seine Fläche rund 7,85∙10
–3m
2. Der Normal- druck der Luft beträgt etwa 100.000 N/m
2. Weiters gilt Druck ist Kraft pro Fläche, also
p = F / A und somit F = p ∙ A . Die Luft drückt also von außen mit einer Kraft von 785 N auf den Deckel, aber von innen nur mit 671 N. Der Deckel wird bei Zimmertemperatur also mit 114 N auf die Dose gedrückt.
Das ist so, als würden rund 11 kg auf der Dose liegen, die du beim Aufschrauben mitheben musst (Abb. 16).
Hilfe zu A17: Bei einer isothermen Zustandsänderung gilt p ∙ V = const., und das ist bei allen Punkten auf die- ser Kurve der Fall. Das Produkt von p und V ist zahlen- mäßig immer 1, also zum Beispiel 1∙1, 2∙0,5, 4∙0,25 usw.
Abb. 17 zu A17 (Grafik: Martin Apolin) 0
0,5 1 1,5 2 2,5 3 3,5 4
0 1 2 3 4
p
V Abb. 16 (Grafik:
Janosch Slama)
Hilfe zu A18: Wenn man ein Gas komprimiert, dann erwärmt es sich, weil man ihm ja durch das Zusam- mendrücken Energie zuführt. Beim Expandieren ist es genau umgekehrt. Damit ein Gas bei einer Volumen- änderung die gleiche Temperatur behält, muss die Wärme ab- oder zugeführt werden. Normalerweise stellt man dazu den Behälter in ein Wasserbad mit konstanter Temperatur.
Bei schnell ablaufenden Vorgängen ist die Zeit aber zu kurz für einen Temperaturausgleich. Der erste Teil von Takt 2 (Komprimieren; siehe Abb. 7) und der gesamte Takt 3 (Expandieren) sehen ähnlich wie Isotherme aus.
Sie sind aber Adiabaten (verlaufen also steiler), weil die Wärme nicht schnell genug ausgeglichen werden kann. Selbst im Leerlauf bei 1000 U/min macht jeder Kolben rund 17 ganze Durchläufe pro Sekunde. Ein ganzer Durchlauf dauert daher nur rund 6/100 Se- kunden und ein Takt gar nur etwa 1,5/100 Sekunden.
Hilfe zu A19: Wird der Kolben mit der flachen Hand niedergeschlagen und die Luft dadurch sehr schnell komprimiert, findet eine adiabatische Zustandsände- rung statt. Die dabei freigesetzte Energie erwärmt die Luft, und die Wärme kann auf Grund der schnellen Kompression nicht nach außen abgegeben werden.
Im Inneren muss sich ein leicht entzündbares Material befinden. Meistens befindet sich unter dem Kolben an einem Häkchen eine Stückchen Zündschwamm, das dabei zu brennen beginnt.
Abb. 18 (Grafik: Janosch Slama; siehe auch Abb. 19) Hilfe zu A20: Ein ideales Gas kann nur jene Werte für p , V und T annehmen, die auf der Oberfläche des 3d-
Diagramms liegen (siehe A 18). Bei einer adiabatischen Zustandsänderung ändern sich alle drei Werte, also auch die Temperatur. In der Projektion des 3d- Diagramms in ein p-V-Diagramm ergibt sich dadurch ein steilerer Anstieg der Kurve, als das bei einer iso- thermen Zustandsänderung der Fall wäre.
Hilfe zu A21 a: Moleküle können nicht nur Translati- ons-, sondern auch Rotationsenergie haben. Außerdem können auch ihre Bestandteile, Atome, Ionen oder so- gar Elektronen gegeneinander schwingen. Jede solche unabhängige Bewegungsmöglichkeit nennt man einen Freiheitsgrad. Die Anzahl der Freiheitsgrade hängt vom Aufbau der Moleküle ab. Für die Temperatur spielt aber nur die Translation eine Rolle, nicht die Rotation. Daher kann die zugeführte Energie in der Rotation quasi „ver- sickern“ und wird nicht als Temperatur bemerkbar.
Hilfe zu A21 b: Wie stark sich das Gas beim Kompri- mieren erwärmt, hängt davon ab, wie sehr sich die durchschnittliche kinetische Energie erhöht (siehe A21 a). Ein Teil der Energie steckt nachher in der Rota- tionsenergie der Moleküle, und wird nicht als Tempera- tur bemerkt. Deshalb ist die Temperaturerhöhung und somit der Wert γ von der Art des Gases abhängig.
Beim adiabatischen Komprimieren entsteht Wärme, die den Druck des Gases erhöht. Daher liegt die Adiabate in diesem Bereich über den Isothermen (Abb. 19). Beim Ausdehnen verlieren die Gasmoleküle an Energie und somit an Energie und Temperatur. Die Adiabate liegt in diesem Bereich unter der Isothermen.
Abb. 19 zu A21 b: strichliert: Isotherme, durchgezogen: Adiaba- te. p und V sind relativ angegeben. Werte unter V = 1 stellen die
Komprimierung dar, Werte darüber die Expansion (siehe auch Abb. 18; Grafik: Martin Apolin)
0 0,5 1 1,5 2 2,5 3 3,5 4
0 1 2 3 4
p
V
Hilfe zu A22: Über den Tragflächen herrscht ein Un- terdruck. Deshalb kommt es zu einer Expansion der Luft. Weil diese sehr schnell erfolgt, ist sie adiabatisch, und die Luft kühlt sich ab. Unter bestimmten Umstän- den kann diese Abkühlung so stark sein, dass es zum Kondensieren des Wasserdampfs in der Luft kommt und somit zur Nebelbildung.
Hilfe zu A23:
Abb. 20 (Grafik: Martin Apolin)
Hilfe zu A24 a: Wenn man die allgemeine Gasglei- chung umformt, erhält man
. Die Einheit der Boltzmann’schen Konstante ist daher:
%&
'∙'
()*
+
()*,
=
-,
=
.,
.
Hilfe zu A24 b: Einerseits gilt
= /0, andererseits
= . Für 1 Mol ( n = 1) gilt daher R = Nk und k = R / N . Die allgemeine Gaskonstante R beträgt 8,3 J/(Mol∙K) ≈ 10 J/(Mol∙K). Ein Mol hat 6∙10
23Teil- chen ≈ 10
24Teilchen. Die Boltzmann’sche Konstante liegt daher in der Größenordnung 10/10
24J/K = 10
-23J/K. Genau sind es 1,38∙10
-23J/K.
Hilfe zu A25: Umformen der Gasgleichung für 1 Mol ergibt 2 =
3. Wenn man die bekannten Werte ein- setzt (Normaldruck p = 101.300 N/m
2), erhält man Abb. 21. Bedenke dabei, dass in der Gasgleichung die Temperatur in Kelvin einzusetzen ist, und dass das Vo- lumen erst von Kubikmeter in Liter umgerechnet wer- den muss. Das Volumen liegt zwischen 22,4 und
30,6 Litern, die Seitenlänge des „Gaswürfels“ beträgt zwischen 2,8 und 3,15 dm. Man kann also über den Daumen sagen, dass ein Mol eines Gases in einen Wür- fel mit der Seitenlänge von rund 30 cm passt.
Abb. 21: Zusammenhang zwischen der Temperatur eines Gases (x-Achse), seinem Volumen (durchgezogene Linie; linke y-Achse) und der Seitenlänge des „Gaswürfels“ (strichlierte Linie; rechte y-
Achse; Grafik: Martin Apolin).
2,8 2,85 2,9 2,95 3 3,05 3,1 3,15
20 22 24 26 28 30 32
0 10 20 30 40 50 60 70 80 90 100
Seitenlänge des Gaswürfels in Dezimetern
Volumen in Litern bzw. Kubikdezimetern