Name: Bastian Engelke
Semester: Sommersemester 2012 Klassenstufen 5 & 6
Schmelz- und Siedetemperatur
Inhalt
1 Beschreibung des Themas und zugehörige Lernziele...2
2 Lehrerversuche... 3
2.1 V 3 – „Der wandernde Eiswürfel“... 3
2.2 V 4 – „Draht gleitet ohne Schaden durch einen Eisblock“...5
3 Schülerversuche... 7
3.1 V 1 – „Schmelztemperaturbestimmung alltäglicher Substanzen“...7
3.2 V 2 – „Bestimmung der Siedetemperatur“...8
3.3 V 5 – „Eiswürfel fischen“... 10
4 Reflexion des Arbeitsblattes... 12
4.1 Erwartungshorizont (Kerncurriculum)...12
4.2 Erwartungshorizont (Inhaltlich)... 12 Auf einen Blick:
Das vorgestellte Thema „Schmelz- und Siedetemperatur“ lässt sich in 3 Schüler- (SV) und 2 Lehrerversuche (LV) gliedern und wurde für die 5. & 6. Klassenstufe konzipiert.
Insbesondere bei den Schülerversuchen wurde Wert auf Alltagsbezug und die phänomenologische Sichtweise chemischer Prinzipien gelegt. Insgesamt werden in je einem SV die Schmelz- sowie Siedetemperaturen bekannter und ungiftiger Stoffe bestimmt. Ein LV verdeutlicht die Auswirkungen von Druck auf den Schmelzpunkt von Eis, indem ein Draht durch einen Eisblock wandert ohne ihn zu zerteilen. Ein schneller SV mit Wettbewerbscharakter lässt die SuS die Auswirkungen von Salz auf den Schmelzpunkt von Eis erfahren. Im einem weiteren LV werden alle Phasenübergänge anhand eines Eiswürfeltransports demonstriert, wobei die Auswirkungen des Drucks erneut thematisiert werden.
1 Beschreibung des Themas und zugehörige Lernziele
Das Thema Siede- und Schmelztemperatur ist laut Kerncurriculum eingebettet in das weite Feld Stoffeigenschaften, sodass den SuS das Rüstzeug für eine spätere Charakterisierung von Stoffen und Verbindungen anhand dieser ermöglicht werden soll. Dass die SuS mit verschiedene Aggregatszuständen und deren Phasenübergängen alltäglich zu tun haben (Kochen, Kerze, ...) begründet die Relevanz, dieses Thema zu behandeln. Die ausformulierten Lernziele aus dem Kerncurriculum sind in Tabelle 1 zusammengefasst.
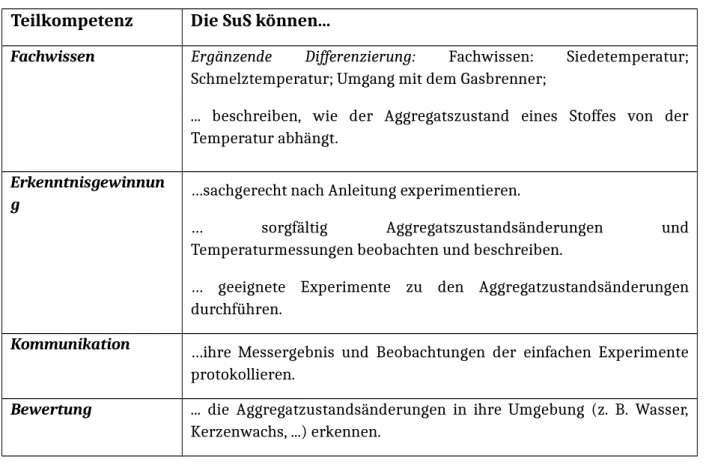
Tabelle 1: Lernziele nach KC
Teilkompetenz Die SuS können...
Fachwissen Ergänzende Differenzierung: Fachwissen: Siedetemperatur;
Schmelztemperatur; Umgang mit dem Gasbrenner;
... beschreiben, wie der Aggregatszustand eines Stoffes von der Temperatur abhängt.
Erkenntnisgewinnun
g …sachgerecht nach Anleitung experimentieren.
… sorgfältig Aggregatszustandsänderungen und Temperaturmessungen beobachten und beschreiben.
… geeignete Experimente zu den Aggregatzustandsänderungen durchführen.
Kommunikation …ihre Messergebnis und Beobachtungen der einfachen Experimente protokollieren.
Bewertung ... die Aggregatzustandsänderungen in ihre Umgebung (z. B. Wasser, Kerzenwachs, ...) erkennen.
Die folgenden Experimente haben die Aufgabe den SuS ein Gefühl für Schmelz- und Siedepunkte verschiedener Stoffe zu vermitteln. In den ersten beiden SV geht es darum, diese selbstständig zu messen, anhand von Stoffen und Stoffgemischen bzw. Lösungen aus der Lebenswelt der SuS.
Verdeutlicht wird dadurch, dass jeder Stoff individuelle Schmelz- (V1) und Siedetemperaturen (V2) hat und diese sich durch Mischung mit anderen ändern. Als Problemexperiment werden dann fortführend alle möglichen Phasenübergänge inklusive deren Druckabhängigkeit in einem LV demonstriert (V3). Als Erarbeitungsexperimente mit Wundercharakter sollen die SuS anhand eines LV (V4) und eines SV (V5) ihr bisher erworbenes Wissen verknüpfen, um eigenständig Erklärungen abzuleiten.
2 Lehrerversuche
2.1 V 3 – „Der wandernde Eiswürfel“
Gefahrenstoffe
Wasser H: - P: -
Kältesalz
(Natriumchlorid) H: - P: -
Materialien: Destillierbrücke, 2x Kolben (ca. 100 ml), Thermometer mit Schliff, Thermometer, 2x Kühlwasserschläuche, Vakuumschlauch, Siedesteinchen, Bunsenbrenner, Becherglas (1000 ml), diverse Klemmen und Schlauchschellen.
Chemikalien: Eiswürfel ca. 20 g, 500 g Eis, ca. 100 g Kältesalz
Durchführung: Es wird wie in Abbildung 1 zu sehen eine Destillationsapparatur aufgebaut.
In diese wird ein Eiswürfel gegeben und anschließend kräftigt erhitzt, bis ein großer Teil verdampft ist und am anderen Ende der Apparatur kondensieren kann. Gleichzeitig mit dem Sieden und Gefrieren des Wassers werden Siede- sowie Schmelztemperatur gemessen. Eine Mischung aus Eis und Kältesalz bewirkt ein schnelles Abkühlen des kondensierten Wassers unter den Gefrierpunkt.
In einem zweiten Versuchsdurchlauf wird die Apparatur luftdicht verschlossen und Vakuum angelegt.
Beobachtung: Während des Versuchsablaufs schmilzt im linken Teil der Eiswürfel durch die Wärme des Brenners. Sobald das entstandene Wasser bei 100 °C siedet, kann man den Wasserdampf am Ende der Destillierbrücke zunächst zu Das Experiment demonstriert wie ein fester Eiswürfel zuerst schmilzt, das entstehende Wasser verdampft und dieser Wasserdampf durch Umkehr der Aggregatszustandsänderungen in einem anderen Gefäß wieder zu einem festen Eiswürfel wird. Dabei werden Schmelz- und Siedetemperatur bestimmt und durch anlegen eines Vakuum die Druckabhängigkeit verdeutlicht. Die SuS sollten zuvor mit den Messverfahren und der Apparatur vertraut gemacht werden. Alltagswissen über Wasser ist ausreichend.
Wasser kondensieren sehen. Etwa 5 min danach beobachtet man wie dieses Wasser wieder bei 0 °C gefriert.
Abbildung 1: Versuchsaufbau zu "Der wandernde Eiswürfel"
Deutung: Es finden je nach Druck die entsprechenden Aggregatszustandsänderungen beim Wasser statt. Durch Wasserkühlung kondensiert der Wasserdampf an der Destillierbrücke und tropft in den Auffangkolben. Das mit Kältesalz angereicherte Eis um diesen hat eine Temperatur von ca. -20 °C, wodurch eine schnelle Abkühlung unter den Gefrierpunkt stattfindet.
Liegt annähernd ein Vakuum an, so verringert sich die Siedetemperatur von 100 °C auf ca. 40 °C. Für den Schmelzpunkt ist nur eine kaum messbare Verringerung zu verzeichnen.
Literatur: -
Der Versuch ermöglicht Anknüpfungspunkte zu den lebensweltlichen Themenbereichen Prinzip des Schnellkochtopfs bzw. Kochen in großer Höhe oder die Funktionsweise eines Flüssiggasfeuerzeugs. Die Entsorgung erfolgt unproblematisch über das Abwasser.
1.1 V 4 – „Draht gleitet ohne Schaden durch einen Eisblock“
Gefahrenstoffe
Eisen (Draht) H: - P: -
Wasser H: - P: -
Materialien: 2x 1kg Gewichte, 2x Dreifuß mit Drahtnetz, Auffangwanne (mind. 50x20 cm).
Chemikalien: Eisblock (mind. 20x5x5 cm), Eisendraht (< 0,3 mm).
Durchführung: Eisblock zwischen den Dreifüßen sicher aufstellen. Draht mit den Gewichten fest verbinden und auflegen. Die Wartezeit bis zum ersten Effekt beträgt nur ca. 15 min. Der Versuch selbst kann mehrere Stunden weiterlaufen, bis der Draht den Eisblock durchquert hat (Abbildung 2).
Beobachtung: Der Draht gleitet langsam in das Eis hinein. Am Anfang kann man geringe Mengen flüssiges Wasser um den Draht herum sehen.
Als Wunder- bzw. Erarbeitungsexperiment konzipiert, demonstriert das Experiment wie Eis durch einen hohen lokalen Druck in Form eines dünnen Eisendrahtes mit Gewichten Eis in geringem Umfang zum Schmelzen bringen kann. Das Vorwissen der SuS sollte soweit reichen, dass Druckauswirkungen auf einen Schmelzpunkt bekannt ist. Ebenso sollte aus der Physik ein Grundverständnis für Kraftwirkung vorhanden sein.
Abbildung 2: Aufbau zu Versuch „Draht gleitet ohne Schaden durch einen Eisblock“ inkl. Phasendiagramm für die LehrerIn
Deutung: Es herrscht lokal ein hoher Druck, welcher das Eis schmelzen lässt. Dieses flüssige Wasser fließt um den Draht herum und gefriert oberhalb des Drahtes wieder, weil der Eisblock insgesamt eine starke Kühlung unter den Gefrierpunkt verursacht.
Literatur: Andreas Tillmann, 2009, http://www.kids-and-science.de/experimente- fuer-kinder/detailansicht/datum/2009/08/11/versuch-mit-einem-
eisblock-einem-draht-und-einem-gewicht.html (abgerufen am 25.9.2012 18 Uhr)
Dieses Experiment bietet die Möglichkeit für die Vernetzung bereits im Rahmen der Unterrichtseinheit behandelter fachwissenschaftlicher Bereiche, vorzugsweise als Gruppenarbeit. Die SuS müssen zum genauen Beobachten angehalten werden, um das sich bildende flüssige Wasser zu beobachten. Lebensweltlich kann das Funktionsprinzip des Schlittschuhs erläutert werden.
3 Schülerversuche
1.2 V 1 – „Schmelztemperaturbestimmung alltäglicher Substanzen“
Gefahrenstoffe
Eis H: - P: -
Butter H: - P: -
Kerzenwachs
(Hartparaffin) H: - P: -
Glukose H: - P: -
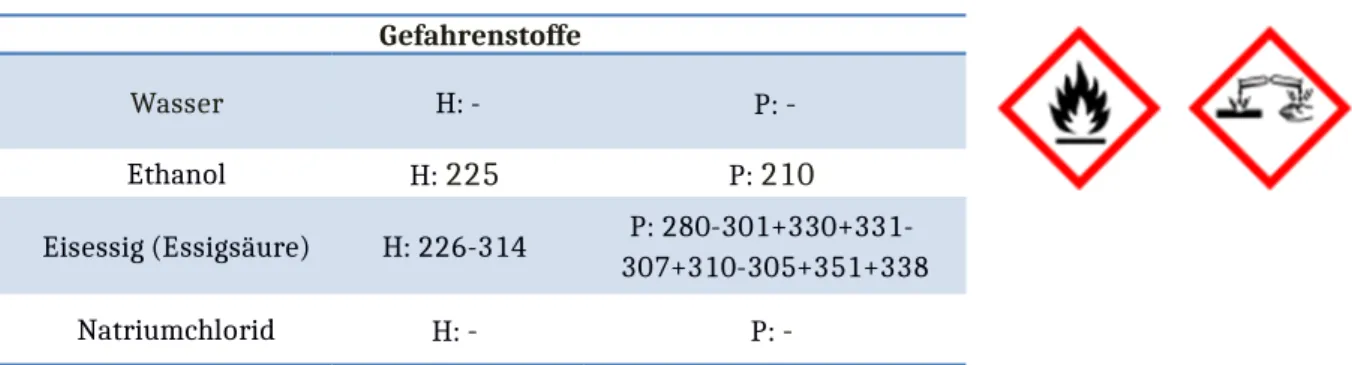
Eisessig (Essigsäure) H: 226-314 P: 280-301+330+331- 307+310-305+351+338
Materialien: 4x kl. Porzellanschale, Bunsenbrenner, Dreifuß mit Drahtnetz, Thermometer
Chemikalien: Eis, Butter, Kerzenwachs, Glukose, Eisessig (jeweils ca. 20 g)
Durchführung: Der Aufbau erfolgt analog zu Abbildung 3 durch die SuS. Die Porzellanschale mit der Probe wird langsam unter ständiger Kontrolle der Temperatur mit Hilfe des Bunsenbrenners erhitzt.
Beobachtung: Die Feststoffe schmelzen nach unterschiedlichem Maß an Wärmezufuhr und haben dann den Charakter einer Flüssigkeit.
Vorkenntnissen benötigen die SuS nur in der Bedienung des Bunsenbrenners, sowie eines Thermometers. Die SuS sollen selbsttätig die Schmelztemeraturen bzw. –bereiche von Eis, Essigsäure, Butter, Kerzenwachs und Glukose messen.
Abbildung 3: Versuchsaufbau für "Schmelztemperaturbestimmung alltäglicher Substanzen"
Deutung: Da Butter und Kerzenwachs keine Reinstoffe sind ergeben sich Schmelzbereiche. Die Schmelzpunkte bzw. –bereiche liegen für Eis bei 0°C, für Essigsäure bei 17 °C, für Butter bei 20-30 °C, für Kerzenwachs bei ca. 55
°C und für Glukose bei 146 °C.
Literatur: -
Zur individuellen Förderung können schnelle SuS den Gefrierpunkt nochmals ermitteln. Dieses mal durch Abkühlen der Proben. Eis und Essigsäure sollten bis zum Versuch im Gefrierfach aufbewahrt werden. Vorsicht beim Umgang mit der Essigsäure! Entsorgung nach dem Abkühlen über den Feststoffabfall, bzw. Wasser und Eisessig (verdünnt mit Wasser) über die Kanalisation.
1.3 V 2 – „Bestimmung der Siedetemperatur“
Die SuS sollen eigenständig Siedetemperaturen und- bereiche messen. Vorbedingung für den Versuch ist der sichere Umgang mit dem Bunsenbrenner und dem Thermometer, sowie die Protokollierung von Messwerten.
Gefahrenstoffe
Wasser H: - P: -
Ethanol H: 225 P: 210
Eisessig (Essigsäure) H: 226-314 P: 280-301+330+331- 307+310-305+351+338
Natriumchlorid H: - P: -
Materialien: Stativ mit Klemme, Thermometer, Becherglas (ca. 200 ml), Bunsenbrenner, Dreifuß mit Drahtnetz.
Chemikalien: Wasser ca. 50 ml, Natriumchlorid ca. 10 g, Essigsäure ca. 50 g, Ethanol ca.
50 g
Durchführung: Der Aufbau erfolgt nach der Skizze in Abbildung 4. Die Lösungen von 50 Vol-% Ethanol mit Wasser und die gesättigte Kochsalzlösung werden am besten für die ganze Klasse angesetzt. Die verschiedenen Flüssigkeiten werden nacheinander solange erhitzt, bis sie zu sieden beginnen. Für die Essigsäure sollte dieses unter einem Abzug erfolgen.
Abbildung 4: Versuchsaufbau zum Experiment "Bestimmung der Siedetemperatur"
Beobachtung: Die Siedetemperaturen liegen für Wasser bei 100 °C, für Ethanol bei 78 °C, für die Wasser-Ethanol-Gemisch am Anfang bei ca. 82 °C, für die Natriumchloridlösung bei ca. 105 °C und für die Essigsäure bei 118 °C.
Deutung: Bei homogenen Gemischen liegen die Siedetemperaturen immer im Bereich zwischen denen der Ausgangsstoffe.
Literatur: -
Vorsicht bei Verwendung der Essigsäure (Abzug!). Entsorgung der ethanolhaltigen Lösungen in den Behälter für org. Flüssigabfälle. Alles andere in die Kanalisation und mit Wasser nachspülen.
1.4 V 5 – „Eiswürfel fischen“
Gefahrenstoffe
Wasser H: - P: -
Natriumchlorid H: - P: -
Materialien: Glasschale mit mind. 30 cm Durchmesser, Bindfaden, Becherglas (100 ml), Eis, Stoppuhr.
Chemikalien: Wasser, Natriumchlorid.
Durchführung: Die Glasschale wird ca. 5 cm hoch mit Wasser gefüllt durch Eiszugabe herunter gekühlt. Die Eiswürfel sollen ohne sie mit den Händen zu berühren aus der Schale gezogen werden. Dieses ist unter Einsatz geringer Mengen Natriumchlorid zu bewerkstelligen.
Beobachtung: Lokal an den Stellen auf die Salz gestreut wurde bildet sich flüssiges Wasser. nach ca. 1 min ist der Faden festgefroren (Abbildung 5).
Es handelt sich um einen eindrucksvollen Versuch in welchem die SuS eigenständig die Wirkung eines weiteren Stoffes auf dessen Schmelzpunkt entdecken.
Abbildung 5: Aufbau (links) und Beobachtung (recht) zum Versuch "Eiswürfel fischen"
Deutung: Durch die zunächst lokal relativ hohe Natriumchloridkonzentration kommt es zum Schmelzen des Eises, sodass der Faden im Wasser verschwindet. Es schmilzt immer mehr Eis, bis die Konzentration an Natriumchlorid so gering ist, dass dessen Gefrierpunkt erreicht wird. Die Abkühlung liefert der Eiswürfel selbst.
Literatur: Prof. Dr. Volker Mellert et al. http://www.physikfuerkids.de/lab1/
versuche/eisangeln/index.html (am 25.9.2012 15 Uhr)
Entsorgung über die Kanalisation. Eine Anknüpfungspunkt für das Experiment wären Kältemischungen von Salzen. Als Ergänzung eignet sich ein Versuch, bei dem versucht wird, verschieden konzentrierte Salzlösungen einzufrieren.
Führe das Experiment mit deinem Sitznachbarn in Partnerarbeit durch.
Materialien: Glasschale mit 30 cm Durchmesser, Bindfaden, Becherglas (100 ml), Eis, Stoppuhr.
Chemikalien: Wasser, Natriumchlorid.
Durchführung: Fülle die Glasschale einige cm hoch mit kaltem Wasser. Füge dann eine Hand voll Eis hinzu und warte, bis dieses geschmolzen sind. Während der Wartezeit knotest du einen ca.
30 cm langen Bindfaden an einem Ende zu einer Schleife zusammen. Es werden nun mehrere große Eiswürfel in das Wasser gelegt. Wichtig: Ab jetzt sollten die Hände keinen der Eiswürfel mehr berühren. Nun kann das Angeln beginnen. Platziere hierfür die Angelrute auf einem Eiswürfel und bestreue diese leicht mit Salz. Warte 1-2 min und versuche, die Angelrute mit dem Eiswürfel aus der Glasschale zu ziehen. Ihr könnt auch einen Wettbewerb daraus machen.
Aufgabe 1: Was lässt sich in Bezug auf die Eiswürfel beobachten? Notiere ebenfalls deine Beobachtungen was mit der Eiswürfeloberfläche passiert, wenn Salz gestreut wird und was nach einigen Minuten mit der Oberfläche passiert. Variiere auch die Menge an eingesetztem Salz.
Aufgabe 2: Ordne die folgenden Begriffe den Pfeilen zu. „schmelzen“, „kochen/verdampfen“,
„gefrieren“, „niederschlagen/kondensieren“
Eis Wasser Wasserdampf
Aufgabe 3: Nenne eine Anwendungsmöglichkeit für das im Experiment beobachtete Phänomen und erläutere sie.
4 Reflexion des Arbeitsblattes
Das folgende Arbeitsblatt dient der Vertiefung des Themas Schmelz- und Siedetemperatur.
Selbstständiges Durchführen einfacher Experimente in Partnerarbeit und detailliertes Protokollieren von Beobachtungen stehen bei den SuS im Fokus.
4.1 Erwartungshorizont (Kerncurriculum)
Teilkompetenz Die SuS können...
Fachwissen: Ergänzende Differenzierung: Fachwissen: Siedetemperatur;
Schmelztemperatur
... beschreiben, wie der Aggregatszustand eines Stoffes von der Temperatur abhängt.
Erkenntnisgewinnung
: …sachgerecht nach Anleitung experimentieren.
… sorgfältig Aggregatszustandsänderungen beobachten und beschreiben.
… geeignete Experimente zu den Aggregatzustandsänderungen durchführen.
Kommunikation: …ihre Messergebnisse und Beobachtungen der einfachen Experimente protokollieren.
Bewertung: ... die Aggregatzustandsänderungen in ihre Umgebung (z. B. Wasser) erkennen und erläutern.
4.2 Erwartungshorizont (Inhaltlich)
Aufgabe 1: Es soll erkannt werden, dass Eiswürfel auf dem Wasser schwimmen, ohne dieses näher zu erklären. Außerdem soll beschrieben werden, dass Salz streuen flüssiges Wasser auf der Oberfläche erzeugt. dessen Menge nimmt zu, bis es erneut zum Gefrieren kommt. Bei zu viel Salz schmilzt der Eiswürfel sehr schnell und es kommt zu keinem Gefrieren.
Aufgabe 2: Die Aggregatszustandsänderungen vom und zum Wasserdampf sollten in vorherigen Stunden der UE schon behandelt worden sein.
schmelzen verdampfen
gefrieren kondensieren
Eis Wasser
Wasserdampf
Aufgabe 3: Beispielsweise denkbar wäre der bekannte Einsatz von Salz bzw. Salzlösung im Winter auf der Straße, um diese von Schnee und Eis zu befreien.