Philipps-Universität Marburg Fachbereich 15: Chemie
Experimentalvortrag Anorganische Chemie Sommersemester 2009
Experimentalvortrag
„Die vier Elemente“
Elisabeth Sieg
LA modularisiert: Chemie, Englisch, DaF Geschwister-Scholl-Straße 3
35039 Marburg
Matrikelnummer: 2132532
Inhaltsverzeichnis
1. Einleitung 4
2. Feuer 7
V1 „Vulkan“ 7
V2 „Feuer unter Wasser“ 8
3. Wasser 10
V3 „Springbrunnen“ 10
D1 „Wasseruntersuchungen“ 13
V4 „Nitritnachweis“ 15
4. Luft 17
V5 „Luftverbrennung“ 17
5. Erde 21
V6 „Verkokung von Steinkohle“ 21
6. Die vier Elemente in der Alchemie 23
D2 „Die vier Elemente“ 23
V7 „Magisches Feuer“ 26
7. Die vier Elemente heute 27
V8 „Brennstoffzelle“ 28
8. Schulrelevanz und didaktische Analyse 31
9. Quellenverzeichnis 32
9.1 Literaturverzeichnis 32
9.2 Internetquellen 32
9.3 Versuchsbeschreibungen 33
9.4 Abbildungen 34
1. Einleitung
Schon seit tausenden von Jahren vor Beginn der Zeitrechnung ehrten Völker auf der ganzen Welt die vier Elemente Feuer, Erde, Wasser und Luft. Sie waren Teil von Ritualen, entsprachen Gottheiten und fanden sich in Gebräuchen der Menschen wieder.
Der Elementbegriff
Ursprung und Prägung des Begriffes „Element“ sind unbekannt. Man nimmt an, dass das lateinische Wort „elementum“ eine Neuschöpfung oder auch ein Kunstwort war. Anscheinend entstammt es dem Indogermanischen und wurde als „die Buchstaben, in denen die Welt geschrieben ist“ bezeichnet. Populär wurde der Begriff durch die Mathematik und Euklid.
Die Ära der Griechen
Im europäischen Kulturkreis brach durch die Griechen und die durch sie hervorgebrachten Naturphilosophen eine neue Zeit und Betrachtungsweise für die Elemente an. Man ging in der Antike von fünf Grundelementen (neben den bekannten vier noch Äther bzw. Chaos) aus, die als mythologische Gesamtheit fungierten. Die griechische Philosophie nahm jedoch als erste eine Abstraktion dieser Vorstellungen vor.
1Die Elemente sollten als „Bausteine“ betrachtet werden, eine erste „Verwissenschaftlichung“ der Theorie fand statt.
Thales von Milet war einer der ersten griechischen Philosophen, der sich um etwa 600 v.Chr.
die These aufstellte, dass alles aus Wasser entstanden sein sollte. Er beobachtete, dass Wasser für Lebewesen unentbehrlich war und dass es in verschiedenen Formen (z.B. Eis, Regen, Dampf) vorkam. Später (ca. 500 v.Chr.) erklärte Anaximenes von Milet Luft zu dem einzigen Urstoff, da er durch Umwandlung in verschiedene Formen übergehen könne. Heraklit (ca. 520 v.Chr.) machte schließlich das Feuer zu seinem Urstoff, „das Veränderlichste aller Erscheinungen“
2und Kernpunkt seiner Lehre.
Empedokles
1 Treumann, Rudolf : Die Elemente- Feuer, Erde, Luft und Wasser in Mythos und Wissenschaft.
2 Engels, Siegfried : Auf der Spur der Elemente.
Trotz dieser aufgestellten Theorien blieb die verwirrende Vielfalt der sinnlich wahrnehmbaren Vorgänge. Die beobachtete Natur war zu komplex, um sie mit einer der Theorien beschreiben zu können.
Empedokles (ca. 490 bis 430 v.Chr) stellte als Erster den Versuch an, die Beweglichkeit und Vielseitigkeit der Welt zu verstehen. Er definierte mehrere Stoffe, indem er die Erkenntnisse seiner Vorgänger zusammenfasste, die als gleich wichtig und unvergänglich galten. Die vier Urstoffe galten in seiner Theorie als
„Wurzeln aller Dinge“ (rhizómata), die stetigen Veränderungen unterliegen. Diese sind ein Wechselspiel zwischen Liebe (Vermischung) und Hass (Entmischung).
Empedokles gilt mit dieser Theorie als „Begründer der ersten chemischen Theorie“
3und als Begründer der „Vier-Elemente- Theorie“ (Elementenlehre).
Abbildung 1: Empedokles.
Platon
Die Weiterentwicklung der Vier-Elemente-Theorie erfolgt durch Platon (ca. 410 v.Chr.). Er
postulierte, dass die Elemente aus demselben Urstoff bestehen würden. Dies sollte es möglich
machen, sie ineinander überführen zu können. Er versuchte dies zu verdeutlichen, indem er
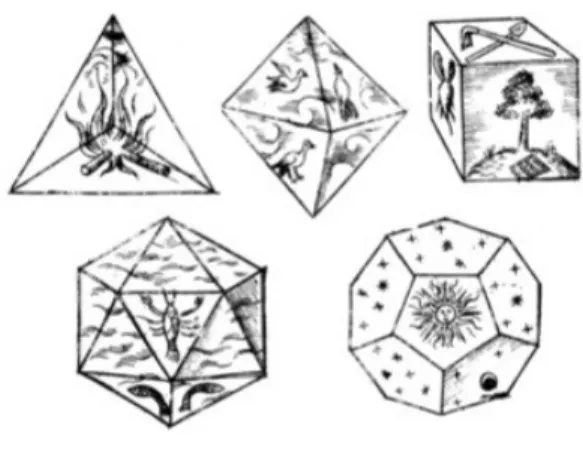
die Elemente als geometrische Körper beschrieb. Dabei stand das Feuer für das Tetraeder,
Luft für das Oktaeder, Wasser das Ikosaeder und Erde für den Kubus. Platon fügte noch ein
fünftes Element hinzu, das er als „Universum“ bezeichnete und mit dem Dodekaeder
beschrieb.
Abbildung 2: Die platonischen Körper.
Aristoteles
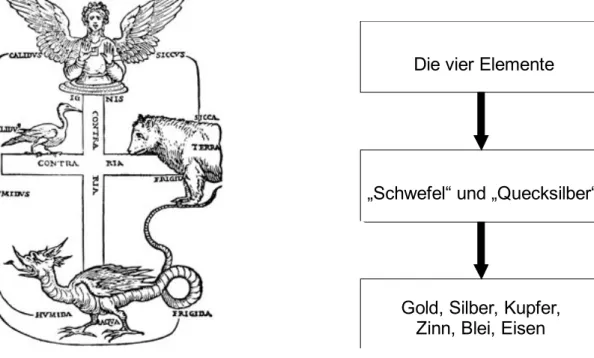
Aristoteles übernahm die Lehre seines Vorgängers und versuchte, seine Beobachtungen der Natur und deren Erscheinungen in seine Theorie einzubeziehen. Er schrieb den Elementen sinnlich wahrnehmbare Eigenschaften zu. Hierbei verfügten zwei Elemente immer über eine gemeinsame Eigenschaft, die es ihnen möglich machte ineinander überzugehen. Feuer besaß die Eigenschaften heiß und trocken, die Erde war trocken und kalt, das Wasser kalt und feucht und die Luft feucht und heiß. Diese Theorie zur Erklärung von chemischen Vorgängen blieb 2000 Jahre unwidersprochen und galt als Grundlage der Forschung der damaligen Zeit.
Abbildung 3: Das aristotelische Elementenviereck.
2.
Feuer
Die Bändigung oder Zähmung des Feuers durch den Menschen liegt ungefähr 300.000 Jahre zurück.
4Seither gilt es als Licht- und Wärmespender und wird zur Vertreibung der Finsternis genutzt. Heraklit bezeichnete es in der Antike als Urelement. Im Mittelalter hielten die Alchemisten das Feuer für eine belebte Substanz, die sie beschwörten. Natürvölker beteten den Feuergott Java an. Ihrer Meinung nach sollte dieser in Vulkanen leben und bei dessen Ausbruch ihnen Fruchtbarkeit schenken. Der Vulkan galt seit jeher als Symbol des Feuers.
Versuch 1: „Vulkan“
Chemikalien:
Ammoniumdichromat (NH
4)
2Cr
2O
7T+, Krebserregend 2 g
Aceton C
3H
6O 2 mL
Geräte:
feuerfeste Unterlage (z.B. Backblech), Aluminiumfolie, Schutzhandschuhe, Bunsenbrenner, Spatel, Pipette, 50 mL Becherglas
Durchführung:
In einen Abzug wird ein mit Aluminiumfolie abgedecktes Backblech gestellt. Das Ammoniumdichromat wird in Form eines Haufens auf die Unterlage gegeben
4 Hoffmann Mary, Ray Jane: Erde, Feuer, Wasser, Luft.
(Schutzhandschuhe tragen!). Die Spitze des Haufens wird mit einigen Millilitern Aceton angefeuchtet. Danach wird die Spitze mit dem Bunsenbrenner entzündet.
Beobachtung:
Das orangene Ausgangsprodukt glüht, unter Funkenfreisetzung, nach Entzündung. Zurück bleibt ein grünes Reaktionsprodukt.
Entsorgung:
Die Rückstände werden gelöst und neutral in den Sammelbehälter für giftige anorganische Substanzen überführt.
Auswertung:
Aceton (Propanon) wird zur einfacheren Entzündbarkeit des Ausgangsstoffes hinzugegeben.
Bei der Reaktion zerfällt das orangene Ammoniumdichromat unter Freisetzung von Stickstoff und Wasser in grünes Chrom(III)oxid. Es findet eine exotherme Redoxreaktion statt.
Oxidation
Reduktion
3 6 0 3
2 ( )
4 2 2 7 ( ) 2 ( ) 2 3 ( )
( N H ) C r O s N g 4 H O g C O s
- + +
¾ ¾® D + +
Heute kommt das Feuer im Alltag noch in vielen Begriffen wie z.B. „Lagerfeuer“ und
„anfeuern“ oder in Sprichwörtern wie „Spiel nicht mit dem Feuer“ vor. Die Menschen umgeben sich mit Kaminen, Kerzenlicht, Osterfeuern und Feuerwerk, um sich an Traditionen und Gebräuche zu erinnern.
Chemisch ist das „Feuer“ eine exotherme Reaktion, eine Verbrennung (Oxidation) mit Flammenerscheinung, die sehr vielseitig sein kann.
Da das verwendete Ammoniumdichromat krebserregend ist, ist die Durchführung des Versuches in der Schule verboten.
Versuch 2: „Feuer unter Wasser“
Chemikalien:
Kaliumpermanganat KMnO
45 g
Ethanol C
2H
6O 1 mL
Schwefelsäure
(konz)H
2SO
4C 5 mL
Geräte:
Stativmaterial, Demoreagenzglas, 3 50 mL Bechergläser, Spatel, Pipette
Durchführung:
Das Reagenzglas wird zu ¼ mit Schwefelsäure gefüllt und in ein Stativ eingespannt. Mit derselben Menge an Ethanol wird die Schwefelsäure vorsichtig überschichtet (Reagenzglas etwas schräg halten oder einspannen). Das Kaliumpermanganat wird in das Reagenzglas gegeben, wenn sich zwei sichtbare Schichten gebildet haben (maximal 10 Spatelspitzen).
Beobachtung:
Nach dem Überschichten bilden sich zwei farblose Phasen aus. Nach Zugabe des Kaliumpermanganats findet an der Phasengrenze eine heftige Reaktion statt. Die Lösung im Reagenzglas färbt sich erst grünlich und dann braun.
Entsorgung:
Die Lösungen werden neutral in die anorganischen Abfälle gegeben.
Auswertung:
Das Kaliumpermanganat reagiert mit der konzentrierter Schwefelsäure zu Dimanganheptoxid (grün).
4 ( )s 2 4 ( )l 2 4 (a q) 2 7 (a q) 2
K M n O + H S O ® K S O + M n O + H O
An der Phasengrenze zerfällt das Heptoxid in Mangan(IV)oxid (braun) und Sauerstoff.
Oxidation
Reduktion
7 2 4 0
7 ( ) 2 ( )
2 a q 2 2 ( a q ) 1 , 5 g
M n O + - ® M n O + + O
Der entstandene reaktive Sauerstoff oxidiert das Ethanol zu Kohlenstoffdioxid und Wasser.
Oxidation
Reduktion
- 3 - 1 0 + 4 - 2
®
2 ( g ) 2 ( g )
3 2 ( a q ) 2 ( g )
C H C H O H + 3 O 2 C O + 3 H O
3.
Wasser
Schon Thales von Milet betrachtete das Wasser als unvergängliches Urelement, von dem alles Leben abhängt. Er soll gesagt haben: „alles ist Wasser und Wasser ist nicht erklärbar.“
5Wasser hat seit Jahrhunderten eine große Bedeutung für die Menschen, so wird es seit jeher in religiösen Zeremonien zu Waschungs- und Reinigungszwecken eingesetzt. „Das Element des Lebens“, wie das Wasser auch oft genannt wird, galt schon im Mittelalter als Symbol der Fruchtbarkeit und man sprach ihm magische Fähigkeiten zu. Neben „Jungbrunnen“ und Quellen umgaben sich die Menschen mit Wasserspielen wie z.B. dem Springbrunnen, um sich an diesem Element zu erfreuen.
Versuch 3: „Springbrunnen“
Chemikalien:
Ammoniak NH
315 mL
Kupfersulfat CuSO
42 g
Entionisiertes Wasser H
2O 500 mL
Geräte:
1L Kolben, Ammoniakgasflasche, Hebebühne, Stativmaterial, Ventil, Gasflaschenhalter, dünner PVC-Schlauch, Unitestpapier, Doppelgebläse, Steigrohr, Woulff’sche Flasche
Durchführung:
5 Van der Sluis, Claudia: Reihe der vier Elemente Teil 1-4 (Erde, Wasser, Feuer, Luft).
Die Gasflasche wird angeschlossen und mit einem PVC-Schlauch verbunden, den man in den Abzug legt. In die Woulff’sche Flasche werden 4 Spatel Kupfersulfat gegeben und in 500 mL entionisierten Wasser gelöst. Die Apparatur wird mit Stopfen verschlossen. In den Kolben wird das Gas eingeleitet. Der Kolben ist vollständig gefüllt, wenn sich das angefeuchtete Unitestpapier blau färbt. Selbiger wird nun in das Stativ eingespannt und mit dem Rest der Apparatur verbunden. Mit dem Doppelgebläse wird ein Teil der Flüssigkeit durch das Steigrohr in den Kolben befördert.
Abbildung 4: Versuchsaufbau.
Beobachtung:
Die hellblaue Flüssigkeit steigt im Steigrohr auf und reagiert mit dem Gas im Kolben zu einer
dunkelblauen Flüssigkeit.
Abbildung 5: Kupfersulfat-Lösung. Abbildung 6: Blaue Lösung im Kolben.
Entsorgung:
Die Lösungen werden neutral in die anorganischen Abfälle gegeben.
Auswertung:
Ammoniak dissoziiert im Wasser zu Ammonium- und Hydroxid- Ionen.
3 ( ) g 2 4 ( a q ) ( a q )
N H + H O ® N H + + O H -
Das Kupfersulfat zerfällt im Wasser zu Kupfer-Ionen und Sulfat-Ionen.
2