Wertigkeit der Chymotrypsin-Bestimmung im Stuhl für die Erkennung,
Verlaufsbeobachtung und Therapiekontrolle der Mukoviszidose
Teil I: Methodenbeschreibung und -Kritik
W.Appel1
R. Stier, P. Greiner und M. Jesper2
1 Zentrallaboratorium der St.-Vincentius-Krankenhäuser Karlsruhe (Prof. Dr. med. P. M. Reisen) und der Kinderklinik Mannheim der Universität Heidelberg (Prof. Dr. med. E. Huth)
2 Universitäts-Kinderklinik Freiburg im Breisgau (Prof. Dr. med. W. Künzer)
Zusammenfassung: ./-
Die kinetisch'titrimetrische Bestimmung der Enzymaktivität von Chymotrypsin im Stuhl am pH-Stat wird einer methodenkritischen Überarbeitung unterzogen. Die Messung erfolgt durch fortlaufende Registrierung der Titration der kontinuierlich freigesetzten Protonen mit 0.01 mol/1 NaOH-Lösung. Die Reaktion läuft'ab bei 25,0'C mit 10 bis 200mg Stuhl gegenüber Na-Benzoyl-L-tyrosinethylester, 15mmol/l in einem Reaktionsgemisch aus 316mmof//
NaCI, 3,16mmol/l Tris und 3,16mmol/l CaCI2, pH 7,90. Jeder Meßwert ist durch eine lineare Zeit- und Konzentrationsabhängigkeit abgesichert. Maßnahmen und Ergebnisse der internen Qualitätskontrolle, Angaben zu Praktikabilität und Wirtschaftlichkeit und eine detaillierte Arbeitsvorschrift werden mitgeteilt. Die Methode hat sich an über 2000 Stuhlproben von Erwachsenen und 1600 Stuhlproben von Kindern und Säuglingen be wähn.
Schlüsselwörter:
Chymotrypsin r Stuhlenzyme — Mukoviszidose — Exokrine Pankreasinsuffizienz — Klinische Enzymologie — pH- Stat
Summary:
The kinetic-titrimetric determination of the enzymatic activity of Chymotrypsin in feces with the aid of a pH-stat has been rechecked. The measurement is done by continuous registration of the titration of liberated protons with 0.01 mollINaOH. Reaction occurs at 25.0'C with 10 to 200 mg stool, Na- benzoyl- L - tyrosine- ethylester. 15mmo//lin a reaction mixture containing 316mmolllNaCI, 3.16mmol/ltrisbuffer and 3.16mmol/ICaCI2atpHof7.90.Each value is checked by a linear correlation to time and concentration. Procedures and results of internal quality control, data for practicability and economy and a working procedure in detail are reported. The method has been verified with more than 2000 specimen of feces of adults and 1600 specimen of children and infants.
Keywords:
Chymotrypsin — fecal encymes —fystic fibrosis — exocrine pancreas insufficiency — clinical enzymology — pH-stat
Einleitung einer routinefähigen Methode zwecks Beurteilung der dia-
gnostischen Wertigkeit bei Kindern mit Verdacht auf Muko- Die Endopeptidase Chymotrypsin (EC 3.4.21.1) wird im viszidose (zystische Fibröse).
Pankreas von Mensch und höheren Säugetieren gebildet und in den Darm sezerniert. Dabei besitzt sie eine unerwartet höhe Stabilität und wird mit dem Stuhl ausgeschieden; wahr-
scheinlich unter Bindung an Stunlpartikel. Die quantitative . , .. . _ . . Bestimmung der katalytischen Aktivität im Stuhl ist zur MeinOdlSCnes
Beurteilung der Funktionsfähigkeit des Pankreasgewebes Bestimmung der katalytischen Aktivität des Chymotrypsins im herangezogen worden. Bei Erwachsenen kann s» zur D.ffe- Stuh|homogenatrnitNa.Benzoyl-L-tyrosinethylesteralsSub- rent,ald,agnost,k von Pankreaserkrankungen (1 -3), be, Km- jn Q wart von Ca^onen unter fortlaufender Titra- dern zur Mukov.sc.dose-Erkennung (4-10) herangezogen tfon ^ frejwerdenden PrOtonen mit 0,01 mol/l Natronlauge
werden· . bei einem konstanten pH-Wert von 7,90 und einer Meß- Ziel der vorliegenden Untersuchungen ist eine kritische Über- temperatur von 25,0'C (pH-Stat-Methode, Messung der An- prüfung der methodischen Grundlagen und die Ausarbeitung fangsreaktionsgeschwindigkeit).
Wissenschaft und Fortbildung Lab.med. 7: 203 (1983) 203 Untersuchungsmaterial
Stuhlproben von Erwachsenen und Kindern mit verschiede- nem Geschlecht und Alter und verschiedener Beschaffenheit.
Kotproben von Hunden und Katzen.
Reagenzien
1. Tris (hydroxymethyl) aminomethanhydrochlorid (Tris) zur Analyse, Merck 8382.
2. Calciumchlorid, CaCI2 · 2 H20, zur Analyse Merck.
3. Natriumchlorid zur Analyse Merck.
4. Na-Benzoyl-L-tyrosinethylester (BTEE), Fluka 13110.
5. Methanol zur Analyse Merck.
6. Natronlauge, 0,1 mol/l Titrisol Merck.
7. Salzsäure 1 mol/l Titrisol Merck.
8. Chymotrypsin A4 ( -Chymotrypsin) aus Rinderpan- kreas, lyophilisiert, salzfrei, 72 U/mg, Firma Boehringer Mannheim, Best.-Nr. 103306.
a-Chymotrypsin, 3 kristallisiert, lyophilisiert, salzfrei, ca. 45 U/mg, Firma Serva, Best.-Nr. 17160.
9. L-1-Chlor-3-[4-tosylamido]-4-phenyl-2-butanon (TPCK). C17H18CIN03S, MG 351,8, Firma Serva. Best.- Nr. 17016.
10. N-Succinyl-L-Ala-L-Ala-L-Pro-L-Phe-p-nitranilid, Fir- ma Bachern, CH-4416 Bubendorf, Schweiz.
Geräte
pH-Stat: TitratorTTT2 mit Titrigraph SB R 3 und Autobürette ABU 12, Reaktionsgefäße aus Polyethylen in einem doppel- wandigen Mantelgefäß, Umlaufthermostat mit Wasserbad und Magnetrührvorrichtung im geschlossenen System (Fa.
Radiometer).
Coolworth „Stomacher" und Polyethylenbeutelchen mit Klettverschluß.
Oberschalige Waage mit Wägebereich bis 100g und einer Ablesegenauigkeit von 0,01 g.
Dunsthaube oder Abzug, soweit vorhanden.
Stuhlgefäß: Handelsübliche Stuhl(-versand)röhrchen mit im Lamellenstopfen eingeschweißten Löffelchen.
V2A-Spatel.
Voltpipetten, 50 ml, evtl. 25 ml.
Herstellung der Lösungen (für 20 Bestimmungen)
I Tris-Stammlösung, 100mmol/l, pH 7,9.
6.05g Tris in 400,0ml bidest. Wasser lösen. 15,4ml 1 mol/l Salzsäure zugeben, auf 500,0ml auffüllen, eventuell pH nachstellen.
II Tris-Gebrauchslösung, 10mmol/l.
5,00ml der Lösung l auf 50,0ml im Meßkölbchen mit bidest Wasser auffüllen. *
III Natriumchloridlösung, 1 mol/l.
29,3g NaCI in 500ml bidest. Wasser lösen.
IV Natriumchloridlösung, 0,154 mol/l - 9,0 g/l.
9,0g NaCI in 1000ml bidest. Wasser lösen.
V Calciumchlorid, 1 mol/l.
7,35g CaCI2 in 50ml bidest. Wasser lösen.
VI Tris-Aktivatorlösung enthaltend 5 mmol/l Tris, 500 mmol/l NaCI und 5 mmol/l CaCI2.
10,0ml Lösung II + 10,0ml Lösung III + 0,10ml Lösung V in einem 50ml Becherglas,
vor Gebrauch mischen.
VII Substrat-Stammlösung, 90mmol/l BTEE = 282mg BTEE irj 10,0ml Methanol lösen.
VIII Substrat-Gebrauchslösung 45mmol/l BTEE, 5mmol/l Tris.
Vor der Bestimmung 10,0ml Lösung VII mit 0,5ml Methanol und 9,5ml Lösung II in dieser Reihenfolge mischen.
IX Titrant: NaOH, 0,01 mol/l.
10,0 ml 0,1 mol/l NaOH auf 100,0 ml im Meßkolben mit bidest. Wasser bei 20,0 °C verdünnen.
X Chymotrypsinlösung, 1 mg/ml.
10,0mg Chymotrypsin mit 10,0ml Lösung VI in einem Polystyrolröhrchen auflösen. Sofort verwenden.
XI Chymotrypsin-Kontroll-Lösung, 10 g/ml.
Lösung X 1:100 verdünnen: 100 Lösung X mittels Kolbenhubpipette in 9,90ml Lösung VI in einem Poly- styrolröhrchen eingeben. Sofort verwenden!
Vorbereitung der Gebrauchslösungen (vor jeder Serie frisch anzusetzen) 1. Herstellung der Lösung II aus der Lösung l.
2. Herstellung der Substrat-Stammlösung VII und der Sub- strat-Gebrauchslösung VIII
z.B. 11 ml für 10 Bestimmungen.
3. Herstellung der Lösung VI aus den Lösungen II, III und V, z.B. 20ml für 10 Bestimmungen.
4. Herstellen der Lösung XI unmittelbar vor Gebrauch!
Herstellung eines
Stuhlhomogenats 1:10 (g/g)
Auf der oberschaligen Waage wird ein geöffnetes Polyethy- lenbeutelchen in eine Halterung (z.B. Urinbecher) eingestellt und die gesamte Anordnung austariert. Dann gibt man mit dem Löffel des Stuhlversandgefäßes oder einer Spatel etwa 2—3g Stuhlprobe in das Beutelchen, verschließt dieses weitgehend, stellt das Nettogewicht genau fest und gibt mit der Pipette solange NaCI-Lösung IV hinzu, bis die Waage genau das 10f ache Stuhlgewicht anzeigt. Das Beutelchen wird ganz verschlossen, ca. 2min im „Stomacher" belassen und (nach Sichtprüfung) mit dem Stuhlhomogenat einge- froren, kühlgestellt oder sofort an den Arbeitsplatz weiterge- leitet. Zur Aufbewahrung dient der beschriftete Urinbecher.
Rührmagnet zugeben und bei pH 7,90 mit Lösung IX austitrie- ren. Registrierung des Titrationsverlaufes und Ermittlung des Titrationsverbrauches 0,01 mol/l NaOH-Lösung pro min aus dem linearen Anfangsteil der Registrierkurve, meist nach einer log-Periode zwischen der 3. und 5. (10.) min. Werden statt 0,10ml Homogenat 0,20 oder 0,05 bzw. 0,02 ml Homo- genat eingesetzt, wird mit Lösung VI entsprechend ausgegli- chen. Bei zu hoher Anfangsaktivität wird das Stuhlhomogenat vorweg nochmals 1:10 mit Lösung IV verdünnt.
Apparative Einstellung
Titrator TTT 2
Autob rette ABU 12 Titrigraph SBR 3
Temperatur:
Puffer:
pH -Bereich:
Titration:
Proport. Band:
Delay:
Recording:
Chart Calibration:
Speed:
Volumen:
Chart feed:
Pen movement:
25,0 'C 704-11 up scale 0,1 oder 0,05 COpH-Stal 1 mV/cm 160(80.40) 0,25ml 1 min/cm
x1
Durchf hrung der Bestimmung
Beutelchen geringf gig ffnen und das Homogenat mit einer Kolbenhubpipette zugeben:
L sungen L sung VI vorlegen Homogenat zugeben L sung VIII
Volumina 1,90ml 0,10ml 1.00ml
Konzentrationen im Test NaCI: 316mmol/l CaCI2:3,16mmol/l Tris:3.16mmol/l BTEE:15.0mmol/l
Leerwerte:, Anstelle Stuhlhomogenat wird L sung IV einge- setzt.
Kontrollwerte: Anstelle Stuhlhomogenat wird die Chymo- trypsin-Kontroll-L sung XI eingesetzt.
Berechnung
Grundlage der Berechnung
1 U entspricht der Hydrolyse von 1 ì9 Substrat pro min, somit einer Freisetzung von 1 ìççïÀ Benzoyltyrosin/min.
1 ìáéïß Benzoyltyrosin entspricht 1 ìççïÀ NaOH = 100ìÉ der 0,01 mol/l NaOH-L sung. ' Ein Verbrauch von 1 ìÀ 0,01 mol/l NaOH pro min entspricht somit 0,01 ìðçïÀ Benzoyltyrosin pro min.
0,01 ìðéïß Substrat hydrolysiert pro Minute entspricht somit einer Enzymaktivit t von 0,01 U.
Bei einem Einsatz von 100ìÉ eines 1:10 Komogenates = 10mg Stuhl entspricht ein Verbrauch von 1 ìÀ 0,01 mol/l.
NaOH somit 0,01 U/1 Omg oder 1 U/g Stuhl.
Nach graphischer Ermittlung der Ausgleichsgeraden errech- net sich:
Chymotrypsin-Aktivit t x : U/g = a [ìÀ/min]. . a = Verbrauch an 0,01 mol/l NaOH (ìÀ/min) ,»
÷ = Chymotrypsin-Aktivit t pro g Stuhl
Bei Einsatz von 50, 20 oder 200 ì l Homogenat werden entsprechende Faktoren (2, 5 oder*0,5) ber cksichtigt.
Kalibrierung
Eine Kalibrierung ist mit (einer Chymotrypsinl sung, 1,40 mg/ml f r Kontrollzwecke m glich.
Einwaage: 14mg in 10ml L sung IV.
Vor Gebrauch verd nnen 1:10 mit L sung IV (140ìò/çôéÉ).
Vorgehen wie bei Herstellung der L sungen X und XI.
Einsatz zum Test: 50ìÉ Á 7ìg Enzym.
Beispiel: Verbrauch 94 ì l/min 0,01 mot/l NaOH-L sung.
94 ì l/min = 0,94ìçéïÉ/ðéßç * 0,94 U 0,94 U bei7ìg * 0,134U^g - 134 U/mg.
Umrechnung von ìg Chymotrysin zu U Chymotrypsin bei Literaturangaben:
1 U = z.B. 13^g 1 ìg = z.B. 75mU.
Ergebnisse
Anforderungen an das Untersuchungsmaterial
Als Resultat vieler methodischer Voruntersuchungen wird folgender Anforderungskatalog an das Untersuchungsmate- rial aufgestellt.
1. Es sollen 3 St hle aus 3 verschiedenen Tagen untersucht werden. F r Aussagen im Grenzbereich oder mit beson- derer Wertigkeit ist diese Forderung obligatorisch.
2. Die Stuhlproben d rfen nicht lter als 3 Tage sein.
3. Das 24-Std.-Stuhlgewicht soll beim Erwachsenen unter 300g liegen.
4. Die Stuhlprobe soll f r die Grundgesamtheit repr senta- tiv sein.
5. Die Stuhlproben sollen aliquote Teile eines 24-Std.- Stuhles darstellen.
6. Die Stuhlproben d rfen nicht grob inhomogen, fl ssig, fettig und sonstwie auffallend sein.
7. Die zur Verf gung stehende Stuhlprobe soll mindestens 3g, besser 5g wiegen.
8. Das Stuhlhomogenat soll aus verschiedenen Teilen der Stuhlprobe hergestellt werden.
9. W rige Stuhlproben d rfen nicht, breiige nur unter Vorbehalt untersucht werden. Bei der Befundmitteilung ist darauf hinzuweisen.
10. Verdauungspr parate sollten nach M glichkeit 3 Tage vorher abgesetzt werden, es sei denn, sie sind Gegen- stand der Fragestellung.
Qualit tssicherungsdaten
Pr zision
Die Pr zision in Serie an einem Stuhlhomogenat mit einer Chymotrypsinaktivit tvon ÷ = 48,5 U/g betr gt VK* = 6,43%
(n = 1p).
Die Pr zision von Tag zu Tag an bei — 18eC eingefrorenen Proben eines Stuh'lhomogenats im Verlauf eines Monats mit
÷ = 23,5 U/g betr gt VKT = 11,2% (n = 19).
Die spezifische Aktivit t kristallisiertem a-Chymotrypsins wurde unter den beschriebenen Versuchsbedingungen kon- trolliert.
Chymotrypsin A 4 (Boehringer) war mit 75 U/mg (gegen ber Na-Acetyl-L-tyrosinethylester) deklariert. Bei Einwaagen von 10 bis 20 mg in 9 g/l NaCI-L sung wurden im Mittel 72 U/mg gefunden; dies entspricht einer Wiederfindung von 96,0%.
Wissenschaft und Fortbildung Lab.med. 7:205 (1983) 205
-Chymotrypsin (Serva) war mit ca. 45 U/mg deklariert. Unter den Versuchsbedingungen wurden zwischen 95—105% ge- funden. Der spezifische Inhibitor TPCK hemmt auch unter den gegebenen Versuchsbedingungen die Chymotrypsinaktivität im Stuhl.
Wiederfindung
Ein Zusatz von kristallisiertem Chymotrypsin, 45 U/mg, zu Stuhlhomogenaten mit Chymotrypsinaktivitäten von ca.
5 U/g, 12 U/g und 24 U/g ergab Wiederfind u ngsq u oten von 93.7 bis 109,5%. Die zugesetzten Aktivitäten lagen in der gleichen Größenordnung wie diejenigen der Stuhlproben.
Temperatureinfluß
Zur Absicherung gegenüber nicht-enzymatischen Reaktionen kann folgender Versuch durchgeführt werden: Ein kompletter Ansatz mit Stuhlhomogenat wird unter Eiswasserkühlung im pH-Stat titriert. Nach 10min Reaktionszeit wird das Eiswas- serbad durch das Thermostaten-Mantelgefäß ersetzt, das an einem Umwälzthermostaten mit definierter Temperatur ange- schlossen ist. Dabei bleibt das gesamte System geschlossen.
Beispiel: Stuhlhomogenate mit Chymotrypsinaktivitäten von 32 U/g und 15 U/g zeigen bei Eiswasserinkubation Aktivitä- ten von <0,5U/g, die nach Erhöhung der Mantelgefäßtem- peratur auf 25,0 "C langsam ansteigend innerhalb 10min wieder die Ausgangsaktivitäten erreichen.
Wiederholbarkeit
Die Chymotrypsinaktivitäten von Stühlen aus drei aufeinan- derfolgenden Tagen eines Patienten sind fast immer sehr gut vergleichbar (Tab.1). Unklare Befunde (Tab. 2) bedürfen der klinischen Abklärung und Wiederholung zu späteren Zeit- punkten.
Zeit- Wirkungsbeziehung
Die Reaktion verläuft nach einer lag-Periode von 1 -3min bis zu 120 min linear, wobei als praktischer Meßbereich 3 - 5 min gewählt wird, Abb. 1.
Konzentrations-Wirkungsbeziehung
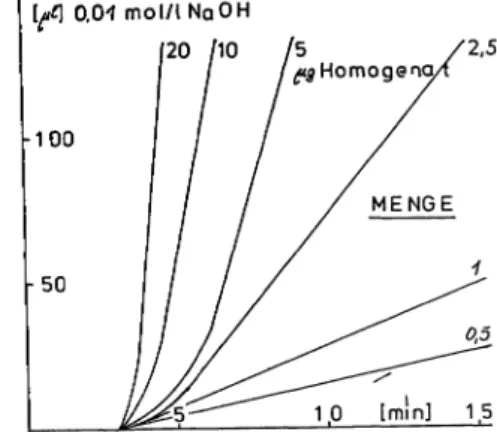
Die Reaktion zeigt Linearität zwischen 2 und mindestens 40 g kristallisiertem Chymotrypsin, Abb.2. Bei Stuhlhomo- genaten liegt der ünearitätsbereich mindestens zwischen 2 und 200 (1:10 Homogenat) entsprechend 1 bis 100 U Chymotrypsin pro g Stuhlfeuchtgewicht (Abb. 3). Bei Aktivi- täten >80 U/g sollten die Homogenate 1:3 oder 1:10 zusätz- lich vorverdünnt werden.
Nachweisgrenze
Als praktische Nachweisgrenze (Empfindlichkeit E90 90%
aller Messungen einwandfrei möglich bei 10min Reaktions- zeit und 200 Homogenat) konnten 0,5 U/g Stuhl ermittelt werden. Aktivitäten zwischen 0,5 bis 80 U/g können ohne Probenkonzentrierung oder -Verdünnung gemessen werden.
Haltbarkeit
Zur Stabilität des Enzyms im Nativstuhl liegen keine systema- tischen Untersuchungen vor.
1-10 Homogenate in 9 g/l NaCI-Losung mit verschiedenen Enzymaktivitäten zeigen nach 4wöchiger Lagerung bei _ 18 *C. 4- 8 *C und bei Raumtemperatur (!) keine Aktivitats- verluste.
Tab. 1: Befundbeispiele I. Chymotrypsin-Aktivitäten in drei Stühlen von drei aufeinanderfolgenden Tagen A, B und C bei Erwachsenen und Kindern verschiedener Einsender Eindeutige Befunde
Seh. K. St.-Vincentius-Krankenhäuser Karlsruhe 30.12.1981 A hart 55 U/g Befund:
B hart 41 U/g Im Normbereich C hart 51 U/g
M. K. Kreiskranjtenhaus Bad Friedrichshall 02.03.1982 A weich 10 U/g Befund:
B weich 7 U/g Leicht patho- C weich 9 U/g logisch erniedrigt V. M. Kreiskrankenhaus Bad Friedrichshall 24.02.1982 A flüssig 3 U/g Befund:
B flüssig 2 U/g Stark patho- C weich 4 U/g logisch erniedrigt Befundbeispiele: Kinder
S. H. Städtisches Krankenhaus Kehl 17.11.1981 A hart 70 U/g Befund:
B hart 68 U/g Im Normbereich C hart 71 U/g
Seh. A. Dr. Zw., Emmendingen 04.02.1982 A hart 24 U/g Befund:
B hart 29 U/g Im Normbereich C hart 33 U/g
H. Chr. Universitäts-Kinderklinik Freiburg 07.12.1981 A weich 15 U/g Befund:
B weich 18 U/g Im Grenzbereich.
C weich 13 U/g Bitte wieder- holen lassen M. St. Universitäts-Kinderklinik Freiburg 05.02.1982 A hart 6 U/g Befund:
B hart 6 U/g Stark patho- C hart 8 U/g logisch erniedrigt M. A. Inst. Lab. Med. Dr. Hauck/Dr. Ziegler, KA 21.08.1982 A hart 11 U/g Befund:
B hart 9 U/g Leicht patho- C hart 12 U/g logisch erniedrigt F. Chr. Universitäts-Kinderklinik Tübingen
A weich 2 U/g Befund:
B weich <1 U/g Extrem patho- C weich 1 U/g logisch erniedrigt Tab. 2: Befundbeispiele II. Wie Tab. 1. jedoch unklare Be- funde
Kinder
H. J. Dr. LL, Buchen/Odenwald 20.01.1982 A weich 48'U/g Befund:
B weich 40 U/g Unklar.
C weich 12U/g? Analysenfehler?
j M. Kreiskrankenhaus Bad Friedrichshall 26.01.1982 A weich 8U/g? Befund:
B weich 16U/g? Unklar.
C weich 27 U/g Wiederholen W G Kreiskrankenhaus Bad Friedrichshall 05.01.1982 A flüssig 8U/g? Befund:
B weich 14U/g? Wahrscheinlich C hart 5U/g? patho/ogisch
erniedrigt p p Universitäts-Kinderklinik Mannheim 02.08.1982 A hart 130 U/g Befund:B hart 225 U/g Im Normbereich.
C hart 185 U/g Unter Enzym- substitution?
5 10 [min] 15
Abb. 1: Zeitabhängigkeit der Chymotrypsin-Reaktion. Abszis- se: Zeit in min. Ordinate: Titrierte Menge an 0,01 mo///NaOH in 11 min.Abb. 2: Konzentrationsabhängigkeit der Chymotrypsin-Reak- tion. Kristalliertes Chymotrypsin. Abszisse: Eingesetzte Chy- motrypsinmenge in g. Ordinate: Titrierte Menge an 0,01 mol/l NaOH in /min. Die Bereiche stellen die S pann- weite bei Stach-Bestimmung dar.
Eine Langzeituntersuchung eines Homogenates mit 15 U/g ergab nach 6 Monaten bei 4—8°C und bei Raumtemperatur unter wöchentlicher Kontrolle noch eine Chymotrypsin-Aktj-
• vitätvon13 und 11 U/g.
Eingefrorene Homogenate sind nach dem,Auftauen hinrei- chend homogen, um präzise Volumina abpipettieren zu kön-x
nen.
Praktikabilität
Die Methode ist nicht mechanisierbar. Sie erfordert einen relativ hohen Aufwand bei der Herstellung der Reagenzien, der Proben-Aufarbeitung und Vorbereitung der Messung. Der Zeit- und Arbeitsaufwand für die Messung hält sich in
Abb. 3: Konzentrationsabhängigkeit der Chymotrypsin-Reak- tion. Abszisse: Zeit in min. Ordinate: Titrierte Menge an 0,01 mo/// Na OH in //min. Die Angaben zu den Kurven stellen die als 1:10 Homogenat eingesetzte Stuhlmenge in
g Feuchtstuhl dar.
Grenzen; in Serie können ca. 15 Stühle in 1 Std. untersucht werden.
Allerdings ist Sorgfalt und Geschicklichkeit des Untersuchers vorauszusetzen, da hinreichend viele Fehlermöglichkeiten gegeben sind.
Kosten
Die Kosten für eine Titriereinrichtung liegen in der Größenord- nung eines guten Photometers. Die Reagenzienkosten sind sehr gering; 2,5g BTEE (ausreichend für ca. 50 Bestimmun- gen), kosten z. Zt. ca. 14,— DM. Puffer und Titrant fallen kaum ins Gewicht.
Norm werte
Als Normwertgrenze bestätigen wir für Erwachsene Literatur- angaben (2). Für Kinder ergab eine spezielle Untersuchung die Gültigkeit dieser Normwerte bis ins Säuglingsalter. Bei Neugeborenen ist Chymotrypsin im Mekonium eindeutig nachweisbar, die Normgrenzen verschieben sich zu tieferen Werten (Dissertation M. Jesper).
Bis zur endgültigen Ermittlung von Normwerten werden aus unseren Erfahrungen folgende Stufen vorgeschlagen:
Normal: über 17 U/g Grenzbereich: 12-17 U/g erniedrigt: ca. 4-12U/g stark erniedrigt: 0-ca. 4 U/g
Störungen technischer Art sind an den Registrierkurven relativ leicht zu erkennen. Arzneimittelstörungen sind nicht unter- sucht, jedoch sind mit Sicherheit falsch positive oder erhöhte
Wissenschaft und Fortbildung Lab.med. 7: 207 (1983) 207
Werte bei Anwesenheit von Digestiva zu erwarten. Diese können bei bestimmten Therapien nicht ohne weiteres abge- setzt werden.
Diskussion
Eine Zusammenstellung verschiedener Meßprinzipien zeigt Abb.4. Die Verwendung einfacher p-Nitranilide (11,12) für direkte Endpunktbestimmungen (Prinzip 1) ist nicht möglich, da deren Empfindlichkeit nicht ausreicht, um in Stuhlhomoge- naten oder -extrakten gegenüber den hohen Eigen leerwerten eine einwandfreie Aktivitätsbestimmung zu ermöglichen.
Darüber hinaus werden - im Gegensatz zu den meisten Enzymaktivitätsbestimmungen - pathologisch erniedrigte Werte erwartet. Inzwischen ist ein wesentlich empfindlicheres Substrat entwickelt worden, N-Succinyl-alanyl-alanyl-pro- lyl-phenylalanyl-p-nitranilid (13, 14), das eine höhere Ver- dünnung der Probe mit einer kinetischen Messung erlaubt (15). Dabei wird auch eine Möglichkeit zur Ablösung des Chymotrypsins von den Stuhlpartikeln mittels Lauryl-trime- thyl-ammoniumchlorid aufgezeigt. Die Aktivität bleibt dabei erhalten, die Extrakte sind haltbar. Dadurch wird die Chymo- trypsinbestimmung im Stuhl mechanisierbar. Erste klinische Untersuchungen verliefen zufriedenstellend (16), erste eigene vergleichende Messungen zeigten Vergleichbarkeit.
Eine weitere Methode verwendet anstelle des p-Nitranilin ß-Naphthylamin, das durch Diazotierung in der Bratton-Mar- shall-Reaktion zu einem tiefblauvioletten Farbstoff reagiert, dessen Konzentration bei 546 nm gemessen wird (Prinzip 2).
Allerdings handelt es sich um eine aufwendigere Endpunkts- reaktion, die aber ihre klinische Brauchbarkeit bewiesen hat (17).
Eine U V-Methode, bei der der nach Esterhydrolyse freigesetz- te Äthanol mittels Alkoholdehydrogenase in einer NADH- abhängigen Reaktion erfaßt wird (Prinzip 3), hat sich bislang nicht durchsetzen können.
Statt der von allen Autoren verwendeten N-Acetylverbindung des Tyrosinesters bevorzugen wir das N-Benzoylderivat auf- grund seiner größeren Stabilität und damit geringeren Eigen- hydrolyserate; es ist geringfügig schwerer löslich. Im komplet- ten Ansatz wird N„-Benzoyl-L-tyrosinethylester zu Na-Ben- zoyl-J.-tyrosin und Ethylalkohol hydrofysiert.
Die kontinuierlich freigesetzte Aminosäure wird kinetisch am pH-Stab abtitriert. Der kontinuierliche Verbrauch an 0,01 mol/l NaOH ist der in der gleichen Zeiteinheit gebildeten Menge der Aminosäure direkt proportional, d.h. die Umsatzgeschwindigkeit ein Maß für die katalytische Aktivität des Chymotrypsins im eingesetzten Stuhlhomogenat (Prinzip Die von uns angegebenen Ergebnisse sind in besonderem Maße verwertbar:
1. Jeder Zahlenwert ist gesichert durch eine Zeit-Linearitäts- kurve über mindestens 3 min.
2. Jeder Wert ist gestehen durch eine Dosis-Linearitätskurve über mindestens 2 Konzentrationen.
Damit wird ein in der klinischen Chemie sehr selten ange- wandtes Qualitätskriterium gefordert: zeit- und konzentra- tionsgesicherter Analysenwert.
Für die klinischen Ergebnisse wird auf Teil II dieser Arbeit verwiesen. Beispiele sind in den Tabellen 1 und 2 gezeigt.
R- *
HC-CHCC ^en-civ
NH
A L D H - M e t h o d - e k i n e t i s c h 334 nm Hj-OH + HjC-CH-COOH
0 0
R - G
PH-SIQI kinetisch
Verbrauch an NaOH
» R-COOHn
Abb. 4: Reaktionsprinzipien
BRATTON-MARSHALL E N D P U N K T 546nm
K i n e t i s c h £05nm
Schrifttum:
1. AMMAN. R. in ENGLHARDT. A., LOMMEL. H.: Methodische Fortschritte im medizini- schen Laboratorium. Band 2 Malabsorption. Maldigestion. S. 193-200. Verlag Chemie (1974).
2. SCHNEIDER. R.. DÜRR. H. K.. BODE, J. Ch.: Diagnostische Wertigkeit der Bestimmung von Chymotrypsin im Stuhl für die Erfassung einer exokrinen Pankreasinsuffizienz. Dlsch.
med. Wschr. 99, 1449-1454 (1974).
3. ROSE, H.-J.. BAUFELD. W., HAUDE. W.: A Method for Determining Chymotrypsin in Faeces. Z. Med. Lab. Diagn. 22. 119-124 (1981).
4. MULLINGER. M., PALASI, M.:Tryptic and Chymotryptic Activity of Stools of New Born Infants. Pediatrics 38, 657-661 (1966)
5. DYCK, W. P.: Measurements of Fecal Trypsin and Chymotrypsin in Cystic Fibrosis with Pancreatic Exocrine Insufficiency. Am. J. Digest. Dis. 12. 310-316 (1967).
6. HERMIER. M.. MATHIEU, M., FILLAT, M.. GILLY, R.. CHAZALETTE, I. P.. COTTE, J.:
Etude de la fonction pancrSatiqueexocrinedans la mucoviscidose. Rev. Franc. Etud. clin. biol.
14.867-878 (1969).
7. WEISE, J., KOBAYASKI, Y„ TOLCKMITT, W.: Untersuchungen über die Anwendbarkeit trvptischer und chymotryptischer Aktivitätsmessung im Stuhl in Diagnostik und Therapie der Mucoviscidosis. Europ. J. Pediat. 122, 107-115 (1976).
8. SALZER.K., KOBAYASKI, Y.,TOLCKMITT, W.:TryptischeundchymotryptischeAktivität im Stuhl von Kindern verschiedener Altersgruppen. Europ. J. Pediat. 121,279-286 (1976).
9. BHAVANI, S., EGGERMONT. E.. STANDAERT. L. et al.: Stool Chymotrypsin in the pre- term infant. Acta Paediatr. Belgica 32. 51-58 (1979).
10. KÜSTER, M.: Diagnostik der Cystischen Fibröse. mta-Journal 4. 380-381 (1982).
10a. SITZMANN, F. C.. DOCKTER, G : Kim. Pädiat. 194, 283 (1982) 11. NAGEL. W., WILLIG. F.. PESCHKE, W.. SCHMIDT, F. H.: Über die Bestimmung von Trypsin und Chymotrypsin mit Aminosäure-p-nitioaniliden. Hoppe-Seyler's Z. Physiol.
Chem. 340.1-10(1965).
12. WILLIG. F.. KORBER, W.: Eine Methode zur Bestimmung von Trypsin und Chymotryp- sin im Stuhl mit Aminosäure-p-nitroaniliden. Z. Gastroenterologie. 5. 33-36 (1967).
13. DEL MÄR. E. G.. BRODRICK, l. W.. GEOKAS, M. C., LARGMANN. C.: Effect of Oxidation of Methionine in a Peptide Substrate for Human Elastases: A Model for Inactivation of a,-Protease-Inhibitor. Anal. Biochem. 99. 316-320 (1980).
14. ACHSTETTER, T., EHMANN, C., WOLF, D.H.: New Proteolytic Enzymes in Yeast. Arch.
Biochem. Biophye. 207. 445-454 (1981).
15. KASPAR, P., MOELLER, G.. WAHLEFELD. A. W.. STAEHLER. F.: A New Photometric Method for the Determination of Chymotrypsin in Stool. Fresenius Z. Anal. Chem. 311.391 - 392(1982).
16. JUNGE, W.: Chymotrypsinbestimmuno im Stuhl, erste praktische und klinische Erfahrungen mit einem neuen photometrischen Test. Vontag Medica 1982.
17. WILLIG, F.: Über verschieden· Formen der durch Enzymmanflel bedingten Verdau- ungeinsuffizienz. Therapie-Woche 20. 43. 2715 (1970).
Frau Ingrid Kirstein sei an dieser Stelle für ihre außerordentlich intelligente und engagierte Mitarbeit gedankt.
Anschrift des Verfassers:
Prof. Or. rer.nat. Walter Appel
Zentrallaboratorium der St.-Vincentius-Krankenhäuser Karlsruhe Südendstr. 32 _ D-7500 Karlsruhe 1 D