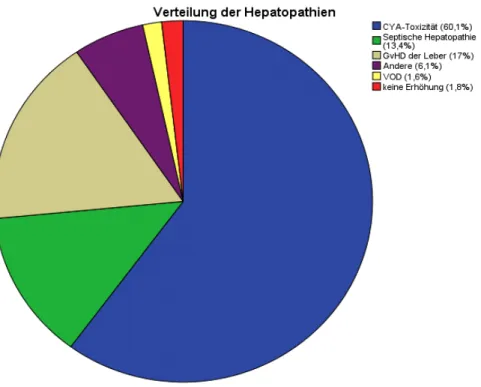
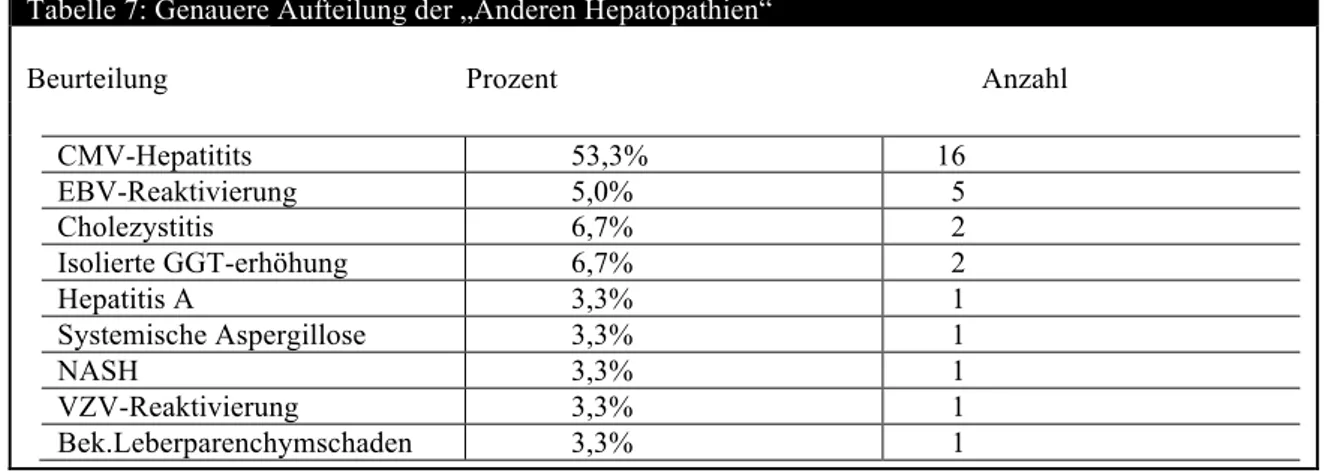
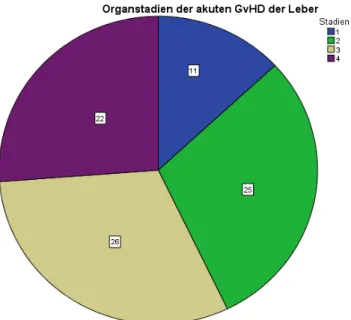
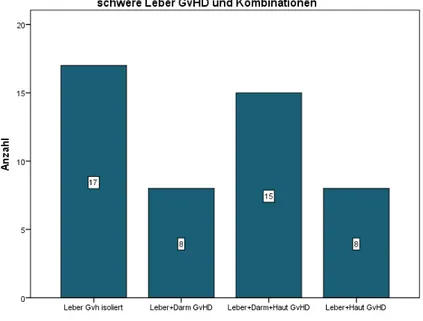
RISIKOFAKTOREN FÜR DIE GRAFT-VERSUS HOST DISEASE DER LEBER
Volltext
Abbildung


ÄHNLICHE DOKUMENTE
Donor T cells deficient for miR-142 show impaired cell cycle progression and simultaneously reduced proliferation, which in turn leads to reduced GvHD severity and mortality
Kanfer, et al., Graft invariant natural killer T-cell dose predicts risk of acute graft-versus-host disease in allogeneic hematopoietic stem cell transplantation. Coman,
In our study, the selected genes encoding chemokines were all up-regulated in mice transferred with GC-resistant allogeneic T cells compared to mice transplanted with
Gut 30 Jahre nach der Conter- gan-Katastrophe wurde das Sedati- vum Thalidomid von amerikanischen Onkologen zur Behandlung der chronisch verlaufenden Graft-Ver-
Arnold, NIH-Defined Chronic Graft-Versus-Host Disease and Graft-Versus- Leukemia Effects in Patients Receiving Allogeneic Hematopoietic Cell Transplantation for Acute
DP/CD4SP ratios were in the majority of these mice not distinguishable from ratios in OT-II b →[d→C57BL/6] non-deleting controls (no thymic mOVA). Deficient elimination
The overall hypothesis underlying this thesis postulates that GVHD- mediated injury to the thymus, in particular to the thymic epithelial cell compartment, is a
„Nach der Transplantation ändert sich auch die Blutgruppe des Patienten“, so Zeiser, „ein Blutgruppen-Switch, weil alle Blutzellen neu gebildet werden.“ Dabei sind die