Hinweis
Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite www.chids.de weitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Übungen im Experimentaivortrag
Leitung:
Dr. J. Butenuth Dr. E. Gerstner Prof. Dr. H. PerstAnorganische Pigmente
Elvira Bold Am Schwanhof 2 35037 Marburg Tel:06421/270886
Inhaltsverzeichnis:
Teil I
I. Einleitung
2. Definition und Klassifizierung
Versuch 1 Definition Pigment/Farbstoff 3. Einsatzgebiete der Pigmente
4. Eigenschaften und Funktionen der Pigmente 5. Geschichte der Pigmente
Teil 11
1. Titandioxid - das wichtigste Weißpigment Demonstration 1: Aufhellvermögen von Ti02 Demonstration 2: Vergleich des
Deckverrnögens:
Ti02und ZnO Versuch 2: Quantitative Bestimmung
von Titan bzw. Ti02
Teil 111
1. Synthese und Farbentstehung a) Berliner Blau
Versuch 3: Synthese von Berliner Blau b) Oxidische Mischphasenpigmente-
Thenards Blau
Versuch 4: Synthese von Thenards Blau
Teil IV
1. Perlglanzpigmente
Versuch 5: Lip Gloss-Herstellung
Seite
3
3-9 5 9
10 10
12-17
13 1315
17-24
18-20 19 21-2421
2225-29
26
Teil I:
1.
Einleitungeu,e«tk.Ude4~ i#I~4eIAM
fJJiee4 ~
~~.dJ"
Wie man an diesem Zitat aus der "Farbenlehre" sehen kann, hat sich selbst Goethe zu seiner Zeit schon Gedanken über Pigmente gemacht.
2.
Definition und KlassifIZierungDie anorganischen Pigmente gehören zusammen mit den anorganischen Farbstoffen in die Gruppe der anorganischen Farbmittel. Demgegenüber steht die Gruppe der organischen Farbmittel, die sowohl organische Pigmente als auch organische Farbstoffe beinhaltet. Farbmittel ist ein Sammelname für alle farbgebenden Stoffe.
Laut DIN gibt es zwei Möglichkeiten der Klassifizierung anorganischer Pigmente:
] . nach koloristischen Gesichtspunkten
2.nach chemischen Gesichtspunkten
Al KlassifIZierung nach koloristischen Gesichtspunkten
Schwarzpigmente
.6;. ' .. Glanzpigmente 6.1 Metalleffektpigmente
Ti0
2,ZnS, Lithopone, Bleiweiß, ZnO
R1.!:ß" Eisenoxidschwarz
Eisenoxid-,Cadmi um-u.Ultramarin-Pigmente, Chrom gelb, Molybdatrot, Kobaltblau
Goldbronze, Aluminiumbronze
6.2
Perlglanzpigmente bas. Bleicarbonat , BiOCl , TiOrGlimmer- Pigment
7.
Aufdampfschichten Metalle, Metalloxide, Zinksulfid
8.Leuchtpigmente
8.1
Fluoreszenzpigmente " radioaktive " Leuchtpigmente
8.2Phosphoreszenzpigmente Zinksulfid/Erdalkalisulfide,
dotiert mit Schwermetallionen
9.
Magnetpigmente
y-Fe 20;" Cr02, Fe
10.
Korrosionsschutzpigmente Pb;,Ü4, Eisenglimmer, Zn-Staub
B) KlassifIZierung nach chemischen Gesichtspunkten
1.
Pigmente aus ehern. Elementen Al, Cu-Zn, C
2.
Oxid-/Oxidhydroxidpigmente rio, ZnO, FeOOH,Fez03, CrZ03,
3.Oxid-Mischphasenpigmente (Ti,Cr,Sb)02(gelb),
CoAlZ0
4,4.
Sulfid-/Sulfidselenidpigmente ZnS, CdS, Cd(S,Se)
5
Carbonatpigmente CaC0
36.
Chromat-/Chromat-Molybdat- PbCr04
Mischphasenpigmente
7.
Komplexsalzpigmente M[ FeFe(CN)6]
"xH2O
8.
Silikatpigmente Al20
3 "2 Si0
2 ·2 H
20( weiß), NagAl6Si6024Sn
n==2-4Versuch 1: Definition PigmentIFarbstoff
Geräte:
2 Demoreagenzgläser, 2 Gummistopfen, 50 ml Meßzylinder, 2 Mikroreagenzgläser
Chemikalien:
0,030 g Kongorot 0, ]20 g Thenards Blau
2x 50
mldest. Wasser
Durchfuhrung:
Man gebe jeweils 50 ml dest. Wasser in die Demoreagenzgläser, fuge in Reagenzglas 1 Kongorot
hinzu und in Reagenzglas
2Thenards Blau, verschließe beide mit einem Gummistopfen und
schüttle beide gut durch.
Auswertung:
Reagenzglas 1: Farbstoff Kongorot [ 3,3'- ( 4,4'- Bisphenyldiylbisazo) bis ( 4 - ammo - 1 - naphthalinsulfonsäure) - Dinatriumsalz] in Wasser
Lösevorgang in Wasser:
NH2 NH2
N~ N
H2Ü
~N N
SOlNa
NH2 NH2
N~N N~N ~ ~
# " #
Na+ SOl Na+
Kongorot dissoziiert in 2 Natriumkationen und 1 Naphthalinsulfonsäureanion. Es entsteht eine klare rote Lösung, die das Licht nicht streut.
Ein Farbstoff definiert sich demnach wie folgt:
Farbstoff:
DIN:Ein im Anwendungsmedium lösliches organisches Farbmittel. Die Eigenschaften werden von molekularen Strukturen und der Wechselwirkung mit dem Substrat bestimmtReagenzglas 2:Thenards Blau ( CoAh04 ) in Wasser
Es liegt eine blaue, milchigtrübe Dispersion vor, die das Licht streut.
Eine
Dispersion (
lat.: dispersio = Zerteilung) ist eine feine Verteilung eines Pigments ( mind.dispergierte Phase) in einem Bindemittel (Dispersionsmittel).
Dispergiermittel (Additive, Emulgator) erleichtern die Benetzung, da SIe die Grenzflächenspannung erniedrigen.
o
G
e: o
PrtmlrtetlchenAggregate
Agglomerate Abb. 77:Schmr.tUie"~ D."/~'hm,VOllPi,rwlllmIlruJ Pi'JlWlttzru.mmmbtIIlwt,,,. (DIN 53206,BI.I}
Pigmentprimärteilchen sind zwischen 0,1 und lum groß. Aufgrund ihrer Größe kommt es zu innigen Wechselwirkungen. Die Kohäsionskräfte zwischen den Primärteilchen, die bei deren winzigem Durchmesser die auf die Partikel wirkenden Schwerkrafteinflüsse übersteigen, sind so groß, daß es zu Pigmentanhäufungen kommt, zum einen zu Aggregaten und zum anderen zu Agglomeraten.
Aggregate
sind über gemeinsame Flächen dicht und fest verbundene PrimärteilchenAgglomerate
hängen über Ecken und Kanten aneinander. Sind voluminöser, aber leichter in die einzelnen Primärpartikel aufzutrennen.Die Kohäsionskräfte von Aggregaten liegen in Größenordnungen der Festigkeit der Primärteilchen. Sie sollen nicht zeteilt werden. Nicht zerteilbare Aggregate führen zu einer
geringeren Ausnutzung des Pigments hinsichtlich Farbstärke. Eine Forderung ist es deshalb,
Pigmente mit geringstem Aggregatanteil zu produzieren.Das Vorhandensein von Agglomeraten im Pulver hat eine praktische Bedeutung: Wenn sie nicht vorhanden wären, WÜrde das Pigmentpulver zu stark stauben und so Aerosole bilden, d. h das Material könnte nur unter erschwerten Bedingungen verarbeitet werden.
Beim Vorgang des Dispergierens laufen 4 Teilschritte nebeneinander ab:
I. Zerteilen:
Die Haftkräfte zwischen den Teilchen müssen überwunden werden. Dies kann mittels mechanischer Energie ( Mühlen, Dissolvern, schnelles Rüheren oder Schütteln) erfolgen.
Zum einen muß sich das Agglomerat im Dispergierraum an einer Stelle aufhalten, an der es einer mechanischen Beanspruchung unterworfen wird.
Und zum anderen muß die an dieser Stelle herrschende mechanische Zugspannung ausreichen, die Haftkräfte zwischen den Komponenten des Agglomerats zu überwinden.
Je länger dispergiert wird, desto wahrscheinlicher ist es, daß ein Agglomerat an eine solche Stelle gelangt und je höher die eingebrachte mechanische Leistung, desto größer die Wahrscheinlichkeit, daß dort die Leistungsdichte zum Zerteilen ausreicht.
Durch Einwirkung von Scherkräften in Mühlen, Walzenstühlen oder durch schnelles Rühren kommt es durch inniges Vermischen beider Komponenten zum einheitlichen Farbeindruck.
2. Benetzen:
Ein enger Kontakt zwischen dem Pigmentteilchen und dem Einbettungsmedium wird ausgebildet.
Dafür müssen die beim Einbringen des pulverförmigen Pigments in das Medium auf der Oberfläche der Pigmentagglomerate befindlichen Sorbate wie Wasser, O
2,N
2und CO
2entfernt und durch das Medium ersetzt werden. Dieses muß auch durch Eindringen in die kapillaren Hohlräume der Agglomerate die dort enthaltene Luft verdrägen. Die beim Zerteilen entstehenden Oberflächen müssen mit dem neuen Medium belegt werden.
Benetzung muß so erfolgen, daß die adsorptiv an die Oberflächen fixierten Moleküle des Mediums das Reagglomerieren wirkungsvoll verhindern.
Bei unpolaren Medien wird die Pigment oberfläche mit organischen Verbindungen ausgestattet,
deren Moleküle polare sowie unpolare Gruppen aufweisen, um die Benetzung zu erleichtern. Die
polaren Enden solcher Moleküle, bestehend aus einer hydrophilen Gruppe, binden sich durch H -
Brücken an die polare Oberfläche der Pigmentteilchen. Die unpolaren KW-enden verknüpfen sich
mit den Molekülen des unpolaren Mediums, z.B. eines Kunststoffes.
3. Verteilen
:Es kommt zu einer statistischen gleichmäßigen Verteilung auf alle Volumenelemente.
4. Stabilisieren:
Physikalische Systeme sind bestrebt, einen Zustand minimaler freier Energie anzunehmen.
Offenbar verringert sich diese, wenn Pigmentpartikel reagglomerieren, weil dabei derselbe Energiebetrag frei wird ( Wärme), der zur Zerteilung der Agglomerate und zur Benetzung der Pigmente aufgewendet wurde.
Pigment:
Ein Pigment ist ein im Anwendungsmedium unlösliches anorgansiches oder organisches unbuntes oder buntes Farbmittel
3.
EJn2i ~'~!:la 1:J ]:d~ ~9f Pkl IJJaJJ'E~ ~ Verbrauch 1988:3 Mio. Tonnen
Lacke und Farben I Druckfarben
58%
Kunststoffe 18%
Baustoffe 12%
Papier 7%
Email und Keramik
3% Pharmazie und Kosmetik, Kautschuk,
Fasern 2%
4. Eigenschaften und Funktionen der Pigmente:
Sie verleihen der Beschichtung farbiges Aussehen, das Vermögen, den Untergrund optisch abzudecken, metallische Reflexion und Fluoreszenz. Außerdem tragen Sie durch hohe Packungsdichte zur Verfestigung, mittels Verwendung nadelförmiger Partikel zur Rißfestigkeit, mittels plättchenförmiger Partikel zur Haftung und bei Verwendung weicher Füllstoffe zur Schleitbarkeit/ Verwendung harter Füllstoffe zur Abriebfestigkeit bei.
Sie beeinflussen bzw. begründen physikalische Eigenschaften wie elektrische Leitfähigkeit, Schweißbarkeit und Flammfestigkeit.
Sie erfullen chemische Aufgaben. Zu nennen wären dort die Passivierung des Untergrundes, das Abfangen korrosionsfördernder Ionen, die Beteiligung an der Filmvernetzung und photochemischeEffekte.
5. Geschichte der Pigmente
Pigmente gibt es nicht erst seit ein paar Jahrhunderten, sondern schon unsre Vorfahren vor grauer Vorzeit wußten, wie sie Pigmente für sich einsetzen konnten.
Die Höhlenmalereien der Eiszeitmenschen sind wohl die ältesten Zeugnisse für die Verwendung von Pigmenten. Die Farbe der dazu benutzten Erdpigmente werden wesentlich durch Eisenoxide bestimmt, die jedem in Form von Rost geläufig sind. Die Farbtöne reichen von Gelb oder Ocker bis zu Blau und Rot. Schon um
60 000vor Christus wurde damit gearbeitet. Aber auch natürliche Rohstoffe wie Ruß und Metalle wurden zur Abbildung alltäglicher Ereignisse wie Jagden oder Götter verwendet.
In der frühzeitliehen Höhlenmalerei lassen sich schon etwa
15Pigmente nachweisen. Ruß wird seit
20 000v. Chr. als eigenständiges Pigment benutzt.
Sicher hatte der Mensch seit jeher den Wunsch, das Farbenspiel der Natur nachzuahmen, und die
Farbe spielte seit der Frühzeit als Schmuckattribut und damit zur Bereicherung des An- und
Aussehens eine dominierende Rolle. Aus dem Farbenreichtum der Tier- und Pflanzenwelt
schöpften unsre Urahnen Anregungen, die schließlich zur Körperbemalung führten, wie wir sie
noch heute bei den Natuervölkern Afrikas, Neuguineas und Amazoniens nicht selten als Symbol
der Beherrschung anderer, das heißt als Symbol der Macht, finden. Auch bei primitiven Völkern
ist es ein unentbehrliches Hilfsmittel, künstlerischen Ausdruckswillen in die Tat umzusetzen und
ästhetische oder praktische Bedürfnisse der Umweltgestaltung zu befriedigen.
Hinsichtlich Teilchengröße, Teilchengrößenverteilung, Farbstärke und Deckvermögen entspricht ein großer Teil antiker Pigmente nicht den heutigen Anforderungen. Zudem war das Farbspektrum begrenzt.
Neben der Verwendung natürlicher Pigmente kam es schon vor Christi Geburt zur Entwicklung der technischen Herstellung, da man reproduzierbare Eigenschaften forderte. Schon ab 3000 v.Chr. wurde Ruß als das 1. synthetische Pigment in China hergestellt:
Bis Christi Geburt kam es noch zur Herstellung von Bleimennige ( PbO· Pb
203)und Bleiweiß (
2PbC0
3 ·Pb(OH)2).
Erst ab dem 18. Jahrhundert stieg der Bedarf an synthetischen Pigmenten rapide. Mit der fortschreitenden Industrialisierung ging die Pigmentindustrie sozusagen Hand in Hand.
Es kam u.a. zur synthetischen Herstellung folgender Pigmente:
1704 1800 1802 1818 bis 1900
Eisenblau ( Fe4[Fe(CN)6]3 ) Zinkweiß (ZnO)
Thenards Blau ( CoA1204) Cadmiumsulfid (CdS)
künstlicher blauer Ultramarin ( NagAl6Si6024S2) Eisenrot ( a - Fe203 )
Durch die ständig wachsenden und sich erweiternden analytischenUntersuchungsmethoden und verfeinerten Produktionstechniken konnten qualitativ hochwertige, maßgeschneiderte Pigmente produziert werden.
In diesem Jahrhundert kam es dann u.a. zu folgenden Entwicklungen:
1910 1916 1925-1951
1963
1977
Cadmiumsulfoselenid ( Cd(S,Se) )
Beginn der technischen Herstellung von Ti02 Eisengelb ( a - FeOOH ), Eisenschwarz ( Fe304),
orangefarbenes
y-FeOOH, transparentes Eisenoxid
Perlglanzpigmente ( Ti0
2 -Glimmer-Pigment)
Bismutvanadat ( BiV0
4 )Teil I1
Titandioxid - das wichtigste Weißpigment
Titandioxid nimmt 70% der Weltproduktion an Pigmenten ein, d.h. 1988 waren das 2,3 Mio Tonnen.
Diese Vormachtstellung hat es sicherlich seinen guten Eigenschaften zu verdanken:
Zum einen besitzt es ein hohes Streu- und Deckvermögen, als auch ein hohes Aufhellvermögen.
Es ist gut wetterbeständig und leicht dispergierbar. Seine hohe Helligkeit und sein neutraler Farbton zeichnen es ebenso aus wie die chemisch Resistenz. Außerdem ist es toxikologisch unbedenklich, so daß es selbst in der Lebensmittelindustrie Anwendung findet, z.B. in der Salamiumhüllung oder in der Asche von Zigarren.
In der Natur kommt es in drei Modifikationen vor:
1. Rutil ( orthorombisch ):o. -Ti02
-+
nn:2,75
2. Anatas ( tetragonale ):ß -
Ti02-+
lln: 2,553. Brookit ( orthorhombisch ):y -Ti02
Als Pigment finden nur Rutil und Anatas Verwendung. Anatas wandelt sich allerdings irreversibel in Rutil um, ab 700°C sogar schnell.
Titan hat in beiden Gitterstrukturen die Koordinationszahl 6, Sauerstoff ist von 3 Titan umgeben.
Die Oktaeder sind nur unterschiedlich räumlisch verknüpft, was dann zu verschiedenen Eigenschaftenführt.
Ein Pigment mit Rutilstruktur z.B. absorbiert UV-Licht , so daß es als Sonnenschutz ( Haut, Kunststoffe..) Verwendung findet.
Es gibt 2gängige Herstellungserfahren für Titandioxid:
I.
das Sulfatverfahren, das 55% der Weltproduktion ausmacht2.
das Chloridverfahren, das 45% der Weltproduktion ausmacht.Verwendung findet dieses Weißpigment zu
60%
in der Farben und Lackindustrie , die Kunststoffindustrie nimmt200/0,
in die Papierindustrie gehen120/0
,der Rest verteilt sich auf Email, Keramiken, Gläser und Kosmetika und pharmazeutische Produkte.Demonstration 1: Aufhellvermögen von Titandioxid
Geräte:
Demoreagenzgläser, Becherglas, Magnetrührer (beheizbar), Rührfisch, Spatel
Chemikalien:
verschiedenfarbige Pigmente ( z.B. gelb, blau, braun) Titandioxid
Leinöl
Bienenwachs ( Pellets aus Spinnrad)
Durchführung:
Man gebe 50 ml Leinöl und 10 Pellets Bienenwachs in ein Becherglas, rühre und erhitze das Ganze, bis das Bienenwachs vollkommen geschmolzen ist, gebe dann 2 Spatelspitzen Pigment (farbig) hinzu und lasse es weiterrühren, bis ein homogener Farbeindruck entsteht. Man gebe es in ein Demoreagenzglas und lasse es erkalten ( erstarren).
Für die aufgehellte Version verfahre man wie oben, nur gebe man anstatt
2Spatelspitzen farbiges Pigment
1Spatelspitze farbiges Pigment und 1 Spatelspitze Titandioxid hinzu.
Man erhält jeweils ein Demoreagenzglas mit normalfarbigem Pigment und ein Demoreagenzglas mit der aufgehellten Version, z.B. gelb
~hellgelb, blau
~hellblau, braun
~hellbraun
Das Aufhellvermögen ist das Vermögen, die Helligkeit eines bunten, grauen oder schwarzen Mediums zu erhöhen.
Man kann durch Verwendung von Titandioxid in Kombination mit Buntpigmenten eine breite Variationsbreite an Farben kreieren.
Demonstration 2:
Vergleich des Deckvermögens: Ti0
2und ZnO
Geräte:
Malerpalette,
2Pinsel, blau-weiß gestreifter Karton ( oder schwarz-weiß kariert)
Chemikalien:
Ti02 - Farbe (
0,79
g Ti02in10
ml Leinöl)ZnO-Farbe ( 0,81
gZnO in 1 ° ml Leinöl)
Durchfuhrung:
Man pinsele Titandioxidfarbe rechts auf den Karton und Zinkoxidfarbe links auf den Karton. Es sollten etwa gleich große Felder bedeckt sein. Man sieht, daß die Titandioxidfarbe erheblich besser deckt als die Zinkoxidfarbe.
Auswertung:
ZnO findet ebenfalls Verwendung im Anstrichmittelsektor. Es ist unlöslich in Wasser, aber löslich in verdünnten Säuren.
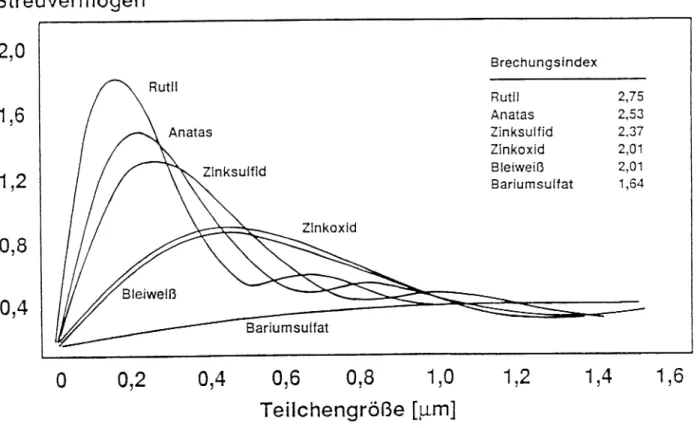
Dieses Schaubild zeigt den Zusammenhang zwischen Teilchengröße, Brechungsindex und Streuvermögen und somit auch dem Deckvermögen. Denn je größer das Streuvermögen,d.h. je stärker das nicht absorbierte Licht gestreut wird, desto größer ist das Deckvermögen.
Streuvermögen 2,0
1,6
1,2
0,8
0,4
Brechungsindex Rutil
Anatas Zinksulfid Zinkoxid Bleiweiß Bariumsulfat
2,75 2,53 2,37 2,01 2,01 1,64
o 0,2 0,4 0,6 0,8 1,0
Teilchengröße [}-im]
1,2 1,4 1,6
Abb. Abhängigkeit des Streuvermögens von der Teilchengröße
Je kleiner die Teilchengröße und je größer der Brechungsindex, desto größer ist das Streuvermögen, d.h. das Deckvermögen. Da man normalerweise ein System aus Pigment / Bindemittel hat, muß man dies auch berücksichtigen. Die Deckfähigkeit ist nämlich umso größer, je größer der relative Brechungsindex ist, d.h das Verhältnis von Brechungsindex (Pigment) /
Brechungsindex ( Bindemittel).
Für jedes Pigment gibt es eine optimale Teilchengröße, bei der die Deckfähigkeit auch am größten ist.
Außerdem muß beachtet werden, daß die Teilchenstruktur ebenfalls eine Rolle bei der Streuung spielt. Man beobachtet eine Zunahme der Streuung beim Übergang von runden Teilchen zu stäbchenförmigen.
Ein deckendes Pigment läßt Helligkeitsunterschiede verschwinden.
Deckvermögen:
Fähigkeit, den Kontrast zwischen einem schwarzen und weißen Untergrund aufzuheben, so daß die Lichtemission über dem schwarzen und weißen Untergrund nahezu gleich ist.
Versuch 2:
Quantitative Bestimmung von Titan bzw.TitandioxidGeräte:
Waage, Porzellantiegel ( groß, glasiert), Dreifuß, Tondreieck, Filtrierring, Bunsenbrenner, 250 ml Becherglas, Glastrichter, Papierfilter, 2 Meßkolben ( 250 rnl), 8 Meßkolben ( 50 ml), Vollpipetten ( 2x 5 ml, 1x 10
ml,
1x 20 ml), Eppendorfpipette ( 1 x 1 ml), Meßpipette ( 10mlund 25 ml), Photometer,2 Quarzküvetten ( d== 1cm)
Chemikalien:
Kaliumdisulfat (K2S2
0
7)Schwefelsäure (H2S04) ( 1:5 verdünnt, c(H2S04) == 3 mol/l und 1:3 verdünnt, c(H2S04 )
==
4,5 mol/l)Wasserstoffperoxid ( w (H2Ü2)== 0,03 )
Titan-Stammlösung ( p* ==2 mg/ml) bidest Wasser
Farbe ( Superdeckerwandfarbe von Obi) Lack ( Buntlack Weiß, Satine )
Durchfuhrung:
1 g Farbe / Lack wird mit der 5 fachen Menge an K2S2Ü 7 ( Kaliumdisulfat in einem Prozellantiegel aufgeschlossen. Man erhitzt dazu langsam bis zur Schmelze und glüht das Ganze dann noch kurz.
Mit 30 ml Schwelfelsäure ( 4,5 molar) wird die erkaltete Schmelze in ein 250 m1 Becherglas überfuhrt, mit 50 ml bidest. Wasser versetzt und aufgeschlämmt. Die Probe wird dann in einen 250 ml Meßkolben filtriert und mit bidest. Waser bis zur Marke aufgefullt.
Man erstelle dann ein photometrisches Eichdiagramm wie folgt:
Eichlösungen mit den Massenkonzentrationen 500, 1000, 1500, 2000, 2500, 3000
ug /
50 m1 werden hergestellt. Dazu pipettiert man jeweils das entsprechende Volumen an Titan- Stammlösung in ein 50 ml Meßkolben. Man fuge jeweils 5 ml Schwefelsäure hinzu, fulle mit bidest. Wasser auf 40 ml auf und gebe dann noch 5 ml Wasserstoffperoxid dazu. Anschließend wird mit bidest Wasser bis zur Marke aufgefullt.Die farbigen Standartproben werden bei 410 nm gegen eine Vergleichsprobe photometriert.
Von der Probenlösung ( LacklFarbe) im 250
ml
Meßkolben entnimmt man nun 10ml,
überfuhrt dieses in einen 50 ml Meßkolben und verfährt desweiteren wie bei der Herstellung der Eichproben.Ebenfalls Messung der Extinktion bei 410 nm
Mittels des Eichdiagramms ist es nun möglich,den Titan bzw. den Titandioxidgehalt zu bestimmen.
Auswertung:
1. Aufschluß der Farbe bzw. des Lackes
TiOS04 (s)
+
K2S04 (s)2. Photometrische Bestimmung des Titan - bzw. Titandioxid-Gehalt
[ Ti
(OH)2
(H20 )4
]2+ (aq)+
H20
2(aq)+
2 H2S0
4(aq) ~ [ Ti(02) (S04)2 ]2-(aq)+
4 H30 +(aq)+
2 H20(gelb)
Bsp:
1g Farbe / Lack werden eingesetzt. Die Extinktion beträgt E==0,423 X ==68 mg / 250 ml
lmg Ti entspricht 1,67 mg Ti02
-+
w ( Ti02) == ] 13 · 103-g / 1 g~ 1],3 % Titandioxidgehalt
Teil 111
Synthese und Farbentstehung
Die Mehrzahl der synthetischen anorganischen Pigmente kann durch Fällung oder Hydrolyse aus wäßriger Lösung hergestellt werden. Zum Teil
fuhrt
die chemische Umsetzung ohne irgendeine Nachbehandlung direkt zum Pigment mit gewünschter Farbe, Teilchengröße und Kristallstruktur, zum Teil haben die bei der Fällung entstehenden Festkörperteilchen noch nicht unmittelbar die optimale Teilchengröße, den gewünschten Farbton oder Kristallstruktur, so daß eine Nachbehandlung ( z.B. Glühen) notwendig ist.Die Variation der Fällungsbedingungen beeinflußt die Ausbildung bestimmter Pigmenteigenschaften.
Eine andere Herstellungsweise ist das Glühen der Ausgangssubstanzen.
Beim Glühprozess kommt es bei Temperaturen zwischen 400 und 1000°C zu emer Teilchenvergrößerung. Dies beruht in 1. Linie auf der höheren
Oberflächenergie
der kleineren Teilchen, aber auch an Sinterungsprozessen und Aggregationsvorgängen. Es werden flüchtige Bestandteile abgespalten und Gase aufgenommen, außerdem kann es zu einer Umwandlung der Kristallstruktur kommen (Zinkblende zu Wurzit).a) Berliner Blau - ein komplexes Eisencyanid
Berliner Blau ist auch u.a. unter den Namen Milori Blau, Pariser Blau und Chinesisch Blau bekannt.
Es ist die älteste synthetisch hergestellte Koordinationsverbindung, die als Zufallsprodukt von einem Maler namens Diesbach aus Berlin entdeckt wurde.
Die Primärteilchen sind zwischen 0,01 -0,2 um groß. Berliner Blau zeichnet sich dadurch aus, daß es resistent gegen verdünnte Säure und Oxidationsmittel ist, außerdem farbecht und bis 150°C temperaturstabil. Ebenfalls besitzt es eine hohe Licht-und Wetterechtheit, ist schwer dispergierbar und schlecht alkalibeständig.
Der LDso-Wert ist 8g / kg bei oraler Gabe bei Ratten. Als Vergleichswert sei Kochsalz mit
2,6g / kg genannt. Fazit: Berliner Blau ist auch toxikologisch unbedenklich. Deshalb wird es auch als Mittel für mit 137CS kontaminierte Menschen eingesetzt. Das Cäsium wird gegen Eisen(II) ausgetauscht und gelangt dann über den Stuhlgang nach außen.
Weitere Einsatzgebiete sind die Druckfarbenindustrie und die Lack-und Papierindustrie. Ebenfalls wird es zum Einfarben von Polyethylen, zum Mischen für Chromgrün und Zinkgrün und zur Blauschönung beim Wein verwendet.
Die weltweite Produktionskapazität 1989 lag bei 50 000 t/a.
Industriell wird Berliner Blau durch Fällung eines Weißteigs aus ammoniumsulfathaltiger Eisen(II)sulfatlösung mittels Natriumhexacyanoferrat gefallt. Durch Kochen altert dieser Weißteig und durch anschließende Oxidation im Schwefelsauren bildet sich Berliner Blau. Als Oxidationsmittel verwendet man z.B. Kaliumchlorat oder Kaliumdichromat.
1. Fällung eines Weißteigs:
FeS04
·7H
20(aq)+ Na4Fe(CN)6· 10 H20(aq) + (NH
4)2S0
4 (aq) ~(NH4)2FeFe(CN)6
~+ 2 Na2S04
(aq)+ 17H
20Berliner Weiß
2. Lösung in H2S0 4und Oxidation
6
(NH4)2FeFe(CN)6
~+
3H2S0
4(aq)+ NaCI0
3 (aq) ~6
"(NH
4)FeFe(CN)6"~+ NaCI (aq) +
3(NH
4)2S04(aq)+
3H
20blau
Versuch 3: Synthese von Berliner Blau
Geräte:
Kristallisierschale, Overheadprojektor, 50 ml Enghalsflaschen, Pipette
Chemikalien:
0,01 molare FeCl3 -Lsg.
0,1 molare K4[Fe(CN)6]3 - Lsg.
Durchführung:
Man gebe soviel Eisen(III)chlorid- Lösung in die Kristallisierschale auf dem Overheadprojektor, daß der Boden gut bedeckt ist. Anschließend tropft man langsam Kaliumhexacyanoferrat-Lösung hinzu. Es bildet sich ein blauer, kristalliner Niederschlag.
Dieser Niederschlag kann abgesaugt und bei 90°C im Trockenschrank getrocknet werden.
Auswertung:
4 Fe
3+ (aq)+ 3 [Fe(CN)6]4-(aq)
---j.Fe4[Fe(CN)6]3'
xH20
~x== 14-16 blau
Die Farbe von Berliner Blau: Fe4[Fe(CN)6l3' x H
20
Fe (11) liegt als
low-spin-t~g - Zentrum in einem C-Oktaeder vor und Fe (111) ist als high-spin-
t2 3
ge
g2-Ion an die N-Enden des Cyanid -Ions gebunden.
Das Strukturelement Fe(II)-C-N-Fe(III) ist essentieller Baustein dieser Verbindung, die eine
"Mixed valence "- Verbindung darstellt. Eine "Mixed valence "- Verbindung ist eine Verbindung,
die ein Element in 2 verschiedenen Oxidationsstufen oder Wertigkeiten enthält. Die Farbe ist nicht
als additive Eigenschaft der beiden Koordinationseinheiten interpretierbar, sondern als
kooperative Met all-Metall-Wechselwirkung.
Strukturausschnitt:
Berliner Blau enthält sowohl koordiniertes und zeolithisches Wasser ( siehe Strukturausschnitt ) und als auch oberflächlich adsorbiertes Wasser.
Der Ursprung der Farbe ist im Metall-Metall- Ladungstransfer zu suchen. Berliner Blau hat eine breite Absorptionsbande mit einern A
max =680 nm.
Schon die Energie des langwelligen gelben Lichtes reicht aus, um den Elektronentransfer von Fe(II) zu Fe(III) anzuregen. Wir sehen dann die Komplementärfarbe blau. Die Energiebarriere ist recht klein, da die chemischen Umgebungen von Fe(II) und Fe(IlI) recht ähnlich sind.
MMCT (Metal-Metal-Charge-transfer)
Fe(II)-C-N-Fe(III) Fe(III)-C-
N-Fe(II)
b) Oxidische Mischphasenpigmente:
Substitutionskristalle, in denen die Oxide mindestens 2er Metalle in einem Gittertyp vereint sind und eine homogene Phase bilden.
Übersicht über die oxidischen Mischphasenpigmente:
chemische Kristall-
Pfgmentgruppe Zusammensetzung struktur Farbe
Spinell-Blau CoAI2
0
4 rotstichig blau bisCo(AI,Q)2
0
4 grünstichig blauSpinell-Grün (Co,Ni,Zn)2Ti04 grün
Zink-Eisenbraun ZrFe204 Spinell heU- bis mittefbraun
Spinell-Braun zn(Cr,Fe)2
0
4 rotbraunSpinell-Schwarz Cu(Fe,Q)2
0
4 schwarzChrom-Rutil-Gelb (Ti,Cr,Sb)02 orangegelb
Nicket-Rutil-Gelb (Ti,Ni,Sb)02 Rutil zitronengelb
Mangan-Rutil-Braun (Ti,M"l,Sb)02 hell- bis dunkelbraun Pseudobrookit-Gelb Fe2
no,
x nTi02 Pseudobrookit gelbbraunEisen-Mangan-Schwarz (Fe,Mn)2
0
3 Bixbyit schwarz Eisen-Mangan-Braun (Fe,fv1n)20
3 Hämatit braunEisen-Chrom-Braun (Fe,Q)2Ü3 Korund rot- bis schwarzbraun
Thenards Blau:
Es gehört zu den oxidischen Mischphasenpigmenten und ist aiuch u. a. unter den Synonymen Kobaltultramarin, Königsblau und Tonerdeblau bekannt. Es weist 3 Absorptionsmaxima zw. 600 und 525 nm auf Sein Schmelzpunkt liegt bei 1700 - 1800 °C, der Brechungsindex ist 1,8.
Das oxidische Spinell CoO· Al203wird auch als Doppeloxid bezeichnet.
Es ist beständig gegen Licht, Luft, Temperaturunterschiede, Laugen, Säuren und Chlor.
Erste Verwendung fand es schon zwischen 618 und 906 n. Chr. in China / Persien zur Dekoration von Tonwaren. Heutzutage wird es in Kunststoffen, in Anstrichmitteln, in Baustoffen und in Keramik und Email verwedet. Auch als Künstlerfarbe wird es angewendet. So hat Leonardo da Vinci bei seiner berühmten "Madonna in der Felsengrotte" Thenards Blau verwendet.
Versuch 4: Thenards Blau Synthese
Geräte:
Porzellantiegel ( unglasiert), Muffelofen, Spatel
Magnetrührer mit Fisch (beheizbar), 2x 250 ml Becherglas Glastrichter, Papierfilter
Chemikalien:
1,2
gCoC0
31 g AJ2
0
31,2 g KCl desto Wasser
Durchfuhrung:
Man vermische Cobaltcarbonat, Aluminiumoxid und Kaliumchlorid als Flußmittel innigst und gebe es in einen unglasierten Porzellantiegel. Man stelle ihn für 30 Minuten in den schon auf 1OOO°C hochgeheizten Muffelofen.
Anschließend muß es noch in heißes Wasser gegeben werden, um das KCI zu entfernen. Nach Filtration wird es im Trockenschrank bei ca. 90°C getrocknet.
Auswertung:
CoC0
3(8)+ A1
203(8)+ KCl
(8)braun weiß
- - - i I ' )
CoA1
20 4(8)~+ cO
2(g)i+KCl
(8)blau
eA es 00
Spinell-Struktur A8 20 4
Spinelle (Me2~(MeJ~)2X4oder Me4+(Mez-)2
X, ) sind kubisch, annähernd dichteste Kugelpackung von 0 (kann auch S, Se, Halogenide und Pseudohalogenide sein), in der ein Teil der tetraedrischen und oktaedrischen Lücken zwischen Sauerstoffionen teils regelmäßig, in anderen Fällen auch statistisch, mit Metallionen besetzt ist.
Thenards Blau:
Pro Elementarzelle bilden die 02- - Ionen ein kubisch dichtestes Gitter, in dem es 8 tetraedrisch koordinierte Plätze von Co (A) und 16 oktaerdisch koordinierte Plätze von Al (E) gibt.
Zustandekommen der Farbe: Co
2+ (3d
7)Cobalt ist ein 3d-Element. Als 2-wertiges Kation besitzt es 7 Elektronen in den d-Orbitalen.
5 2
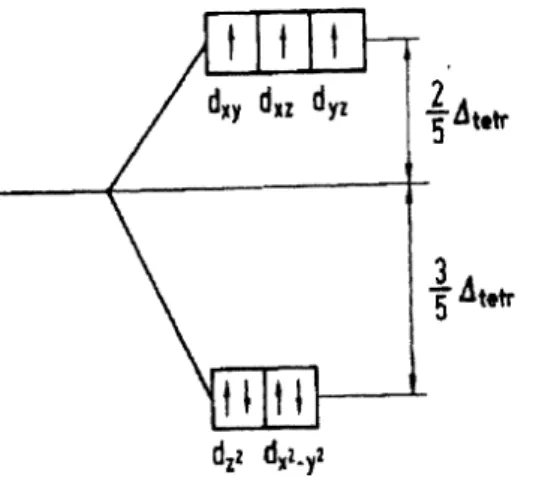
ßtttrdzz dxl..y2
Abbildung 5.31 Besetzung der d-Orbitale von C0
2+im tetraedrischen Ligandenfeld.
Bei Absorption von Strahlung geeigneter Energie kommt es zu einer Anregung eines Elektrons vom energieärmeren in einen energiereicheren d-Zustand.
Wir sehen dann die Komplementärfarbe der Absorptionsfarbe gelb.
Eine quantitative Deutung kann nur über das Mehrelektronenmodell erfolgen und erfordert eine Berücksichtigung der Elektron-Elektron-Wechselbeziehungen.
Für Co2+ ( d7) gibt es folgende 3
Übergänge:
4 T 19 ---) 4T 2g 8700
~4A2g 16000
~ 4T1g : 19400
Die Intensität der Farbe beruht darauf, daß die d-d-Übergänge voll erlaubt sind. Sie sind spin- erlaubt, d.h. der Gesamtspin ändert sich beim Elektronenübergang nicht. Die Elektronenübergänge werden,wenn sie voll erlaubt sind, wahrscheinlicher.
Teil IV
Perlglanzpigmente
Schon in Ägyten gab es kosmetische Rezepturen mit erstaunlicher Vielfalt an Farbe. In der Antike dienten wismuthaltige Pulver, Perlweiß genannt, als gute Gesichtskosmetikgrundlage.
Glanzeffekte und irrisierende Erscheinungen,die in allen Regenbogenfarben schillern, waren schon immer sehr attraktiv.
Ab 18. Jhdt. wurden Perlglanzpigmente das 1. Mal erwähnt. 1781 schrieb Johann Christian Wiegleb "Die Verfertigung der falschen Perlen" . Diese falschen Perlen bestanden aus
Perlessence (GuaniniHypoxanthinmischkristalle, die in Fischschuppen zu 1% enthalten sind.).
Bis zu Beginn dieses Jahrhunderts gab es in Paris eine blühende Industrie für Perlessence, dessen Hauptprodukt Kunstperlen waren.
Ein zu hoher Preis veranlaßte die Herstellung neuer synthetischer Verbindungen in Form von plättchenförmigen Kristallen von Zn-,Hg-,Pb-,und Bi-Verbindungen.
Yorallem die aufstrebende Kunststoffindustrie hatte eine große Nachfrage für Perlglanzpigmente.
In den 30er Jahren kam es zum Einsatz von bas. PbC0
3in Polyester, in den 50er Jahren zum Einsatz von Wismutoxichlorid.
Und in den 60er Jahren kam es zum entscheidenden Durchbruch mit der Erfindung der Glimmer- Metalloxid- Pigmente, die die Effekte der Perle nachahmen.
Sie finden in der Lackindustrie ( Autolacke, Industrielacke), in der Druckfarbenindustrie und in der Kunststoffindustrie Verwendung. Ebenso kann man sie für keramische Farben verwenden, da die Löslichkeit von Titandioxid so reduziert ist, daß es zu keiner Anlösung der Metallschicht kommt.
Als Besonderheiten wäre zu nennen zum emen die Lasermarkierung zu nennen, bei der Perlglanzpigmente den CO
2-Laserneine kontrastreiche kantenscharfe Markierung ermöglichen.
Bei Projektionsleinwänden erweitern sie den Winkel, unter dem man ein scharfes Bild sieht.
Außerdem dienen sie zum anderen als Photokopierschutz und Röntgenkatheterschläuche werden
dadurch sichtbar, daß Bi, im Schlauch enthalten, Röntgenstrahlen absorbiert
In der Kosmetik werden sehr hohe Anforderung an Reinheit und physiologische Unbedenklichkeit gestellt. Sie können hier auch funktionelle Anwendung finden: in Sonnenschutzmittel: Zusatz von rotem Glimmer- Titandioxid-Interferenzpigment bietet Schutz gegen Infrarotstrahlung, sogar gegen UV.
Neuheiten sind Low-Luster-Pigmente und Transparent Colours,d.h. extrem kleine (Nanometerbereich) Eisenoxidteilchen auf Glimmer
Versuch 5:
Lip Gloss - HerstellungGeräte:
Kristallisierschale, Magnetrührer, Rührfisch, Trichter, Lip Gloss - Hülse
Chemikalien:
Paraffinöl
Perlglanzpigment (Iriodin Perlgrün ( Merck)
Durchführung:
Man gebe 50 ml Paraffinöl in die Kristallisierschale. 2 Spatelspitzen Perlglanzpigment werden nun 2-3 Minuten bis zur vollständigen Homogenisierung eingerührt. Man fülle das Lip Gloss nun in die Hülse.
Auswertung:
Glanz und Interferenz (selektive Reflexion von Lichtstrahlen) sind physikalisch-optische Phänomene, die den Farben dünner Blättschen (hier: Perlglanzpigment) zugrunde liegen.
Eine wesentliche Vorraussetzung ist, das Licht auf eine sehr dünne Schicht mit unterschiedlichen optischen Dichten ( z.B. ÖI/Wasser, Luft/Öl) trifft.
Fällt ein Bündel paralleler Lichtstrahlen auf eine Fläche, so wird, je nach Beschaffenheit der Fläche, ein mehr oder weniger großer Anteil des Lichts in eine Vorzugsrichtung reflektiert. Eine rauhe, unebene Oberfläche wird die Lichtstrahlen diffus nach allen Seiten streuen, eine glatte Fläche hingegen reflektiert im Idealfall alle auftretenden Lichtstrahlen in die Vorzugsrichtung. Es gilt: Einfallswinkel E==AusfallswinkelE'
Der Reflexionsgrad, also das Verhältnis von reflektierter Lichtintensität zur urpsrünglichen Intensität, ergibt sich aus dem Einfallswinkel und der Differenz der Brechzahlen.
Je mehr sich die Brechzahlen (Relativmaß fur optische Dichte) beiderseits der Grenzfläche unterscheiden und je flacher das Licht auftrifft ( großer Einfallswinkel), umso mehr Licht wird reflektiert
!Die reguläre Reflexion durch Fresnelschen Reflexionskoeffizienten r
(E)ausdrückbar.
Für Einfallswinkel unter 30° und nicht polarisiertes Licht gilt:
n2 - n1 2
r(DO)=( )
n2+n1
d.h. von einem Lichtstrahl aus der Luft (n= 1) werden bei nahezu senkrechtem Auftreffen an Wasser (n=1,33) 2%,an Lacken,Kunststoffen oder Ölen (n=1
,5%)4% des auftreffenden Lichts reflektiert.
Besitzt das zweite Medium die höhere Brechzahl kommt es zu einer Vorzeichenänderung des elektrischen Feldvektors fur den reflektierten Teil, d.h.zu einer Verschiebung des Licht um eine halbe Wellenlänge in seiner Phasenlage.
Es gibt keinen Phasensprung an Grenzflächen zu Stoffen mit niedrigerer Brechzahl
LI
n,
(Luft)"3
(Wasser)Abb
.:Schema des Strahlengangs an
einem dünnen Ölfilm auf Wasser
Die beiden Teilstrahlen L" und L'" können in Wechselwirkung treten, die Interferenz genannt wird. Sie haben einen Gangunterschied, der sich aus dem Phasensprung ').,/2 des Strahles L" und dem geometrischen / zeitlichen Umweg von L'" ergibt.
a.)
b.)
f---1---..,...--t
1 - - - -
Auslö$Chungf - - - f ' - - - - + - - - t f - - - f - - - - r - - Verstärkung
Abb.: Wechselwirkung zw. Lichtstrahlen verschiedener Phasenlagen
Wenn nun der Gangunterschied dazu fuhrt, daß Wellenberg des einen TeilstrahIs auf Wellental des anderen Strahls trifft, so kommt es zu einer Auslöschung
.Trifft jedoch Wellenberg auf Wellenberg
,so wird die Intensität des Lichtes verstärkt.
Bei nicht senkrechtem Lichteinfall wird der Umweg des eines Strahls länger
.Diese Abweichung fuhrt zu Winkelabhängigkeit der Interferenzfarben (changierender Effekt).
Das Reflexionsmaximum ist abhängig von der Schichtdicke
.Mit wachsender Schichtdicke kommt es zu einer Verschiebung jeweils zu größeren Wellenlängen. Zum Reflexionsmaximum tritt noch ein Minimum und es entstehen deutliche Farbeindrücke in der Reihenfolge des Regenbogens (gelb,rot,blau,grün und wieder gelb, rot,
....).Da mit zunehmender Schichtdicke die Maxima und Minima immer dichter aufeinander folgen, unterscheiden sich die Farben der verschiedenen Ordnungen im Ton und der stärkeren Sättigung.
Interferenz ist die Gesamtheit der Überlagerungserscheinungen zweier oder mehrerer Wellen.
Ein weiteres Charakteristikum ist, daß die Farben mit dem Einfallswinkel des Lichtes wechseln.
Das reflektierte und transmittierte Licht sind komplementär zueinander. Im Glanzwinkel dominiert die Interferenzfarbe und in allen anderen Winkeln zeigt das transmittierte Licht die Komplementärfarbe.
Bei paralleler Orientierung der transparenten Blättchen ( um den horizontalen Strömungen einen möglichst geringen Widerstand entgegenzubringen) wird durch Mehrfachreflexion ein Glanz bewirkt, wie er für Perlen charakteristisch ist. Perlglanz ist der Glanz aus der Tiefe.
Je transparenter das Medium, umso weniger Licht geht verloren
Schicht-Substrat-Pigment:
Ein ideales Perlglanzpigment wäre Ti02. Es ist aber noch rue gelungen, Titandioxid In Blättchenform zu züchtenl!' Deshalb hat man sich Glimmer als Substrat ausgesucht.
Die Beschichtung erfolgt naßchemisch durch Hydrolyse von Titansalzlösungen In Glimmersuspension.
Glimmer (hydroxyl- und alkalihaltige Aluminiumsilikate):
KA12[(OH,F)2A1Si301o] ist ein Muskovit ( KA12[(OH,F)2AlSi301o]) mit der Mohshärte:
2-3
und kommt meistens in Form durchsichtiger Tafeln vor. Er besitzt einen perlmuttartigen, silbrigmetallischen Glanz.Je feiner die Teilchen, desto mehr Licht wird an Ecken und Kanten gestreut, der Glanz verringert und das Deckvermögen erhöht. Je nach Verwendungszweck gibt es Größen, die sich zwischen 5-
150
um
bewegen. Die Dicke kann 100 bis 500 nm betragen.Silberweiße Perlglanzpigmente entstehen bei einer Ti02 -Schicht von 40-60nm,
Interferenzpigmente:
Dosiert man weiter Titandioxid auf Glimmer beginnen die Pigmentteilchen goldgelb zu glänzen, dann kupferrot, lila, blau, türkis, grün, und wieder von vorne.
-+
ausgeprägter Farbflop, auch changierender oder Flip-Flop-Effekt genannt.Literaturverzeichnis
1.A.Ludi;Chemie in unserer
Zeit,
22,-.1,123-1272.K.Bitter,W.Ostertag;
Angew. Chemie,
1980 ,92, 187-194 3.F.Hund;Angew.
Chemie, 1981,93,763-7714.W.Kaim, S.Ernst, St. Kohlemann;Chemie in unserer Zeit,21, 2, 50-58 5.K.Wiegand;Chemie in unserer
Zeit
, 13, 3, 118-1256. W.NoH, Chemie in unserer Zeit, 14,2,37-43
7. Ullmanns
En
cyklopädieder technischen Chemie,
3.Aufl .,Bd 13,738-805 ,VCH-Weinheim 8.Ullmann'sEncyclopedia ofIndustrial Chemistry ,
Vol A20, VCH Verlagsgesellschaft, 1995 9. G.Pfaff,Chemie in unserer Zeit, 1997,31, 1, 6-1610.A.R. Maisch,M.Weigand,
Perlglanzpigmente,
2.Aufl.,Bibliothek der Technik, Bd 56, Verlag moderne Industrie ( Merck), 199211. Riede!,
anorganische
Chemie,3.Aufl .,Walter de Gruyter,Berlin, 199412.Folienserie des Fonds der chemischen Industrie, Farbstoffe und Pigmente, Bd. 15, 1885 13.N.Mronga,
Pigmente, Füllstoffe und Farbstoffefür die Lackindustrie
- AnorganischeBuntpigmente
FPerlglanz- und
Effektp igmente, Unterlagen zum Lehrgang 19488.1/58.015, Technische Akademie Esslingen 199514. CD Römpp Chemie Lexikon - Version 1.0, Stuttgart/New York,Georg Thieme Verlag 1995 15. G.Weißenhorn,
Praxis der Naturwi
ssenschaften, 1988,37, 7, 10-3116.Gesenhues,
Praxis der Naturwissenschaften,
1993,42,5, 14-32 17.BASF,Safe Handling of Pigments,
European Edition, 1995 18.E.Gerstner,Versuchsvorschriften und Script
zum Praktikum19.BAYER,
Lichtgrün, Lichtblau, Echtschwarz, anorgan. Spinellpigmente. 1995
20.KRONOS,Titandioxid in Kunststoffen,
Ausgabe 199321.D.Rohe,
Weg vom Pulver hin zur Präperation,
Chemische Industrie, 198622. DIN - Taschenbuch,