Natriumchlorid (NaCl) oder einfach Kochsalz
Fabian Gelies
Sommersemester 2002
Experimentalvortrag
Versuch 1
Darstellung aus den Elementen
Vorbereitung: Entwicklung von Chlorgas
MnO
2(s)+ 4 HCl
(aq)Mn
2+(aq)+ 2 Cl
-(aq)+ 2 H
2O
(l)+ Cl
2(g)Reaktionsgleichung:
2 Na
(l)+ Cl
2(g)2 NaCl
(g/s)+ 822,56 kJ
+ IV - I + II 0
0 0 + I - I
Bezug auf die Elemente
Flammenfärbung:
Na
(g)Na
(g)*Na
(g)Δ E = h · ν = h · c / λ Natrium: 589 nm (gelb)
Aufbau der Elektronenhüllen:
Natrium: 1s
22s
22p
63s
1Chlor: 1s
22s
22p
63s
23p
5Natürliche Oxidationsstufen: Natrium (+ I ) als Na
+-Ion
- Δ E Δ
Bezug auf die Elemente
Vorkommen von NaCl:
3,6 · 10
16Tonnen gelöst in den Weltmeeren
10
15Tonnen in unterirdischen Salzlagern Steinsalz weiterhin in salzhaltiger Kohle und Organismen
Physiologie:
150 bis 300 g in Blut und Gewebesäften
10 bis 15 g tägliche Aufnahme Kochsalz 5 g/kg akut toxische Dosis
0,9 % : “physiologische Kochsalzlösung”
Bezug auf die Elemente
Verwendung von NaCl:
Herstellung fast aller Natrium- und Chlorverbindungen
Gewinnung von NaCl:
Herausbrechen oder Lösen aus Salzlagern Eindampfen von Salzsolen
Verdunsten oder Ausfrieren von Meerwasser
Reinigung von NaCl:
Ausfällung von Verunreinigungen
Fällung von NaCl mittels HCl-Gas
Versuch 2
„Leblanc-Verfahren“
Darstellung von HCl-Gas aus Kochsalz
NaCl
(s)+ H
2SO
4(aq)NaHSO
4(s)+ HCl
(g)( NaCl
(s)+ NaHSO
4(s)Na
2SO
4(s)+ HCl
(g))
20°C
Vollständiger Umsatz erfolgt in zwei Stufen Reaktionsgleichung:
800°C
• Gebräuchliche Labordarstellung (oft mit NH
4Cl statt NaCl)
• Moderne HCl - Darstellung in der Technik:
Elementares Chlor wird mit Kohlenwasserstoffen umgesetzt
Versuch 2
„Leblanc-Verfahren“
Nachweis des entstandenen HCl-Gases
Chloridnachweis:
Fällen als Silberchlorid:
Ag
+(aq)+ NO
3-(aq)+ Cl
-(aq)NO
3-(aq)+ AgCl
(s)(weiß) Lösen in Ammoniak:
AgCl
(s)+ 2 NH
3(aq)Cl
-(aq)+ [Ag(NH
3)
2]
+(aq)(farblos)
Säurenachweis:
Farbumschlag der Phenolphthaleinlösung
(violett farblos)
Kristallisation von Kochsalz
Löslichkeit in Wasser:
35,6 g / 100 mL bei 20°C
39 g / 100 mL bei 100°C Foto Uni Siegen
Foto: Dr. E. Becker Uni Siegen
Versuch 3
Kristallisation im Eiltempo
NaOH (aq) + HCl (g) H 2 O (l) + NaCl (s)
Reaktionsgleichung:
Reaktionsart: typische Neutralisationsreaktion Relevanz: Entsorgung bei technischen
Prozessen (z.B. PVC - Verbrennung)
Kochsalzkristalle
Würfel (farblos und durchsichtig) Dichte: 2,164 g/cm
3Schmelzpunkt: 801 °C Siedepunkt: 1413 °C
Natriumchloridstruktur:
KOZ = 6 (Na
+und Cl
-)
kubisch flächenzentrierte Anordnung
Fotos: Dr. E. Becker Uni Siegen
Foto Uni Siegen
Kochsalzkristalle
NaCl-Struktur
als SWF-Animation
aus dem elektronischen Unterrichtsmaterial
der Universität Zheng Zhou (VRC)
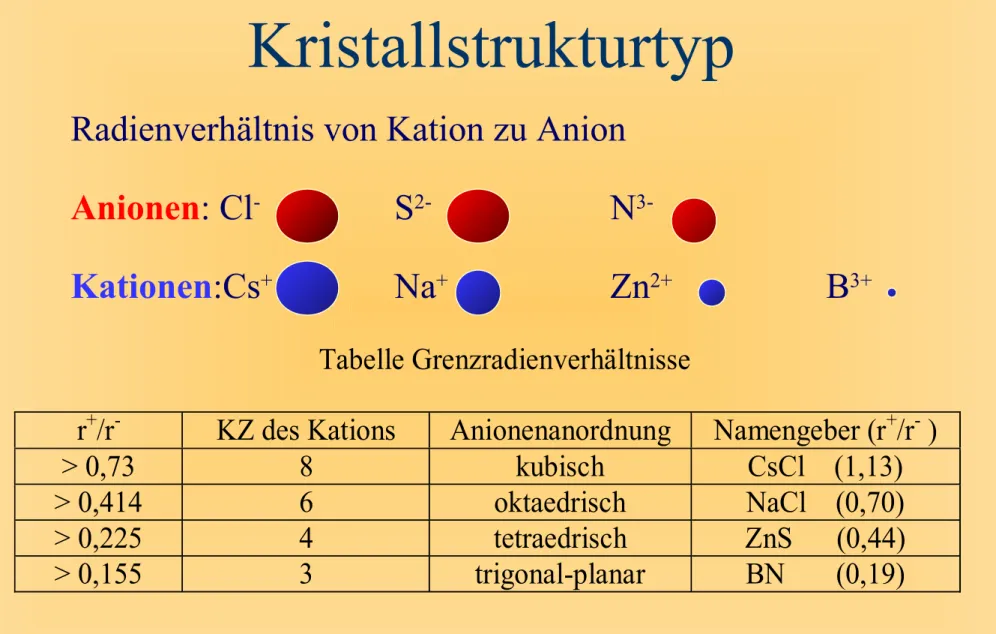
Kristallstrukturtyp
Radienverhältnis von Kation zu Anion Anionen: Cl
-S
2-N
3-Kationen:Cs
+Na
+Zn
2+B
3+Tabelle Grenzradienverhältnisse
r
+/r
-KZ des Kations Anionenanordnung Namengeber (r
+/r
-)
> 0,73 8 kubisch CsCl (1,13)
> 0,414 6 oktaedrisch NaCl (0,70)
> 0,225 4 tetraedrisch ZnS (0,44)
> 0,155 3 trigonal-planar BN (0,19)
Elektrolyse von NaCl
Wässrige Elektrolyse Vortrag Thomas Decher Schmelzflusselektrolyse:
Elektrodenvorgänge:
Reduktion: 2 Na
+(l)+ 2 e
-2 Na
(s)Oxidation: 2Cl
-(l)Cl
2(g)+ 2 e
-Redoxreaktion: 2 Na
+(l)+ 2 Cl
-(l)2 Na
(s)+ Cl
2(g)Schema einer NaCl-Elektrolyse- anlage
aus: Chemie für Gymnasien, Berlin (Cornelsen) 1994
Versuch 4
Chlorierendes Rösten von Kupferoxid
Lösung von CuCl
2in Wasser: [Cu(H
2O)
6)]
2+(hellblau) Versetzen mit Ammoniak: [Cu(NH
3)
4)]
2+(tiefblau)
2 CuO
(s)+ 2 NaCl/CaCl
2(s)2 CuCl
2(s)+ Na
2O/CaO
(s)Reaktionsgleichung: Δ
(Schmelze)
Nachweis gelöster Cu
2+- Ionen:
Übergang vom Kristall zur Lösung
bisherige Versuche: NaCl in kristalliner Form im Weiteren: NaCl in wässriger Lösung
Phänomene beim Lösevorgang
Versuch 5
Kochsalz-Kältemischung
Physikalisch-chemischer Hintergrund:
Lösen von Salz in Wasser Ionen werden aus dem Gitter durch die Wasserdipole „herausgebrochen“.
Ist die freiwerdende Hydratisierungsenergie kleiner als die Gitterenergie, so ist der Lösevorgang endotherm.
1.Kühlungseffekt: Lösungswärme wird aus Umgebung entnommen Abkühlung von Lösung und Gefäß.
Eis ist immer von einer Wasserschicht umgeben.
Eis (fest) + Energie Wasser (flüssig)
Lösevorgang verschiebt Gleichgewicht: Es wird immer mehr Wasser flüssig.
Versuch 5
Kältemischung
Tabelle: Kältemischungen
Salz Zusammensetzung Niedrigste erreichbare
Temperatur (°C)
Harnstoff 10g/100g Eis -10,8
NH4NO3 14g/100g Eis -13,6
NaNO3 15g/100g Eis -13
NH4Cl 25g/100g Eis -15,4
NaCl 33g/100g Eis -21,3
Ethanol 105g/100g Eis -30
CaCl2 . 6 H2O 143g/100g Eis -55
KOH 31g/100g Eis -63
Verwendung: Technik (historisch) Labor
Straßenverkehr
Dichte von Kochsalzlösung
Konzentrierte Salzlösung hat höhere Dichte als reines Wasser Problematik: Recycling unterschiedlicher Kunststoffe
Anwendung: Trennung von Kunststoffmüll unter
Ausnutzung der unterschiedlichen Dichte
Ablauf: 1. Müllgemenge mechanisch zerkleinert
2. Kunststoffteile in Lösung geringster Dichte 3. Kontinuierliches Umwälzen der Oberfläche 4. Absaugen der zum Boden gesunkenen Teile 5. Abgesaugte Kunststoffteile in Flüssigkeit mit nächst größerer Dichte
• Technische Bezeichnung: Schwimm-Sink-Verfahren
20
Demonstration 1
Dichte einer konzentrierten Salzlösung
Kunststoffmüll-Trennung:
Wasser NaCl-Lsg Na
2S
2O
3-Lsg ρ = 1,0 g/cm
3ρ = 1,18 g/cm
3ρ = 1,4 g/cm
3200 800
1000 mL 400 600
200 800
1000 mL 400 600
200 800
1000 mL 400 600
alle
Kunststoffe schwimmen PVC und PET
sinken ab PP schwimmt
PS sinkt ab
Versuch 6a
Korrosionsförderung des Elektrolyten Kochsalz
Unter welchen Bedingungen rostet Eisen?
Bei Gegebenheit der drei notwendigen Korrosionskomponenten:
2. Sauerstoff (Raumluft)
3. Elektrolyt (NaCl-Lösung) 3. Wasser (NaCl-Lösung)
Reaktionsgleichung :
2 Fe
2(s)+ O
2(g)+ H
2O
(l)2 FeO(OH)
(s)= Fe
2O
3· H
2O
(s)Salzlösung ersetzbar durch SO - oder CO -haltiges Wasser
Versuch 6b
Korrosionsförderung des Elektrolyten Kochsalz
Ein Bleistiftspitzer als Lokalelement (Modell der Opferanode)
Große Potentialdifferenz zwischen Stahlklinge (Eisen) und
Leichtmetallblock (Legierung: 97% Magnesium, 3% Aluminium)
Block (Anode): Mg
(s)Mg
2+(aq)+ 2 e
¯Klinge (Kathode): 2 H
2O
(l)+ 2 e
¯H
2(g)+ 2 OH
¯(aq)Rand des Blocks: Mg
2+(aq)+ OH
¯(aq)Mg(OH)
2(s)Verwendung:
Korrosionsschutz ( z.B. bei Schiffen oder Heizungsanlagen)
Versuch 6c Salzbatterie
Standardpotentiale ε
0Mg Mg
2+: -2,38V Fe Fe
2+: -0,44V
Vermeidung der elektrochemischen Korrosion:
- Kontakt der verschiedenen Metalle unterbinden
Osmotischer Druck
Begrifflichkeit
Diffusion einer Flüssigkeit durch semipermeable Membran, welche zwei Flüssigkeiten trennt
Wassermoleküle werden durchgelassen, solvatisierte Ionen nicht
Grundlage: Das Bestreben Konzentrationsunterschiede auszugleichen
osmotischer Druck Biologische Bedeutung
Halbdurchlässige Wände:
- Grenzschichten des Plasmas der Tiere und Pflanzen - Innendruck und Außendruck von Zellen