AUS DEM LEHRSTUHL FÜR HALS-NASEN-OHREN-HEILKUNDE PROF. DR. JÜRGEN STRUTZ
Volltext
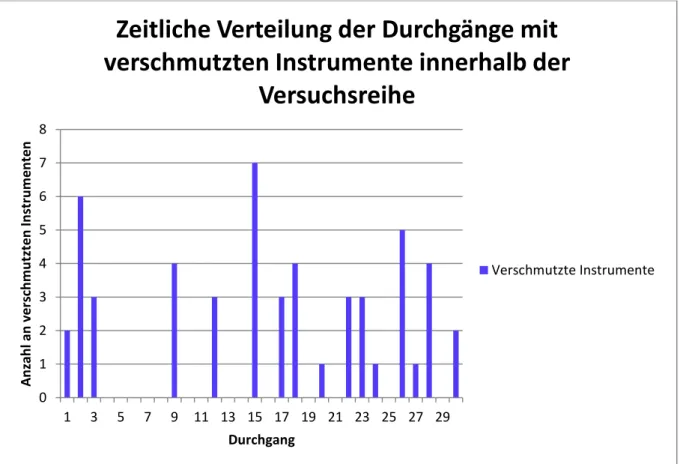
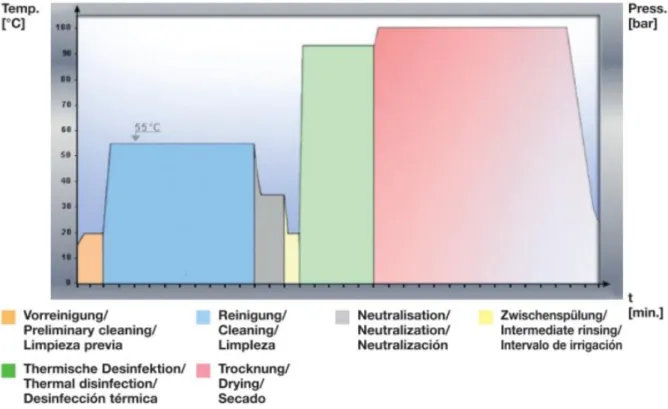
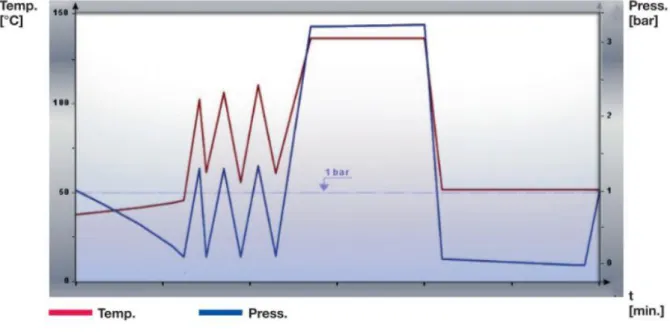
Abbildung


ÄHNLICHE DOKUMENTE
Viele dieser primärpräventiven Maßnahmen haben eine direkte Bedeutung für Erkrankun- gen des HNO-Traktes und die HNO-ärztliche Tätigkeit, werden aber bereits an anderer Stel-
Auch bei einer ein- seitigen Ertaubung (zum Beispiel nach einem Hörsturz oder einer Meningitis) und normalem Gehör auf der Gegenseite kann ein CI die Reha- bilitation
Der angebotene Kurs soll nicht nur einen Überblick über eine leitliniengerechte, interdiszipli- näre strukturierte reguläre Tumornachsorge bieten, sondern auch Tipps und Tricks
[r]
spiegelung bezieht sich auf den vorderen, den mittleren oder den hinteren Teil der Nase: Bei der vorderen Rhinoskopie wird über ein zangenförmiges Gerät ein Trichter in
oder „etwas in den falschen Hals bekommen” zeigen schon eine Erkrankung, aber auch Funktionen von Rachen und Kehlkopf an: Ersterer dient dem Nahrungstransport, der Kehlkopf sorgt
Nasenerkrankungen Krankheiten, die sich an der Nase ab- spielen oder ihre Funktion beeinflussen, etwa Nasenat- mungsbehinderungen, Rhinorrhöen (gestörte Nasensekre- tion)
Bei einer Otitis externa (Gehörgangsentzündung, Au- ßenohrentzündung) ist die Haut im äußeren Gehörgang, also im Bereich von Ohrmuschel bis Trommelfell entzündet, was