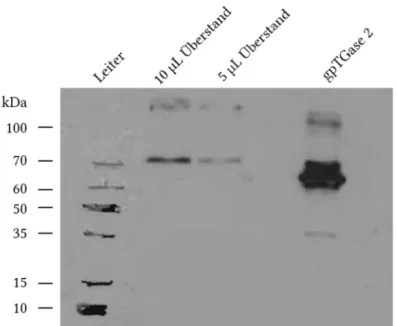
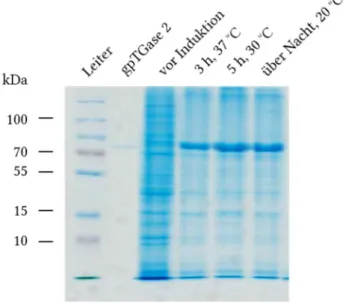
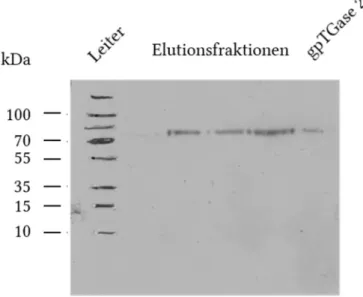
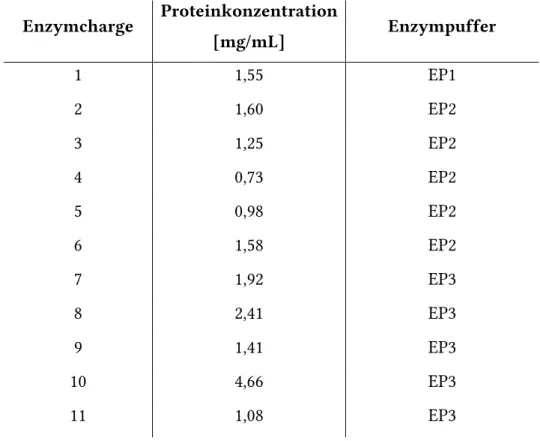
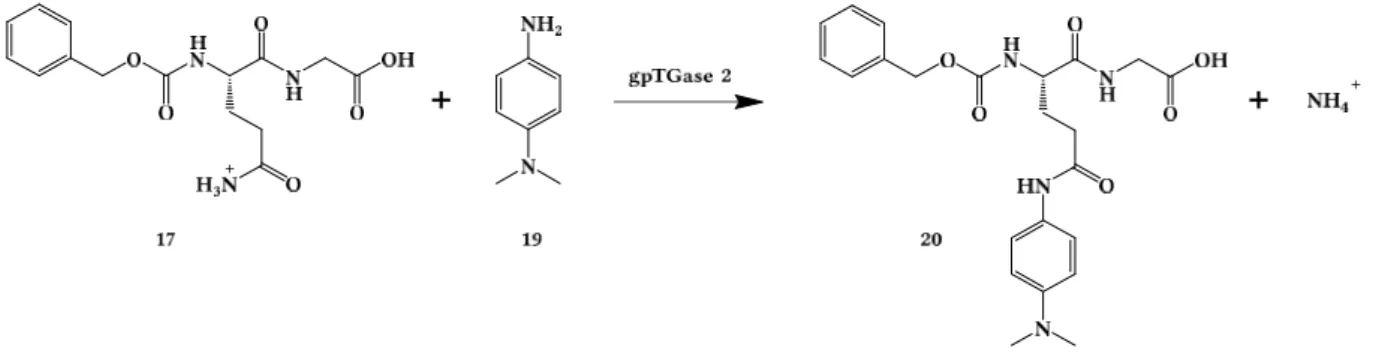
Neue Assays zur Charakterisierung der Transamidaseaktivität und der GTP-Bindungsfunktion von Transglutaminase 2 I D
Volltext
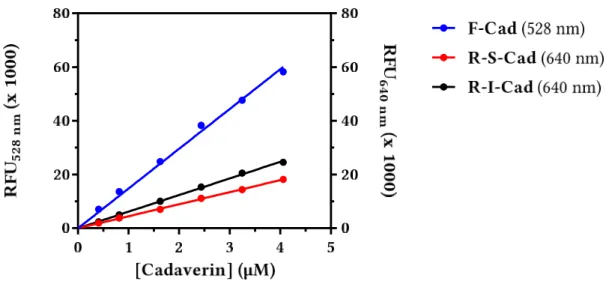
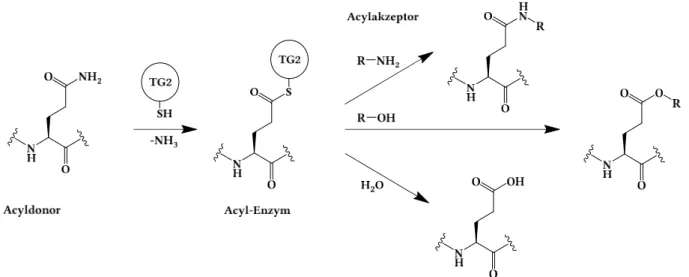
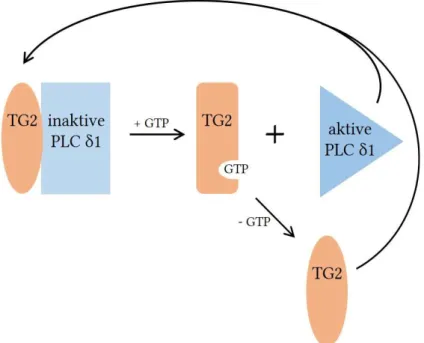
Abbildung
ÄHNLICHE DOKUMENTE
[r]
similarly effective at activating [3H]GTP formation from [3H]GDP and GTP in HL-60 membranes and by NDPK purified from bovine liver mitochondria.. Our data suggest
Starting from 4-bromoacetophenone 1, the 4-bromo- β -hydroxydithiocinnamic acid 2 and the 4-bromo- β -hydroxydithiocinnamic acid hexyl ester 3 were prepared using carbon disulfide
Da dieses Submodul auf AutoCAD basiert, stehen auch unmittelbar alle AutoCAD- Funktionen für eine weitere Manipulation des Modells wie Drehen, Zoomen, Verschieben oder das Ändern
Aus diesem Grunde erscheint die Hormonbestimmung durch einen Rezeptorbindungstest (RBT) biologisch relevanter, da hier eher die biologisch wirksame Menge an Leptin,
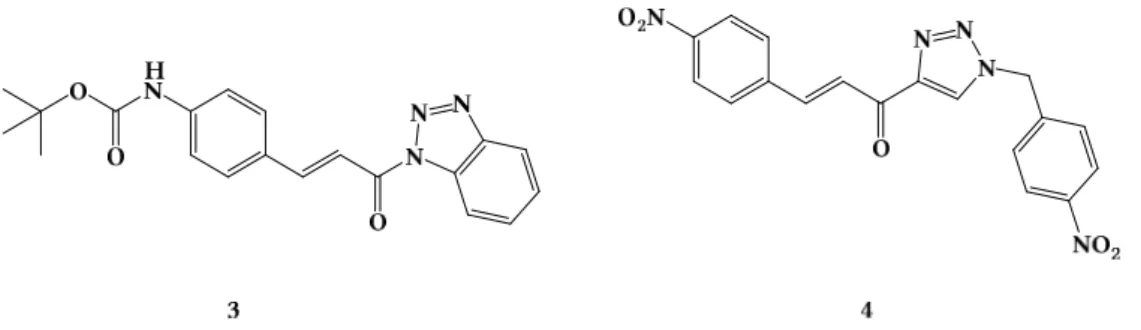
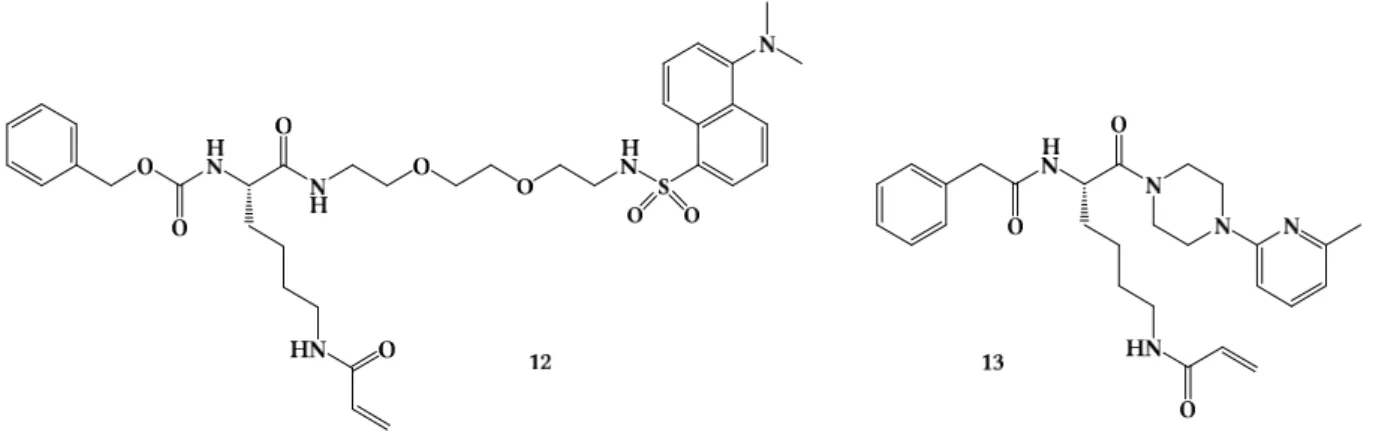
Der direkte Vergleich analoger Inhibitoren mit Acetyl- oder Phenylacetyl-Gruppe in P5-Position zeigt, dass die Phenylacetyl-Gruppe nicht nur zu einer besseren Detektierbarkeit
Auch für andere DREBs konnte durch Überexpression eine hohe Trockenstresstoleranz erzielt werden, jedoch zeigen die Pflanzen unter Normalbedingungen ebenfalls häufig
a) Es wird vorausgesetzt, dass die Politik Rahmenbedingungen schafft, die eine zunehmende De- karbonisierung des Gasverbrauchs entsprechend den Klimazielen der Bundesregierung