Inhaltsverzeichnis
1 Geschichtliches 2 Versuch 1: Gärung 3 Zucker
3.1 Demonstration 1: Öchslegrad 3.2 Refraktormeter
3.3 Versuch 2: Titrimetrische Zuckerbestimmung 4 Versuch 3: Herstellung von Weinbrand
5 Versuch 4: Methanolnachweis 6 Alkohol
Demonstration 2: Vinometer
Demonstration 3: Alkoholgehalt über die Dichte
Versuch 5: titrimetrische Alkoholbestimmung 7 Versuch 6: Reduktoren im Wein
8 Versuch 7: photometrische Weinsäurebestimmung
1. Geschichtliches
Der Name Alkohol kommt aus dem Arabischen und bedeutet übersetzt soviel wie „das Edelste“. Bereits die Ägypter hatten eine beachtliche Trinkkultur.
So kannten sie bereits 2000 v.Chr. über 70 verschiedene Biersorten.
Allerdings waren alkoholische Getränke zu der damaligen Zeit nicht lange haltbar und hatten, da Reinzuchthefen noch nicht verfügbar waren, eine nur sehr geringe Alkoholkonzentration. Somit wurden bis in die christliche Zeitrechnung hinein alkoholische Getränke fast ausschließlich zu festlichen Anlässen produziert und mussten auch innerhalb kürzester Zeit aufgebraucht werden. Das hieß alkoholische Getränke waren nicht allzeit verfügbar und es kam kein Alkoholproblem in der Bevölkerung auf.
Ab dem Mittelalter war die Bier – und Weinherstellung in der Hand der Klöster. Da die Rohstoffe zur Alkoholgewinnung sehr kostbar waren (Weintrauben, Gerste) konnte sich der Normalbürger im frühen Mittelalter kaum einen kontinuierlichen Alkoholkonsum leisten. Zwar gab es einige Alkoholprobleme in den Klöstern, doch wurde übermäßiger Alkoholkonsum durch strenge Verhaltensregeln weitgehend unterbunden.
Um 800 n. Chr. wurde von Karl dem Großen das erste Alkoholverbot erteilt.
Da es zu einigen schweren Fehlentscheidungen im Alkoholrausch gekommen war, wurde ein Gesetz geschaffen, welches den Fürsten untersagte betrunken Gericht zu halten.
Gegen 900 n.Chr. erließ König Edgar von England ein Gesetz, welches das unkontrollierte Betrinken verhindern sollte. So mussten alle Gläser, in welchen alkoholische Getränke ausgeschenkt wurden, mit Eichmarken (sog.
Pegs) versehen werden. Es war von nun an nicht mehr gestattet mehr als von Peg zu Peg zu trinken, ohne das Glas zwischendurch abzusetzen.
Zur ersten Alkoholkrise kam es dann im 16. – 17. Jahrhundert. Die Brandweingewinnung durch Destillation wurde populär. Das hatte zur Folge, dass zum Einen der Alkohol nun sehr hoch konzentriert vorlag und zum Anderen eine sehr lange Haltbarkeit hatte. Dies führte dazu, dass der Alkoholkonsum in der Bevölkerung schlagartig zunahm. So schaffte die Stadt Nürnberg 1530 einen Karren an, der Betrunkene auf der Straße aufließ und sie in den Arrest fuhr.
Durch neue Verhaltensregel (betrunken sein wurde als unangenehm und nicht standesgemäß angesehen) und durch das Aufkommen von neuen Getränken wie Tee und Kaffee war der Alkoholkonsum ab dem 18.
Jahrhundert stark rückläufig.
Im 19. Jahrhundert kam es erneut zu einer Alkoholkrise. Die Alkoholindustrie produzierte in großen Mengen billigen Alkohol, die Landflucht setzte ein und viele Fabrikbesitzer schenkten kostenlosen oder sehr billigen Alkohol an die Angestellten aus. Damit versuchten sie die schwere und gefährliche Arbeit erträglicher zu machen und evtl.
aufkommendem Unmut entgegenzuwirken. Eine Statistik aus dem Jahre
1900 besagt, dass durchschnittlich 20% des Monatslohnes für Alkohol ausgegeben wurde.
Ende des 19. Jahrhunderts wurde die schädliche Wirkung des Alkohols zum ersten Mal öffentlich bekannt und diskutiert. So wurde 1879 das erste Krankenhaus für den Alkoholentzug eröffnet. Sechs Jahre später kam es zur Gründung des „Blauen Kreuzes“ und 1907 kam es zu einem Beschluss der Gewerkschaften, der den Alkoholkonsum am Arbeitsplatz gänzlich verbot.
Durch den ersten und zweiten Weltkrieg kam der Alkoholkonsum fast zum erliegen. Wegen der Nahrungsmittelknappheit konnte es sich kaum jemand leisten in großen Mengen Alkohol zu konsumieren.
Im Jahr 1919 wurde in den gesamten USA der Alkoholkonsum verboten. Die Zeit der Prohibition dauerte bis 1933.
Seit der Nachkriegszeit kann, auch wenn viele es nicht wahrhaben wollen, von der dritten Alkoholkrise der Menschheitsgeschichte gesprochen werden.
So leben alleine in Deutschland ca. 2,5 Millionen Alkoholiker, ca. 5 mal so viele sind akut alkoholgefährdet. Entspricht diese Statistik den Tatsachen, so sind das fast 20% (!) der Gesamtbevölkerung.
Der volkswirtschaftliche Schaden wird dabei auf 25 Milliarden Euro geschätzt. Alleine in der BRD gibt es 12000 stationäre Behandlungsplätze für Alkoholiker. Leider reicht die Kapazität immer noch nicht und es gibt lange Wartezeiten bis man einen solchen Platz bekommt.
Betrachtet man sich noch die Unfallstatistiken an Arbeitsplatz und
Straßenverkehr so kann mit gutem Gewissen von einer Alkoholkrise
gesprochen werden. Verwunderlich ist hierbei nur, dass erst 1973 die 0,8
Promillegrenze für den Straßenverkehr eingeführt wurde.
2. Versuch 1:
Gärung
Chemikalien:
Ba(OH)
2; Wasser ; Zucker ; Bäckerhefe ; (NH
4)
2HPO
4Geräte:
Zweihalskolben, Gärröhrchen, U – Rohr mit Hahn, Stopfen, Stativmaterial Aufbau:
Durchführung / Beobachtungen:
Es wird ein Gemisch aus 400g Zucker, 3 l Wasser, 1 l Apfelsaft und 3 Päckchen Bäckerhefe hergestellt. Dieses beginnt nach ca. 1h heftig zu gären. Die Gärlösung wird in einen 5 l Zweihalskolben gegeben und auf die eine Öffnung wird ein Gärröhrchen gesetzt. An die zweite Öffnung wird ein U – Rohr angeschlossen. Dieses wird mit Ba(OH)
2– Lösung zu ca. ¼ gefüllt. Beide Öffnungen sind mit Hähnen verschließbar.
Es wird nun die Öffnung, welche zu dem Gärröhrchen führt, verschlossen und
die Öffnung, welche zum U – Rohr führt, geöffnet. Somit strömt das
entstehende Gas durch die Ba(OH)
2– Lösung. Dabei entsteht ein weißer
Niederschlag von BaCO
3.
Reaktionsgleichungen:
a) Die Gärung:
Glucose wird in den Hefezellen im sog. Zitronesäurezyklus zu Brenztraubensäure (Pyruvat) oxidiert:
( Die Enolform ist durch Phosphorilierung stabilisiert. Daher liegt die Enolform zu über 99%
vor.)
Brenztraubensäure wird zu Acetaldehyd decarboxyliert und dieser mittels NADH zu Ethanol reduziert:
Bruttogleichung der (anaeroben) Gärung:
C
6H
12O
6 2 CO
2+ 2 C
2H
5OH G°= -234 KJ/mol Oxidative Glucoseabbau:
C
6H
12O
6+ 6 O
2 6 CO
2+ 6 H
2O G°= -2880 KJ/mol b) CO
2– Nachweis:
Das entstehende CO
2löst sich in Wasser CO
2+ H
2O H
2CO
3(aq)pKs = 2,6 H
2CO
3(aq)+ H
2O H
3O
+(aq)+ HCO
3-(aq)
pKs = 3,8 HCO
3-(aq)
+ H
2O H
3O
+(aq)+ CO
32-(aq)
pKs = 10,3 Fällung mit Ba(OH)
2Ba
2+(aq)+ 2OH
-(aq)+ CO
32-(aq)
BaCO
3 (s)+ 4 H
2O
Lp (BaCO
3) = 2 x 10
-9mol
2/l
2Allgemeines zum Thema Gärung:
Die Tatsache, dass sich Zucker bei der Gärung in Alkohol und Zucker umwandeln lässt war bereits seit über 2000 Jahren v.Chr. bekannt. Die grundlegenden chemischen und biologischen Zusammenhänge der Gärung wurden jedoch erst im 19. Jahrhundert untersucht.
Justus v. Liebig entwickelte Ende der dreißiger Jahre des 19. Jahrhunderts die sogenannte Zersetzungstheorie. So schrieb Liebig: „ Mit Gärung (Fermentation) bezeichnet man die Fäulnis von vegetabilischen Substanzen, welche bei diesem Zersetzungsprozess keinen oder keinen unangenehmen Geruch verbreiten...“
Weiter schrieb er: „ Gärung und Fäulnis sind einerlei Zersetzungsprozesse, die erstere von stickstofffreien, die andere von stickstoffhaltigen Substanzen...“
Louis Pasteur griff in den sechziger Jahren Liebigs Theorie an: „Der chemische Vorgang der Fermentation ist im wesentlichen ein Phänomen, welches mit dem Lebensvorgang zusammenhängt, beginnend und endend mit dem letzteren. Ich denke, es gibt keine alkoholische Gärung ohne eine gleichzeitige Organisation, Entwicklung und Vervielfältigung der Kügelchen...“ (Anmerkung: Pasteur meint mit Kügelchen Hefezellen.)
Gegen Ende des 19. Jahrhunderts griff Eduard Buchner eine Anfang des Jahrhunderts von Moritz Traube entwickelte Theorie auf. Traube hatte die sogenannte Enzymtheorie entwickelt. Buchner glaubte, dass die Enzyme in dem Inneren der Zelle fixiert sind. Er stellte einen zellfreien Presssaft aus Hefezellen her. Dieser begann in Verbindung mit Zucker zu gären.
Adolf v. Baeyer sagte, nachdem er die Publikation gelesen hatte: „Damit wird er berühmt, wenn er auch nicht für Chemie begabt ist.“
Eduard Buchner bekam für seine Entdeckungen 1907 den Nobelpreis für
Chemie.
3.1 Demonstration 1:
Öchslegrad
Chemikalien:
Fruchtsaft (möglichst durchsichtig) Geräte:
Standzylinder, Öchslewaage Aufbau:
Durchführung:
Ein Standzylinder wird mit Fruchtsaft gefüllt. Daraufhin wird eine Öchslewaage in dem Standzylinder so positioniert, dass sie frei schwimmt. Nun kann man die
°Oe an der Skala ablesen.
durchschnittliche Öchslewerte deutscher Traubenmoste:
Weinsorte Öchslegrade [in°Oe]
Kabinett 76 – 82 Spätlese 76 – 90 Auslese 83 – 100 Beerenauslese 110 – 128
Eiswein 110 – 128
Trockenbeerenauslese 150 –154
Umrechnung von Öchslegrad in vol% Alkohol:
Das Mostgewicht einer zu vergärenden Zuckerlösung (meist Fruchtsäfte) wird in Grad Öchsle ( = °Oe ) gemessen. Der Öchslewert gibt an wie viel g/l der Most im Vergleich zu Wasser mehr wiegt. Das bedeutet, dass dieser Wert mit dem spezifischen Gewicht der Lösung gleichzusetzen ist. Über den Zuckergehalt einer Lösung wird damit zunächst einmal nichts ausgesagt. Es gibt jedoch Näherungsformeln und Tabellen, mit deren Hilfe man den Alkoholgehalt errechnen kann.
c (Zucker) = Oe°/4 – 3
Aus 1,7 g Zucker werden 1 ml (= 0,794g) Ethanol gebildet
Beziehung zwischen Mostgewicht, Zuckergehalt, Alkoholgehalt Grad
Oechsle
Zucker g/l
Alkoholgehalt vol %
70 156 9,22
75 170 10,00
80 183 10,79
85 196 11,57
90 209 12,35
95 223 13,14
100 236 13,92
105 249 14,71
110 263 15,49
Refraktormeter
Tritt ein Lichtstrahl von einem optisch dichteren in ein optisch dünneres Medium oder von einem optisch dünneren in ein optisch dichteres Medium, so wird er gebrochen. Bei einem bestimmten Winkel, dem sogenannten Grenzwinkel, kann der Lichtstrahl nicht mehr in das andere Medium eintreten, sondern wird an der Übergangsfläche reflektiert. Dieser Grenzwinkel ist von dem Quotienten der Brechzahlen der beiden Medien abhängig.
Wasser hat eine Brechzahl von ca. 1,33. Ist z.B. Zucker im Wasser gelöst, so nimmt die Brechzahl linear zur Zuckerkonzentration zu. Somit kann über die Brechzahl einer Zuckerlösung deren Konzentration bestimmen werden. Da die Brechzahl sowohl von der Temperatur, als auch von der Wellenlänge des Lichtes abhängig ist, müssen diese Parameter berücksichtigt werden.
Um den Grenzwinkel zu bestimmen wird die Gleichung von Snellius verwendet, welche besagt, dass der arcsin des Quotienten der beiden Brechzahlen den Grenzwinkel ergibt.
Grenzwinkel= arcsin (n
1/n
2)
Abbe – Refraktormeter
Das Abbe-Refraktormeter besteht aus zwei Prismen, zwischen denen ein kleiner
Spalt liegt. Dieser Spalt wird mit der zu untersuchenden Flüssigkeit gefüllt. Es
wird ein Strahl senkrecht durch die beiden Prismen geschickt. Der Lichtstrahl
tritt nun in eine Röhre ein, in der sich ein Fadenkreuz befindet. Bei einem
bestimmten Auftreffwinkel auf die Flüssigkeit (hier grün) tritt Totalreflexion
auf. Die Prismen sind frei beweglich und werden so lange gedreht, bis die Hell
-Dunkelgrenze genau in der Mitte des Fadenkreuzes verläuft. An den Prismen ist
ein Zeiger befestigt. Er zeigt die Brechzahl der zu untersuchenden Flüssigkeit
an.
Herkömmliches Handrefraktormeter, wie es von Winzern oft eingesetzt wird.
Derartige Handrefraktometer haben den Vorteil, dass der Winzer direkt im
Weinberg aus dem Presssaft einer einzigen Weintraube den Öchslegrad des
Mostes und damit den Reifungsgrad der Trauben bestimmen kann.
Versuch 2:
Titrimetrische Zuckerbestimmung
Chemikalien:
Wein, CuSO
4, NaOH, Na-K-tartrat, KJ, H
2SO
4, Na
2S
2O
3, Stärke Geräte:
Becherglas, Bürette, Magnetrührer mit Rührfisch, Stativmaterial, Bunsenbrenner, Tiegelzange, Vollpipetten
Durchführung/Beobachtungen:
10 ml Wein (1:10 verdünnt), 10 ml CUSO
4– Lösung (c = 0,1 mol/l), 5 ml Na-K- tartrat-Lösung (c = 0,1 mol/l) und 2 ml NaOH – Lösung (c = 2 mol/l) werden gemischt und über dem Bunsenbrenner aufgekocht. Die Lösungen müssen mit der Vollpipette abgemessen werden!
Beim Aufkochen verfärbt sich die zunächst tiefblaue Cu
2+- Lösung rotbraun.
Nach dem Abkühlen werden 30 ml KI-Lösung (c = 0,1 mol/l) und 25 ml 25%ige H
2SO
4-Lösung hinzugegeben.
Das entstandene Jod wird nun mit einer Na
2S
2O
3– Lösung (c = 0,1 mol/l )
rücktitriert. Sobald sich die Lösung zu entfärben beginnt, wird etwas
Stärkelösung hinzugegeben und bis zum Umschlag titriert. Der Umschlagspunkt
ist etwas schwer zu erkennen, da das Cu
2+mit seiner blauen Farbe den Jod-
Stärke-Komplex überdeckt.
Reaktionsgleichungen:
Die Zuckerlösung (Wein) wird in einer alkalischen Cu
2+- Lösung aufgekocht Cu
2+(aq)+ OH
-(aq)+ H
2O + Zucker Cu
2O
(s)+ (C
1–C
3Verbindungen)
Die Reaktion verläuft NICHT stöchiometrisch!
Glucose spaltet sich in alkalischem Milieu unter Hitzeeinwirkung in zwei C
3– Reste.
Triose - Redukton
Die Oxidation findet erst später statt
Das gebildete Cu(II) oxidiert Jodid zu Jod.
2 Cu
2+(aq)+ 2 I
-(aq)+ 3H
2O Cu
2O
(s)+ I
2(aq)+ 2 H
3O
+(aq)Das primär entstehende CuI
2ist nicht stabil und disproportioniert zu CuI und I
2. Grund hierfür ist das niedrige Löslichkeitsprodukt des CuI von 10
-12mol
2/l
2.
Das gebildete I
2wird mit Thiosulfatlösung rücktitriert.
2S
2O
32-(aq)
+ I
2(aq)
-O
3S-S-S-SO
3-(aq)
+ 2I
-(aq)Auswertung:
Es wird zunächst eine Titration ohne Zugabe von Zuckerlösung (hier Wein) durchgeführt. Der Verbrauch an S
2O
32-wird notiert. Anschließend wird eine Titration mit Zuckerlösung (hier Wein) durchgeführt. Dieser Wert wird von dem zuvor ermittelten abgezogen. Der hierbei entstandenen Wert wird in der Weinanalytik (nach Dr. Rebelein) als „tatsächlich verbrauchte Menge Thiosulfatlösung“ angegeben.
Da die Fehling-Reaktion nicht stöchiometrisch verläuft, muss eine Kalibrierkurve aufgenommen werden. Es zeigte sich, dass hierbei annähernd eine Gerade entstand.
Verbrauch an Thiosulfatlösung ohne Weinzugabe - Verbrauch an Thiosulfatlösung mit Weinzugabe tatsächlicher Verbrauch an Thiosulfatlösung
Pro ml „tatsächlich verbrauchter Thiosulfatlösung“ lagen 2,4 g/l Zucker vor.
Daraus ergibt sich folgende Formel:
__________ (tatsächlicher Verbrauch Thiosulfat) x 2,4 g/l = ____________g/l
Versuch 3:
Weinbrandherstellung
Chemikalien:
700 ml Wodka mit 40 vol% Alkoholgehalt, ca. 1 l Dosenfrüchte mit eigenem Saft (z.B. Himbeeren)
Geräte:
Magnetrührer mit Rührfisch, Heizpilz, Rundkolben, Destillationsbrücke, Thermometer, Gläser zum Auffangen des Destillates, Schläuche, Stativmaterial Durchführung:
Da bei dem hier aufgeführten Versuch Lebensmittel produziert werden, dürfen nur neue Glasgeräte, die noch nie mit Chemikalien in Berührung gekommen sind, verwendet werden.
700 ml Wodka werden mit ca. 1 l Dosenfrüchte gemischt, kleingemixt und mehrere Tage ziehen gelassen. Danach wird das Gemisch in den Destillierkolben gefüllt und der Heizpilz wird angeschaltet. Bei ca. 80 °C wird der Heizpilz auf die kleinste Heizstufe geschaltet. Bei ca. 88°C beginnt das Gemisch zu sieden. Nun werden kleine Gläschen mit dem Destillat gefüllt.
Sobald ca. 20 ml aufgefangen wurden, wird ein neues Gläschen untergestellt.
Die Gläschen werden in eine Reihe gestellt und durch Kosten wird der Vor – und Nachlauf vom Edelbrand getrennt. Anschließend muss mit destilliertem Wasser auf Trinkstärke (d.h. 40 vol% Alkoholgehalt) verdünnt werden.
Ab einer Kopftemperatur von ca. 92 °C tritt im Destillat normalerweise der
unangenehme Geschmack des Nachbrandes auf. Daher muss bei Erreichen
dieser Temperatur besonders sorgfältig geprüft werden.
Auch nimmt die Alkoholkonzentration des Destillates mit steigender Kopftemperatur ab. Somit sollte der Brennvorgang auch dann abgebrochen werden, wenn kein unangenehmer Geschmack auftritt.
Der hier aufgeführte Versuch ist steuerrechtlich unbedenklich, da bereits
versteuerter Alkohol erneut destilliert wurde. Auch ist Vorlauf, Nachlauf und
Edelbrandfraktion gesundheitlich unbedenklich, da nur Lebensmittel eingesetzt
worden sind.
Hintergründe zur Brandweingewinnung:
Wann in der Menschheitsgeschichte zum ersten mal Branntwein hergestellt worden ist, ist nicht überliefert. Um 800 v.Chr. haben die Inder bereits Reisschnaps (Arrak) produziert. Auch die Chinesen kannten die Kunst des Destillierens bereits mehrere Jahrhunderte vor Christi Geburt.
Aristoteles schrieb 400 v.Chr. von dem gebrannten Wasser. Die ersten christliche Klöstern produzierten bereits hochprozentigen Alkohol, jedoch wurde er weniger zum Trinken, als vielmehr zur Herstellung verschiedener Tinkturen verwendet. Es zeigte sich nämlich, dass mit Alkohol ein viel besserer Kräuterauszug herzustellen ist, als mit Wasser oder Wein.
Erst Paracelsus gab dem gebrannten Wasser einen Namen. Er nannte es
>>Alkohol<< - das Wort entlehnt er dem Arabischen Al-Khol.
Nach dem dreißigjährigen Krieg wurde die Alkoholsteuer eingeführt und Schwarzbrennen streng bestraft.
Bis heute unterliegt die Brandweinherstellung einer hohen Steuer. In der EU ist
nur in Griechenland und Spanien die Produktion von Brandwein zum
Eigenbedarf unbegrenzt gestattet. In Österreich ist das Kesselvolumen zur
steuerfreien Eigenproduktion auf 2 l beschränkt. In Italien dürfen die privaten
Brennanlagen 5 l Kesselvolumen aufweisen. In Deutschland muss das
Kesselvolumen geringer als 1 l sein. Doch selbst damit lassen sich pro
Brennvorgang noch gut und gerne 100 ml Brandwein – steuerfrei zum
Eigenbedarf – herstellen.
Versuch 4:
Methanolnachweis
Chemikalien:
Methanol-Ethanol-Wassergemisch (1:1:1), KMnO
4– Lösung, H
3PO
4– Lösung, Na
2S
2O
3– Lösung, H
2SO
4konz., Chromatotropsäure
Geräte:
Pipetten, Reagenzglas
Durchführung:
1 ml Methanol/Ethanol/Wasser-Gemisch wird mit 1 ml phosphorsaurer KMnO
4– Lösung gemischt und 10 min. stehen gelassen. Anschließend wird so lange Na
2S
2O
3– Lösung zugetropft, bis sich die Lösung entfärbt hat. Dabei ist darauf zu achten, dass Thiosulfat nicht im Überschuss zugesetzt wird, da sonst Schwefel ausfällt.
Zu der farblosen Lösung wird nun ca. das 3 bis 4fache Volumen konzentrierter H
2SO
4zugegeben. Anschließend wird eine Spatelspitze Chromatotropsäure hinzugegeben. Sofort tritt eine tiefviolette Färbung auf.
Reaktionsgleichungen:
Das Methanol –Ethanol –Wassergemisch wird mit MnO
4-oxidiert. Dabei
entsteht zunächst sowohl Formaldehyd als auch Acetaldehyd. Es besteht die
Möglichkeit, dass der Formaldehyd weiter zu Ameisensäure oxidiert wird. Der
Acetaldehyd kann weiter zur Essigsäure oxidiert werden.
Das Verbleiben des Formaldehyds in der Lösung wird dadurch gewährleistet, dass unter Säurekatalyse drei Moleküle Formaldehyd zu einem Molekül Trioxan reagieren. Während Formaldehyd einen Siedepunkt von –19°C hat, siedet Trioxan erst bei 115°C. Auch ist der Formaldehyd so vor der Weiteroxidation geschützt.
Überschüssiges MnO
4-wird mit S
2O
3-- Lösung entfernt
4 MnO
4-(aq)
+ 5 S
2O
3-(aq)
+ 57 H
2O 4 Mn
2+(aq)+ 10 SO
42-(aq)
+ 38 H
3O
+(aq)Zwei Chromatotropsäuremoleküle reagieren mit Formaldehyd
Durch Oxidation wird ein 20 e
-umfassendes - Elektronensystem
gebildet
Methanol im Brandwein:
Befindet sich in einem Brandwein Methanol, so liegt das zumeist daran, dass in der Gärlösung Pektin vorhanden war. Pektin kommt in pflanzlichen Zellen entweder gelöst im Zellsaft oder in der Mittellamelle vor. Es besteht aus einer Kette von 1,4--glykosidisch verbundenen Galacturonsäure- Einheiten, deren Carboxylgruppen mit Methanol verestert sind.
Durch die in Hefezellen vorhandene Pektinesterase wird die Spaltung zwischen Carboxy- und Methyl-Gruppe bewirkt. Dadurch kann bei der Gärung eine hohe Methanolkonzentration auftreten.
Da Methanol deutlich früher siedet als Ethanol wird Methanol im Destillat
nochmals angereichert.
Demonstration 2:
Vinometer
Versuchsbeschreibung:
Das Vinometer wird auf den Kopf gestellt und mit Wein gefüllt. Sobald der Wein unten herauszutropfen beginnt, wird das Vinometer umgedreht und auf ein Stück saugfähiges Papier gestellt. Daraufhin beginnt der Wein die Kapillare herunter zu laufen. Sobald er in der Kapillare zum Stillstand gekommen ist, kann der Alkoholgehalt des Weines an der Skala abgelesen werden.
Die Funktionsweise beruht darauf, dass Alkohol im Vergleich zu Wasser
geringere Kapillarkräfte aufweist. Somit kommt eine Flüssigkeit mit einer
höheren Alkoholkonzentration später in der Kapillare zu stehen als eine mit
einer geringeren Alkoholkonzentration.
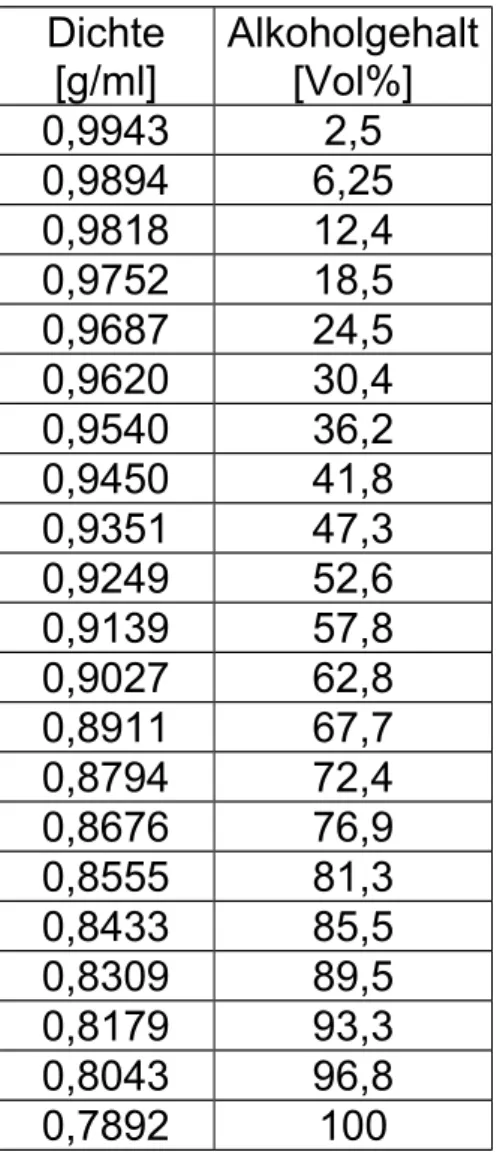
Demonstration 3:
Alkoholgehalt über das spezifische Gewicht
Versuchsablauf:
Mit steigendem Alkoholgehalt nimmt das spezifische Gewicht eines Wasser – Ethanolgemisches ab. Somit kann mit einer frei schwimmenden Spindel, ähnlich wie in Demonstration 1, der Alkoholgehalt einer Wasser-Alkoholmischung bestimmet werden. Jedoch kann dieses Verfahren nur angewendet werden, wenn keine weiteren Stoffe in der Lösung sind.
Beim Mischen von Ethanol mit Wasser tritt eine Volumenkontraktion ein. Daher muss der Alkoholgehalt bei bekannter Dichte der Flüssigkeit aus einer Tabelle entnommen werden.
Tabelle zur Bestimmung der Alkoholkonzentration:
Dichte [g/ml]
Alkoholgehalt [Vol%]
0,9943 2,5
0,9894 6,25 0,9818 12,4 0,9752 18,5 0,9687 24,5 0,9620 30,4 0,9540 36,2 0,9450 41,8 0,9351 47,3 0,9249 52,6 0,9139 57,8 0,9027 62,8 0,8911 67,7 0,8794 72,4 0,8676 76,9 0,8555 81,3 0,8433 85,5 0,8309 89,5 0,8179 93,3 0,8043 96,8
0,7892 100
Versuch 5:
Alkoholgehalt titrimetrisch
Chemikalien:
Weindestillat, K
2Cr
2O
3– Lösung (c = 0,1 mol/l), HNO
3, KI – Lösung ( c = 0,1 mol/l), Na
2S
2O
3– Lösung ( c = 0,5 mol/l), Stärkelösung
Geräte:
Magnetrührer mit Rührfisch, 500 ml Becherglas, Bürette, Stativmaterial Durchführung:
Zuerst wird ein Weindestillat hergestellt. Dazu werden 100 ml Wein so lange destilliert, bis ca. 80 ml übergetreten sind. Das Destillat wird darauf auf 100 ml aufgefüllt.
20 ml K
2Cr
2O
7-Lösung, 10 ml HNO
3konz. und 2 ml Weindestillat werden gemischt und bei Zimmertemperatur genau 2 Minuten reagieren gelassen.
Daraufhin werden 60 ml KI – Lösung zugegeben und die Lösung auf 450 ml mit destilliertem Wasser aufgefüllt.
Nun wird mit Na
2S
2O
3– Lösung bis zum Umschlag titriert. Kurz vor Erreichen des Umschlagspunktes wird etwas Stärkelösung zugegeben. Der Umschlagspunkt ist sehr schwer zu erkennen, da die Cr
3+- Lösung eine blaugrüne Farbe hat.
Reaktionsgleichungen:
Oxidation mit Dichromat:
2 Cr
2O
72-(aq)
+ 3 CH
3CH
2OH
(aq)+ 16 H
+(aq) 4 Cr
3+(aq)+ 3 CH
3COOH
(aq)+ 11 H
2O
Überschüssiges Dichromat oxidiert Jodid zu Jod:
Cr
2O
72-(aq)
+ 6 I
-(aq)+ 14 H
3O
+(aq) 2 Cr
3+(aq)+ 3 I
2(aq)+ 21 H
2O
Das gebildete I
2wird mit Thiosulfatlösung rücktitriert. Dabei entsteht Tetrathionat:
2S
2O
32-(aq)
+ I
2(aq)
-O
3S-S-S-SO
3-(aq)
+ 2I
-(aq)Der primäre Schritt der Ethanoloxidation mit Dichromat verläuft über den Chromsäureethylester:
Unter Protonenabspaltung wird Ethanol zu Achtaldehyd oxidiert während Cr(VI) zu Cr(IV) reduziert wird:
Cr(IV) – Verbindungen sind in wässriger Lösung instabil und disproportionieren
zu Cr(VI) und Cr(III). Cr(VI) kann nun weiteres Ethanol zu Acetaldehyd
oxidieren bzw. Acetaldehyd zu Essigsäure weiteroxidieren.
Auswertung:
Die Reaktion von Ethanol mit Dichromat verläuft nicht stöchiometrisch. Zum einen kann der leichtflüchtige Acetaldehyd (Sdp. 21°C) verdampfen, bevor er weiteroxidiert wird. Zum anderen kann bereits vorhandene Essigsäure mit dem noch verbleibenden Ethanol zu Essigsäureethylester reagieren.
Daher muss eine Kalibrierkurve aufgenommen werden. Es zeigt sich, dass die Kurve annähernd eine Gerade ergibt.
Dieses Verfahren ist relativ ungenau und findet in der Weinanalytik kaum noch Verwendung. Genauere Werte erreicht man mit dem Gaschromatographen.
Rechnung:
100 – (_____________ [Verbr. ml Thiosulfatlösung] x 1,15) =
___________ g/l Alkohol
Umrechnung g/l in Vol% ( Volumenkontraktion wurde nicht berücksichtigt )
_______________ [g/l] X 0,125 = ____________ Vol%
Versuch 6:
Reduktoren im Wein (amperometrisch):
Chemikalien:
Wein, H
2SO
4(25 %ig), KIO
3, KI Geräte:
Magnetrührer mit Rührfisch, Becherglas, Bürette, 2 Platinelektroden, Krokodilklemmen, Messinstrument (0,3 mA), Netzteil, Stativmaterial Aufbau:
Durchführung:
20 ml Wein werden mit 10 ml H
2SO
4– Lösung (25 %ig) in einem Becherglas gemischt. In dem Becherglas werden zwei Platinelektroden befestigt.
Platinelektroden, Messgerät und Spannungsquelle werden wie oben aufgeführt verbunden. Das Messgerät wird auf die Empfindlichkeit 0 – 0,3 mA eingestellt.
Nun wird mit einer KI/KIO
3– Lösung titriert. Die Lösung wird hergestellt, indem man 0,1 mol KIO
3mit 3 mol KI (deutlicher Überschuss!!!!) mischt und dies in 1 M NaOH löst. Anschließend wird die Lösung auf 1 l aufgefüllt.
Wird nun langsam die Thiosulfatlösung in das Titriergemisch getropft, so nimmt der Stromfluss mehr und mehr ab. Irgendwann steigt der Stromfluss rapide an.
Der Wendepunkt der Kurve ist der Äquivalentspunkt.
Reaktionsgleichungen:
Zur Titration wird eine IO
3-- I
-- Lösung verwendet:
IO
3-(aq)
+ 5 I
-(aq)+ 6 H
3O
+(aq) 3 I
2(aq)+ 9 H
2O Eine der vielen möglichen Redoxreaktionen:
HSO
3-(aq)
+ I
2(aq)+ 4H
2O SO
42-(aq)
+ 3 H
3O
+(aq)+ 2I
-(aq)Auswertung:
Da nicht bekannt ist, welche Reduktoren vorliegen, wird in der Weinanalytik von H
2SO
3-Äquivalenten gesprochen. Es wird also errechnet, wie viel SO
32-zu SO
42-durch das zugelaufene Jod oxidiert werden könnte.
In der Iodlösung befinden sich 0,025 mol/l I
2. Demzufolge werden mit jedem ml Iodlösung 0,025mmol SO
32-zu SO
42-oxidiert. Das entspricht 2,05 mg H
2SO
3(H
2SO
3: 82 g/mol) pro ml verbrauchter I
-/IO
3-- Lösung.
___________Verbrauch Jodlösung X 2,05mg = ___________mg/l (H
2SO
3)
Bei den Reduktoren handelt es sich u.a. um SO
2(ungebunden), Ascorbinsäure
und Sorbinsäure. Für den Winzer sind die Reduktoren von Bedeutung, um
abzuschätzen wie oxidationsbeständig ein Wein ist. Auch wird diese Methode
verwendet, um den Schwefeldioxidgehalt im Wein zu bestimmen.
Die Dead-Stop-Titration:
Das hier angewande Verfahren zur Bestimmung des Endpunktes einer Titration nennt man Dead-Stop-Methode. Es beruht darauf, dass viele Reaktionen reversibel sind. Liegen solche konkurrierenden Ionen in einer Lösung vor, so ist die Lösung besonders leitfähig.
Beispiel:
I
2(aq)+ 2 S
2O
32-(aq)
2 I
-(aq)+ S
4O
62- (aq)2 S
2O
32-(aq)
S
4O
62-(aq)