Praktikum zur Organischen Chemie für Studierende des Lehramts WS 2010/11
Volltext
Abbildung

ÄHNLICHE DOKUMENTE
Der Versuch lässt sich somit gut in den Lehrplan einordnen und besitzt zudem einen sehr guten Alltagsbezug, da er zur Erklärung der Verschiedenfarbigkeit vieler Pflanzen (bzw.
Der zugeführte Harnstoff löst sich relativ rasch in der Formaldehydlösung und es wird eine hell-gelbe Lösung erhalten (Abb.. Nach der Zugabe von Seife und
Der klare Kunststoff kann durch Einmischen eines Farbstoffs (im Versuch Methylenblau - siehe Abb. 3: 3) zudem relativ einfach gefärbt werden, was insbesondere für
Diese können bei Zimmertemperatur leicht durch Einwirkung einer Kraft gedehnt werden und nehmen, sobald die Kraft nicht mehr einwirkt, schlagartig ihre
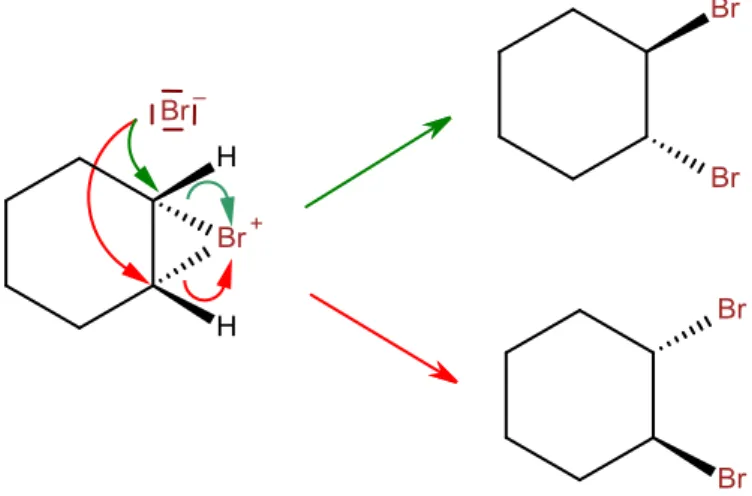
Werden nun die Informationen aus beiden Nachweisen zusammengezogen, wird deutlich, dass Bromwasserstoff entstanden sein muss, welches, sobald es in Lösung geht,
In der Vergangenheit wurde Ethin neben Chloroform als Narkosemittel verwendet, heute wird es jedoch aufgrund seiner Nebenwirkungen und seiner Explosionsfähigkeit nicht mehr
8: Mesomeriestabilisierung des tri-p-Tolylmethylradikals (über alle drei Tolylringe möglich). Wird nun Ethanol zugeführt, muss das Radikal zerstört werden, da die gelbe
Die Nitrierung von Toluol braucht auch ein gewisses Maß an Zeit, da die Nitriersäure nicht zu schnell zugeführt werden darf, da das Substrat sonst überhitzt. Auch die