Lab.med. 13:14-19(1989)
Gesamtproteinbestimmung im Urin:
Adaptierung einer nephelometrischen Methode zur Erfassung typischer Leitproteine
und Bence-Jones-Proteine
F. Boege, A. Luther1
Hauptlabor, Medizinische Poliklinik der Universität Würzburg
Zusammenfassung: , Die Adaptierung einer nephelometrischen Gesamtproteinbestimmung an den Behring-Nephelometer-Analy- ' zer (BNA) wird vorgestellt. Durch Messungen von humanen Reinproteinen, die in sa/inen Lösungen in '·
definierter Konzentration vorliegen, wird die Sensitivität dieser Methode für urintypische Leitproteine und Bence-Jones-Proteine untersucht und mit dem geräteüblichen Verfahren sowie zwei Proteinnachweis- · methoden mittels kommerzieller Teststreifensysteme verglichen. Präzision und Richtigkeit werden in Ver- dünnungsreihen eines kommerziellen Kontrollserums ermittelt \ Schlüsselworte: !
— _ -|
Gesamtprotein — Leitproteine — .Nephelometrie — Teststreifen i
Summary:
Adaption ofa nephelometric method for total protein determination in urine to the Behring-Nephelometer- Analyzer (BNA) is described. The sensitivity ofthis method for typical urin markerproteins and Bence-Jones proteins is evaluated using sä l ine Solutions with defined concentrations of pure human proteins äs a test System and by comparing it with an established nephelometric method and with two commercially available test-strip-systems. Analysis ofprecision and validity is carried out using dilutions ofa commercially available control serum preparation.
Keywords:
Urin total protein — marker proteins — nephelometry — ürin test Strips
Einleitung
Die Proteinurie ist Leitsymptom vieler Nierenerkrankun- 3. daß alle (im Urin auftretenden) Proteinspezies zuver- gen. Aufgrund verschiedener Pathomechanismen, die zu lässig quantitativ erfaßt werden,
einer vermehrten Proteinausscheidung im Urin führen (1f ,, ,. -,· , . , · _,· , , 2), variieren sowohl Zusammensetzung als auch Konzen- Unter dieser Zielsetzung erschien uns die nephelometn- tration der ausgeschiedenen Proteinspezies. Die Bestim- ^e Bestimmung der mit Trich oress,gsaure(TCA)-ge- mung der Urinproteinausscheidung ist von großer klini- ™te" * "*/, f ^ Aussichtsreichste Verfahren (5, sehe? Bedeutung, stellt aber ein seit Jahren ungeklärtes 17): Fu/ dfse, Meßmethode stehen mittlerweile vollauto-
Problem dar (3-17). Für die quantitative Bestimmung matische Analysensysteme, wie z. B. der Behrmg-Nephe- wurden u.a. colorimetrische (16, 18, 19), turbidimetri lometer-Analyzer (BNA) zur Verfugung. Ausgehend von sehe (3, 20, 21) und nephelometrische (5,17) Meßver- einem von der Herstellerfirma (Behringwerke AG Mar- fahren vorgeschlagen, die jedoch sämtlich für den Routi- burg) fu;dlesen Analyseautomaten empfohlenen Verfah- neeinsatz zu zeit- und personalaufwendig sind ren 2ur Gesamtproteinbestimmung im L.quor wurde von uns eine entsprechende Methode zur Gesamtprotembe- Idealerweise ist von einer Gesamtproteinbestimmung im Stimmung im Urin adaptiert und mit dem o.g. Verfahren Urin zu fordern. und zwei handelsüblichen trockenchemischen Methoden 1. daß sie kostengünstig, schnell und mechanisierbar ist verglichen Als Testsystem dienten Verdünnungsreihen humaner, für die Urindiagnostik relevanter, Reinproteine, 2. daß sie ausreichend empfindlich ist, um pathologische die durch immunnephelometrische oder radioimmunche- von physiologischer Urinproteinausscheidung zu trennen mische Referenzmessungen kontrolliert wurden.
und
1 Diese Untersuchungen sind Teil einer Dissertation, die A. L. an der medizinischen Fakultät der Julius-Maximilians-Universität, Würzburg, eingereicht hat.
14 Lab.med. 13:14(1989)
> i r, · " '.:.' : ,'" >..·' · ·*"" "T" ·. ?"^~:'."Λ—""'"" ^ ,". *"*"/'; '".-.'Γ*·'"'·'·' •V.V/^™'.·4 ""^, -'«'"'"".."J^ 'ν"' '· '%"*:·*". ""^ -t:"'?"":"
••-•- ; i Γ ; ·;·;· S: .^;4l^
.'· .· · . - • " : ^ · .7 *** . .;··...· *"7 .*• · ... ..· " * ·. .-.-v ·· . .·; ..· ' . , · · . · · . . ·.. · · · · : · · . "*; s,* ·· '· ·'··.·.' ' , ;:j.rt?v'*vv*"· ·.'-' :.. τ.,'\"*-r^-^C^?··''^'''*'.. .' :^r·"'*- ^; " v y ·:.··.,., ··.*;, ··- < · . · · · ; . . · : " . y · . ^ / ; · . ^t?i.:7'''^'sT*.X' v "··.''' - ;-'!: · ··*···,· --'.'.'V·'
.:,- .·. .:-v -·'·'*;.. /'*..'·.·. ·;^-
:Η" \\':<'.· :".-,:,•^•^.^'.··; ^ .·;;
;:;v'-.^·
;••y./y·^:'K^:v^.f"
;>.i
,TM^rHTh^(^ggjj|g^ : j;^^
^©%Α^
>;% % ;^<SV''
Yi
;i'>fiifl^lT$i^^
l -: •^,^·,-:^·
• . ·· '..A .*""«'·· .Λ." ·.::' '···· > ..-. <tfe^»N^JiffNliwflyiiiil<f)w·^ · .····""·· ·..··. .,*.
:, έΐ^ ·
f y.CilpSi^^
·«; -i. v:NtedeHissung Deutschbnd Fekibehnstr. 4 A [>20ΚΟυοώθΓηTel!O^106^1061 "Tetex2;i80668kboe"d,~'··>ϊ':. ·.·?.('# ..:;
." '". .;·':"·: - · •":
^
Komplettpreism 80IDM Bestellungen an:
Verlag Kirchheim + Co GmbH Postfach 2524,6500 Mainz
Reproduzierbarkeit ist das Wichtigste.
Deshalb BAKERBOND SPE.
Jetzt können Sie sogar blind darauf vertrauen. Mit BAKERBOND SPE-Säulen werden Ihre Proben immer reproduzierbar vorbereitet. Diese sind mit analy- tischen Festphasen gefüllt. Der Beweis der von Charge zu Charge gleich- mäßigen Qualität ist ein umfangreiches Analysenzertifikat. Es liegt jeder Packung bei.
Ausgewähltes Silicagel, ausgereifte Bindungsverfahren, Chargen bis zu 160 kg und strikte Kontrollen, vom Rohstoff bis zur gefüllten Säule, sind die Basis dieser Garantie. Fordern Sie die Informationsschrift an.
BakerChemikalientPostfach1661,6080Groß-Gerau,Telefon(06152)710378
öJfflIJSS
vereinigt mit feg MedizinischeLaboratorium
°^^-
mAJiki? Offizielles Organ der Deutschen Gesellsd s!WII§) medizm e.V.
"II M l Offizielles Organ des Berufsverbandes De
|\ \| Offizielles Organ der Österreichischen Ge M l\ l ^r Laboratoriumsmedizin
Offizielles Organ des Institutes für Stande mentation im medizinischen Laboratoriurr
cr***>
Bitte senden Sie mir ab sofort 2 Ausgaben von LABORATORIUMSMEDIZIN, verei- nigt mit „Das Medizinische Laboratorium", für mich kostenlos zur Probe.
Gebe ich Ihnen 10 Tage nach Erhalt des zweiten Heftes keine gegenteilige Nach- richt bin ich mit der regelmäßigen Weiterbelieferung bis auf Widerruf einverstan- den. Ich zahle dann den Abonnentenpreis von 11,- DM pro Ausgabe = 121,- DM im Jahr.
Ich nehme Ihr Angebot an und möchte die Probehefte an folgende Anschrift erhal- ten:
Name:
Straße:
PLZ: Ort:
Datum: Unterschrift:
Sie garantieren mir, daß ich berechtigt bin, diese Vereinbarung schriftlich inner- halb emer Woche durch Mitteilung an den Verlag Kirchheim, Kaiserstraße 41, 6500 Mainz 1, zu widerrufen. Zur Wahrung der Frist genügt die rechtzeitiqe Absendunq des Widerrufs.
Datum und Unterschrift Lab. med. 1/89
iaft für Laboratoriums- ^v ®>
utscher Laborärzte e.V. ^X©v^S^«l>
Seilschaft >Sby!/^ ^®*
rdisierung und Doku- >^OT l e.V. (INSTAND e.V.) \T I Wir laden Sie ein, diese Fachzeit- | schrift für 2 Ausgaben kostenlos kennenzulernen.
Ein Jahresabonnement kostet 121,- DM.
Wir garantieren Ihnen, daß Sie be- rechtigt sind, diese Vereinbarung schriftlich innerhalb einer Woche durch Mitteilung an den Verlag Kirchheim, Kaiserstraße 41, 6500 Mainz 1, zu widerrufen. Zur Wah- rung der Frist genügt die rechtzei- tige Absendung des Widerrufs.
VERLAG
KIRCHHEIM
MAINZ Postfach 25 24 6500 Mainz 1
Sie erhalten umgehend Ihr erstes Heft.
VIII
Materialien und Methoden
7. Gesamtprotein nephelometrisch, Endpunktmethode Es wurden zwei getrennte Testschemata am BNA (Beh- ringwerke AG, Marburg) erstellt die im folgenden TP1 und TP2 genannt seien (Gerätespezifikation siehe Tab. 1).
Sie unterscheiden sich in der eingesetzten Probenmenge und dadurch in der Prpbenvorverdünnung bei identi- schem Meßansatz: Proteinfällung durch 2% TCA, End- punktbestimmung der Streulichtintensität nach 12min.
Durch TP1 wird ein unterer Meßbereich von 30- 925 mg/l und von TP2 daran anschließend ein oberer Meßbereich bis 7400 mg/l erfaßt. Durch simultanen Ein- satz beider Tests wird (unter Berücksichtigung eines in automatisch durchgeführten Nachmessungen miterfaß- ten oberen Sicherheitsbereiches) insgesamt ein Meßbe- reich von 30 bis ca. 28000 mg/l abgedeckt. Als Protein- fällungsmittel (Reagenz 1, Tab.1) dient eine wäßrige 15%ige (Gewicht/Volumen) Lösung von Trichloressig- säure (TCA, p. a., Merck AG, Darmstadt), die täglich frisch aus einer 100%igen Stammlösung herunterverdünnt wurde. Die Stammlösung war bei 4°C im Dunkeln bis zu 3 Wochen stabil. Um während der langen Meßzeit die Sedimentation der Proteinpräzipitate zu verlangsamen, wird als Zusatzreagenz (Reagenz 2, Tab.1) 30%iges Gly- cerin (1 Vol. 90% Glycerin, p.a., Merck AG, Darmstadt + 2 Vol. N-Diluens, Behringwerke AG, Marburg) zugesetzt.
Zur Kalibration dient N/T-Standard-Serum (Behring- werke AG, Marburg). Die Kalibration war wie die TCA- Stammlösung ca. 3 Wochen stabil.
2. Gesamtprotein nephelometrisch, fixed-time-Methode Das vom Hersteller empfohlene und bereits im Gerät unter der Bezeichnung Test-Nr.69: Total Protein CSF (TPC) implementierte Verfahren wurde mit denselben Reagen- zien wie in 1. verwendet.
3. Gesamtprotein trockenchemisch
Es wurden zwei gängige semiquantitative Teststreifenme- thoden getestet: Total Screen L (Behringwerke AG, Mar- burg) wurde mit dem darauf abgestimmten Auswertege- rät Rapimat l l/T (Behringwerke AG, Marburg) in der vom Werk vorgegebenen Standardeinstellung und Combur 9 (Boehringer GmbH, Mannheim) durch Vergleich mit der auf der Verpackung abgedruckten Farbskala ausgewertet.
4. Vergleichsmethoden
Albumin, Transferrin, sowie an intakte Immunglobuline gebundene und freie Immunglobulinleichtketten wurden immunnephelometrisch am BNA bestimmt. Hierbei fan- den die implementierten Testschemata sowie Reagenzien und Standards des Herstellers· Verwendung. ß2-Mikro- globulin wurde radioimmunologisch (Pharmacia, Frei- burg) bestimmt.
5. Humane Reinproteine
Albumin und Transferrin wurden von den Behringwerken AG, Marburg, ß2-Mikroglobulin von der Firma Janssen, Belgien, bezogen. Freie Immunglobulinleichtketten wur- den aus den Urinen von jeweils 8 Patienten mit Bence- Jones-Proteinurie vom Typ oder präpariert, wie be- schrieben (22): Patientenurine mit einem Gesamtpro- teingehalt von ca. 10- 30 g/I wurden über Nacht bei 4°C gegen phosphatgepufferte physiologische NaCI-Lösung dialysiert. Niedermolekulare Proteine wurden durch Ul-
Tab. 1: Geräteparameter TP1
Proben-Vol. [ ] Reagenz 1 Vol. [ ] Reagenz 2 Vol. [ ] Puffer Vol. (1) [ |]
Puffer Vol. (2) [ |]
Meßzeit [min]
Standard-Serum Anzahl der Meßpunkte Erste Verdünnung Erlaubte Abweichung [%]
Gültigkeit [Tage]
Konzentrationseinheit Meßbereich [mg/l]
Untere Grenze Obere Grenze
70
4070
5020
12
1:806 285 mg/l
ca. 30 925
Proben -Verd. 1 :1 Minimale Verd. 1 :1 15% TCA- Lösung 30% Glycerin N-Diluens Endpunkt N/T-Standard- Serum
TP2
Proben-Vol. [ |]
Reagenz 1 Vol. [ ] Reagenz 2 Vol. [ ] Puffer Vol. (1) [ ] Puffer Vol. (2) [ ] Meßzeit [min]
Standard-Serum Anzahl der Meßpunkte Erste Verdünnung Erlaubte Abweichung [%]
Gültigkeit [Tage]
Konzentrationseinheit Meßbereich [mg/l]
Untere Grenze Obere Grenze
10
4070
10030
12
1:104 285 mg/l
7400925
Probe n -Verd. 1 :1 Minimale Verd. 1 :1 15% TCA- Lösung 30% Glycerin N-Diluens Endpunkt N/T-Standard- Serum
trafiltration in einer Amicon Ultrafiltration Unit „50 kD Cut-Off" (Grace and Co., USA) abfiltriert. Proben des Ultrafiltrats wurden auf reduzierenden (10% ß-Mercap- toethanol) SDS-Polyacrylamid-Gelen analysiert und stellten sich in der Silberfärbung jeweils als eine einzige Proteinbande dar. Die nephelometrische Analyse ergab Kontamination durch-.oh-Mikroglobulin < 10%, Albumin
< 5%, ß2-Mikroglobulin, Transferrin und IgG < 1%.
Verdünnungsreihen der Reinproteine (Albumin 41 — 11100 mg/l, Transferrin 52-"10800 mg/l, ß2-Mikroglo- bulin21-1160mg/l, IgL 54-28100 mg/l, IgL 59- 14830 mg/l) wurden mit N-Diluens (Behringwerke AG, Marburg) angelegt.
6. Auswertung
Die Ergebnisse der beiden nephelometrischen Gesamt- proteinbestimmungen wurden mit den jeweiligen pro- teinspezifischen Referenzmessungen durch Regressions- analyse verglichen: Es wurden lineare, potentielle, expo- tentielle .und logarithmische Regressionsmodelle gete- stet. Die Kurvenanpassung erfolgte nach der Methode der Minimierung der kleinsten Fehlerquadrate. Die Güte der Kurvenanpassung wurde durch den Determinationskoef- Lab.med.13:15(1989) 15
fizienten bzw. bei linearen Regressionen durch den Punkt-Moment·Korrelationskoeffizienten R bestimmt.
Das statistisch beste Anpassungsmodell wurde jeweils durch den F-Test ausgewählt (Regressionsgleichungen in den Abb. 1 A-E enthalten). Zur Ermittlung der Präzi- sion und Richtigkeit der neuen Methode wurden in Ver- dünnungen (N-Diluens) von N/T-Protein-Kontrollserum (Behringwerke AG, Marburg) der Variationskoeffizient von Bestimmungen in Serie und von Tag zu Tag ermittelt.
Ergebnjsse
1. Nephelometrische quantitative Gesamtproteinbestimmungen
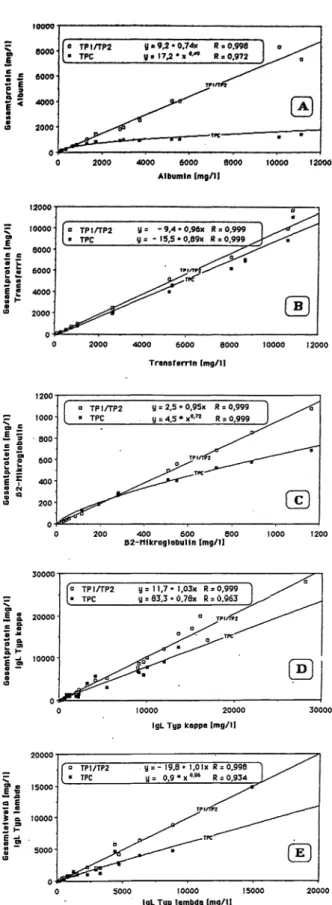
Abb. 1 A - E korreliert die Ergebnisse der quantitativen ne- phelometrischen Gesamtproteinbestimmung reiner Pro- teine (in saliner Lösung) mit der immunnephelometrisch bzw. radioimmunchemisch kontrollierten „wahren" Kon- zentration des jeweiligen Humanproteins. In jedem Dia- gramm sind nephelometrische Gesamtproteinbestim- mung nach der Endpunktmethode (TP1/TP2) und nach dem fixed-time-Verfahren (TPC) vergleichend darge- stellt. Untersucht wurden 5 Proteinspezies, die im Urin bei verschiedenen pathologischen Situationen vermehrt auftreten: Albumin (Abb.1 A), Transferrin (Abb.1 B), ß2- Mikroglobulin (Abb.lC) und Bence-Jones-Proteine (Abb.lD, E).
TP1/TP2: Die mit der Endpunktmethode gewonnenen Gesamtproteinwerte korrelieren für alle 5 untersuchten Proteinspezies gut mit den immunologisch verifizierten Konzentrationen. Eine lineare Regression der Daten führt in allen 5 Fällen zu sehr guten Punkt-Moment-Korrela- tionskoeffizienten (R > 0,998). Die Steigungen der Re- gressionsgleichungen liegen nahe dem Wert 1 (0,95 < a
< 1,03) mit Ausnahme von Albumin (a = 0,74). Die y-Achsenschnittpunkte liegen in guter Näherung des Ur- sprunges.
TPC: Mit der fixed-time-Methode fanden wir nur für Transferrin und Immunglobulinleichtketten vom Typ zwischen immunnephelometrischer Messung und Ge- samtproteinbestimmung lineare Zusammenhänge mit akzeptablen Punkt- Moment- Korrelationskoeffizienten (R = 0,999 bzw. 0,963). Die Steigungen der Regres- sionsgeraden (a = 0,89 bzw. 0,78) sind jedoch ungünsti- ger als bei TP1/TP2 und es finden sich erhebliche y-Achsenabschnitte (-15,5 bzw. 83,3). Für die übrigen Proteine fanden wir mit nicht-linearen Regressionsmo- dellen signifikant (p < 0,001) bessere Korrelationen als mit linearen. Dies war für Albumin besonders ausgeprägt.
Tab.2 zeigt eine beurteilende Übersicht:
Von TP1/TP2 werden mit Ausnahme von Albumin alle getesteten Proteine mit guter Wiederfindungsrate (95- 103%) und in einem großen Meßbereich linear erfaßt.
Albumin wird nur zu 74% (s. Tab.2) erfaßt, jedoch ist auch hier die Erfassung über den gesamten Meßbereich linear. Wir nehmen an, daß eine schlechtere TCA-Präzipi- tierbarkeit von Albumin die Ursache für die geringe Emp- findlichkeit der Methode gegenüber diesem Protein ist.
Die Nachweisgrenzen liegen zwischen 20 und 50 mg/l, die größten vom Gerät automatisch erfaßten Konzentra- tionen zwischen 11 und 28 g/l (für ß2-Mikroglobulin nur bis zu 1,2 g/l untersucht). Bei 2fach höheren Konzentra- tionen des jeweiligen Proteins traten falsch-negative Re- sultate auf (für ß2-Mikroglobulin nicht untersucht). Ob diese Meßbereichsobergrenzen eine ausreichende Si- cherheit bei der Erfassung sämtlicher Proteinurien z. B. im
9,2 * 0.74x R = 0.998 17,2 · ·** R s 0,972
2000 4000 6000 8000 10000 12000 Albumin (mg/U
2000 4000 6000 8000 10000 12000 Tronsferrtn (mg/11
1200
^ 1000 ä | -800
l
? 4oo w
o 200- 0
200 400 600 800
ß2-Mikroglobulin [mg/1] 1000 1200
o TPI/TP2 y = 11,7 * 1,03x R s 0,999
• TPC y = 83.3 * 0.78x = 0.963
10000 20000 IgL Typ keppa [mg/1]
- 19.8+ J.01X R = 0,998 y = 0.9 »x°·96 R = 0.934
0 5000 10000 15000 20000 j IgLTyp lombda Img/lJ ·
Abb. 1: Vergleich von quantitativen nephelometrischen Gesamt- \ Proteinbestimmungen nach der Endpunktmethode TP1/TP2 ( ) \ und nach der fixed- time-Methode TPC (U ) mit immunnephelo- i metrisch (A, B, D, E) oder radioimmunchemisch (C) kontrollier- ten Konzentrationen humaner Reinproteine in saliner Lösung. Es wurden folgende Proteine getestet: Albumin (A), Transferrin (B), ß2-Mikroglobulin (C), Immunglobulinleichtketten Typ (D) und
Typ*. (E) 16 Lab.med. 13:16 (1989)
Tab. 2: Erfassungsbereiche/Nachweisgrenzen und Wiederfin- dungsraten
Erfassungsbereich [mg/1] Wiederfindungs- rate [%]
TP1/TP2 TPC TP1/TP2 TPC
Albumin 20-11000 100-11000 74 n. l.
Trans-
ferrin 30-11000 300-11000 96 89 Ig L 50-28000 250-28000 103 78 IgLX 50-15000 350-15000 101 n.l.
ß2-Mikro-
globulin 20-> 1200 100-> 1200 95 n.l.
n.l.: nicht linear.
Rahmen eines nephrotischen Syndröms bieten, können wir anhand des von uns betreuten Patientenkollektivs nicht validisieren. Bence-Jones-Proteinurien wurden bis 28 g/l zuverlässig erfaßt.
TPC ist für die quantitative Bestimmung von Albumin, ß2-Mikroglobulin und Bence-Jones-Proteine vom Typ ungeeignet, da kein linearer Zusammenhang zwischen tatsächlicher und gemessener Konzentration besteht und beide Größen im Bereich > 600 mg/l erheblich divergie- ren. Transferrin und Immunglobulinleichtketten vom Typ werden mit Wiederfindungsraten von 89 bzw. 78% li- near erfaßt. Die Nachweisgrenzen liegen bei 300 bzw.
250 mg/l, die größte noch ohne Vorverdünnung erfaß- bare Konzentration bei 11 bzw. 28 g/l.
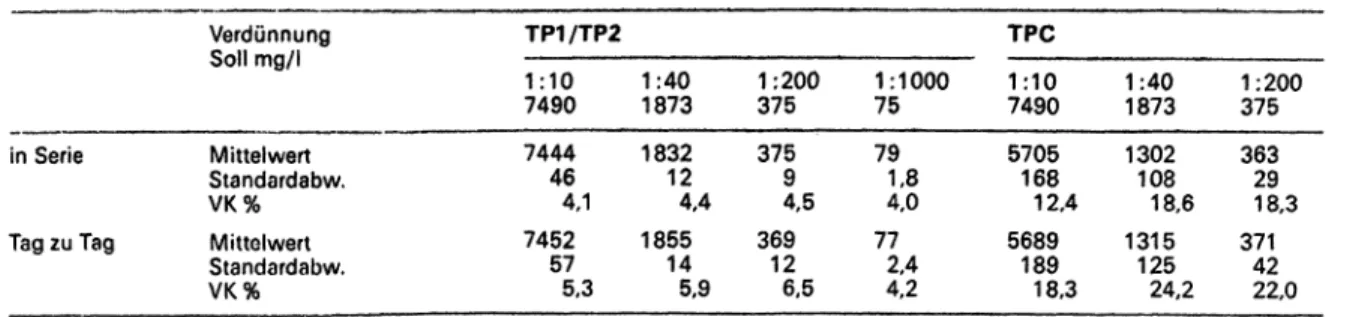
Untersuchungen von Präzision und Richtigkeit beider Methoden wurden in Verdünnungen (N-Diluens) von N/
T-Protein-Kontrollserum (Behringwerke AG, Marburg) durchgeführt. Die Ergebnisse sind in Tab.3 dargestellt.
2. Semiquantitative Gesamtproteinbestimmung mit Teststreifen
Abb. 2A—E vergleicht Gesamtproteinwerte, die mit zwei handelsüblichen Teststreifensystemen (Com.bur 9 und Total Screen L) in saunen Verdünnungen humaner, für die Urindiagnostik relevanter Reinproteine erhoben wurden, mit den immunnephelometrischen bzw. radioimmunche- mischen Referenzwerten. Für die mittel- bis hochmoleku- laren Proteine Albumin (Abb.2A) und Transferrin (Abb.2B) entsprechen .bei beiden Systemen die ange- zeigten Konzentrationsstufen größenordnungsmäßig den tatsächlichen Konzentrationen. Die Nachweisgrenzen liegen für Albumin bei 130 mg/l (Total Screen L) bzw.
200 mg/l (Combur9) und für Transferrin bei 180 mg/l (beide Systeme). Das niedermolekulare ß2-Mikroglobu- lin (Abb.2C) wird erheblich schlechter erfaßt. Die ange- zeigten Konzentrationsstufen entsprechen nur 10-20%
der tatsächlichen Werte. Die Nachweisgrenzen liegen bei*
500 (Total Screen L) und 550 (combur 9) mg/l. Bence- Jones-Proteine (Abb. 2 D, E) werden sehr schlecht erfaßt.
In beiden Teststreifensystemen entsprechen die ange- zeigten Stufenwerte weniger als 5% der tatsächlich vor- handenen Proteinkonzentrationen. Die geringsten noch nachweisbaren Konzentrationen liegen bei > 1 g/l.
Diskussion
Als Screening-Methode zur Erfassung von Proteinurien hat sich in der Routine der semiquantitative trockenche- mische Proteinnachweis mittels Teststreifen durchge-
1200 1000 600 600-
200- o-
-200 200 400 600 800 1000
Albumin [mg/1] 1400
1000
Transferrin [mg/11 2000 400
0)
o e
l
"w.8
300
200-
100-
o-
400 600
ß2-M1krog1obulin [mg/1] 1000
i:
« 800-12001000-e E 600-
§ 400- 2 200-
0)« oH
10000 20000
IgL typ kappe [mg/1] 30000
^ 1200
"o» 1000-
» 800- e
& 600 l 400-
£ 200 w 0-
2000 6000
IgL typ lambda [mg/11
Abb. 2: Vergleich von semiquantitativer Gesamtproteinbestim- mung durch die zwei Teststreifenmethoden Total Screen L und Combur 9 mit immunnephelometrisch (A, B, D. E) oderradioim- munchemisch (C) kontrollierten Konzentrationen humaner Rein- proteine in saliner Lösung. Es wurden folgende Proteine getestet:
Albumin (A), Transferrin (B). ß2-Mikroglobulin (C), Immunglo- bulinleichtketten Typ » (D) und Typ ( )
Lab.med. 13:17 (1989) 17
Tab. 3: Präzision und Richtigkeit in Verdünnungen von NT-Kontrollserum
in Serie Tag zu Tag
Verdünnung Soll mg/1
Mittelwert Standardabw.
VK%
Mittelwert Standardabw.
VK%
TP1/TP2 1:107490 744446 4,1 745257
5,3 1:401873 183212 4,4 185514
5,9
1:200 375 3759 4,5 36912
6,5
1:1000 75 791,8
4,0 772,4 4,2
TPC 1:107490 5705168 12,4 5689189
18,3 1:401873 1302108 18,6 1315125
24,2
1:200 375 36329 18,3 37142
22,0 In allen Meßserien: n = 10.
setzt. Diese analytische Methode ist schnell, kostengün- stig, gut automatisierbar und mit geringem apparativem Aufwand verbunden. Wie die hier vorgestellten Daten und auch andere Untersuchungen (7, 23) belegen, rea- gieren Teststreifen erst ab Proteinkonzentrationen von 150 — 200 mg/l. Diese analytische Sensitivität reicht nicht aus, um diskret erhöhte Albuminausscheidungs- raten bei glomerulären Frühschädigungen z.B. bei dia- betischer Nephropathie (sog. Mikroalbuminurie) zu er- kennen (24). Darüber hinaus weisen Teststreifen über- wiegend hochmolekulare Proteine wie Albumin und Transferrin nach, während niedermolekulare Proteine wie ß2-Mikroglobulin oder Bence-Jones-Proteine fast über- haupt nicht erfaßt werden [siehe Abb. 3 und (25)]. Die nephelometrische Gesamtproteinbestimmung scheint uns daher eine notwendige und sinnvolle Ergänzung des Screening-Programms. Bei der Adaptierung des für Li- quorgesamtproteinbestimmungen vom Hersteller vorge- schlagenen Testschemas an Urinmessungen stellten sich uns folgende Probleme:
1. 5fach höhere analytische Sensitivität notwendig.
2. Sehr viel weiterer Meßbereich abzudecken (0 — 20000 mg/l).
3. Heterogenes und inkonstantes Spektrum der zu erfas- senden Proteine, wobei die einzelnen Proteinspezies un- terschiedliche TCA-Konzentrations-Optima besitzen (3).
Um die unterschiedliche Präzipitationskinetik verschie- dener Proteinspezies auszugleichen, erschien es uns vor- teilhaft, statt des für den BNA geräteüblichen halbkineti- schen fixed-time-Meßverfahrens eine Endpunktmessung mit verlängertem Meßintervall durchzuführen. Durch die Verlängerung der Meßzeit wurde auch die notwendige Sensitivitätssteigerung erreicht. Um auch sehr hohe Pro- teinkonzentrationen sicher zu erfassen, wurde ein Simul- tanansatz in wesentlich höherer Probenverdünnung durchgeführt.
Diese Methode ist unseres Erachtens dem geräteüblichen halbkinetischen Meßverfähren hinsichtlich Präzision und analytischer Sensitivität überlegen. Es ist allerdings unumgänglich, Urinproben vor der Analyse zu zentrifu- gieren (10000 g, 2 min) oder zu filtrieren, da, anders als bei fixed-time-Messungen, eventuelle Probenvortrübun- gen mit in den Meßwert eingeht. Gegenüber dem Test- streifenverfahren zeichnet sich die nephelometrische Me- thode bei ähnlich guter Mechanisierbarkeit durch eine höhere analytische Sensitivität und gleichmäßigere Erfas- sung der für die Urindiagnostik wesentlichen Proteine aus. Nachteilig ist der wesentlich höhere apparative Auf- wand.
Differentialdiagnostisch ist neben der Gesamtmenge der im Urin ausgeschiedenen Proteine auch deren Größen-
verteilungsmuster von großem Interesse (26 — 29). Zur Bestimmung dieses Ausscheid u ngsmusters ist die im- munnephelometrische oder turbidimetrische Quantifizie- rung bestimmter Leitproteine als gut mechanisierbare routinefähige Methode vorgeschlagen worden (6, 30).
Bei solchen immunchemischen Messungen stellen im Antigenüberschuß erhobene falsch-niedrige Meßwerte ein besonderes Problem dar, da im Urin — anders als im Serum — die Konzentrationen der zu messenden Proteine um ein Vielfaches des Meßbereiches der jeweiligen Nach- weismethode schwanken können. Auch in diesem Zu- sammenhang kommt der Gesamtproteinbestimmung gro- ßes Gewicht zu, weil nur durch Bilanzierung mit einem zuverlässigen Referenzwert eine Plausibilitätskontrolle der immuntitrimetrisch ermittelten Einzelkonzentrationen möglich ist. Die hier vorgeschlagene nephelometrische Gesamtproteinbestimmung ist als derartige Referenzme- thode gut geeignet.
Danksagungen
Für das Korrekturlesen des Manuskriptes und hilfreiche Verbesse- rungsvorschläge danken wir Herrn Dr. W. Fischbach, für An- regungen und unterstützende Diskussionen den Herren Dr. M.
Lammers und T. Moll. Vor allem aber sei Frl. G, Rothenbucher für exzellente technische Hilfe gedankt.
Schrifttum:
1. HARDWICKE, J., CAMERON, J. S.. HARRISON, J. F., HULME, B.. SOOTHILL, J. F.: Proteinuria studied by clearences of individual macro-molecules. In: MANUEL, V., REVILLARD, J. B.. BETUEL, H.: Proteins in Normal and Pathological Urine. Karger, Basel, p. 111 (1970).
2. HÖRL, W. H., HEIDLAND, A.: Proteinurie. In: SARRE, H.: Nierenkrankheiten:
Physiologie, Pathophysiologie, Untersuchungsmethoden. Klinik und Therapie. A.
Thieme, Stuttgart, pp. 175 -180 (1988).
3. LORENTZ, K., WEISS, T.: Proteinbestimmung im Urin - Eine kritische Übersicht.
J. Clin. Chem. Clin. Biochem. 24. 309-323 (1986).
4. EHRICH, J. H. H., FOELLMER, H. G., KRULL, F., WINNECKEN, H. J., WURSTER, U.: Aussagen, Fehlerquellen und Grenzen der Proteindiagnostik im Urin. Monatsschr.
Kinderheilkd.132,136-143 (1984).
5. KIRCHHERR, H., SCHI WAR A, H.-W.: Quantitative Proteinbestimmmung im Harn mit einer empfindlichen Streulichtmethode. J. Clin. Chem.'Clin. Biochem. 23,57-62 (1985).
6. HOFMANN, W., GUDER. W. G.: Automatisierung der quantitativen Bestimmung von Harnproteinen und Harnenzymen zur nephrologischen Stufendiagnostik. Fres. Z.
Anal. Chem. 330,428-429 (1988).
7. GUDER, W. G.: Die Proteinurie: Ursachen, Formen, Bestimmungsmethoden.
Diagnose & Labor 38,1 -8 (1988).
8. LIZANA, J., BRITO, M.. DAVIS, M. R.: Assessment of five quantitative methods for determination of total proteins in urine. Clin. Biochem. 10,89-93 (1977).
9. SWAIN, R. R., BRIGGS, S, L: Measurement of total protein in urine comparison of 2 dye-binding procedures with a gel-filtration modified biuret method. Microchem.
J. 24. 56-61 (1979).
10. ZAWISLAK, R., VINCENDIN, G., FLORI. J.. GEISERT, J.: Dosagede la proteinurie chez l'enfant variabilite des results selon la methode de dosage. Arch. Fr. Pediatr. 38, 171-175(1981).
11. THOMAS, L. WINCKELMANN. M., MICHAELIS, H. C., WALB. D.: Quantitative Proteinbestimmung im Harn mit dem Proteinbindungsfarbstoff Coomassie Brilliant Blau G 250. J. Clin. Chem. Clin. Biochem. 19.203-208 (1981).
18 Lab.med. 13:18(1989)
![Tab. 1: Geräteparameter TP1 Proben-Vol. [ ] Reagenz 1 Vol. [ ] Reagenz 2 Vol. [ ] Puffer Vol](https://thumb-eu.123doks.com/thumbv2/1library_info/5130546.1658940/4.747.384.718.82.654/tab-geräteparameter-proben-vol-reagenz-vol-reagenz-puffer.webp)
![Tab. 2: Erfassungsbereiche/Nachweisgrenzen und Wiederfin- Wiederfin-dungsraten Erfassungsbereich [mg/1] Wiederfindungs-rate [%] TP1/TP2 TPC TP1/TP2 TPC Albumin 20-11000 100-11000 74 n](https://thumb-eu.123doks.com/thumbv2/1library_info/5130546.1658940/6.750.387.714.41.974/erfassungsbereiche-nachweisgrenzen-wiederfin-wiederfin-dungsraten-erfassungsbereich-wiederfindungs-albumin.webp)