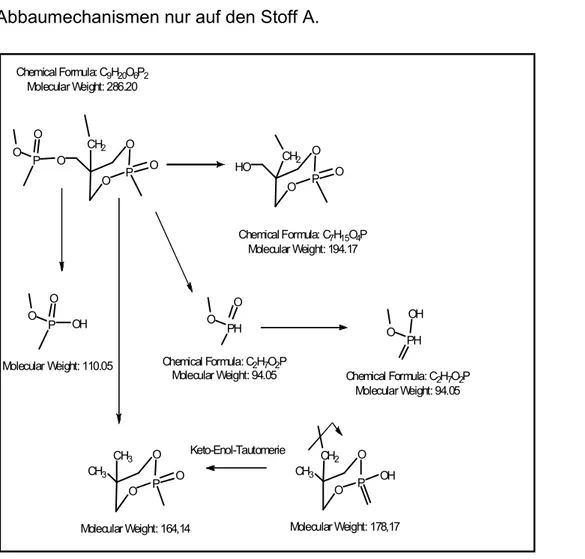
Entwicklung von prozessnahen Teilstrom-Abwasser-Behandlungsverfahren auf der Basis biologischer und sonochemischer Reaktorstufen mit online-prozessanalytischer Verfahrensoptimierung
Volltext
Abbildung
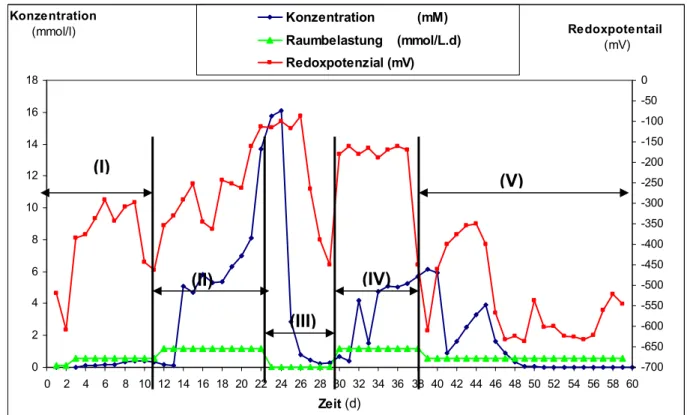
![Abbildung 16: Aufbau des Analysenverfahrens für das Monitoring des anaerob- anaerob-aeroben Abwasserbehandlungsverfahrens [36]](https://thumb-eu.123doks.com/thumbv2/1library_info/3645277.1503017/81.892.97.769.147.581/abbildung-aufbau-analysenverfahrens-monitoring-anaerob-anaerob-aeroben-abwasserbehandlungsverfahrens.webp)
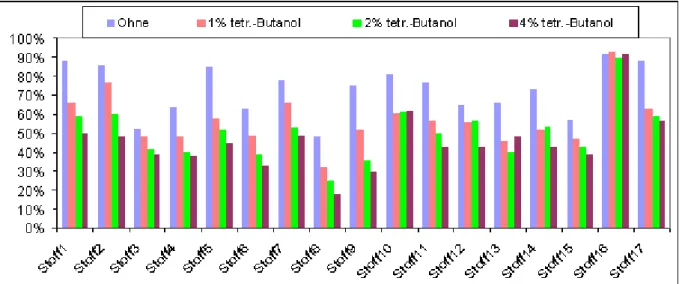
![Abbildung 18: Visualisierung des biologischen Verfahrens zur Behandlung von azofarbstoffhaltigen Abwasserkonzentraten [10], [36]](https://thumb-eu.123doks.com/thumbv2/1library_info/3645277.1503017/85.892.98.779.551.950/abbildung-visualisierung-biologischen-verfahrens-behandlung-azofarbstoffhaltigen-abwasserkonzentraten.webp)
ÄHNLICHE DOKUMENTE
Ge- mäß DWA-A 216 (DWA 2015) wird der Eigenversorgungsgrad des GKW Nordkanal in ca. 70 % der betrachteten Kläranlagen überschritten. Es wird im Folgenden berücksichtigt, dass
tiedjei membrangebun- den ist (DeWeerd et al. 1990) und vermutet wird, daj3 die Reaktion an Elektronentransport über die Membran gekoppelt ist (DeWeerd et al 1991) wurde die
Bevor abwasserrelevante Stoffe in groflen Mengen in den Verkehr gelangen, sollte man deren Verhaltensweise in Kl~ir- anlagen kennen. Der O E C D 303
Anaerobe Reaktoren, die bei psychrophilen (< 20 °C) Tempe- raturen betrieben werden, bieten somit eine attraktive und kostensparende Alternative. Unabhängig von
Da Stamm FAc12 mit dem Elektronenakzeptor Ferrihydrit und dem Elektronendonator Acetat angereichert und isoliert wurde, sollten auch die Konzentrationen von Fe(II), Fe(III) und
Summary The anaerobic oxidation of methane AOM by methanotrophic archaea and sulfate-reducing bacteria is the major sink of methane formed in marine sediments.. The study of AOM as
Im N-Terminus der potentiellen Aktivase von Stamm OcN1 konnte dieses Motiv ebenfalls identifiziert werden (siehe Abb.19), so dass für diesen Stamm ebenfalls ein
für Actinomyces israelii oder Propionibacterium propionicum beschrieben ist („spider-like“ colonies), ist noch nicht einmal ein konstantes oder generelles