Versuchsprotokoll 1.) Versuch 1d: Bestimmung der photochemischen Aktivität isolierter Chloroplasten mit der Sauerstoffelektrode
Volltext
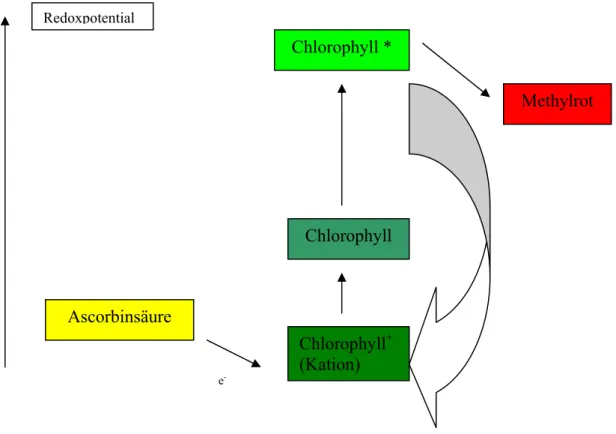
Abbildung
ÄHNLICHE DOKUMENTE
Da bis heute jedoch noch nicht geklärt ist, wie genau der Abbau der Stärke durch Speichelamylase durch die Polyphenole gehemmt wird, ist es fraglich, ob dieser
Den erkalteten Stoff in eine Porzellanschale geben und nach Eigenschaften
Nur durch die Zugabe des Kaliumnitrats kann das Gummibärchen in Brand gesetzt werden, da bei dem Schmelzen von Kaliumnitrat für die Verbrennung wichtiger Sauerstoff
Der Versuch kann genutzt werden, um eine eindrucksvolle exotherme Reaktion zu demonstrieren, bei der die Energie nicht nur in Form von Wärme, sondern auch
Dieser Versuch soll zeigen, dass selbst in Haushaltsprodukten viel Sauerstoff vorkommen kann.. Somit kann hier schnell verdeutlicht werden, dass dieser Stoff charakteristisch für
Diese Aufgabe schließt inhaltlich an das Basiskonzept Chemische Reaktion an. Die chemische Reaktion wird im Unterricht häufig anhand der Verbrennung eingeführt, die in diesem
Das Reagenzglas, welches Phnolphtalein enthält, wird nun mit verdünnter Natronlauge versetzt bis zum Farbumschlag.. Die Anzahl an Tropfen wird
Abbildung 6: Reagenzglas 1 (links), Reagenzglas 2 nach Zugabe der Eisen(III)chlorid-Lösung (mitte) und Reagenzglas 3 (rechts)... Reagenzglas 2)