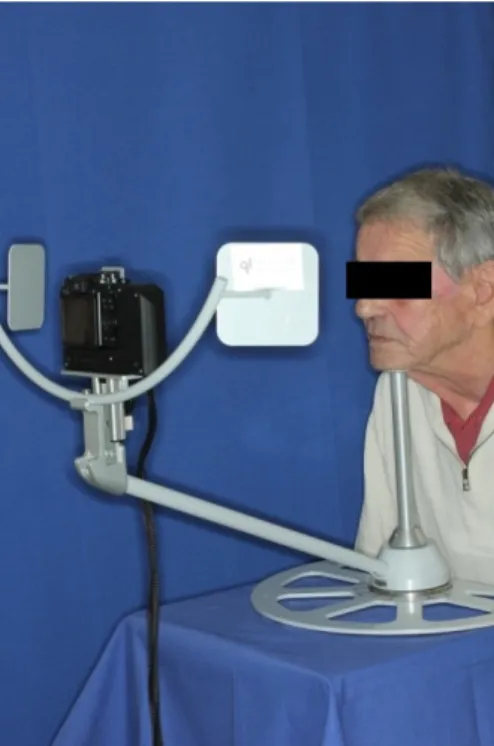
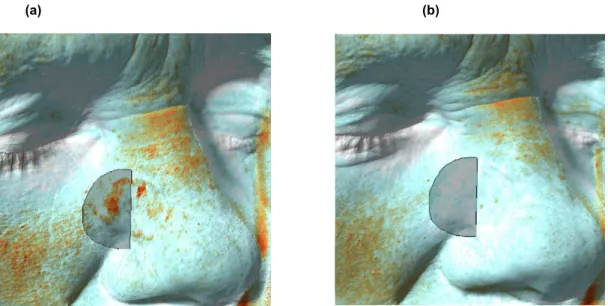
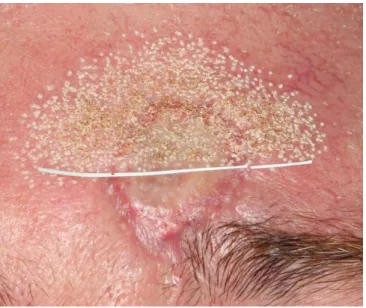
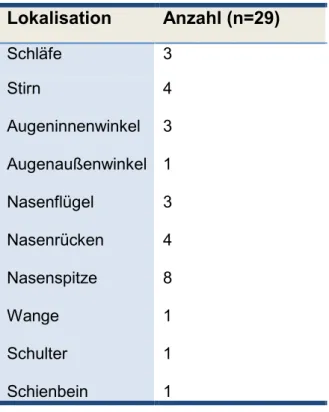
Prospektive, monozentrische, einarmige, randomisierte, kontrollierte Studie über fraktionierte CO
Volltext
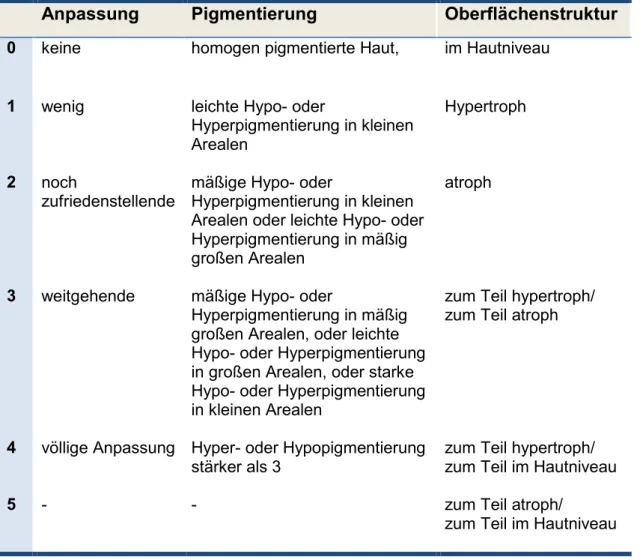
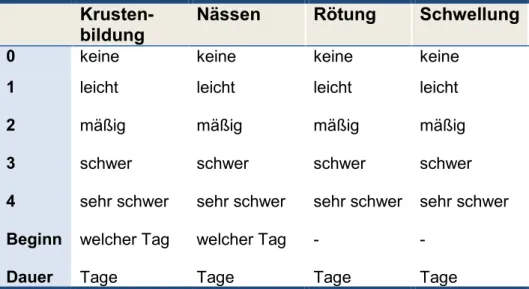
Abbildung
ÄHNLICHE DOKUMENTE
Die gegenwärtige Datenlage lässt es allerdings nicht zu, den gesamten Anteil von Arzneimitteln und anderen medizinischen Produkten am CO 2 -Fußabdruck des
In der Interventionsgruppe wurde nach 8 Wochen eine geringe Verbesserung der körperlichen (PCS-12) und psychischen (MCS-12) Lebensqualität sowie des
Der vom FLS® Programm übernommene und ausgebaute Score, den diese Untersuchung nutzte, zeigte bei den Experten keinen Unterschied für Stiftetransfer und Knotenaufgabe
Die vorliegende Arbeit untersucht Beschwerden, die durch Bildschirmarbeit hervorgerufen werden, und präsentiert eine Studie der Klinik für Physikalische Medizin und Rehabilitation
Es wurde in vitro mehrmals gezeigt, dass die Anwendung von Thrombozytenkonzentraten und damit auch den autologen Wachstumsfaktoren die Proliferation und
Eine wirksame psychologische Behandlung der Zahnbehandlungsphobie erzielt den Angst- rückgang während der zahnärztlichen Therapie, der ebenso auf niedrigem Niveau vor
Ist die Gabe von Metformin zusätzlich zu einer Betreuung durch ein multidisziplinäres Adipositas-Team eine sinnvolle Möglichkeit zur Sekundärprävention von Typ 2 Diabetes
In einem Fall kam es in der Gruppe A zu einer postoperativen Blutungsanämie, die durch Transfusion von 2 Erythrozytenkonzentraten therapiert wurde. Eine postoperative