ORIGINAL
ARBEITEN
Verfahren der Gewebeauflösung zur Isolierung von
periprothetischen Abriebpartikeln
Florian-Dominique Naal, Peter Diehl, Rainer Bader, Jutta Tübel, Erwin Steinhau- ser, Hans Gollwitzer, Wolfram Mittelmeier
Schlagworte:
Abriebpartikel - Isolie- rung - periprothetisches Gewebe
Für aseptische Hüftendoprothesen-Lockerungen werden unter an- derem periprothetische Abriebpartikel aus der Artikulationsfläche Kopf/Pfanne sowie aus der Grenzfläche Implantat/Knochen bzw.
Implantat/Knochenzement verantwortlich gemacht Um diese Par- tikel auf ihre Eigenschaften hin zu untersuchen, müssen sie mög- lichst vollständig und schonend aus dem periprothetischen Gewebe isoliert werden. Hierfür sind mehrere methodische Ansätze be- schrieben, die jedoch hinsichtlich ihrer Effizienz kontrovers diskutiert werden. Ziel der Arbeit ist der Vergleich von unterschiedlichen Me- thoden auf ihre Wirksamkeit, periprothetisches Gewebe vollständig aufzulösen. Zu diesem Zweck wurde Gewebe aus Pseudokapsel und Interface mit einer proteolytischen Lösung, mit konzentrierten Basen und Säuren unter Variation von Behandlungszeit, Konzen- tration und Temperatur inkubiert.
Dabei führte die Verwendung der proteolytischen Lösung ebenso wie die Verwendung von konzentrierten Basen zu keiner vollstän- digen Gewebeauflösung. Jedoch konnte mit 65%iger Salpetersäure (HN0
3) bei 65 °C nach 24 Stunden eine reproduzierbar gute Gewe- beauflösung erreicht und metallische Abriebpartikel isoliert wer- den. Diese Methode ermöglicht es, die Charakterisierung von in vivo Abriebpartikel zu verbessern. Damit kann ein Beitrag zur Klärung der Vorgänge zwischen Grenzflächenprodukten und menschlichem Biosystem, welche für das klinische Ergebnis von Hüftendoprothesen von Bedeutung sind, geleistet werden.
Einleitung
Bei einer Vielzahl von Hüftendoprothesen kommt es nach einer durchschnittlichen Standzeit von zehn bis f ü n f z e h n Jahren zu einer sogenannten aseptischen Lockerung des Im- plantats, die eine Revisionsoperation notwendig macht. Die aseptische Endoprothesenlockerung stellt letztlich mit über 70% die Hauptursache für Revisionen dar [24],
Unter anderem spielt die Entstehung von Abriebpartikeln, die zumeist in der Artikulationsfläche Kopf/Pfanne, aber auch in der Grenzfläche Implantat/Knochen bzw. Implan- tat/Knochenzement freigesetzt werden, für den als "Wear Disease" bezeichneten Prozess eine große Rolle [2, 3, 6, 13, 15, 17, 29], Für die biologische Reaktion des Körpers ist neben der Anzahl der Partikel auch deren Form, Werkstoff- zusammensetzung und Größe ausschlaggebend [12].
In den meisten vorliegenden Arbeiten wurden Abriebpartikel nach Größe, Form, Vorkommen und chemischer Zusammen- setzung untersucht [18, 20, 21, 25], Auch wurde der Einfluss kommerzieller Partikel und in vitro generierter Partikel auf
Zellkulturen untersucht [4], Die industriell generierten Parti- kel entsprechen aber in Ihrer Charakteristik offenbar nicht der "in vivo" - Situation [14, 16, 28].
Deshalb sollten Partikel aus Patienten mit gelockerten Endo- prothesen möglichst unverändert und vollständig gewonnen werden, um somit eine exakte Charakterisierung sowie auch eine Untersuchung der zellulären Reaktionen über Inkubati- on in verschiedenen Zellkulturen durchführen zu können.
Sekundär kann auf dieser Basis ein Vergleich der Wertigkeit von in vitro generierten Partikeln angestrebt werden.
Um "in vivo" - Abriebpartikel isolieren bzw. für Zellversu- che gewinnen zu können, muss das periprothetische Gewebe durch geeignete Maßnahmen möglichst vollständig zersetzt werden. Es werden in der Literatur drei Methoden zur Auflö- sung von Gewebe beschrieben: durch proteolytische Verdau- ung mit Enzymen [10, 18-20], durch konzentrierte Basen wie Natriumlauge (NaOH) und Kaliumlauge (KOH) [22, 23, 27] oder durch konzentrierte Säuren wie Salzsäure (HCl) und Salpetersäure (HN03) [5, 21, 23, 25]. Diese Methoden werden
2 7 0 iB I° ™ t e n a H e n 4 (*)• 2003
Florian-Dominique Naal: Verfahren der Gewebeauflösung zur Isolierung von periprothetischen Abriebpartikeln
ORIGINAL· A R B E I T E N
jedoch kontrovers diskutiert und führen laut Literatur nicht immer zur sicheren Gewebeauflösung.
In verschiedenen Arbeiten werden Methoden angewendet, die zu einer erheblichen Anzahl von W a s c h - und Pipettier- schritten sowie Zentrifugationen führen [ 1 , 8 , 26]. Jeder die- ser Schritte verursacht j e d o c h einen Verlust von Partikeln, da diese, wie in eigenen Arbeiten nachgewiesen, eine Affi- nität insbesondere zu Kunststoff- und Glasoberflächen auf- weisen und daran haften bleiben.
In der vorliegenden Arbeit werden mehrere in der Literatur beschriebene Methoden a u f ihre Wirksamkeit, periprotheti- sches Gewebe, insbesondere aus dem Interface, vollständig aufzulösen, evaluiert. Zudem soll durch deren Modifikation die Erschließung der Partikel optimiert werden, indem Ge- webe in möglichst wenigen Inkubations- und Arbeitsschrit- ten vollständig aufgelöst wird.
Material und Methoden
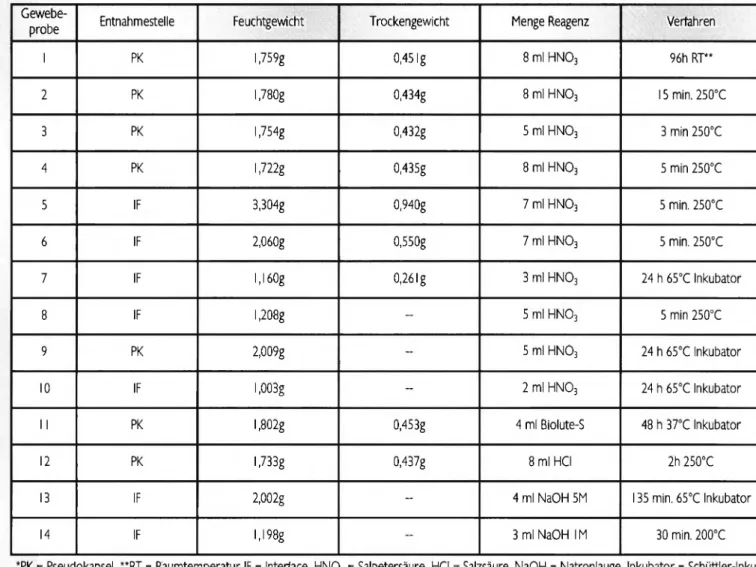
Im Rahmen von Revisionsoperationen nach künstlichem Hüftgelenksersatz wurde periprothetisches Gewebe aus der Pseudokapsel und dem Interface (s. Tab. 1) mittels Skalpell steril entnommen, in kleine würfelförmige Stücke von ca.
2 x 2 x 2 mm zerschnitten und gewogen. J e nach Versuchsrei- he wurden die Proben feucht belassen, oder für 4 8 Stunden bei 65°C im Trockenschrank getrocknet (Abb. 1 und 2). Das Trocknen des Gewebes sollte den Austritt von Wasser aus dem Gewebe und somit eine Konzentrationsminderung der Reagenzien verhindern.
Abb. I: Kleingeschnittenes perl· Abb. 2: Die gleiche Gewebeprobe prothetisches Gewebe, feucht. nach 48-stündigem Trocknen bei
65°C.
Die derart aufbereiteten Stücke der jeweiligen Gewebeprobe wurden in 15 ml Schraubglasgefäße (Mikrofläschchen, Fa.
Neo-Lab, Heidelberg) überführt. Zur Testung der verschiede- nen Verdauungsmethoden wurden proteolytische Lösung Biolute-S (Fa. Serva, Heidelberg), 1-molare bzw. 5-molare Natronlauge (NaOH), 10°/oige Salzsäure (HCl), sowie 65°/oige Salpetersäure (HN03) zu den entsprechenden Ansätzen hin- zugefügt. Die genauen Mengen und das Reagenz j e Gewebe- probe sind in Tabelle 1 aufgelistet.
Die Proben wurden entweder bei offenem Deckel (3min. - 2h, 65°C - 250°C) erhitzt oder bei Raumtemperatur (RT) inku- biert. Die Proben bei 65 °C wurden im Schüttler (Heidolph Inkubator 1000, Fa. Heidolph, Schwabach) inkubiert.
Während des Kochens wurde das Ausgangsvolumen im Schraubglas konstant gehalten, indem die entsprechenden Reagenzien nachgefüllt wurden.
Die Proben wurden nach der Inkubation mit den entspre- chenden Reagenzien zunächst makroskopisch a u f die Qua- lität der Gewebeauflösung hin beurteilt. Proben, in denen sich das Gewebe auflöste und makroskopisch keine Reste
sichtbar waren, wurden zentrifugiert, um nachzuweisen, ob sich noch ein Gewebe-Pellet aus der Lösung absetzt. Des Weiteren wurde die Lösung mikroskopisch a u f Gewebereste untersucht.
Hierfür wurden 1,5 ml der Lösung mit einer Pipette aufge- nommen, in 2 ml-Reaktionsgefäße (Eppendorf Cups, Fa. Ep- pendorf, Hamburg) überführt und für 3 0 min. bei 13.000 U/min. zentrifugiert. Bei j e d e r Gewebeprobe (1-14) wurden jeweils drei Ansätze untersucht.
Ergebnisse
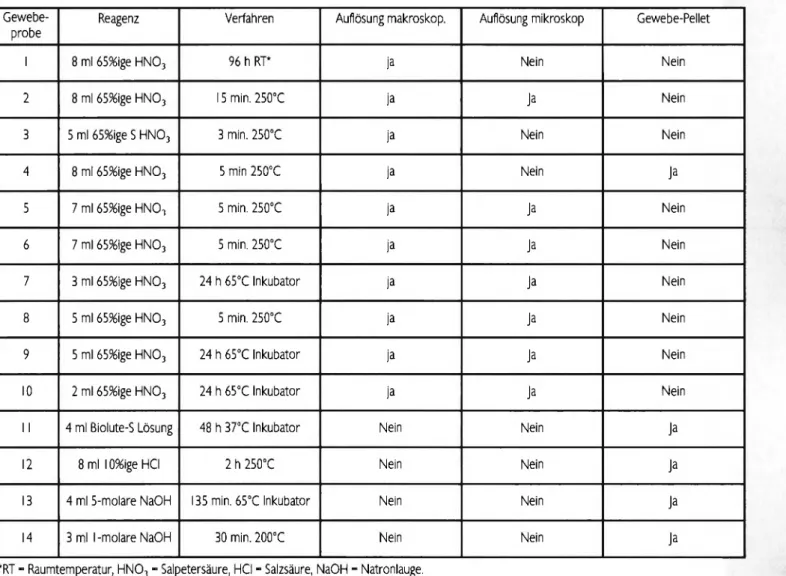
In Tabelle 2 ist die Wirksamkeit der verschiedenen durchge- führten Methoden dargestellt.
Auflösung des Gewebes mit der proteolytischen Lösung Biolute-S:
Das mit der Lösung Biolute-S bei 37 °C inkubierte Gewebe (Probe 11) zeigte nach 4 8 Stunden keine befriedigende Auf- lösung. Es waren deutliche Gewebereste und nicht aufgelö- ste Gewebestücke am Boden des Schraubglases sichtbar (Abb. 3).
Abb. 3: Gewebeprobe nach 48-stündi- ger Inkubation mit der proteolytischen Lösung Biolute-S. Es sind deutliche Ge- webereste sichtbar.
Auflösung des Gewebes mit konzentrierter (1-molarer und 5-molarer) Natronlauge:
Das mit 4 ml 5-molarer Natronlauge für 6 0 Minuten bei 65°C inkubierte Gewebe (Probe 13) zeigte keine Auflösung.
Nach weiteren 7 5 Minuten waren weiterhin nicht aufgelöste Gewebestücke sichtbar (Abb. 4).
Auch die für 3 0 Minuten in 1-molarer Natronlauge inku- bierte Gewebeprobe 14 zeigte keine ausreichende Gewebe- auflösung. Es waren nach wie vor ganze Gewebestücke sichtbar, ein Pellet setzte sich ab.
Auflösung des Gewebes mit konzentrierter (10%iger) Salzsäure:
Nach zweistündigem Kochen in 10°/oiger Salzsäure zeigten sich in der Probe 12 noch kleinere ungelöste Gewebereste
| f ^
Abb. 4: Gewebeprobe nach 135- minütiger Inkubation in 5molarer Na- tronlauge bei 65°C. Es sind deutliche Geweberückstände zu erkennen.
2 ~J ] BlOmateriahen 4 (4), 2003
ORIGINAL
"ARBEITEN
Florian-Dominique Naal: Verfahren der Gewebeauflösung zur Isolierung von periprothetischen AbriebpartikelnTab. I: Übersicht über die durchgeführten Verfahren zur Gewebeauflösung Gewebe-
probe Entnahmestelle Feuchtgewicht Trockengewicht Menge Reagenz Verfahren
1 PK 1,759g 0,451g 8 ml H N 03 96h RT**
2 PK 1,780g 0,434g 8 ml H N 03 15 min. 250°C
3 PK 1,754g 0,432g 5 ml H N 03 3 min 250°C
4 PK 1,722g 0,435g 8 ml H N 03 5 min 250°C
5 IF 3,304g 0,940g 7 ml H N 03 5 min. 250°C
6 IF 2,060g 0,550g 7 ml H N 03 5 min. 250°C
7 IF 1,160g 0,261g 3 ml H N 03 24 h 65°C Inkubator
8 IF 1,208g - 5 ml HN03 5 min 250°C
9 PK 2,009g - 5 ml HN03 24 h 65°C Inkubator
10 IF 1,003g - 2 ml HN03 24 h 65°C Inkubator
11 PK 1,802g 0,453g 4 ml Biolute-S 48 h 37°C Inkubator
12 PK 1,733g 0,437g 8 ml HCl 2h 250°C
13 IF 2,002g - 4 ml NaOH 5M 135 min. 65°C Inkubator
14 IF 1,198g 3 ml NaOH IM 30 min. 200°C
*PK - Pseudokapsel, **RT - Raumtemperatur IF - Interface, H N 03 - Salpetersäure, HCl = Salzsäure, NaOH = Natronlauge, Inkubator - Schüttler-Inku- bation
(Abb. 5). In allen drei Reaktionsgefäßen war nach der Zen- t r i f u g a t i o n ein Pellet zu erkennen (Abb. 7). Dieses Pellet zeigte sich unter dem Lichtmikroskop als Geweberest.
Abb. 5: Gewebe nach 2-stündigem Ko- chen in 10%iger Salzsäure. Es sind wei- terhin Gewebereste sichtbar.
Die Gewebeproben der Ansätze 2 - 6 und 8 zeigten nach dem Kochen in 65°/oiger Salpetersäure eine sehr gute Gewe- beauflösung. In dem Gefäß der Probe 4 war ein sehr kleines weißes Pellet zu sehen. Die Reaktionsgefäße der Proben 2, 3, 5, 6 und 8 zeigten kein Pellet. Mikroskopisch waren in den Proben 3 und 4 noch Gewebereste zu identifizieren.
Abb. 6: Gewebeprobe nach 24-stündi- ger Inkubation in 65%iger Salpetersäu- re bei 65°C im Schüttler. Makrosko- pisch resultiert eine klare Lösung ohne Geweberückstände.
Auflösung des Gewebes mit konzentrierter (65%iger) Salpetersäure:
Gewebeprobe 1 war nach 96 Stunden Inkubation in 65°/oiger Salpetersäure bei R a u m t e m p e r a t u r gut gelöst. Nach der Zentrifugation waren keine Rückstände in Form eines Pellets zu erkennen, j e d o c h konnten mikroskopisch noch Gewebereste identifiziert werden.
Das Gewebe der Proben 7, 9 u n d 10 w a r nach 24 Stunden bei 65°C und Schütteln im Inkubator sehr gut gelöst (Abb.
6). In den Gefäßen war nach der Zentrifugation kein Pellet
2 7 2 i
B,0materiaiien 4(
4)·
2003Florian-Dominique Naal: Verfahren der Gewebeauflösung zur Isolierung von periprothetischen Abriebpartikeln
Tab. 2: Wirksamkeit der Gewebeauflösung in Abhängigkeit des eingesetzten Verfahrens
ORIGINAL! ARBEITEN
Gewebe- probe
Reagenz Verfahren Auflösung makroskop. Auflösung mikroskop Gewebe-Pellet
1 8 ml 65%ige H N 03 96 h RT* ja Nein Nein
2 8 ml 65%ige H N 03 15 min. 250°C ja Ja Nein
3 5 ml 65%ige S H N 03 3 min. 250°C ja Nein Nein
4 8 ml 65%ige H N 03 5 min 250°C ja Nein Ja
5 7 ml 65%ige HNO-, 5 min. 250°C ja Ja Nein
6 7 ml 65%ige H N 03 5 min. 250°C ja Ja Nein
7 3 ml 65%ige H N 03 24 h 65°C Inkubator ja Ja Nein
8 5 ml 65%ige H N 03 5 min. 250°C ja Ja Nein
9 5 ml 65%ige H N 03 24 h 65°C Inkubator ja Ja Nein
10 2 ml 65%ige H N 03 24 h 65°C Inkubator ja Ja Nein
11 4 ml ßiolute-S Lösung 48 h 37°C Inkubator Nein Nein Ja
12 8 ml 10%ige HCl 2 h 2S0°C Nein Nein Ja
13 4 ml 5-molare NaOH 135 min. 65°C Inkubator Nein Nein Ja
14 3 ml 1-molare NaOH 30 min. 200°C Nein Nein Ja
*RT - Raumtemperatur, H N 03 - Salpetersäure, HCl - Salzsäure, NaOH - Natronlauge.
Abb. 7: Eppendorf - Reaktionsgefäß nach Zen- trifugation der mit I0%iger Salzsäure durch 2- stündiges Kochen aufgelösten Gewebeprobe. Es ist ein Pellet mit Geweberesten zu erkennen.
Abb. 8: Eppendorf - Reaktionsgefäß nach Zentrifuga- tion der mit 65%iger Salpetersäure fur 24h bei 65°C im Schüttler inkubierten Gewebeprobe. Es sind keine Gewebereste in Form eines Pellets zu erkennen.
zu erkennen (Abb. 8). Mikroskopisch waren unter 10-facher- A u f l ö s u n g keine Geweberückstände nachweisbar.
U m Gewebe mit 6 5 % i g e r Salpetersäure vollständig aufzu- lösen, ist als Reihenfolge empfehlenswert, das Gewebe zunächst feucht in kleine Stücke zu zerschneiden u n d anschließend in ein Glasgefäß zu überführen. Es sollte 65°/oige Salpetersäure im Verhältnis Säure/Gewebe v o n 2,5:1 hinzugegeben und die L ö s u n g dann bei 65°C unter Schüt- teln für 24 Stunden inkubiert werden.
Diskussion
Abriebpartikel aus Endoprothesen in ausreichenden M e n - gen aus Gewebe freizusetzen, u m diese für Zelllabor-Ver- suche einzusetzen, stellt sich als sehr problematisch dar. Es wurden mehrere Methoden beschrieben, u m periprothe- tisches Gewebe zu erschließen [5, 10, 18, 19, 20, 21, 22, 23, 25, 27], Dabei sind aufgrund der offenbar problematischen Gewebeauflösung die Ergebnisse sehr unterschiedlich be- schrieben.
2 7 3 B I O m a t e r lalien 4 (4), 2003
ORIGINAL ARBEITEN
Florian-Dominique Naal: Verfahren der Gewebeauflösung zur Isolierung von periprothetischen AbriebpartikelnDie in der Literatur beschriebene Methode der Gewebeauflö- sung durch proteolytische Lösungen [10, 18, 19, 20] führte in unseren Untersuchungen zu keinem befriedigenden Er- gebnis. Die eingesetzte Lösung Biolute-S ermöglichte keine ausreichende Gewebeauflösung. Auch andere Arbeitsgrup- pen kamen zu dem Ergebnis, dass Abriebpartikel nicht in ausreichenden Mengen aus dem periprothetischen Gewebe isoliert bzw. gewonnen werden können oder mit mikrosko- pischen Geweberesten verunreinigt sind [18]. Auch Camp- bell et al. zeigten in ihren Versuchen zur Gewebeauflösung, dass der Einsatz von Enzymen (Protease und Kollagenase) und die Verwendung proteolytischer Lösungen (Papain und Soluene) nicht immer zu einer ausreichenden Gewebeauf- lösung führen [9].
Die von mehreren Autoren beschriebene Inkubation der Kapselgewebe mit konzentrierten Basen, führt ebenfalls zu unbefriedigenden Ergebnissen [22, 23, 27]. Auch bei An- wendung der ISO Norm 17853 [11] (Probe 13, 5-molare NaOH 1:2, 60 min. 65° C) konnte in unseren Untersuchungen keine vollständige Auflösung erreicht werden. Ein Grund dafür könnte sein, dass diese Methoden der Gewebeauflö- sung nur für Weichgewebe wie etwa Interface-Gewebe an- gewendet wurden. Für derbe Gewebeproben, wie aus der Pseudokapsel, ist dieses Verfahren jedoch ungeeignet.
Campbell et al. benutzten 5-molare Natronlauge zur Auflö- sung von periprothetischem Gewebe [8]. Es zeigte sich, dass j e fibröser bzw. derber eine Gewebeprobe war, um so
schlechter funktionierte die Gewebeauflösung mit 5-molarer Natronlauge.
Ein weiterer Nachteil bei der Verwendung von starken Basen wie Kaliumlauge und Natronlauge ist die Verklumpung von Titanpartikeln [9]. Diese kann durch weitere aufwändige Schritte teilweise rückgängig gemacht werden, was jedoch zu einem Verlust oder zu einer Veränderung der Partikel führen kann.
Im Gegensatz dazu ließ sich mit 65°/oiger Salpetersäure das Gewebe reproduzierbar und - gemäß der mikroskopischen Untersuchung - vollständig auflösen. Das Verfahren mit In- kubation des Gewebes im Schüttel-Inkubator (65°C, 24h) (Proben 7, 9 und 10) zeigte gleich gute Ergebnisse wie die Auflösung durch Kochen des Gewebes bei 250°C (Proben 2- 6 und 8). Der Arbeitsaufwand war mit der Schüttel-Inkuba- tion jedoch deutlich geringer. Das Inkubieren der Probe mit 65°/oiger Salpetersäure (24 h, Raumtemperatur) ist dabei der Inkubation bei 65°C im Schüttler unterlegen [21], Auch das in der Literatur empfohlene Trocknen des Gewebes vor der Auflösung [1] zeigte keine Vorteile, ist aber mit einem er- höhten Arbeitsaufwand verbunden.
Es konnte gezeigt werden, dass durch Gewebeauflösung mit Salpetersäure die Morphologie und Menge sowohl von Ko- balt-Chrom- wie auch von Titan- und Polyäthylenpartikeln nicht verändert wird [21]. Titan wird bei der Inkubation mit 65°/oiger Salpetersäure bei 65°C als beständig eingestuft (DIN 17869, 1992). Hingegen zeigten mit Salzsäure inku- bierte Partikel eine starke Veränderungen ihrer Charakterei- genschaften [21].
Ein weiterer Vorteil von 65°/oiger Salpetersäure liegt in der sauberen Trennung durch Zentrifugation der Partikel. Dies liegt an den unterschiedlichen relativen Dichten (Titan 4,51g/cm3, Polyethylen 0,97g/cm5, Salpetersäure (65°/oig)
l,40g/cm3). Die dabei sedimentierten Titanpartikel und Po- lyäthylenpartikel bilden ein schwimmendes Pellet auf der Salpetersäure, so dass alle Fraktionen gut voneinander zu trennen sind. Diese Gewinnung von Partikelfraktionen ist weniger aufwändig als die von Campbell et al. beschriebene Zentrifugation durch einen Sukrose-Gradienten [7, 8, 9].
Darüber hinaus führt eine höhere Zahl von erforderlichen Wasch- und Pipettierschritten zu einem zusätzlichen Parti- kelverlust. Von wesentlicher Bedeutung bei allen Arbeits- schritten ist aber auch die Auswahl der Gefäße und Pipetten.
Deren Werkstoff- und Oberflächen-Beschaffenheit beeinflus- st das Anhaftungsverhalten von Partikeln [29]. Dabei ist auch auf eine mögliche Verunreinigung o.g. handelsüblicher Laborprodukte mit Fremdpartikeln zu achten.
In der vorliegenden Arbeit konnte somit gezeigt werden, dass mit 65°/oiger Salpetersäure bei 65 °C eine vollständige Auflösung von periprothetischem Gewebe nach 24 Stunden zu erreichen ist. Mit der beschriebenen Methode können so- wohl metallische Partikel wie auch Polyäthylen-Partikel aus dem Gewebe isoliert und für zellbiologische Untersuchungen zur Verfügung gestellt werden.
Abstract
The biological responses to wear particles contribute to the failure of total hip arthroplasties through bone resorption and consequent implant loosening. Little is known about the nature and morphology of wear particles. For clinical investi- gations of particles, complete tissue digestion has to be performed. Several methods of tissue digestion have been reported for the recoveiy of metallic or bone cement particles, but all of those are still a matter of dispute concerning
Florian-Dominique Naal
Florian-Dominique Naal über Dr. med. Peter Diehl Klinik für Orthopädie und Sportorthopädie, Technische Universität München, Isma- ninger Str. 22, D-81675 Mün- chen, Germany.
Tel: +49 (89) 4140 5289 Fax: + 49 (89) 4140 7242 E-mail: P. Diehl@lrz.tum.de Akademischer Lebenslauf
1997 Erwerb der allgemeinen Hochschulreife 1998 - 2002 Studium der Humanmedizin an der
RWTH Aachen
2001 - 2002: Fernstudium der Gesundheitsökonomie am betriebswirtschaftlichen Institut Dr.
Braunschweig, Köln
Seit 2002: Studium der Humanmedizin an der TU München
Dissertation: Seit März 2003 an der Klinik für Or- thopädie und Sportorthopädie, Klini- kum Rechts der Isar der TU München (Biomechanische Eigenschaften von Knorpelgewebe und in vitro Verhalten von humanen Chondroblasten und hu- manen Chondrosarkomzellen nach hy- drostatischer Hochdruckbehandlung)
2 V A iB , 0 n i a t e r i a i i e n 4 Μ·2 0 0 3
Florian-Dominique Naal: Verfahren der Gewebeauflösung zur Isolierung von periprothetischen Abriebpartikeln
ORIGINAL· ARBEITEN
complete tissue digestion. The aim of this study was to com- pare these methods regarding the efficiency of complete peri- prosthetic tissue digestion and to perform a standardized pro- tocol. Pseudocapsular and interface tissues were obtained at the revision surgeries of patients with total hip arthoplasty.
The tissue samples were incubated with different chemical and enzymatic reagents using different concentrations, tem- peratures and variation of time. With exception of nitric acid (HN03), no other solutions used, successfull digestion have been achieved.
We found that 65 °/o of HN03 was effective and reproducible for digestion when heated for 24 hours at 65 °C. The appli- cation of these method to the study of particles from peri- prosthetic tissues can elucidate aspects of the size and the shape of wear particles that are important to the biologic re- sponse and finally to clinical outcome of total hip arthro- plasty.
Literatur
[1] Agins H. J., Alcock N. W., Bansal M., Salvati Ε. Α., Wil- son Jr P. D., Pellicci P. M., Bullough P. G.: Metallic wear in failed titanium-alloy total hip recplacements. J Bone Joint Surg 70-A 3 (1988) 347-356.
[2] Amstutz H. C„ Campbell P., Kossovsky N., Clark I. C.:
Mechanism and clinical significance of wear debris-induced osteolysis. Clin Orthop 276 (1992) 7-18.
[3] Aspenberg P., Van der Vis H.: Migration, Particles, and fluid pressure. Clin Orthop 352 (1998) 75-80.
[4] Bader R., Steinhauser Ε., Guder S., Gregory J. K., Gradin- ger R., Mittelmeier W.: Modell zur In-vitro-Prtifung von Hüftendoprothesen-Stielen am Interface Implantatober- fläche-Knochenzement. In: Eigenschaften und Prüftechniken mechanisch beanspruchter Implantate. DVM-Arbeitskreis
"Biowerkstoffe", DVM, Berlin (2002), 165-174
[5] Blumenthal N.C., Cosma V., Jaffe W„ Stuchin S.: A new technique for quantitaion of metal particulates and metal reaction products in tissues near implants. J Applied Bioma- terials 5 (1994) 191-193.
[6] Brien N. W„ Salvati Ε. Α., Betts F., Bullough P. G., Wright T., Rimnac C., Bully R., Garvin K.: Metal levels in ce- mented total hip arthroplasty. A comparison of well-fixed and loose implants. Clin Orthop 276 (1992) 66-74.
[7] Campbell P., Doom P., Dorey F., Amstutz H. C.: Wear and morphology of ultra-high molecular weight polyethyle- ne wear particles from total hip replacements. Proc Inst Mec Eng [Η] 210 (1996) 167-174.
[8] Campbell P., Ma S„ Yeom B., McKellop H„ Schmalzried Τ. P., Amstutz H. C.: Isolation of predominantly submicron- sized UHMWPE wear particles from periprosthetic tissues. J Biomed Mater Res 29 (1995) 127-131.
[9] Campbell P., Schmalzried T„ Amstutz H. C.: Tissue dige- stion for wear debris particle isolation. J Biomed Mater Res 28 (1994) 523-526.
[10] Dean D. D„ Schwartz Z., Blanchard C. R„ Liu Y„ Agra- wal C. M„ Lohmann C. H., Sylvia V. L„ Boyan B. D.: Ultra high molecular weight polyethylene particles have direct ef- fects on proliferation, differentiation, and local factor pro-
duction of MG63 osteoblast-like cells. J Orthop Res 17 (1999) 9-17.
[11] ISO 17853: Wear of implant materials - Polymer and metal wear particles - Isolation characteristic quantification.
2003-2007.
[12] Elke R.: Partikelkrankheit. Orthopäde 2001 30:258-265.
[13] Goodman S. B., Lind M„ Song Y„ Smith R. L.: In vitro, in vivo, and tissue retrieval studies on particular debris. Clin Orthop 352 (1998) 25-34.
[14] Haynes D. R., Rogers S. D., Hay, S., Pearcy M. J., Howie D. W.: The differences in toxicity and release of bone-resor- bing mediators induced by titanium and cobalt-chromium- alloy wear particles. J Bone Joint Surg 75-A (1993) 825-834.
[15] Hirakawa K„ Bauer T. W„ Stulberg Β. N„ Wilde A. H., Secic M.: Characterisation and comparison of wear debris from failed total hip implants of different types. J Bone Joint Surg 78-A (1996) 1235-1243.
[16] Horowitz S. M., Gonzales J. B.: Inflammatoiy response to implant particulates in a macrophage / osteoblast cocul- ture model. Calcif Tissue Int 59 (1996) 392-396.
[17] Howie D. W.: Tissue response in relation to type of wear particles around failed hip arthroplasties. J Arthropla- sty 5 (1990) 337-348.
[18] Lee J.-M., Salvati Ε. Α., Betts F., DiCarlo Ε. F., Doty S.
Β., Bullough, P. G.: Size of metallic and polyethylene debris particles in failed cemented total hip replacements. J Bone Joint Surg 74-B (1992) 380-384.
[19] Maloney W. J., James R. E., Smith R. L.: Human macro- phage response to retrieved titanium alloy particles in vitro.
Clin Orthop 322 (1996) 268-278.
[20] Maloney W. J., Smith R. L„ Schmalzried Τ. P., Chiba J., Huene D„ Rubash H.: Isolation and charcterization of wear particles generated in patients who have had failure of a hip arthryplasty without cement. J Bone Joint Surg 77-A (1995)
1301-1310.
[21] Margevicius K. J., Bauer T. W., McMahon J. T., Brown S. Α., Merritt K.: Isolation and characterization of debris in membranes around total joint prostheses. J Bone Joint Surg 76-A (1994) 1664-1675.
[22] Milosev L., Antolic V., Minovic Α., Cor Α., Herman S., Pavlovic V., Campbell P.: Extensive metallosis and necrosis in failed protheses with cemented titanium-alloy stems and ceramic heads. J Bone Joint Surg 82-B (2000) 352-357.
[23] Niedzwiecki S., Klapperich C., Short J., Jani S., Ries Μ., Pruitt L.: Comparison of three joint simulator wear debris isolation techniques: acid digestion, base digestion and en- zyme cleavage. J Biomed Mater Res 56 (2001) 245-249.
[24] Ostendorf M., Johnell 0., Malchau H„ Dhert W. J., Schrijvers A. J., Verbout A.J.: The epidemiology of total hip replacement in The Netherlands and Sweden: present status and future needs. Acta Orthop Scand 2002 Jun;73(3):282- 286
2 7 5
B,0materiaiien 4w·
2003ORIGINAL ARBEITEN
Florian-Dominique Naal: Verfahren der Gewebeauflösung zur Isolierung von periprothetischen Abriebpartikeln[25] Rogers S.D., Pearcy M.J., Hay S.J., Haynes D.R., Bram- ley Α., Howie D. W.: A method for production and characte- rization of metal prosthesis wear particles. J Orthop Res 11 (1993) 856-864.
[26] Shanbag A. S„ Jacobs J. J., Giant T. T„ Golbert J. L., Black J., Galante J. 0.: Composition and morphology of wear debris in failed uncemented total hip replacements. J Bone Joint Surg 76-B (1994) 60-67.
[27] Wolfarth D. L„ Han D. W., Bushar G., Parks, N. L.: Se- paration and characterization of polyethylene wear debris from synovial fluid and tissue samples of revised knee re- placements. J Biomed Mater Res 34 (1997) 57-61.
[28] Yao J., CS-Szabo G., Jacobs J. J., Kuettner Κ. E., Giant Τ. T.: Suppression of osteoblast function by titanium par- ticles. J Bone Joint Surg 79-A (1997) 107-112.
[29] Zeiler G., Distler Α.: Probleme zementierter Titanendo- prothesenschäfte. BlOmaterialien 2000 (1) 19-24
2 j B I O m a t e r i a l i e n 4 (4), 2003