'. Lab.med 13: 329-335 (1989)
Gegenstromelektrophorese - ein schnelles
und einfaches immunologisches Nachweisverfahren
Counterimmunoelectrophoresis — a rapid and practical immunological method
J. U. Wieding, G. Claus, J. Behnke, G. Eisinger Haematologie, Universitätskliniken Göttingen
Zusammenfassung:
Verschiedene Faktoren und Inhibitoren der Blutgerinnung sowie weitere Plasmaproteine wurden mit der Gegenstromelektrophorese (CIE) nachgewiesen. Dazu mußten bei Verwendung handelsüblicher Amiseren und vorgefertigter Gelträger die Verdünnungen von Antigen- oder Antikörper-Lösungen, Laufzeiten und Gelelektroendosmose variiert werden.
Insgesamt bewährte sich die Gegenstromelektrophorese als einfach handzuhabende, rasch durchführbare sowie preisgünstige Methode zum immunologischen Nachweis sowohl von Antigenen als auch Antikörpern;
der wesentliche Vorteil der CIE gegenüber anderen immunologischen Techniken besteht in der universellen Einsatzmöglichkeit und in der schnellen Ergebnis- Verfügbarkeit Daher bietet sie sich gerade in der Schnell- Diagnostik von Einzelproben sowohl bei klinischen als auch wissenschaftlichen Fragestellungen an, wenn eine semiquantitative Aussage genügt.
Schlüsselwörter:
Gegenstromelektrophorese — Plasmaprotein-Elektrophorese — Serodiagnostik
Summary:
Several factors and inhibitors of the blood coagulation System were detected by Counterimmunoelectro- phoresis (CIE). For this purpose the dilutions ofantigen orantibody, running time and gel electroendosmosis had to be var/ed when using commercially available antisera and ready-to-use CIE gels. Altogether the Counterimmunoelectrophoresis has proved to be a quick, easy to handle and economical method in detection of both antigens and antibodies. Compared with other immunological techniques the main advantages of CIE are the broad field ofpossible applications and the fast availability of results. The CIE is especially suited for rapid Immunologie analysis of individual samples in both clinical and scientific taskst if semiquantitative results are considered to be sufficient.
Keywords:
Counterimmunoelectrophoresis — Plasma protein electrophoresis — Serodiagnosis
Einleitung
Immunologische Methoden zeichnen sich gegenüber an- fach 'durchzuführenden Methode zum immunologischen deren Möglichkeiten der Protein-Diagnostik durch ihre Nachweis gerade bei einzelnen Proben der Routine-La- Spezifität und vergleichsweise hohe Empfindlichkeit aus. bordiagnostik oder bei wissenschaftlichen Fragestellun- Sowohl Antigene (AG) als auch Antikörper (AK) lassen gen.
sich je nach Methode mit unterschiedlichem Aufwand prjn2J der Gegenstrom-Elektrophorese: In einem Agaro- undl unterschiedlicher-Empfindlichkeit nachweisen, wo- se_Ge| wan<Jem bejm An| ejnes elektrischen Fe|des bei die Methoden m.t direkter (z.T. visueller) Auswertung dje mejsten P,asmaproteine zur Anode/ die Immunglobu- des Immun-Prazipitates meist weniger empfindlich dafür ,. jedoch bejm Weft 8 4 auf d der Elektroend- aber besser praktücabe sind, wie z.B. die Gegenstrom- Q d A e_Gels zur Kathode (2-6); dadurch elektrophorese (1). Viele immunologische Nachweisme- kommt es zum9überwandern der Antigene (AG) und An- thoden sind sehr zeit-, arbeite- oder kostenaufwendig tf - ( K) Bj|d VQn ,mmyunpräzjpitaten, de- und kommen deshalb erst be, größeren Analysenserien fen £usfa-„üngen im Ge, ^ weiß|iche Banden sichtbar
zur Anwendung. werden (?_9) Synonyme sind „überwanderungselek-
Wir beschäftigten uns daher mit der Gegenstromelektro- trophorese" oder ^CountercrossimmunoElectrophore- phorese als einer vielseitig anwendbaren, rasch und ein- sis", abgekürzt „CIE".
Lab.med, 13: 329 (1989) 329
Material
Probenmaterial: Lösungen mit nachzuweisendem (a) Antigen oder (b) Antikörper Serum oder Plasma u.a.
Lösungen.
Antigenstandard: Eine Lösung mit dem Antigen bekann- ter Konzentration (a) zur Standardisierung und (b) zur Reaktion mit dem nachzuweisenden Antikörper.
Antikörperlösung: Handelsübliche Antiseren (Fa. Beh- ringwerke AG, Marburg, und Fa. Immuno GmbH, Heidel- berg) mit üblicher Spezifität und Antikörpertiter sind meist ausreichend für den Antigennachweis.
Gelträger-Gerätesystem (Fa. Immuno GmbH, Heidel- berg/Wien):
- Netzteil (Strom-/Spannungsversorgung): Elektro- phoresesystem „Radiophor®": konstanter Strom (90 mA), Spannung geregelt (maximal etwa 60 Volt), Feldstärke s.u.
— Fertig-Gelträger für die Überwanderungselektropho- rese: Kit-Zusammenstellungen aus Einweg-Agarose- Gelträgern, Einweg-Pufferkammern und Pufferlösung (Diäthylbarbiturat-Acetat, pH 8,2, 0,35 M lonenstär- ke).
Die im Agarosegel ausgestanzten Löcher zum Auftragen der Proben (Durchmesser 4mm) fassen Lösung, der (Rand-Rand-)Abstand zwischen anöden- und ka- thodenseitigem Loch beträgt 4 mm, die Feldstärke bei Verwendung der genannten Spannungsquelle etwa 11 V/
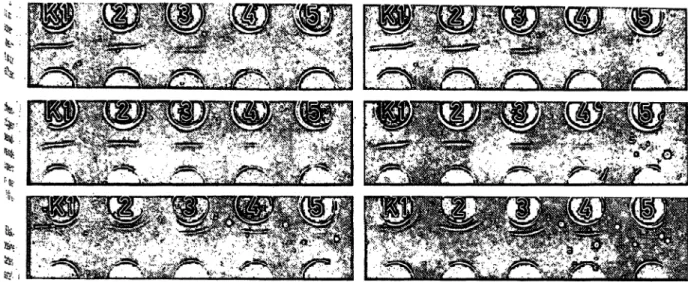
cm. Von den angebotenen Elektroendosmose-Qualitäten HE (= hoch), ME (= mittel) und LE (= niedrig) sollten bei unbekannten AG-/AK-Proben (in der Reihenfolge) mit ME-, LE-, evtl. noch HE-Gelen Versuche durchge- führt werden.
Die Laufzeiten bis zur Immunpräzipitation liegen je nach Gel-Elektroendosmose und Antigen zwischen 25 und 50min; bei unbekannten AG-AK-Präzipitationen kann ein Lauf ab 25 min nach jeweils 5 min zur Beurteilung kurz unterbrochen werden. In wenigen Fällen waren Prä- zipitate besser auszuwerten, wenn entweder Antigen- oder Antikörper 5 — 1 5 m i n vorgewandert waren, bevor dann die korrespondierende AK- oder AG-Lösung aufge- tragen würde.
Methodik
In Vorversuchen sollte in einer 1:2 NaCI-Verdünnungs- reihe von Antigen- und Antikörper-Lösung das geeignete AG-AK-Verhältnis für einen guten Präzipitationsbereieh ermittelt werden (Vermeidung von Antigen-Überschuß;
Heidelberger-Kurve).
Um entstandene Präzipitate gut semiquantitativ auswer- ten zu können, sind Probe und Standard möglichst mit 2 verschiedenen geeigneten Verdünnungen einzusetzen.
Bei Einzelproben in der Routinediagnostik, z.B. beim Nachweis des Faktors VIII assoziierten Antigens, hat sich die Applikation entsprechend dem in Abb.1 dargestellten Verdünnungsschema bewährt.
Beim (a) Antigen-Nachweis werden die zu untersuchen- den Proben (-Verdünnungen) in die kathodenseitigen Löcher des Agarose-Gels (mit geeigneter Elektroend- osmose) aufgetragen, anodenseitig die korrespodierende Antikörperlösung; zum Nachweis von (b) Antikörpern wird die Probenverdünnung dementsprechend an der Anode aufgetragen. Für die geringen Volumina von 10 ! haben sich Dispenser mit Glaskapillaren bewährt.
Mit dem Anlegen der elektrischen Spannung an die Elek- troden-Pufferlösung erfolgt die Wanderung der Proteine im elektrischen Feld mit Bildung von Immunpräzipitaten, welche als weißliche Banden zwischen den Auftragsstel- len sichtbar ausfallen.
Die Betrachtung der Gele erfolgt im Schräglicht gegen schwarzen Hintergrund, evtl. mit Lupe; schwach sicht- bare Präzipitate können gegebenenfalls durch Essigsäu- re-Fällung deutlicher gemacht werden (Überschichtung des Gels für 1 min mit 1%iger Essigsäure).
Die Ergebnis-Dokumentation ist neben der Titerangabe auch durch kurzzeitige Konservierung der Gele in der feuchten Kammer oder fotografisch möglich.
Zur semiquantitativen Auswertung dienen die Präzipitate einer gleichzeitig eingesetzten Standardlösung. Eine ver- gleichende Abschätzung der Präzipitatstärke ermöglicht die semiquantitative Konzentrationsangabe in Titerstu- fen. Die Aussagekraft der visuellen Bewertung ist beson- ders gut wenn auf einem Gelträger sowohl die Probe als auch die mitgeführte Standardlösung in jeweils zwei verschiedenen Verdünnungen Immunpräzipitationen aus- bilden.
Ergebnisse
Die Anwendbarkeit der Gegenstromelektrophorese zum Nachweis von Plasmaproteinen überwiegend des Blut- gerinnungssystems wurde untersucht.
Es gelang der Nachweis vieler verschiedener Antigene und Antikörper, wobei sich die Methode mit geringem Aufwand an die jeweilige Fragestellung anpassen ließ:
Für eine gut sichtbare Präzipitation waren nur die Verdün- nungen der aufgetragenen Lösungen, Gel-Elektroend- osmose sowie die Laufzeit anzupassen. ME- und LE-Gele haben sich für fast alle Fragestellungen bewährt; bei ME- Gelen sind schärfere Banden, bei LE-Gelen eventuell ge-
Abb. 1: Verdünnung/Auftragung
von Probe und Standard fürsemi- (+) Anode quantitative Auswertungen. Prä-
zipitatmuster bei einer Probe mit
halber Antigenkonzentration des (—) Kathode Standards; die genannte Verdün-
nung von Probe und einem Stan- dard mit einer Antigenkonzentra- tion von 100% der Norm ermög-
licht die Auswertbarkeit in Titer- Verdünnung stufen von 25 bis 200% von
Antikörper - Antigen
1:1 1:2 1:1 1:2
Probe 100%-Standard 1:4
; Abb. 2: Vergleich von Gelen mit verschiedener Elektroendosmose bei verschiedenen Laufzeiten: von oben nach unten HE-, ME-, LE- Gel (= hohe, miniere und niedrige Elektroendosmose); links 25 min, rechts 35 min Laufzeit; Nachweis eines Proteinstandards in einer ': 1:2-NaCI-Verdünnungsreihe (K1 bis 5)
ringfügig höhere Sensitivitäten zu erwarten (Abb.2). Bei höherer Elektroendosmose (ME- und insbesondere HE- Gele) treten geringfügige kürzere Analysenzeiten und eine Verschiebung der Präzipitate kathodenwärts auf.
Die Tab.1 führt die insbesondere im Rahmen der Gerin- nungsdiagnostik nachgewiesenen Plasmaproteine auf;
genannt sind die erarbeiteten Cl E-Bedingungen für eine gute Präzipitatbildung (Gel-Elektroendosmose, Verdün- nungen, Laufzeiten sowie Besonderheiten).
Unter Verwendung des angegebenen Testsystems waren die Ergebnisse einfach, ohne Vorbereitung und großen Analysenaufwand gut zu reproduzieren, die Durchfüh- rung und Auswertung erfordert nur kurze Einarbeitung.
Dabei tragen zur Reproduzierbarkeit u.a. ein standardi- sierter Lochabstand, gleichmäßige Gel-Dicke und -Zu- sammensetzung bei, während unterschiedliche Lagerung bei ungünstiger Temperatur, evtl. durch Dehydratation, diese verschlechtern.
Tab. 1: Bedingungen für den Cl E-Nachweis verschiedener Proteine im Plasma Antigen
Fibrinogen Pro-Thrombin Faktor VI l Faktor VI 1 1 Faktor IX Faktor X Faktor XI II A Faktor XIII S Plasminogen Fibronectin Antithrombin III Protein C Protein S
- -Antitrypsin a2-Makroglobulin a2-Antiplasmin C,-lnaktivator FSP-X, -Y. -D, -E:
Gel*
LEME
LELE MELE LELE LEME
MEME ME LEME ME
Laufzeit Sensit|vität (min) Proben-
Verdünnung 30-40
20-30 30-40 30-30 20-30 30-40 40-50 30-40 30-40 20-30 20-30 20-30 20-25 20-25 35-40
:128:128 :16:8 :32:8 :16:32 :64:128
:16:4 :256 :128:128 20-25 1:64
Fibrin (ogen) -Spaltprodukt- Differenzierung mittels Antiseren unterschiedliche Wanderungsstrecke auf dem Gel (24)
Besonderheiten
3 Banden
ggf. Antiserum-Vorverdünnung kaum Präzipitate (Schlieren) 3-4 Banden
4 Banden
Proben- Vorverdünnung 1 :4 Proben-Vorverdünnung 1 :4, Bandeninstabilität auf LE, Doppelbanden
Proben-Vorverdühnung 1 :4 Bandeninstabilität auf LE Bandeninstabilität Bandeninstabilität auf ME 1 5 min Antikörpervorlauf gegen Fibrin(ogen), FSP-D und -E, In ähnlicher Weise nachzuweisen:
Apolipoprotein-A1, -A2, -B, -C, -D, -E
Komplement-Faktor C, (CiQ, C1r> C1s), C3 (C3c, C3d) Antigene im Rahmen von Infektionskrankheiten: HBsAg etc.
Antikörper: Anti-Streptokinase, Anti-HBs-Ag, Anti-Tetanus-Toxin etc.
• Bemerkungen.
i.£-, ME-, HE-Gel - Agarose-Gele mit niedriger, mittlerer, hoher Elektroendosmose; ggf. bei LE-Gelen vor AG-Auftrag den AK bis zu 15 min im elektrischen Feld wandern lassen
Lab.med.13:331 (1989) 331
6.3: FÄbr//? (ogen)-Spaltprodukt-Auf- trennung: Bandenmuster 30 min (A) und 100min (B) nach Streptokinase (SK) in- duzierter Fibrinolyse in einer Plasmaprobe.
Die Anodenlöcher sind markiert (K1 bis 5). Es finden sich Präzipitatbande(n) der Probe (SK-Lysat) mitAntiseren gegen Fi- brinogen (K1), FDP-D (K2) und gegen FDP- .(K3) sowie Präzipitatbande mit Anti-FDP-D nach vorangegangener Prä- zipitation von FDP-E-Antigen (K4) und entsprechend (K5) die Präzipitatbande mit Anti-FD P-E nach vorangegangener Ent- fernung der Moleküle mit FDP-D-Antigen aus der Probe mittels Immunprazipitation (Immunpräzipitationen mit Kaninchen- Antiseren der Behringwerke AG).
Interpretation: Nach 30 min Fibrinolyse (A) zeigt sich mit Anti-Fibrinogen eine Doppelbande (K1), deren kathodennaher Anteil mit Anti-FD P-D isoliert dargestellt wird (K2); während diese Bande zum größten Teil aus FD P-D besteht (K2 im Vergleich zu K4), enthält die anodennahe Bande nur geringe Mengen von FD P-E (K5 mit vorangegangener Entfernung· der FDP-D-Antigene im Vergleich zu K3). Nach WO min Lysezeit (B) zeigt das Präzipitationsmuster fast nur noch FD P-D und FD P-E: Die Präzipitate K2 und K4 bzw. K3 und K5 sind kongruent nach Entfernung der Moleküle mit FDP-E-(K4) bzw. FDP-D-Antigenen (K5)
Die semiquantitative Analyse hat eine gute Aussagekraft, wenn auf einem Gel sowohl die Probe als auch eine mit- geführte Standardlösung in jeweils zwei verschiedenen Verdünnungen visuell gut bewertbare Immunpräzipitatio- nen ausbilden. Die dazu erforderliche Bewertung der Prä- zipitatstärke (von Probe und Standard im Vergleich) er- fordert nur geringe Erfahrung.
Das in Abb.1 dargestellte Verdünnungs- und Applika- tionsschema bewährte sich für zuverlässige, semiquanti- tative Titerangaben, z.B. in der Routinediagnostik des Faktors VIII assoz. Antigens und FXI l IS-Nachweises.
Bei einigen Antigenen traten reproduzierbare Doppel- bis Mehrfachbanden auf, zum Teil auch in Abhängigkeit vom verwendeten Antiserum.
Mehrfachbanden sind ein Hinweis für Moleküle mit un- terschiedlichem Molekulargewicht oder unterschiedli- cher Ladung aber gleichen antigenen Determinanten; da- neben können sie auch durch mangelnde Spezifität der Antiseren bedingt sein (mono-/polyspezifische Antise- ren).
Durch Antigenverwandtschaft aller Fibrin (ogen)-Spalt- produkte entstehen zum Beispiel mit einem Antikörper gegen Fibrinogen Doppel- bis Mehrfachbanden. MitAn- tiseren gegen die Determinanten FSP-D bzw. -E ließen sich FSP-E bzw. -D spezifisch durch Ausschlußreaktion
(= indirekt) nachweisen. Eine weitere Möglichkeit war die Präzipitation von FSP-D oder FSP-E mit entspre- chendem Antiserum vor dem Auftragen, weil die Immun- komplexe in der CIE nicht mehr wanderten (10): Fibrino- gen- und Fibrinlysate wiesen ein unterschiedliches Ver- teilungsmuster der Spaltprodukte auf; bei Patienten mit therapeutischer Fibrinolyse und bei in vitro-Versuchen waren zu Beginn kurzzeitig FSP-X und FSP-Y flüchtig nachweisbar, dann sicher zunächst FSP-D und erst deut- lich später FSP-E (Abb.3).
Schlieren im Gel direkt um die Auftragsstelle traten un- spezifisch bei manchen Plasmen oder (Anti-)Sereh auf,
anscheinend abhängig von der (Lipid-)Zusammenset- zung der Probe.
Diskussion
Im Vergleich zu anderen Möglichkeiten des Proteinnach- i weises in der Labordiagnostik oder bei wissenschaftli- >
chen Fragestellungen zeichnen sich immunologische Methoden durch gute - dem Enzymnachweisvergleich- bare — Spezifität und Sensitivität aus.
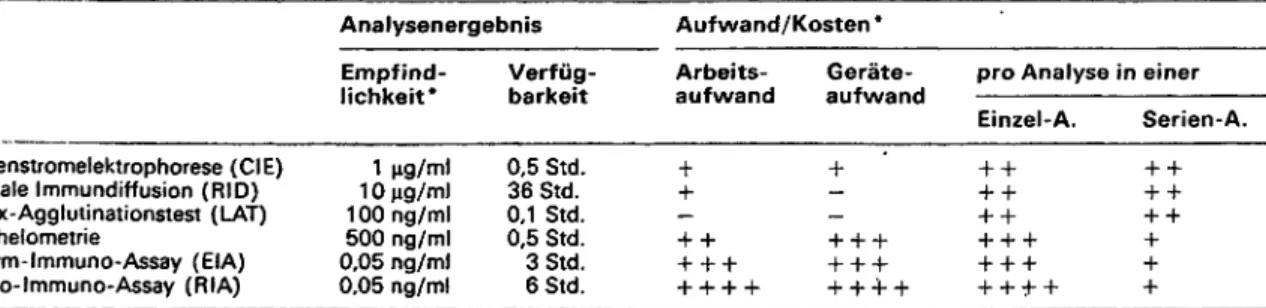
Gegenüber bewährten immunologischen Techniken wie Latex-Agglutinationstest (LAT), Radiale-lmmun-Diffu- sion (RID), Nephelometrie, Radio-lmmuno-Assay (RIA) und Enzym-lmmuno-Assay (EIA) oder Hämagglu- tinationstest sind für die Gegenstromelektrophorese ( = Überwanderungselektrophorese, CIE) folgende Vorteile zu nennen (vgl. 11—15):
— einfache Handhabung und rasche Durchführung
— schnelle Ergebnis-Verfügbarkeit, kurze Analysenzeit
— geringer apparativer Aufwand
— gute Sensitivität (bis ca. 1 g Antigen/ml)
— hohe (immunologische) Spezifität
— kleines Probenvolumen (10 /Ansatz).
Bezüglich Durchführung, Aufwand und Aussagewert ist die CIE vergleichbar der RID. Die Vorteile der CIE hin- sichtlich Analysendauer und -Empfindlichkeit'sind be- dingt durch die direkte Überwanderung von Antigen und Antikörper im elektrischen Feld gegenüber der radialen Diffusion bei der RID; diese liefert zwar quantitativ besser, auswertbare Ergebnisse, jedoch mit geringerer Empfind- lichkeit (bis Faktor 10 hinsichtlich der Nachweisgrenze);
außerdem benötigt die CIE nach dem Probenauftrag eine Analysenzeit von nur ca. 20-40 min, während bei der RID ein Ergebnis erst nach 24-48 Std. vorliegt. Auf- grund der langen Analysendauer sind die RID, aber auch ; EIA und RIA (Ergebnisse erst nach etwa 3-6 Std.) für die Akutdiagnostik weniger geignet.
Die NephelometrJe liefert relativ rasch Ergebnisse, die zu- dem in der Quantifizierung noch wesentlich sensitiver und exakter als bei der Cl E ausfallen; nachteilig ist jedoch der hohe apparative Aufwand sowie die Wirtschaftlichkeit dieser Methode erst bei größeren Analysenserien.
Für Einzelproben in der Routine-/Akut-Diagnostik bietet sich der Latex-Agglutinationstest an (ca. 5 min Analy- senzeit), der zum Nachweis von Fibrinspaltprodukten, Rheumafaktoren, Antistreptolysin und anderen Antige- nen Verwendung findet; die Verfügbarkeit der je nach Fragestellung mit spezifischen Antikörpern beschichteten Latexpartikeln schränkt jedoch den universellen Einsatz dieser Methode ein.
Demgegenüber gelingt mit der Gegenstromelektropho- rese der Nachweis vieler verschiedener Antigene und An- tikörper auf gleichen Agarosegelen, denn die Cl E läßt sich mit geringem Aufwand an unterschiedliche Fragestellung anpassen (Verdünnungen der aufgetragenen Lösungen, Gel-Elektroendosmose, Laufzeit): mit dem zur Probe kor- respondierenden Antikörper/Antigen gelingt ein Nach- weis, wenn sichtbar präzipitierende Immunkomplexe ent- stehen, meist bei Antigenkonzentrationen über ca. 1 g/
ml.
Die CIE ist hinsichtlich der Empfindlichkeit der RID ein- deutig überlegen, wohl auch dem LAT, wobei die appara- tiv und auch sonst sehr aufwendigen Methoden wie Ne- phelometrie, RIA und EIA noch empfindlichere und vor allem besser quantifizierende Ergebnisse liefern. Für die Akutdiagnostik von einzelnen Proben jedoch, bei denen der semiquantitative Antigennachweis ausreicht, bietet sich die Gegenstromelektrophorese an. Die Anwen- dungsgebiete sind vielfältig und liegen neben der medizi- nischen Diagnostik (1) in wissenschaftlichen Fragestel- lungen dort, wo ein rascher Nachweis von Antigenen oder Antikörpern erforderlich ist und einerseits ein semi- quantitatives Ergebnis ausreicht, andererseits es nicht lohnt, großen Aufwand in eine Methodenerarbeitung zu investieren.
Die gute Praktikabilität der hier benutzten Gelträger und hervorragende Reproduzierbarkeit der Ergebnisse auch bei nur gelegentlicher Anwendung der Methode erhöht einerseits die Anwendungsmöglichkeit und zum anderen die Aussagekraft. Unter Verwendung des angegebenen Testsystems waren die Ergebnisse einfach, ohne großen Analysenaufwand und auch durch Ungeübte fehlerfrei zu erzielen.
In der Gerinnungsdiagnostik "lassen sich ergänzend zu den üblichen, funktionellen Tests nahezu alle Faktoren der plasmatischen Blutgerinnung und Fibrinolyse, deren Inhibitoren sowie die Akutphasen-Proteine, immunolo-
gisch nachweisen (16). Fast alle Plasmaproteine der Blutgerinnung und Fibrinolyse ließen sich gegenstrom- elektrophoretisch nachweisen (Tab.1); für die Schwie- rigkeiten beim Nachweis des Faktors VII wird als Ursache u.a. die Variabilität der Molekülladung diskutiert, anstelle eindeutiger Präzipitatbanden waren nur Schlieren nach- zuweisen.
Bei Störungen der globalen Blutgerinnung lassen sich z.T. relativ einfach und schnell zusätzliche diagnostische Hinweise gewinnen; z. B. wurde bei Diskrepanz zwischen normalem Fibrinogenspiegel in der Hitzefällung (nach Schulz) und fehlendem Fibrinogen im funktioneilen Nachweis (nach Clauss) eine mangelnde Aktivierbarkeit des Fibrinogens durch eigenes oder in vitro zugefügtes Thrombin gezeigt.
Der Nachweis des Faktor VIII assoziierten Antigens (FVIII R:Ag) in der v. Willebrandt-Diagnostik ist mehrfach be- schrieben (13, 17); die CIE stellt dabei eine gut prakti- kable Alternative zur aufwendigen Rocket-Immunelek- trophorese (nach Laurell) dar.
Auch der gegenstromelektrophoretische Nachweis von Protein S, dem Cofaktor von Protein C, ist möglich. Wäh- rend Protein C inzwischen auch funktionell nachgewie- sen wird, ist der Nachweis von Protein S bislang nur im- munologisch möglich, die semiquantitativen Ergebnisse (in Titerstufen) schränken jedoch die Aussagekraft des Protein S-Nachweises in der CIE ein.
Die Faktor XI11-Aktivität wird mit den üblichen Gerin- nungstests nicht erfaßt und daher anhand der Löslichkeit eines definierten Fibringerinnsels in Monochlor-Essig- säure semiquantitativ in Titerstufen bestimmt (funktio- neller Schnelltest). Der erarbeitete Nachweis von FXIIIS in der Gegenstromelektrophorese ist ähnlich einfach durchführbar, liefert ebenfalls semiquantitative, aber ge- ringfügig sensitivere Ergebnisse und erlaubt ferner durch verschiedene verfügbare Antiseren Faktor XI11-A und -S zu differenz'ereh (18).
In der Immunologie (Bakteriologie/Serologie) lassen sich Antikörper gegen Bakterien, Viren, Pilze und Toxine nachweisen (15, 19 — 21); IgG-Antikörper nach einer Impfung gegen dasTetanus-Toxin (22), Pneumokokken- Antikörper sowie die Antistreptokinase-Aktivität, die vor einer Fibrinolysetherapie zu überprüfen ist, sind nur we- nige Beispiele (23, 24). Bei Verdacht auf eine frische Hepatitis B-lnoculation kann der Nachweis von HBs-An- tigen in der vermeintlich infektiösen Probe oder der Nach- weis von vorhandenen HBs-Antikörpern unter Umstän- den schon rasche Hilfe zur Klärung der dringlichen Frage liefern, ob eine sofortige passive Immunisierung mit Hy- perimmunglobulin ratsam ist (11,14, 25).
Tab. 2: Gegenüberstellung immunologischer Routinemethoden
Analysenergebnis Aufwand/Kosten *
Gegenstromelektrophorese (CIE) Radiale Immundirfusion (RID) Latex-Agglutinationstest (LAT) Nephelometrie
Enzym- Immuno-Assay (EIA) Radio- Immuno-Assay (RIA)
Empfind- lichkeit*
10 g/ml 1 00 ng/ml 500 ng/ml 0.05 ng/ml 0,05 ng/ml
Verfüg- Arbeits- Geräte- pro Analyse in einer Einzel- . Serien-A.
0,5 Std. + + ++ + + 36 Std. + - ++ + + 0,1 Std. - - + + + + 0,5 Std. ++ + + + + + + +
3Std. + + + + + + + + + +
* Bemerkung: Analysenempfindlichkeit, nur Anhaltswert (grob geschätzt, stark abhängig von Antikörper und Aniigen);
Analy&enaufwand geschätzt für Einzelanalyse bzw. für Serie von 10 Proben
Lab.med.13:333(1989) 333
Der 5-Sekunden-Reader
TITERTEK
MULTISKAN®
PLUS MK II
Natürlich
mit Auswertung
Informationen:
Flow Laboratories GmbH Mühlgrabenstraße 10 D-5309Meckenheim Tel. (02225) 88050 Telex8869334aflod Fax (022 25) 880581
334 Lab.med 13: 334 (1989)
Laboratories
In der jederzeit raschen Ergebnisverfügbarkeit von einzel- nen Proben liegt hier der Vorteil der CIE; die quantitativ ·- sensitiveren und exakteren Ergebnisse aus Radio-/En- zym-lmmunoAssay benötigen wesentlich längere Zeit · und sind erst bei größeren Analysenserien wirtschaftlich.
Jedoch schränken Sensitivität und nur semiquantitative Ergebnisse bei einigen Anwendungen die Aussagekraft j der CIE ein. Zum Beispiel wurde auch der gegenstrom- elektrophoretische Nachweis von Antikörpern im Rah- men von HIV-Infektionen untersucht (26). Bei Patienten mit AIDS oder generalisiertem Lymphadenopathie-Syn- drom waren Antikörper mit der ELISA-Technik bei 81%
der Proben nachzuweisen und mit der CIE nur in 59% (bei Mehrfachanalyse der gleichen Probe in 68%) der Proben.
Die Leptospirose läßt sich dagegen sehr gut mit der CIE nachweisen (27).
Weitere Anwendungen, Einsatz im wissenschaftlichen Bereich: . Zur funktionellen Antithrombin Ill-Heparin-Bindung ge- ; langen Versuche in einem Agarose-Gel mit Heparin durch \ Beeinflussung der Wanderungsgeschwindigkeit bis zur | Immunpräzipitation mit dem ATI 11-Antikörper. | Ebenfalls von wissenschaftlichem Interesse ist die er- ! probte Differenzierung der Fibrin(ogen)-Spaltprodukte (= FSP, je nach Stadium der Fibrinolyse FSP-X, -Y, -D,-E) (10, 12,28).
Durch Antigen-Verwandtschaft von Fibrin(ogen) mit sei- nen der Spaltprodukte entstehen mit einem Antikörper gegen Fibrinogen Doppel- und Mehrfachbanden; eine Differenzierung ist mit Antiseren gegen spezifische Deter- minanten z.B. FSP-D und -E sowie durch das Vertei- lungsmuster der Präzipitatbanden möglich (10).
Ein ähnliches Problem stellt die Differenzierung der C3- Spaltprodukte dar: Gleiche antigene Determinanten des Ausgangsmoleküls und der Spaltprodukte führen zu Kreuzreaktionen mit den Antiseren; in der CIE entstehen Doppel- und Mehrfachbanden durch unterschiedliche Wanderungsgeschwindigkeit in Abhängigkeit von Mole- külgröße und Ladung der C3-/FSP-Spaltprodukte.
Eigene Ergebnisse der C3-Aktivierung mit aggregiertem IgG und Immunkomplexen entsprechen der Literatur (29), haben aber keine Bedeutung für klinische Frage- stellungen.
Auch bei anderen, untereinander ähnlichen Methoden ist eine einfache immunlogische Differenzierung mittels der CIE beschrieben (30, 31). Apolipoproteine-A1, -A2, -B, -C (und -D) sowie -E lassen sich mit den entsprechenden Antiseren, vergleichbar den Faktoren der Blutgerinnung gut nachweisen. Durch Modifikation der Gel-Zusam- mensetzung lassen sich selbst niedrige Konzentrationen von schlecht präzipitierenden kleinen Molekülen nach- weisen; PEG-Zusatz zur Verstärkung der Präzipitation er- laubt z. B. sogar den Myoglobin-Nachweis (32).
Viele vergleichbare Anwendungen der CIE sind veröffent- licht, weitere denkbar; möglich ist der Nachweis von An- tigenen oder Antikörpern, wenn präzipitierende Immun- komplexe in ausreichender Menge und damit sichtbare Präzipitate entstehen. Ein geeignetes AG-AK-Verhältnis ist durch Verdünnung oder auch Anreicherung (der AG- öder AK-Lösungen) zu erzielen, ggf. auch durch eine AK- Ammoniumsulfat-Fällung (10).
Folgende Weiterentwicklungen der Gegenstromelektro- phoresesmd denkbar:
Steigerung der Sensitivität: Antigen-/Antikörper-An- reicherung (10) insbesondere aber Präzipitat-Anfär- bung (33) oder-Fällung, z. B. durch PEG-Zusatz (32) sind denkbare Möglichkeiten.
Bessere Quantifizierung: eine genauere Bestimmung der Konzentration ist zum Beispiel durch geräteopti- sche Präzipitatauswertung versucht worden, ist aber aufgrund des großen technischen Aufwandes wenig praktikabel.
Molekülabhängige Auftrennung: die Lage der Präzi- pitatbanden ist u.a. abhängig von Molekülgewicht und -Ladung; dies könnte (evtl. durch Gele mit Sie- beffekt) genutzt werden bei der Auftrennung von ähnlichen Molekülen (30,31) oder v.on Bruchstücken mit gleichen antigenen Determinanten (5) wie bei den Fibrin(ogen)- oder C3-Spaltprodukten.
Schrifttum:
1. ESTELA, LA., HEINRICHS.!. F.: Evaluation ofthecounterimmunoelectrophoretic (CIE) procedure in a clinical laboratory setting. Am. J. Clin. Path. 70. 239-243 (1978).
2. BUSSARD, A.. PERRIN, D.: Elektrophoresis in agar plates. J. Lab. Clin. Med. 46.
689-701 (1955).
3. JOHANNSSON. B. G.: Agarose Gel Electrophoresis. Scand. J. Clin. Lab. Invest.
29. Suppl.124, 7-19 (1972).
4. OUCHTERLONY. ö.: Diffusion-in-gel methods for immunological analysis II.
Progr. Allergv 6. 20-154 (1962).
5. GRUBB, A.: Analysis of the Immunochemical Relationship between Antigens by Electrophoresis in Agarose Gels Containing Antibodies. Scand. J. Clin. Lab. Invest.
29. Suppl. 124. 59-65 (1972).
6. LAURELL. C.-B.: Electroimmuno Assay. Scand. J. Clin. Lab. Invest. 29, Suppl. 124.
21-37(1972).
7. BUSSARD, A.: Description d'une technique combinat simultanement l electropho- rese et la precipitation immunologique dans un gel: l electrosynerese. Biochim. Bio- phys. Acta (Amst.) 34. 258-260 (1959).
8. GAN ROT, P. 0.: Crossed Immunoelectrophoresis. Scand. J. Clin. Lab. Invest. 29.
Suppl.124. 39-47(1972).
9. LANG. N., HAAN. J.: Nachweis präzipitierender Antikörper und nichtpräzipierender Antikörper durch die Überwanderungs-Elektrophorese. Int. Arch. Allergy 10, 305—
316(1957).
10. BEHNKE. J.: Methodik zur Differenzierung von Fibrin(ogen)-Spaltprodukten mit der Gegenstromelektrophorese und deren Anwendung. Med. Dissertation, Göttingen 1985.
11. ALTER. H. J.. HOLLAND. P. V., PURCELL, R. H.: Counterelectrophoresis for detection of hepatitis-associated antigen: Methodology and comparison with gel diffusion and complement fixation. J. Lab. Clin. Med. 77,1000-1010 (1971).
12. FERGUSON, A. C.. KENNEDY, H., AN K, B. J.. STURGEON. P.. STIEHM, E. R.:
Detection of fibrinogen degradation products. A comparison of counterimmunoelec- trophoresis and two hemagglutination Inhibition methods. Am. J. Clin. Path. 62,861 - 868(1974).
13. GIROLAMI. A.. STICCHI. A.. BARBUI. T.. BAREGGI. G.: Factor VIII immunologi- cal assay. An evaluation of several methods using whole plasma. Blut 29. 309 — 316 (1974).
14. HICKS, E. J.. HUGHES. B. J.: Comparative Sensitivies of Radioimmunoassay.
Crossover Electrophoresis, and Agar Gel Immunodiffusion for HBAg Detection Am J. Clin. Pathol. 65. 540-546 (1976).
15. GUNASEKARAN, M.. SAMBANDAM. T.: Rapid diagnostic methods for aspergillosis. Zentralbl. Bakteriol. Mikrobiol. Hyg. A261. 523-528 (1986).
16. SCHWICK, H. G., TROBISCH. H.. HEIMBURGER. M.: Leistungsfähigkeit und Grenzen immunologischer Methoden in der Gerinnungsdiagnostik. Internist 14 160- 165(1973).
17. BUDDE. U., BECKER. P.. KAISER. A.: Bestimmung des Faktor VI11-assoziierten Antigens mittels Überwanderungselektrophorese im Vergleich zur Elektroimmunodif- fusion nach Laurell. Arztl. Lab. 26.70-73 (1980).
18. WIEDING. J. U.. CLAUS. G.. VEHMEYER. K., SCHUFF-WERNER. ?., KÖSTE- RING, H.: Bestimmung des Faktors XIII in der Gegenstromelektrophorese: Beschrei- bung des Tests und erste Ergebnisse im Vergleich zur funktionalen Methode. In:
KÖSTERING, H. (ed.). Onkologie und Blutgerinnung. S. 111 -118. Schattauer Verlag Stuttgart (1983).
19. JAMES. J. F.. SULLIVAN. P. S.. ROBERTS. D. R.: Counter electrophoresis and detection of viruses. Lancet l, 99-100 (1975).
20. NAIMAN. H. L., ALBRITTON, W. L: Counterimmunoelectrophoresis in the di- agnosis of acute infection. J. Infect. Dis. 142, 524-531 (1980).
21. SMITH, J. M. B.: Counterimmunoelectrophoresis and opportunistic fungal infec- tions. Mycopathologica (Den Haag) 60. 99-104 (1977).
22. HOLZNER. A.: Immunstatus nach Tetanus-Impfung; Möglichkeiten und Indika- tion der quantitativen Schnellbestimmung von Tetanus-Antikörpern im menschlichen Serum. Fortschr. Med. 13. 680-683 (1978).
23. AUEL. H.. MARTIN. M.: Die Technik des quantitativen Streptokinasenachweises im Plasma. Klin. Wschr. 53, 809-814 (1975).
24. GERLACH. D, KOEHLER. W.: Untersuchungen zur Heterogenitaet von Streptoki- nasen. Zbl. Bakt. Hyg. 1. Abt. Orig. A244. 222-228 (1979).
25. GOCKE. D. J.. HOWE. C.: Rapid detection of Australia antigen by Counterimmu- noelectrophoresis. J. Immunol. 104,1031 -1032 (1970).
26. BLASER. M. J.. COHN. D. L, CODY. H. J., PENLEY. K. A.. JUDSON. F. N..
SAXINGER, W. C., WEISS. S. H.: Counterimmunoelectrophoresis for detection of human serum antibody to HTLV-III. J. Immunol. Methods 91,181-186 (1986).
27. MYERS. D. M.: Serodiagnosis of human leptospirosis by Counterimmunoelectro- phoresis. J. Clin. Microbiol. 25, 897-899 (1987).
28. BRODY, J. l.: Detection of fibrinogen-fibrin degradation products by Counterelec- trophoresis. J. Clin. Path. 25. 754-756 (1972).
29. ARROYAVE. C. M.. TAYLOR. D. G., GALLUP. P.. NAKAMURA. R. M.: Screening test for complement activation by Counterimmunoelectrophoresis. Am. J. Clin. Path.
69.440-445(1978).
30. GIROLAMI, A.. BAREGGI. G.. FIORETTI, D.: Different cross-over electrophoretic mobility of factorX Friuli and coumarin-induced abnormal factorX. Haemostasis 1, 229-236(1973).
31. LEWIS, J. H., WILSON, J. H.. BRANDON. J. M.: Counterelectrophoresis test for molecules immunologically similar to fibrinogen. Am. J. Clin. Path. 58. 400-404 (1972).
32. HIRAMORI, K.. SUMIYOSHI, T.: Rapid. sensitive detection of myoglobinemia by improved Counterimmunoelectrophoresis in cases of acute myocardial infarction. Am.
HeartJ. 2.187-190(1978).
33. CROWLE. A. J., CLINE, L. J.: An improved stain for immunodiffusion Tests. J.
Immunol. Meth. 17, 379-381 (1977).
Anschriften der Verfasser:
Dr. Jörk Ulrich Wieding Günther Claus Dr. Julianne Behnke Gundel Eisinger Haematologie Universitätskliniken
3400 Göttingen D
Lab.med.13:335(1989) 335