AUS DEM LEHRSTUHL FÜR CHIRURGIE PROF. DR. HANS J. SCHLITT DER FAKULTÄT FÜR MEDIZIN DER UNIVERSITÄT REGENSBURG
Volltext
Abbildung

ÄHNLICHE DOKUMENTE
Objectives: Fenestrated/branched thoracic endovascular repair (F/Br-TEVAR) is increasingly applied for atherosclerotic thoracoabdominal aortic aneurysm (TAAA); however, use
Aus der Zusammenschau der Studien kann man sich dabei jedoch wie folgt orientieren: Die Indikation zur SLNB wird ab einer Tumordicke von 1,0 mm (ab Stadium IB) in Abwesenheit
(2003) Gemcitabine Plus Vinorelbine Compared With Cisplatin Plus Vinorelbine or Cisplatin Plus Gemcitabine for Advanced Non– Small-Cell Lung Cancer: A Phase III Trial of the
Die Verschiebung in der Altersstruktur als Folge von niedrigen Geburtenraten und steigender Lebenserwartung ist ein Phänomen, welches die Bundesrepublik Deutschland vor neue
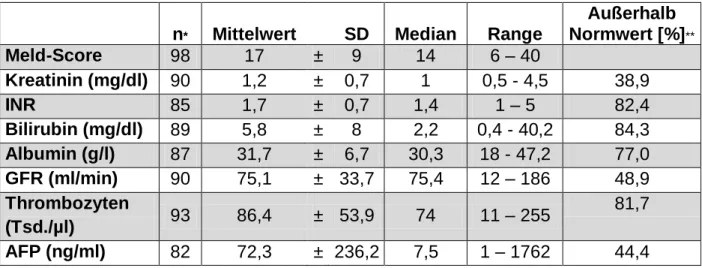
Multivariate Analyse signifikant: Patientenalter, Zirrhose, Mikrovaskuläre Invasion für DFS, Tumor Grading, Tumor Zahl.. Hwang Liver Transpl 2007
Unter Berücksichtigung der Risikofaktoren für die Entwicklung einer Arteriosklerose wird nach Literaturrecherche außerdem untersucht, ob die Kombination Acolysis® mit
Auch in der Indikation der rheumatoiden Arthritis fallen Unterschiede in den jeweiligen Fachinformationen auf. Zunächst zeigen sich
Es konnte hier gezeigt werden, dass das Protein spezifisch in mit SOCS-3 Gen enthalten- den Plasmiden transfizierten Zellen vorhanden war, wohingegen nicht in unbehandelten
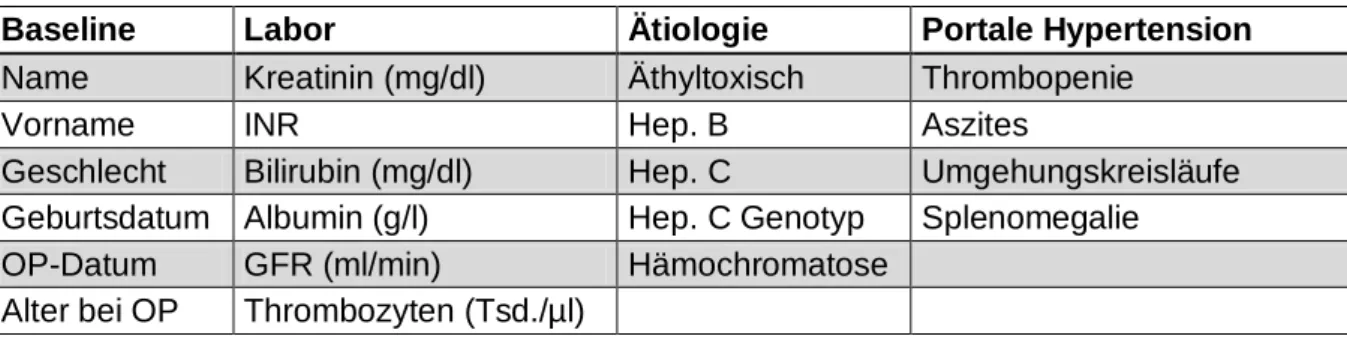
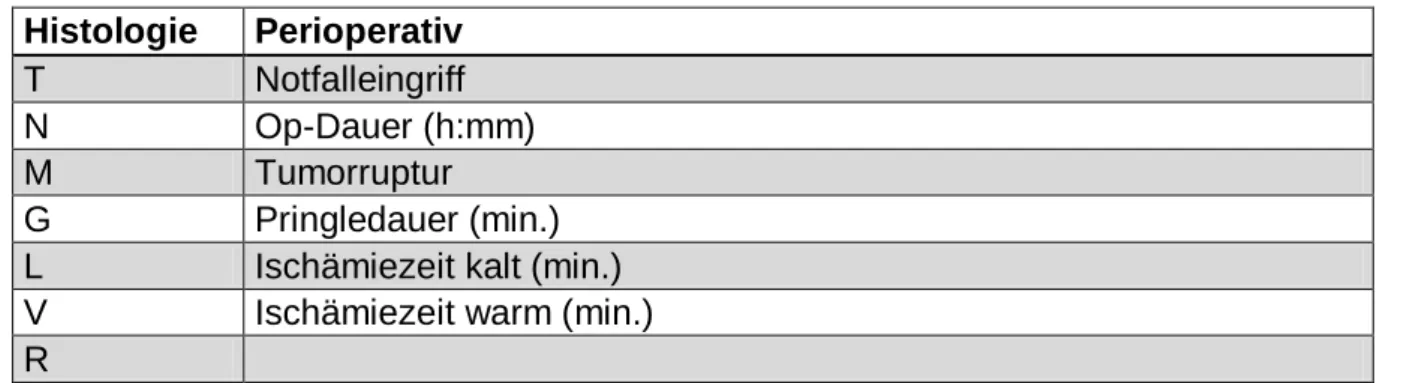
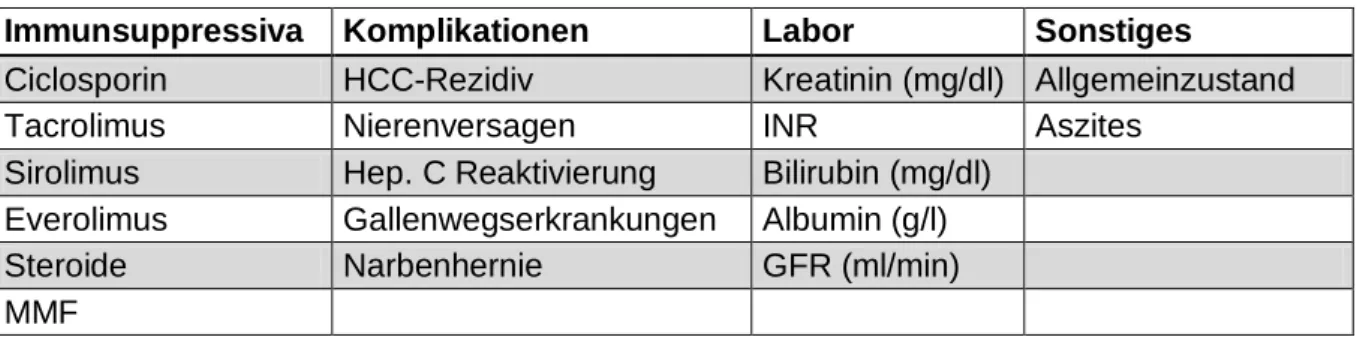
![Abbildung 2 Ätiologie 33,3 9,8 30,4 1 7,8 17,6020406080100Häufigkeit [%]](https://thumb-eu.123doks.com/thumbv2/1library_info/3941250.1533337/46.892.104.787.698.1047/abbildung-ätiologie-häufigkeit.webp)