Zusammenfassung
„Synthese und biologische Evaluierung von Indol-Alkaloid-Analoga und kombinatorische Synthese von Dekalinen“
Phosphatasen sind Schlüsselregulatoren zahlreicher Lebensprozesse und deshalb ein wichtiges Ziel zahlreicher Programme zur Wirkstoffsuche, etwa in der Diabetes- und der Antikrebs-Forschung. Doch noch steckt die Kenntnis über diese Enzyme in den Anfängen, neue Inhibitoren für ihre Aktivität werden daher dringend gesucht.
Naturstoffe sind in lebenden Organismen erprobte Ausgangspunkte für die Suche nach neuen Therapeutika. Sie entstehen durch Biosynthese und stellen somit durch die Evolution ausgewählte, chemische Strukturen dar, deren strukturelle Eigenschaften an ihre jeweilige Funktion angepasst wurden, die meist durch Interaktion mit verschiedenen Proteinen vermittelt wird. Bei dem Prinzip der
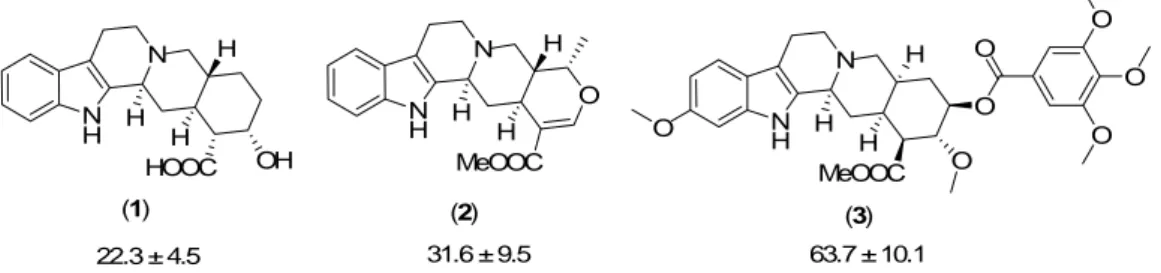
"Biologie-orientierten Synthese" (BIOS) dienen Naturstoffe als Startpunkt für die Suche nach neuen Wirkstoffen. Um die Naturstoffe an das jeweilige Enzym anzupassen, wurden in einer "Naturstoff-inspirierten Synthese" relevante Kernstrukturen der Naturstoffe genutzt, um neue Phosphataseinhibitor-Klassen mit Hilfe des BIOS-Konzepts zu identifizieren. Dazu wurden zunächst 354 isolierte Naturstoffe im biochemischen Screen auf die 7 Phosphatasen VE-Ptp, Cdc25A, Ptp1b, VHR, Shp-2, MptpA und MptpB getestet: dabei erwiesen sich drei von sieben isolierten Yohimbin-Alkaloiden (siehe Abbildung 1) als schwache Inhibitoren der dual- spezifischen Phosphatase Cdc25A.
NH N
HOOC OH H
H
H
NH N
O MeOOC H
H
H N
H N
MeOOC H
H
O H
O O O
O O O
22.3 ± 4.5 31.6 ± 9.5 63.7 ± 10.1
(1) (2) (3)
Abbildung 1. Inhibitoren der dual-spezifischen Phosphatase Cdc25A.
Prinzipiell könnte man durch entsprechende Strukturvariationen der pentazyklischen Grundstruktur Verbindungen mit gesteigerter Aktivität erhalten. Aufgrund der strukturellen Komplexität dieser Alkaloide wurde das SCONP-Prinzip, welches die
Naturstoffe in einer baumartigen Struktur anordnet und klassifiziert, als zweites Kriterium mit in die Untersuchung einbezogen und zur Strukturvereinfachung genutzt.
Dazu wurde die Grundstruktur der Yohimbin-Alkaloide (1-3) dem Indol-Zweig des SCONP-Baumes zugeordnet (Schema 1).
NH N
NH NH
NH NH
N
A
B
C
D
Schema 1. SCONP Schwinghangel für Indol-Alkaloide.
Anschließend führte ein in der Baumstruktur wurzelwärts, also in Richtung einfacherer Grundgerüste gerichtetes "Schwinghangeln" im SCONP-Baum zum tetrazyklischen Indolochinolizidin-Grundgerüst B. In einer effektiven Synthesesequenz aus vinyloger Mannich-Michael-Reaktion und Phosgen-induzierter Zyklisierung wurden daraufhin 384 Indolochinolizidine auf polymerem Träger aufgebaut (Schema 2).
NH HN O OH
(4)
NH N
O O
Fmoc
R2 O R3
R1
5b
NH 7
N O
O
R2 Cl R1
R3
H NH
N
O O
R2
O R3
R1
+
6 N O
O
R2 Cl R1
R3
N H H 5a
N H
N H HO2C
N R3
H
N H Cl
HO2C
H H N
N H HO2C
H
R3
Cl H
N N H HO2C
H
HR3
Cl H R2
R3
Cl
R2 R2
R2 R1
R1
R1
R1
H
8a 8b
8d 8c
2 Schritte und vinyloge Mannich-Michael- Reaktion
Phosgen- induzierte Cyclisierung
Abspaltung
Schema 2. Synthese der Indolo[2,3-a]chinolizidine auf polymerem Träger.
Ein Screening dieser Verbindungen ergab 4 schwache Cdc25A-Inhibitoren, womit gezeigt werden konnte, dass trotz struktureller Vereinfachungen von den pentazyklischen Alkaloiden zum Indolo[2,3-a]chinolizidin-Grunderüst durch das SCONP-Prinzip die Aktivität für das gleiche Enzym erhalten bleibt. Darüber hinaus zeigte sich aber, dass die Verbindungskollektion auch 10 Inhibitoren im niedrigen, mikromolaren Bereich für MptpB enthält. Für MptpB wurde in dieser Arbeit eine der ersten Inhibitor-Klassen gefunden, die darüber hinaus noch außerordentlich selektiv ist. Von diesen 10 Verbindungen hemmten 3 ausschließlich MptpB.
Interessanterweise enthielt die Indolo[2,3-a]chinolizidin-Bibliothek auch potente Apoptose-Induktoren. Dabei zeigte sich wie in der Zielsetzung gefordert und vermutet, eine starke Abhängigkeit der Phosphataseinhibition und Induktion der Apoptose von der Konfiguration an den Positionen 4, 6 und 12b. Eine weitere Anwendung von BIOS konnte in der Synthese von Inhibitoren von MptpB im niedrigen, mikromolaren Bereich mit Cycloocta[b]indol-Gerüst realisiert werden. Naturstoffe mit Cycloocta[b]indol-Struktur besitzen potente antiplasmodische und antiamöbische Eigenschaften (Abbildung 3).
N N
O
Me H
H H
H
N N
CO2Me H H
H H
N
N
O H H
H H
N N
CO2Me H H
H O
Macrocarpamin
antiamöbisch Villalstonin antimalaria
(9) (10)
Abbildung 3. Antiamöbische und antiplasmodische Alkaloide mit Cycloocta[b]indol- Grundgerüst.
In einer Synthesesequenz aus asymmetrischer Pictet-Spengler-Reaktion und Dieckmann-Zyklisierung konnten 119 Cycloocta[b]indole hergestellt werden. Dabei konnte die extrem hohe Diastereoselektivität aus diesen beiden Reaktionsschritten von der Lösungssynthese auf die feste Phase übertragen werden (Schema 3).
NH O
OH NHFMoc
NH O
O N
12
O OR2
R1
13 2 Schritte und
enantiospezifische Pictet-Spengler-Reaktion
Abspaltung und Dieckmann- Cyclisierung
NH O
OH NHFMoc
NH O
O N
15
O O
R1
(R)16 Abspaltung
und Dieckmann- Cyclisierung 2 Schritte und
enantiospezifische Pictet-Spengler-Reaktion Fmoc-D-Trp
Fmoc-L-Trp (11)
14
(S) NH
N R1 H
H
O O R2
NH N
R1 H O
H
O O R2 O
Schema 48. Synthese beider Cycloocta[b]indol-Enantiomere auf fester Phase.
Eine biochemische Evaluierung der Cycloocta[b]indol-Bibliothek lieferte 4 Hits für MptpB und 2 Hits für Ptp1b mit einem IC50-Wert unter 10 µM.
Darüber hinaus konnte in dieser Arbeit die Aldolkondensation am Dekalingerüst zur Herstellung von 213 Dekalin-Analoga genutzt werden (Schema 4).
O O
O
O O
O
1) 12 Äqu. LDA, 25°C, 30 Min 2) 12 Äqu. RCHO, 30 Min, 0°C, 2 h, 25°C
17
O O
O
O O
O 18a
R
18b R
Schema 4. Synthese von Dekalin-Analoga auf fester Phase.
Im Rahmen dieser Arbeit wurde mittels Festphasensynthese ein schneller und effektiver Zugang zu komplexen Naturstoff-inspirierten Verbindungsbibliotheken mit Indolo[2,3-a]chinolizidin- und Cycloocta[b]indol-Gerüst in hohen Ausbeuten eröffnet.
Weiterhin wurde eindrucksvoll gezeigt, wie erfolgreich das Konzept der Biologie- orientierten Synthese für die gezielte Suche nach neuen Verbindungsklassen und für die Entwicklung neuartiger Therapeutika eingesetzt werden kann. Die identifizierten Inhibitoren von MptpB und Induktoren der Apoptose könnten interessante Startpunkte für die Entwicklung neuer Tuberkulose- und Antikrebsmedikamente sein.
![Abbildung 3. Antiamöbische und antiplasmodische Alkaloide mit Cycloocta[b]indol- Cycloocta[b]indol-Grundgerüst](https://thumb-eu.123doks.com/thumbv2/1library_info/3628557.1502127/4.892.114.776.102.445/abbildung-antiamöbische-antiplasmodische-alkaloide-cycloocta-indol-cycloocta-grundgerüst.webp)