Bei dieser Datei handelt es sich um ein Protokoll, das einen Vortrag im Rahmen des Chemielehramtsstudiums an der Uni Marburg referiert. Zur besseren
Durchsuchbarkeit wurde zudem eine Texterkennung durchgeführt und hinter das eingescannte Bild gelegt, so dass Copy & Paste möglich ist – aber Vorsicht, die Texterkennung wurde nicht korrigiert und ist gerade bei schlecht leserlichen Dateien mit Fehlern behaftet.
Alle mehr als 700 Protokolle (Anfang 2007) können auf der Seite
http://www.chids.de/veranstaltungen/uebungen_experimentalvortrag.html
eingesehen und heruntergeladen werden.
Zudem stehen auf der Seite
www.chids.deweitere Versuche, Lernzirkel und Staatsexamensarbeiten bereit.
Dr. Ph. Reiß, im Juli 2007
Ute Babbel 10. Semestrer Bi o/ Chemie
Pro t okol l zum Lehramt sv or t r a g
"Natürliche Far bst offe "
vom 12.7.1 989
GliGderung: Seit e
1 • Einlei tung 1
2. Vorkommen na t ürli ch er Fa r b s t of f e 3
3. Blat t f arbs t offe 7
4. Blüt en- un d Frucht fa rbs tof f e 24
5. Färben mit Na t u rf a r bst offen 32 6. Augenfar bstof fe von Drosophil a mel ano ga ster 38
7. Chemi lumi nesz enz und Biolumi ne s zenz 40
Einleitung:
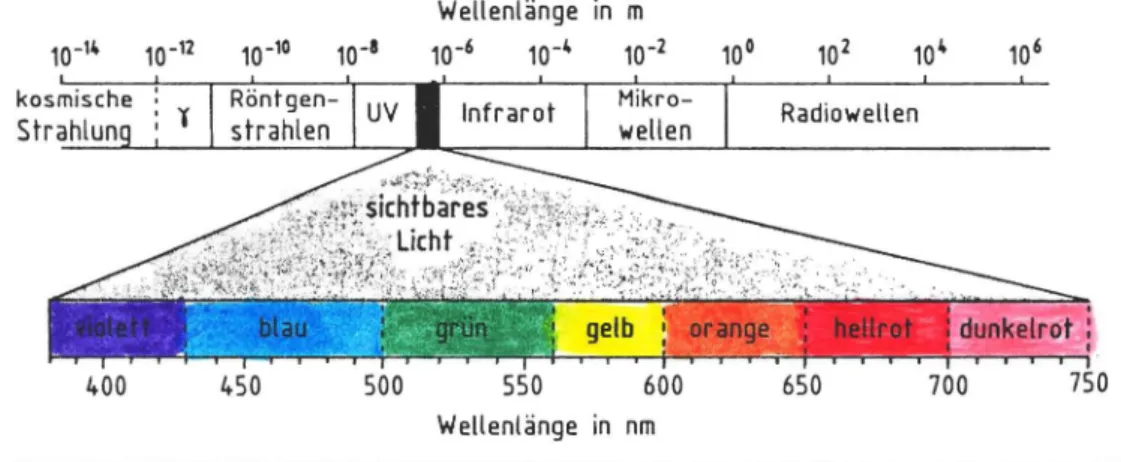
Im wei ten Ber ei ch der elektromagnet is ch en Strahlung nimmt das sichtbar e Li cht nur ein en sehr geringen Platz ein, genauer ge s a gt eine Spanne von 40 0 bis 70 0 nm.
Die Abbil dung veran schaulicht das eben Ge schri ebene und ordnet außerdem den Wel l enlängen die en ts prechende Farbe zu:
Wellenlänge in m
10-14 10-12 10-10 10-8 10-6 10-4 10-2 100
Radiowellen
400 450 500 550 600 650 700 750
Wellenlänge in nm
Abb. 1: Arten elektr omagnetisch er Strahlung zur Einordnung des für da s men schliche Au ge sichtbaren Lichtes
Tabelle 1 gibt die umgekehrte Pr oporti onali t ä t von Wellen- länge und Energieinhalt einer Lichtfarbe wieder.
Je größer die Wß l len l än ge ei ne r Lichtfarbe, desto ger i n ger deren Energiegehalt.
Diese Relation geht auch aus der darübergeschriebenen mathematis chen Gleichung hervorn
Ei n farbiger Sto f f besitz t ei n Absorpt ionsmaximum im sichtbaren Ber eich el ekt romagnet ischer Strahlung .
Eine schwarze Sub stan z abs or biert sämtli ch e Strah l un g aus dem Bereich von 400 bis 700 nm zu 10 0
% .
Erscheint ei n eSubs t anz grau, so abso rb i ert Si e ei nen bestimmten prozentualen Ant eil des gesamten sichtbaren Spektrums, ei n weißer Stoff
Chemie in der Schule: www.chids.de
-- 2 -
wiederum reflektiert sämtlich e elektromagnet i sche Strahlung au s dem Berei ch zwisch en 40 0 bis 700 nm.
Abb. 2 verdeutl icht di es e Def i nitionen von Far be, bzw. der Farbei n dr ü ck e schwar z, grau und wei ß.
-'
-- U
Wellenlänge in nm
700
650
600 500 438 400Tab . 1
Lichtfarbe
rot hellrot gelb blaugrün blau violett
Energie in kJ· mol"
171 184 199 239 272 298
Int ere ssant ist , da ß Sub s t anzen mi t der Lichtf arbe "grün"
zwei Abs orpti onsmaxima im sichtbaren Bereich besitzen :
1. zwi. 380 und 480 nm im roten Bere i ch 2. zwi . 580 und 700 nm im blauen Bere i ch
Auf die s e s Phänomen komme ich bei der Bespre chung des gr ün en B1ttfarbstoffes, der Chlorophyl le, zur ü ck .
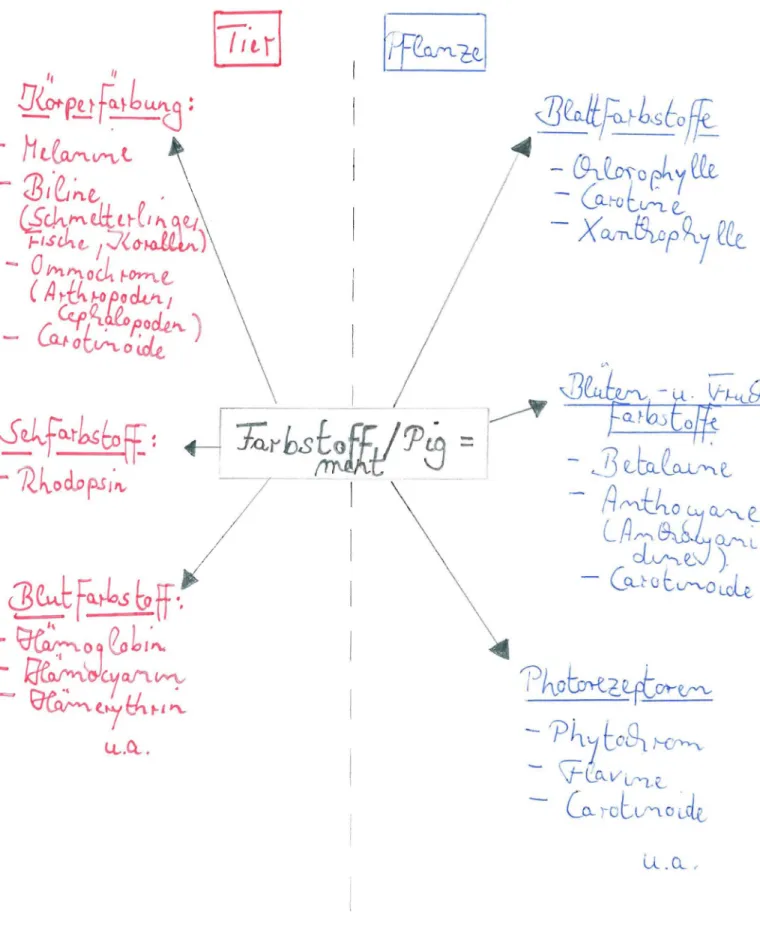
Vorkommen natürli cher Fa rbs t offe
Im Tierreich fin de t man kei n e Blau- und nur weni g Rot- und Grün t öne . Alle i n Ge lb- ,Orange - und Braunt ön e sind
dominier end . Sie verur s a chen die Körperfär bung der me i s ten Ti er e , man bezeichnet sie als Melanine,
Biline (bei Schme tt erlinge n, Fi s ch en und Kor allen), Ommochrome (bei Arthr opoden und Cephalopoden ) und Carot inoide.
Die schillernd bunte Färbung von insb e s onder e tr opi s ch en Vöge ln und Schmet terli n gen beruht auf Inter f erenz phän omen en und ist ni ch ts welter als eine Sinne stäuschung.
We i t ere Pigmente si nd der Sehfarbstoff Rhodops i n und die Vi el z ahl von sa uerstoffübertra gend en Blutfarb s to f f en wie das Hämoglobin , Hämocyani n , Hämerythri n und vie le ander e .
Im Pf lanz enr e ich trifft man auf ei ne größere Vielfalt an isolierbaren Fa rb st offen.
Es gibt zum einen di e Blattfarbstoffe, wie die Chlorophylle , di e Carot i n e und die Xant h ophylle , dan eben die Blüten-
und Frucht f arbs t of fe , wie di e blau-viole tt en Bet alaine und Antocyane (bzw. Anthocyani dine ) und die ge l b- orangenen
Carot i noi de .
Seltsamerweise wer den die vom Mens ch en als na t ür l i ch e Färbe s t off e genutzt en Farb s tof f e , wie der In di go , vom
Chemie in der Schule: www.chids.de
- 4 -
tieris chen bzw. pflanzli chen Organi smus ni ch t als Farbs to ff verwe n det.
Abb, 3 gi.b't eine gr obe Ei nt eilung pflan zli cher und tieri sch er Far bst offe .
I
JJerJt ~!- bs t
0f!i:
- C~~oe~'1ett
- (Qro ~V'1.. e.
- X OJ,J!), v/J.-J ee.e.
?~obx2.~()l-~
- 'P jl1 tc~ ,~
-
V-lr~vvv-,i.x,~Co-
/0t lfl
0~~
LL.Q ,
Die fol genden Bilder sol len die Lokal isat ion der Blatt-
und Blüt enf arbstoffe im pflanzl ichen Or gani smu s ver ansch au l i chen:
Bild 1: Zel l u lär e r Aufbau ei nes Laubmoos blättchen s. Der gr üne Blattfarb stoff i s t in speziel l en Organell en den Chlor o- pl ast en l okalisiert .
Bi l d 2: Flächenschnitt ei n e s Sansev i eria- Blat tes. Auch hi er sind di e kugeligen Chl oropl asten er kennbar , doch
zudem erk ennt man di e granuliert e Strukt u r der Chl or o- plast en. Der Blat tfarb st off ist in Membransyst emen un t e r- gebr acht, di e sich in den körnigen Strukturen in Membr a n - stape l (Gran a ) gefa l t et haben.
Chemie in der Schule: www.chids.de
- 6 -
Bild 3: E~id e rmis ausschnit t aus der Blattunters e it e des Alp en- veilch ens. Das violett e Anthocyan ist nich t in einem Plast id lokal i si e r t, sondern i st gelöst in der mächt igen Vakuole, di e fas t das gesamt e Zellinnere ausfüllt .
Bild 4: Zupfpräpara t aus der Toma t e. Di e orangen e Tönung de s Bi l de s deutet sch on an,daß sich ein Teil des Ca rotin oi ds wie be i den Anthoc yanen frei in der Vakuole befi ndet . Der andere Te il in nadel f örmi gen kri stal l ar t igen Ver bänden
Blat tfar bs t of f e
Hi nt er dem Begr i ff "Blatt f arbstoffe" verbergen si ch zwe i ch emi sch ganz unt er s chi edli ch e Farbstoffklassen, und zwar die Chlorophylle und di e Carotinoide_ Die Carot i no i de la ssen sich wie derum in die Gruppen der Caroti ne und Xanthophylle auft r ennen .
Bevor ich auf di e Konst itut i on der Farbst offe zu sprechen komme , möchte ich die Trennung un d Charakter i si erung
die s er Pi gmen te beschr e iben.
Vor arbe i t für die Analyse ei nes Blattroh extrakte s ist dessen "Zubereitung". Zu diesem Zweck e zerreibt man eine Handvoll Br ennesselblät t er mit Hi l fe von See s and in einem Mörser . Hat man ein en Brei erhalten, so überschi cht et man ihn mit Aceton_ Na ch ca. 30minütigem Einwirken des
Lösungsmitt els ist der Blattr ohext r akt genügend konzent r i ert.
Nun fil tri er t man mitt el s Faltenfilter vom Sand und von Geweberes t en ab und bewahr-t den gewonnenen Extrakt li cht- geschützt im Kühlschrank auf.
Bei Verw endung eines geeignet en Fließmitte ls kann man di e unt ers chi ed li ch pol a r en Komponent en des Blat t r oh- ext r akt es dünns chicht ch r omatogr aphi s ch auft rennen .
Geräte: DC-Mikrokammer , DC-Mikrokart en ( Kieselge l auf Alufolie ) , Kapil lar en , lichtdicht e Box für die Mikrokammer
Chemikalien: Fließmitt el: Gemis ch aus Petrole ther (40/60), Isopr opano l und Wass er im Verhältnis 10 : 1 : 0,3
Der Bla tt extrakt wird mit ei ner Kapi llare auf der Star t - lini e punktförmig aufge t r a gen. Di e gut getrocknete Karte wir d in eine DC-Mikrokammer , die oben besch riebenes Fließ-
Chemie in der Schule: www.chids.de
- 8 -
mit t el enthält, gestellt.
Nach etwa 20 mine ist die Fließmittelfrent 5 mm vom oberen Rand der Kieselgelschicht entfernt. Man entni mmt die Karte der Kammer , markiert die Fließmittelfront mi t Bleistift und läßt die Kart e trocknen.
Da Licht di e Blat t pigmen te bleicht, muß man die Dünnschicht - chromatographie in einer Dunkelbox durchführ en.
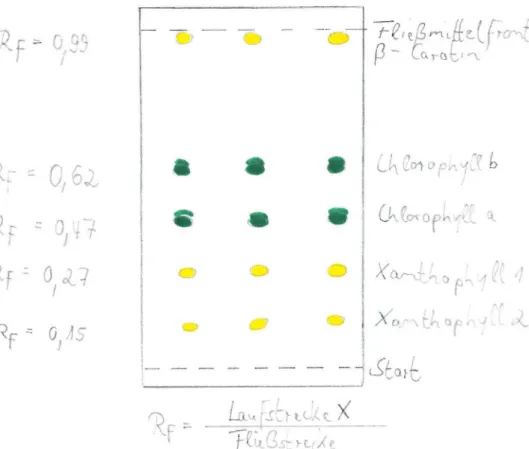
Auf der DC-Kar t e erkennt man 5 Pigmen t f l e cken :
ein vorangelaufenens gel be s Pi gmen t CRf-Wert: 0,99 ), die im mi t t l eren Bereich liegenden gr ünen Pigme nte CRf-Werte:
0,6 2 und 0,47) und zwei nur wenig gelauf ene gelbe Pi gmente (Rf - Wer t e : 0,27 und 0,15).
Mi t t els prä parativer Dünnschichtchromat ographie kann man nun die einzelnen Pigmentflecke identifizieren.
Abb.
4
zeigt da s Ergebnis einer Dünnschichtchromato graphie eines Bl a t t r ohextr akt e s :K.- - er.,
), 0• •
L~C 01
0 pI',v[:;b
L'
~ AC C\.I(r .::
o -,
't r "- C~0pn
f'~~r
JK r
-- 0I ~?X
I,~... Cl1f '"
, , ,I,)(O,r--,
t'"
0t' '
IZ
I<f " 0) A5 I
I
- -' SL
I1- - - - - ! \ß~G
Bei der präparat i v en Dünnschi cht chromato graphi e kratz t man die mit dem Pigment beJlaftete Kie s el gels chi cht ab und el uiert den Farbstoff mit ei nem Lösun gsmit tel, in dies em Fall mit Aceton. Danach zentrifugiert man von
den fest en Bes t andte ilen ab (Kä ltezentrifu ge, 10.000 U/min,
10 mi n . ) und nimmt eine Absorpti on spektrum des Farbst offes
im Berei ch von 720 bis 400 nm auf. Aufgenommen wurden die Spektren mit ein em Zweistrahlspe ktralphotomete r.
Erst die Gestalt der Spe ktren verrät uns etwas über di e Nat ur unserer Blattfarbstoffe.
Mi t Hilfe von Vergleichs spektren bekannt er Substanzen und Literaturwerten von Absorpt i onsmaxima ist di e
Zuordnung der 5 Pigmentfle ck e zu den bekannt en Blat t - far bs to ff grupp en ge lungen . Die l i poph ilen Carotine lösen si ch gut in dem verwendet en Fließmitt el und
weis en dah er einen hohen Rf-Wert auf . Die Chlo r ophy l l e
a und b verdanken dem l i pophi l en Phy tols chweif die mitt leren Rf- Werte und die Xanthophylle haben au f grund ihrer
Sau erst offunktionen eine gro ße Affini t ät zum Wass er
in der Kieselgelschi cht und besitzen daher einen geringen Rf-Wer t .
Tabe 2 bietet eine Aufl i s tung der pho tometri sch ermit t e l - t en Abso rpt ionmaxi ma der einzelnen Blattfarbstoffe.
Abb. 5 gibt die ermittelten Abs orpt i on s spekt r en wi ed er . Zum besseren Vergleich sind die Spektren in eine Abbil - dung eingeze ichnet.
Man kann das Abso rpti on s spekt rum eines Blat t r oh ex t r akt e s auch auf eine andere Wei se demon s t r i eren , und zwar mit Hilfe ein er optischen Bank. Der Aufbau ei ner opt ischen Bank wird in Abb. 6 schematisch beschrieb en:
Das mit t e l s Lichtqu elle (6V u. 5 A) erzeugte Licht wird mi tt el s Spalt, Samme llin se und mit OS2 gefül l t em
Chemie in der Schule: www.chids.de
({1,)
l71X.. Q
- 10 -
0)
;- tJ
'rY"\-uJ: : il
hox. .
,C<SS IA
H""d
t cCLÜ.L rIp- L Q ~o l; "-- : ~ 7 l i IJ S)} ; Y Jö' !_ ~ 7 ':'- j _ ~ ,;-
0;liJ ''. __
~
G 60
JS i
~,)j/8 I _ • ' .. . I
f-LI _" ,6b.l J ( /JO
_ __ _ _
~ +- . ~ _' 6 ~/ 0
J4 (JS /1 .
( ~JI g; l l53ß I b4J j ~S3
Tab. 2: Ph ot omet r is ch ermittelte Absorpt i onsmaxima der Bl at t farb- st offe
».I
0h~.b (Ae.~
ce
l-O~',,-0~rL ~Xo..t1, '~o~\d
h2<J ·CQ1Cll,'",
500
boa
\ " ,i) ,
'" ,,._---~-, \, -,
- - - ' - - -- --t--- - - - I ~
>
-o:
I
Abb. 5: Photomet r isch ermittel t e Absor pt ionsspekt ren der Bla tt- fa r b s t off e
Prisma in ein kontinu ierliches Farbenspektrum aufgespalten.
Das Spektrum erscheint auf einem Schirm. Schaltet man zwischen Pri sma und Schirm ei ne zur Hä lft e mit ver-
dünntem Blattext r akt gefü l l t e Küvette , so muß der untere Teil des Spekt rums die gefüll te Küvett e durchscheinen, während der obere Teil de s Spektrums unbeainflußt auf
dem Schirm abgeb i ldet wird.
Im Vergleich sieht man , daß der gr üne Blattextrakt das blaue Licht des Spekt rums vollständi g absorb iert und ebenso den langweIligen roten Bereich.
Diese Abbil dung läßt sich gut mit dem photometrisch ermitt e lten Absorpt i onsspektrum des Blattrohextrakte s in Deckung bringen : Die fehl enden Farbtöne entsprechen den Absorptionsmaxima. (s. Abb . 6 und 7)
/ / Abb. 6: Auf bau einer optischen Bank
/\
l
Abb. 7:, Abs orpt i ons spektrum
b /
eines Blat t rohext r ak-f
~ ,
te s
I ) /
i0-:
~J
"'I
- ::a
Ic::z:.:
_ i
'/
400 ..../JO
b OO
700/L &~
Chemie in der Schule: www.chids.de
- 12 -
Bevo r ich näher auf die Struktur der ei nzelnen Blatt- farbstoffe eingehe un d deren Farbigkeit diskut iere, möchte ich anhand von MO-Schemata von beliebigen
Far bs t of f en di e Urs a che von Farbigkeit im allgeme i n en erläutern.
In Abb . 8 sehen wir MO-Schemata zweier bel i ebiger Chromophore (=Farbträger) A und B.
Bei Farbs t of fen ist der energetische Abstand zwischen dem höch s t en besetzten Molekülorb ital und dem niedr i g- st en unbese tzten Molekülorbital so ger ing , daß Licht der Wellen länge zwisch en 400 und 700 nm es verma g, ei n Elektron au s dem Grundzustand in den ersten ange- regten Zu stand zu heben.
Bei Farbstoffen handelt es si ch immer um Sys t eme
konjugi ert er
11
-Elektronen, zumi n des t bei organischen Farb s t of f en , wob ei Heteroat ome , vor al l em Stickstoff, eine oder mehr er e Methin grupp e (n ) erset zen kann~Das Heteroatom steuert ein freie s Elekt r onenp a ar dem kon jugi ert en 1,r- Sy s t em bei.
Aus diesem Grunde hande l t es sich bei den Elekt r onen- übergängen me i s t um sog. n-7rr.f<-- Übergänge bzw, 'jf-7111t-_
Übergänge (Die Bezeichnung n stammt von n i cht bi ndend , es handelt sich um die freien Elektronenpaare der
Heteroatome, die laut des MO-Modells auf der urs prüngli- chen Energieniveaust ufe "liegen" bleiben.) e
- -...:-.-
4~,: - 1r *
t
6E :
-ibL
In,
Abb. 8: Häuf igs t e Energieüber gfulge in Chromophoren
Chloroph;yll:
Das Chlor ophyll i s t das häuf igst e Blattpi gmen t.
Es dient vor allem als Licht empfänger be i der pflan zli chen Phot oSYnthese und al s Elektr onenpumpe für di e pflanzl i che Zu ckerprodukt ion (Reaktions zentrum ! ) ~
Chlorophyll besteht au s zwei Komponenten:
einem hydroph ilen Por phyri nr i ngs y stemund ei n em hyd roph oben Phytols chweif .
Das Porphyrinringsys t em be s teht aus 4 Pyr r olr i ngen, di e über Meth i ngruppenol,e::t-) v er knüpft sind.
Im Unter schi ed zu ander en Porphyrinr in gsy st emen wie das Hämoglobin i s t die 3,4-C-C-Bindung gesät tigt .
Chemie in der Schule: www.chids.de
Chlorophyll a
- /{I-A{ om
Phytytres t:ein hydrophob erSchw anz
/1
C- C<:,H 0
,f-C-O- CH3
o
H I
H-cr-f",J )
H HH-C' "
H-C-HI
H-C - HI
I
C= O
oI
H I H-C HI
, H-C-H '
7
~C- H-C-'-C~I H-C-
H H-C~'"
H, ' . ~H-C-'
H-C--C~. .
~ H-C-
HH-C~'
. I . "~C
H-9- . . - .
C~ ;' :' . H' H-C;;:'H-3-:--
C-:-..', H,. :.. ... f+::::,C-
. .,. .-:-:-:--
H-C-',-,- C;;:'H, ,L,
I ' ,H:::::oc-
H '. ., I"
.•",'.: ,,' H
Abb. 9: Struktur von Chl orophy l l
Bei ChI . b i s t die Methylgruppe an Ring B du r ch eine Aldehydgruppe ers etzt.
Im Zent rum des Mah70zyklus liegt eine Ma gnes iumion, dessen fr ei e Valenzen dur ch die Stickstoffatome des Porphyri nringsyst ems abgesättigt si nd. Chlorophyll ist folglich ein Metallkomplex.
Am Ri ng D liegt di e Bin dungs s t el l e für den Phyto l- schweif, durch hydro lytische Spal tung kann die Es t erbi ndung zwis chen dem Alkohol Phytol und der Säu r egruppe am Porphyrinrings y st em gespa l t en werden.
Abb. 9 zei gt die St ruk tur des Chlorophylls.
Das konjugiert e 'iI-Elekt r onen s y st em ist schraf fiert ei n geze i chnet..
Carot i no ide:
Die Carotinoide dienen ebens o wie das Chlor ophyll als Lichtemp fäng er bei der Photosynth ese. Sie schüt ze n
jed och auch das Chl or ophyll vor dem bei der Ph ot osynthe se en t s tehen den Singulet t- Sauerstoff, indem si e sofort unt er Re s onanzenergi eüb er t ragung mit ihm rea gieren, so daß
~plett - Saue r sto ff en tst eht ..
Bei den Carotin oiden handelt es sich um ein linea re s Sys t em kon ju gi erter Doppelbindungen, wobei die Kette auf bei den Se i t en mit ali cy cli schen Ringsystemen , den sog.. Iononringen endet. Bei tL- Carot i n handelt es sich um zwei dv-Iononri n ge und beim p - car oti n um einen
J.-
und einen ~-Iononring.
Im Gegensat z zu den Ca r otinen besitzen die Xant hophyl l e Hydr oxyl gru ppen an den Iononringen, die die Ursache deren hoh er Polarit ä t si nd.
Abb. 10 zeigt die Strukt urformeln der Carotin oide, auch
Chemie in der Schule: www.chids.de
- 16 -
'CI-C lfotin
.~---
H-C-H I
H H
a-Carotin
H H H H
I I I I I
H-C~ /~ C_;~ H~tH~H
H IH H/'~H
H, /C~1~~~~~',~ '~~:,-."" .,
/C 'f~. :~ ~V ... ~4 / ".
~
I
H H H H ,/ H H-C-H"C C H I
H/ " " , / "'-I H
C C- H
I I
H H
~
a-Ion on r in q
H H H
H_,;I
I ·"c~
-, /H
I H C"
/ H H H H "
I
H/ '" " t /H
I • , .. . ·te I C
.. " .
'~~('
c/ ' HH
Y
Hr >.
H-C-H H-C-H H-C-H H- C- H
I I I I
H H H H
ß-Carolin
(ß-Carotin
H H H H
I I I I
H-C C-H H-C-H H H-C- H H
H"
~"" /c/)(
-,~.,.-;:~~ .,
·/{
·~ ~
) ; '~'~~
7Y~" ~ ~
·1 !~
~~.4'C r ~ aW. ~~. <;;<f I
H / I
I IH" t, H H H H "
C r H I
H/ " "C C- HI
/ " I
H H H
@ ~anthOphYl1J
H H"
C/H H H H I " " /H
I I I I I H ' C
H-C~ /C-~~H-~C-H H H-~~-H H / H ~ ...H H
t
I;~HC H..:-P.,., 1" 4~ .f
Afl'\.../
A t~~ A"~, .f; CH " /
C""l
-cr h~rr
.e;, ' ~~
",c~~ ~
..~~'~
...'..' "
",y~~~
I ..~~~
~' ~ ~
." ~~
~~c. "
C/ "HH / I ' .
~/
H / ""H" H H H H I H H-C - H H H-C-H H-C-H H-C - H
r,:::yC
C H I I I I
~
"" c /
"'-t-H H H H HI I Lutein
H H
hier sind die konjugi ert enll-8ys t eme schra f fier t einge- zei chnet..
Chloro~hy ll-Fl ouresz en z und Lös chung der Flour e szenz :
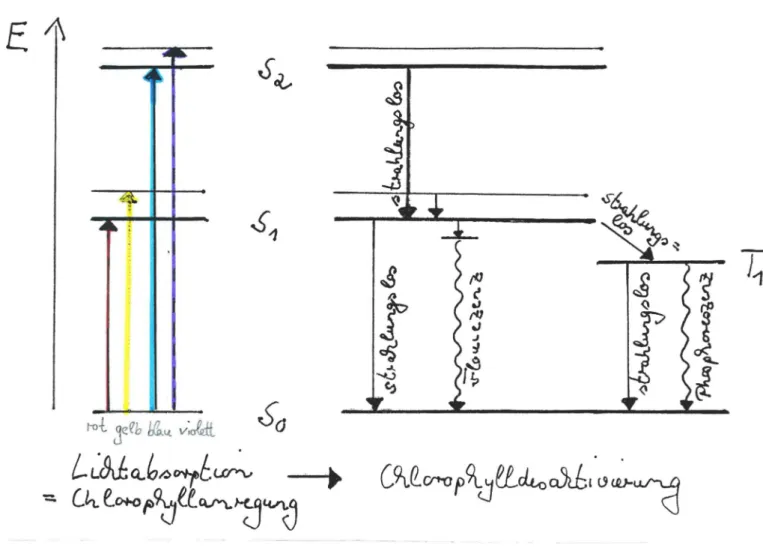
Durch Abs orpt ion von Li cht best immter Wel lenl änge kann das Va l enzel ektron vom Grundzustand (So) in den ersten bzw.. zwei t en angeregten Zustand angehoben werden ..
Rot es Licht überführt das Va len zelektron in den erst en angere gt en Zust an d (S1 ) ' blaue s Licht in den 2 .. angere gt en
Zustand (82).
Es gibt vier Möglichkeit en der Chlor ophyllde sakt i v i erung, d.h. der llii ckführung des Valenzelektrons in den Grundzu- stand:
1. strah l ungsloser Übergang unt er Freiset zung von Wärme 2. Fl oures z enz (=Li cht emi ssi on ) vom niedrigs t en Vibra t i on s -
niveau au s , so daß Fl ouresz enzl icht immer ei ne größere We l l enlänge hat al s das abs or bi ert e Licht .
3. Ph osphore sz en z (=Lich t emi s si on ) ; zuv or muß das Val enz- el ektr on vom Singulett zustand in den entsprechenden Tripl ettzustand überführt worden sein. Die s beze i chnet man im Englis chen al s "inters ys tem crossing" - ein e
Spi numkehr beim Valen zelektron unt er Frei s e t zung von Wärmeenergi e . Aus diesem Grunde i st Phosphor esz enzli cht noch län gerwellig al s Fl oure s z enzl i cht. Zudem dauer t die Phosphoresz enz länge r.
4. Photochemi sche Reaktion; In der int a kten Pflanz e er f olgt die Chlorophylldesaktivierung durch Resonanzener gie- transfer zwi s ch en unt erschi e dl i chen Chlorophyllfo rmen.
Bei Rückkeh r de s Valenzelektron es zum Grundzustand
wird die fre i gesetz~ Energie zur Überführung des Na chbar -
Chemie in der Schule: www.chids.de
- 1
Val enzelekt r ons in den er s t en anger egt en Zustand genutzt . Um einen solchen Energi e t ran sfer zu ermöglichen, müs s en folgende Bedingungen erfüllt sein:
1. Di e Chlorophyll-Molekü le müs s en ei n en optimal en Abs tand voneinander haben
2. Di e Chlorophyl l-Molekü le müssen eine bestimmte Orienti erung zue i nander haben
3. Die Ener gi edi f f er enz zwischen Grun dzustand und erstem angeregt en Zu stan d muß bei den Nachbarmolekülen entwede r gleich sein oder beim Akzept or chl orophyll geringfügig kle i ner sein.
Di e ersten beiden Bedi ngunge n verlangen ein System von gr oßer Ordnung, we l ch es in der intakten Pf l anze gewähr -
leistet i st, da die Chlor ophyll-Mol ekü l e in der Chl oroplast en- Membr an lokalisier t si nd .
Die dritte Be di n gung erfordert die Mögl i chkeit . die Lage de s Abs orpt i onsmaxi mums beim Chlorophyl l modifi zieren zu könn en. Da di e Chlorophyll -Mol ekül e in der Chl oropla sten- Membran als Pigment-Pr ot ein-Kompl exe vorlie ge n, ist eine Ver s ch iebun g des Abs or pt i onsmaximums dur ch ein e Verän derung der Prot ein-Ligand en denkbar .
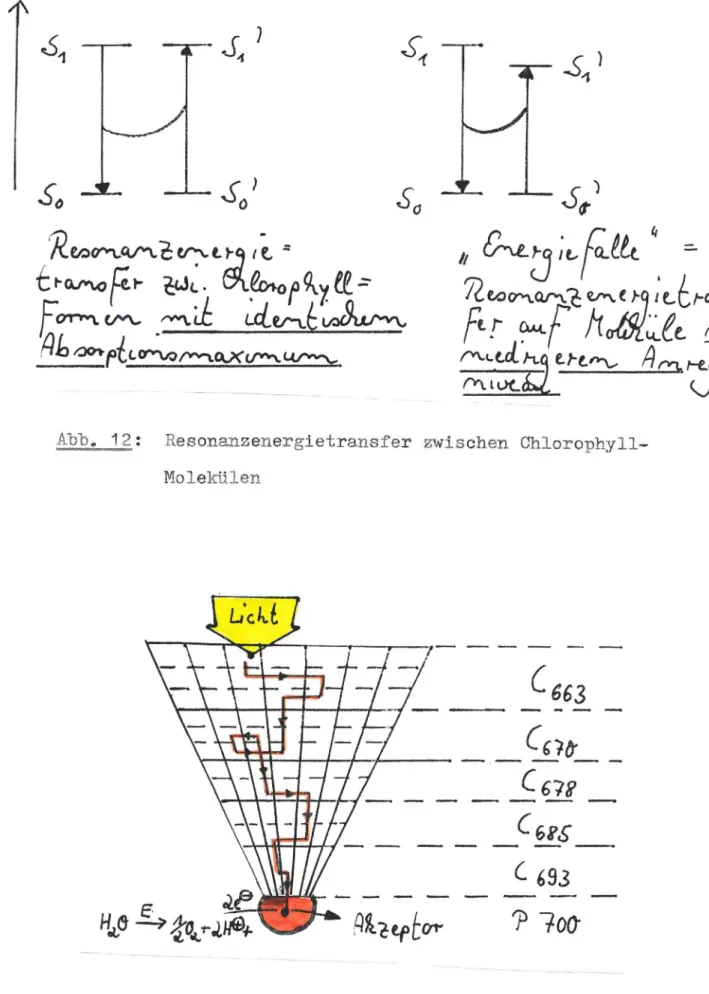
Abb. 11 verans chau l i cht die Mögl i chkei t en der Ch lorophyll- desaktiv ierung anband eines Jablonski- Di a gramme s .
Abb. 12 zei gt die beiden häu figst en Mög lichkei t en der Energi eüber tra gung zwis chen Chloro phyll-I101 e~~len •
In Abb. 13 ist der Aufbau ei n er Li chtantenne im pflanzli chen Chl oroplas ten schema t i s ch gezei chnet . Das Licht "wandert"
mitte l s Res onanze nergietransfer durch die mi t Chloro phyll- Mol ekül en di cht gepa ckt e Lichtant enne , di e hier als Tr icht er
im Lau f e der Energieübertragung in s längerwellige Gebiet versch ieben.
Der Halbkre i s am Ende des Tricht ers st ell t das Reaktions- zentrum da r , welches als Elekt runenpumpe dient und in di e s er Funkti on dem Wasser Elektrone n entz ieht und sie ei n em Elekt ro- nenakzept or zuführt . Da s Reak t ion szentrum die s er "Licht f a l l e "
ist ebenf'a.Lä.e ein Chlor ophylldi mer e s mit spezifis cher Proteinkoor dination •
• •
..
~.4 ...~
Hlt
t~r~eh 1Jl~ v;JJL S'a
L~8J.o..b/.>~t~ --..
~ C~ e.O+O F~etQ./"\.~~
Abb. 11: Chlorophyll anregung und Chl orophyl l de sak t i v ierung (Jablonski-Diagramm )
Chemie in der Schule: www.chids.de
Abb. 12: Re s onanzenergi etransfer zwischen Ch l orophyl l- Molekülen
7- - - - - -
_ _0
(663
_(b~fJ
\-\.~t::t=__I_W'-I_-- - .- - - -
C 6/ f
w..~~-J-t'--I- - - -
C
6f S\--\-'Ht-lI-+-l'--I - - - - - - - -
( 693
- - -
A9tttpt~ 'P tOo-
Abb . 13: Schematis cher Aufbau ei n er Lichtantenne
Im fol genden sollen Versuche zur Chlorophyl l -Flour e sz en z be s chrieb en wer den .
Best rah l t man einen mögli chst stark verdünnten Blatt - extrakt mit UV-Li ch t (366 nm) , so floure s ziert di e
Lösung rot . Die in der intakten Pflanze zu beobacht end e Resonanzenergi eü bert r agung von Chlorophy l l - Molekü l
zum Nachbar-Möleh~l ist aufgrund der Zers törung der Membr an-Mat r ix und der Is oli erung der Chl or ophyllmol e- kül e nicht möglich . Au s diesem Gr un de wi rd die abs orbier te Li cht energi e in Form von Flou reszenz wi eder frei.
Gibt
m an
dem Blat t ext rakt (Aceton!) Wasser zu, so beobachtet man ein Erlö s chen der Flou r es zenz. Abb. 14 ver deutlicht die Ursach e der Fl oure s z en zl ös chung:Aufgrund des polaren Char akter s des Chl orophyll -Mole- küles richtet es sich im wäßr i gen Medium au s:
Die hyd ro ph oben Phytol s chweife ra gen na ch Lnnen, vom Wass er abgewandt, die hydrophilen Porphyrinringsysteme zei gen
zum Wa s ser hin (Prinz ip: Gle i che s löst sich in Gle i ch em). Es entstehen Chlorophyl l -Micell en.
Abb. 14: ~louresz enz löschung durch Wasser
Au ch bei Zugabe von Benzochin on erlöscht di e Chl orophyll- Floures zen z, da das Benzochinon in der Lage ist , dem
Chemie in der Schule: www.chids.de
- 22 -
anger egt en Chlo r ophyll ein Elektr on zu en t ziehen, so daß di e Li cht en ergi e in chemi sche Energi e überführt wi rd (s. Abb. 15) .
Durch Zugabe eines Detergens (Spülmi ttel ) kann man die Floure s zenzlöschung du r ch Wa sser wi e der rückgängi g ma ch en: Da Detergen ti en auch polare Molekül e si n d , durchs e tzen si e die Chlorophyl l -Mi c elle und ver hindern den Re so nan zener gietransfer.
lfL o)}
(he.. _T, -
-~t
~I
Abb . 15 : Fl oure s zenzl öschung dur ch Ben zochin on
Letzt er Versuch zum Kapit el der Bla t tfar bst of fe ist der Nachweis des Magnesiumions im Chl orophy l l.
Zu diesem Zwe cke stellt man si ch einen wäßri gen
Bla tt extrakt her . Mit demMixer zerkleinerte Br enn es s el - blätter wer den in
4
n Salzsäure kur z aufgekocht.Nach dem Aufkochen filtriert man durch einen Falt en f ilt er und neutralis i er t das Filtrat durch Zu gabe von 2 n Natronlauge. Das Fil t r at wird 1 10 verdünnt. Man versetzt diese Lösung mi t 2 n Natronlauge und gi bt kon z ent rierte Titange l b- lösun g dazu. Na ch kurzem Erhitzen über der Bunsen- brenner fl amme fällt ei n roter Niederschlag aus, die Lösung enthäl t Mg2+.
Es ist si nnvoll zum Vergleich eine Blindpr obe mit 0, 1 %iger Magn esi umchloridl ösung durch zuf ühren.
Abb. 16 zeigt da s von Mg2
+ und Ti tangelb im
alkalis chen Mil i eu gebildete schwerl ös liche Salz.
Abb. 16 : Nachweis von Mg2
+ mit Thi azolgelb (Titange lb)
Chemie in der Schule: www.chids.de
- 24 - Blüten- und Fruchtfar b stoffe
Im ersten Versu ch wird die Verwendung von Rotkoh l s aft als pH-Indikat or demon striert . Der Farbstoff im Rot kohl ist das Petunidin, ei n Vertre t er der Anthocyanidine. Verwendet wir d ein wä ßriger Rotkoh lext rakt, den man durch Aufkoche n geschnitz elt er Rotkohl bl ätter in Wa s ser erhält . Man bewahrt den Rot kohlextrakt im Kühlschrank auf .
Versetzt man jeweils 1 ml Rotkohlextrakt mit 9 ml Puffer untersch iedlichen pR-Wertes, so ni mmt das Petunidin
entsprechend dem pH-Wert eine unterschi edliche Farbe an. Au sgehen d von einem sauren Milieu basiert die Farbver- schiebun g auf einer sukze ssivenAbstrakt ion von Protonen. Abb . 17 verdeutlicht das Gescheh en.
Das rote Kati on geht be i einem pH-Wert von 7 in die
violet te Anhydrobase über, die in zwei taut omer en Formen vorliegt. Be i we it erer pH-Wer t - Erhöhun g ent steht das bl au e Anion , erhöht man den pR-Wer t drast isch auf 13, so
entsteht über die farblos e Pseudobase da s gelbe Chalkon. Die grüne }arbe bei pR=11 is t eine Mis chf arbe aus blau und gel b. Die vielfäl tige n mes omeren Grenzs t rukturen sind nicht alle eingezeichnet.
All gemei n kann man sa gen, daß eine Abs t rakt i on von Prot on en von den Rydroxylgruppen (=Auxochrome oder Farbv erti efer) die Elektronendonat ors t ä rke der Gruppen am Benzolkern erhöh t.
In Abb. 18 er häl t man ei nen Überbl i ck über die Vielf alt der Ant hocyanidine, die Aglyk oside der Anthocyane.
HO
aU
[
l~C(~ 0#
oa
H
ICMt'tuM..
f »-li3
- - - - - - - -
H
t-
\<;
0/1 t-II r
, +aH~
-Oy-
Abb . 17 : Rotkohlsaft als pR- Indi k a tor . Der Farbsto ff im
Rotk ohl i s t das Pet unidin, ein Vertreter der Antho- cy.ani di ne.
Chemie in der Schule: www.chids.de
·- 26 -
fI Mlh-& C~
(if1.~d Lh e
HO
Pt[argan~
HH
cyan idin~
OHH
AnthOcyanldin 01 OCHJ
OH
Pttoo~
OH
OCHj
;VClfn\..e 'R1 rt
JA~ (J()tIt~lPV
'Pt.%L- 1-1 11 s.o )Jo.9t~/So1u.~
'P~~~dJ''V OCll
jH S3,~ . ~~I'~J-ot
1lr~'1:.~e. '
(~ß.rl,u1~ ON H S3S ~j,Vte-/ '/ete-
/. J 'iJ ~ Ha.tu-j,~ OCH
jOClJ
J hIt,;, H1'tJu.'RP!f.iJ,i
0l . OCll
J
OH .5' lf 3 JJ~l..·t
f
L ({M.Leb ~
fJt.e.p hl fq,J,; ~ ou DU
.j-(I« ~t~[,~
tl-ch.f.rtI
7<-Ji~f~ .
Ei n zig di e Reste R1 und R
3 variieren, deren Plätze entweder ein Wasserstof f atom, ei n e Methoxy- oder eine HydroxYlgruppe einnehmen können .
In ter e s s ant ist , daß man anhand der Ab s orpt ion s max ima der jeweili gen Anthocyan i di n e den Ei n f l u ß der Grupp en ab- le sen kann. Ein e deutli che Cäsur entsteh t bei Ersatz eines Wa sser s t offatoms durch ei ne Auxochrom (OCH
3 oder OH), eine we it er e Cäsur wi r d sichtbar bei Einfügung ei ne s zweiten
Auxochrome s .Weit er hi n er k ennt man, daß die Hydr oxylgruppe eine stärkere farbver t iefende Il'lir klUlg be sitzt .aLs eHe Meth oxygruppe. Die farbvertiefende Wirkung korr el i ert mit der Fäh i gkeit, dem Chromophoren Elektron en beizust euern.
Ver gleich von Anthocyanidi nen und Bet a l a i nen
Man kann die Anthocyanidi ne und Betalaine auf verschiede ne Weise experiment ell unter s chei den .
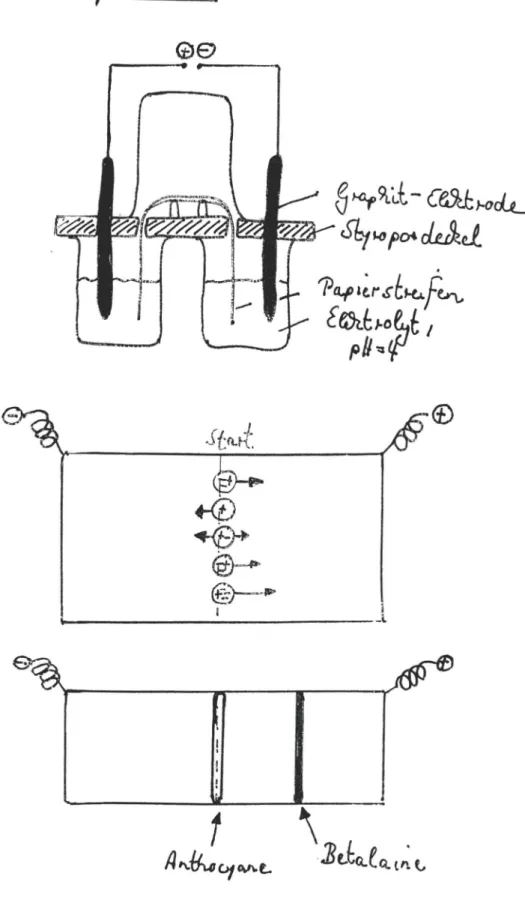
Ein e Tr ennung der beiden Blüt en- und Frucht f arbs toff e geli ngt mi t Hilfe einer Papi er el ektrophor es e .
Abb. 19 ze igt den Aufbau der verwen det en Apparatur . Zwei 600 ml - Bechergläs er wer den mit dem Elektrolyt en, einem Citr atpu f f er mit dem pR- Wert
4
bi s zur Häl f te be- sch ickt . Über die Becher gläser stül pt man einen Styropor- deckel , der Au ssparungen für die Kohl ee 1ktrod en und für den Papi erstre ifen besi t zt, der über zwei Glas bügel in d.te Bech ergl ä s er ragt. Der Papi ers tr eifen ha t eine Länge von 25 cm und eine Breite von 5 cm. Vor dem Aufbrin gen in di e Apparatur wird er mi t dem Elekt rolyt en get ränkt . Bei dem Papier handelt es sich um normales, für die Papi er chroma t ographi e verwend e t es Chromato graphiepa pier der Firma Schle ich er und Schüll.Um das System zu schl ießen, stül pt man ein weiteres 600 ml -
Chemie in der Schule: www.chids.de
- 28 -
S~~~t - (eJd:HJ~
~~ ~J.Of~ck.J.e1
.
tpCLfJI
~
rs tl-tA. ffrt.
[eJtt}oo ~t
Ipb~tf
Abb. 19 : Aufbau der Elektrophorese-Apparatur und
Verha l t en unterschiedl i ch gel aden er Teilchen (hier: Anthocyane und Betalaine bei pH=4) im elektrischen Fel d.
Bech ergl as über die Gl as bügel .
In der Mitte des Papi ers t r eif ens zeichne t man ein e
St artl i ni e mit Bleist i f t ein und trägt sowohl das Gemi s ch der beiden Farbstoffe als auch di e einze l nen Farbstoffe
(Betalain : Rot e Beete- Saf t , Ant hocyan: ei nge dickter Johannis - beersa ft ) punktförmi g auf der St ar tlinie auf.
Nach ca. 15minütiger Elekt r oph orese erkennt man, daß ein rost r oter Farbfleck auf der St artlinie liegen ble ibt
(bei Farbgemisch und Anthocyan) und daß ein violett er
Farbfle ck in Richtung Anode gewand ert ist
(p e :' %. r 0eh1~'.sJc ~ . J3 ekR ~ ) .
Zu erklären ist diese s unte rs chie dl iche Verha lten damit , daß das Ant hocyan bei einem pH-Wert von 4 als Anhydr obas e vorliegt , welche na ch außen elektri sch neu tral ist und
im elekr±schen Feld ni cht wande rt. Hingegen da s Betalain li egt bei einem pH-Wert von
4
-~y .uianion vor (s. Abb . 20)und wandert dementsprechend im el ekt r is chen Feld in Richt ung Anode.
Eine we iter e Unt er s cheidung von Anthocyanen und Betal ainen ermöglicht das unt erschiedli ch e Ver ha l t en bei großen
pR-Änderungen . Während das Ant hocy an ein ausgezei chnet er pR-In dikat or ist (s. Rotkohlsaf t als pH-In dika t or ), so sind bei m Betal ain schon bei einem pH-Wert von 7 sämtliche Protonen abdi ss oziiert, eine Fol ge davon , daß di e Pro t onen von Ca rboxylgruppen und ni ch t von Hydroxylgrupp en stammen. Außerdem (un d vor allem) ruft ein e Ab strakti on ei nes Protons von der Carboxylgruppe keine Erhöhung des Elekt r onendruckes auf den Chr omoph or hervor .
Ei ne dritte Unterscheidung im ch emis chen Verhalt en er mö gli cht die Reakt ion mit drei wertigen Me:Gfü lkationen , wie A13+ und Fe3+. Das Ant hocyan geht mit dem A13+-I on eine Chelatkomplex- bindung ein, wi e sie in Abb . 20 ersicht li ch ist.
Gibt man zu Johannisbeersaft (AnthocyanI) ge s ätt igt e
Chemie in der Schule: www.chids.de
( Abb . 20: Strukturen der Antho cyane und Betal ain e und Ver gleich der chemisch en Eigens ch a ften -- 30 -
Glo
1.
17{{
~ ~n-()(# ~0#
/ I JJ
'J~J.(.~
Üt~J~ lJcA
/~fY\.,t~o u.,
QrVOGJe.
(j~ ~
DU
e-,
I
e-:EL' ~~~h A ~th.o
(,.4cv"\.e. .s eJ:'Q fAl ••
I V
(Jt..~U-~ .. +-
~pU~~'l..
~
..
V-a.(1",~
~ ~&c ~t.
( - )+-
.
!J~pfo<" + .. &
//-~' --
1",,0J.
Q~ ''k;,-'
e: c.Uu).tj -
\:«:
-. -~P.:rt
. . V": '\...
hY\.L.t ~~··z~ 0
- -St
, 0 '~.;~-{t...AC}-I-
().~~ Off 0146> ~-e.,i./--- - - -
tJ~m - + /
~ 4,)-A
hOcL
dA. ()~ n.. cf.Lo t: ,,",-1,,1 •
~e-U
rJ,-..0- Q.()L t9Ot,~1 t...,~J..
. / /,,/""
bfk
f~~4v /
II
Aluminiumnitrat lösung und achte t darauf, da ß bei de Lösungen einen pH-We rt von 4 besit z en, so erfolgt ein Farbumschlag von rot nach blau, ein Hinwe is auf die erfol gte Komplex- bildung . Rote Beete-Saft (Betalain !) ze i gt bei gl ei che r Behandlung keinen Fa r bumsch l ag .
Eine vi er te Mögli chke it , Betalain und Anthocyan zu unt er- sch eiden , bietet die Fällung de s Farb s toff es mit Bleinitr a t . Dazu gibt man im einen Fa l l ge sätt i gt e Bleisa l zl ösung zu Johannisb eers a f t und im anderen Fa l l zu Rote Bee t e-Saf t . Im Falle de s Rote Be e te -Safte s ent steht ei n dichter , flock i ger , t ief- vi ole tte r Nieder s chlag , die Lösung ent- färbt sich. Be im Johannisbeer saft entsteht ein bläulicher Ni eders chlag, aber in viel geringer er Men ge; die Lösung entfärbt sich nicht. Abb. 21 gibt die Reakt ion des Pb2+ mit dem Betalain wieder.
eJoOC
+
~.~to~ UO~JI~COoa
I .:
eOOC - WOG
1
H
Abb. 21: Reaktion ei n e s Betalains mi t dem Pb2+-Ion bei ei nem pR-Wert von 6 - 7.
Chemie in der Schule: www.chids.de
- 32 -
Fä rb en mit Natur f a rbstoffen
Wi e sch on oben erwähnt,wer den die von den Mensch en zum Fär ben genut zt en Fa rbs t off e von den Pfl anzen bzw, den Ti eren selbs t ni cht als Fa r bs to ff verwe nde t .
Tab . 3 gibt ein e Auflis tung der bekannt est en und ge b r-äuch'Li.ch st en natür li chen Far bstoffe.
Eigene Färbeversuche bes tätigen die an gegebenen Farb- töne , doch
kann~i
den Bei z enfarb en durch unt er-schiedli che Wahl de s Beizsalzes eine erstaunliche Viel falt bei Verwe ndung von nur ei nem Far bsto ff erre ichen..
In der Tabelle er scheinen v. a. zwei Färbemethoden, die man l ei cht in Ver suchen demon str ieren kann. Bei der Beiz enf ärbung muß man die Faser vor dem Färben mit sieden der Beizsa l zl ösung behandeln.
Bei der Fä rbung mit Ali zar in , dem Farbsto ff des Kra pps, kann man 3%ige Cobaltchloridlösung als Bei ze ve rwenden. Man lä ßt di e Bei ze ca. 5 mi n . ei nwi rke n. Dana ch kocht man über schü s s ige s Sa lz mit dest. Wa ss er aus der Fa se r (hie r : Baumwol le) ca. 10 min. lang aus. Nun gibt man ein Stück unge bei zten St off und den gebei zt en St off in ein
2%iges Alizarinfarbbad, dem etwas Natriumac etat
bei gefügt is t. Nach 5mi nüt i gem Verbleib im Fa rbba d ent- nimmt man die Stof fstück chen un d wä scht die überschüss ige
Farbe her aus. Ei n Vergl eich zei gt , daß der gebeizt e Stoff viel intensiver gefärbt i st als der un gebe i zt e. Wichtig ist, daß man die Beize unmitt el bar vor dem
==========ifa=Q===t=lLt~rbs~ff!~
-
:J]e~
r...ge~t.M.o..
•
~'fef/Y\, .
co.rr..fuJ..i.Q.~
- /-/0{.6
~Tab. 3: Auflistung der gebräu chli chst en Färbepf lanz en
Chemie in der Schule: www.chids.de
- 34- -
(Abb. 22: Fär bemethoden: Beizen färbung u. Küpenfärbun g)
nicht mehr in der Lage sind, den Kontakt zwis chen Fas er und Farbsto ff her zus t el len .
Abb. 22 zeigt die Ar t der Wechselwirkung zwischen Faser, Met allkat i on (C02+) un d Alizar i n : Ein Tei l der freien Va l enz en am C02+ wi rd von akt i ven Seitengruppen der
Baumwollfa s er besetzt, de r andere Teil durch die Gruppe n am Al izarin. Das Met a l lkat ion ist somit Binde gl i ed zwi schen Faser und Farb stoff.
Eine Küpenf är bung i s t notwendig , wenn der Farbstoff selbst nicht wasserlösli ch istIman ihn daher n cht auf die Faser aufzi ehen kann.
Um z.B. rtiit Indigo fär ben zu können , muß man ihn durch Reduktion mi t einem ge eigneten Reduk tionsmit t e l in eine
wa ss erl ösliche Form brin gen , in
de ~n
Kont a kt mi t der Fasertret en kann. Für Laborzwecke nimmt man dazu Natriumdithioni t ,
N~S204 ' aus dem nach Redukt ion des In di gos zum hydrochinoi den Indigwe i ß Sul f at entsteht. Die Redukti on verläuf t nur im al kalischen Mil ieu.
In einem kle inen Mörs er pul ve ri si ert man ca . 0,3 g Indi go möglichst fein, verreibt ihn mi t etwas Ethanol und gibt 10 ml 10 %ige Na tr on l auge hi nzu . Darauf bringt man die Suspens i on in ein Be ch ergla s, wel che s 100 ml 700C warmes Wasser en t häl t un d fügt et wa 2 g Nat r iumdit hionit hi n zu. Aufgrun d der
ab ge lauf enen Redukt ion schlägt die blaue Farbe nach gelbgrün um. In die ent standene Indigoküpe gibt man die we i ße Baum- wollprobe und koch t si e ca. 5 min. lang unter ständige m
Rühren in der Küpe . Ans chließen d wird die Baumwollprobe unte r fließendem Wasser gründl ich au sgewaschen .
An der Luft beginnt die Rück oxi dati on zum Indigo .
Abb. 22 faßt die beschriebenen Vorgänge nochmals in Reakt i ons- gleichungen zusammen.
Abb. 23 soll die Versch iebung de s Fa rbt one s bei halog eni erten
Chemie in der Schule: www.chids.de
- 36 -
Indigoderivaten verdeu t li chen.
Dichlorindigo zei chne t si ch durch ein leucht enderes Blau aus als Indigo selbst. Di bro mi nd i go, der antike Pur pur , der au s dem Manteldrüsensekret von Purpurschn ecken ge- wonnen wurde , ist künstlich nur sehr schwer herzus t ellen. Doch ist die weitere Verschiebung in s Violet t/Rötliche aus zahlrei chen Abbildungen von Kle i dun g und Teppichen gekrönt er Häupt er aus der Antike bekannt .
Indigo zei chnet sich durch eine sehr hohe Lichte chtheit aus, hafte t jedoch nicht sehr gut auf der Faser, weshalb die Verwendung von Indigo als Farbst off durch die Konkur r en z küns t l icher Far b s t of fe ausgerot t et zu werden drohte.
Doch die Erfindung der Blu e Jeans sicher te dem Indigo eine Überlebensnische . rJlarkenzei chen der Jeans ist ja
ihre Ausgewa s chenhei t . So hat sich ein Nachteil des Indi gos zum Symbol von Jugend und Unabhängigkei t ent wi ck elt.
Der Name "Blauer Montag" soll angebl ich aus den Indigo- fä r b er e i en in England stammen ; Die gefärbten gelbgrünen Wäschestücke wurden zum Wochen en de auf die Leine geh ängt , bei Ar b ei ts begi nn am Mont a g war en dann di e Wäscheleinen voll blauer Wä sch e.
5)i. b"mn.~~&
1]'\ ~
t: ~:ßr
].-0
\.0/
['})u.tpttt']
Abb . 23: Fa r bv e r s ch l.e bung bei Indigod er i va t en
Chemie in der Schule: www.chids.de
~. 38 -
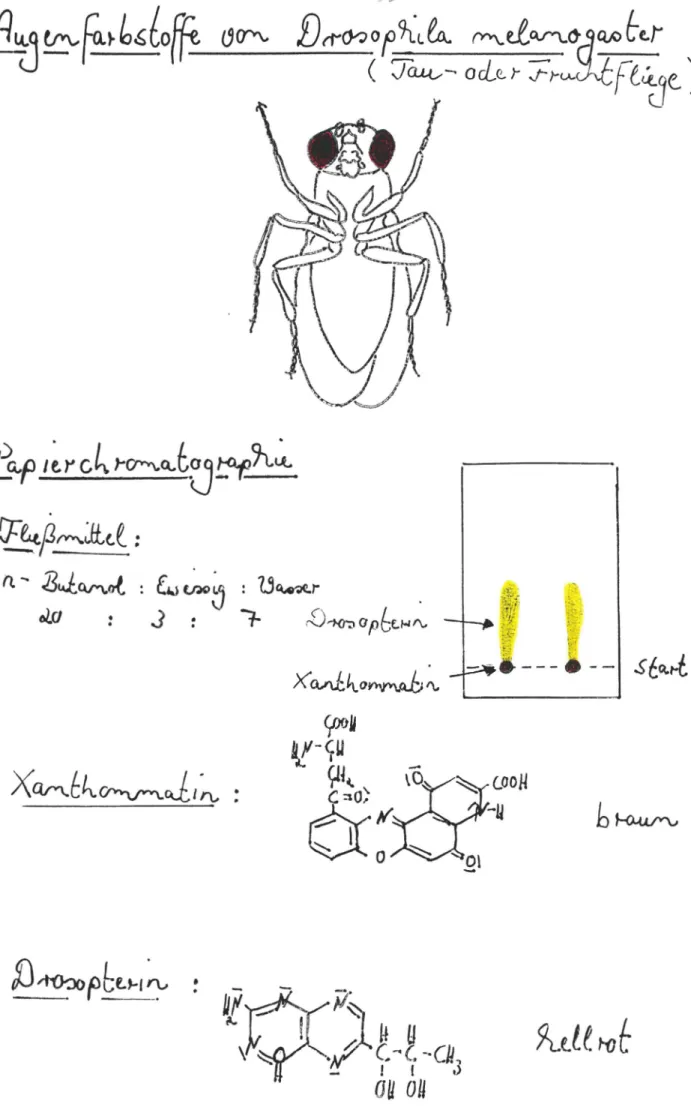
Augenf a rbstoffe von Drosophila melanogas ter
Drosophila me lanogas t er (di e Tau- ode r Frucht f liege ) besi tzt dunkelr ote Au gen. Die s er Farbt on kommt durch Übe rla gerung zwei er Far bsto f fe, dem br aunen Xanthomma t in und dem hel lroten Drosopt erin , zusta n de.
Man kann diese bei den Augenfarbst offe pa pi erchr omatogra- phis ch von einander trennen.
Man verwen det 8 mal 5 cm groß e."Papi ers tückchen der Firma Schleicher und Schüll.
Ein paar Fruchtfl i egen (häufig zu beziehen im nächsten bi ologi s chen Instit ut ) werden mit Diet hyl ether abgetö t et. Mit t els Rasierklinge wer den die Fliegenköpfe abge tr ennt und auf der Startlinie au sgedrü ckt . Es genügen 2 - 3 Köpfe pro Sta r tfleck. Als Fließmi t t el verwendet man ein Gemi s ch aus n-Butano l , Eises sig und Wa sser im Verh ä l tnis
,,~
20 : 3 : 7. Nach ca. 20mi nüt igem Verbl eib inr vC-Mi krokammer ha t das Fl ießmi ttel das Pap i er en de ("Ziellinie" zuvor
mark i er en !) er rei cht.
Man erkennt, daß ein br auner Fle ck, das Xanthommat i n, au f der Startl i n ie verblieben ist, währ end ein oran gerot er Schweif na ch obe n gewander t ist, da s Dros opt erin.
Das Drosopterin zeigt eine bläuli che Fl our es z enz unter der UV-Lamp e (366 nm).
Abb. 24 gi bt da s ob en ge s a gt e im Bi ld wieder und enthäl t auch die St rukturfor meln der beteili gten Fa rbs toffe.
)
. .
'!.- a.p
Je.rc~ "C7"\.o..tfj !:'f..'h~
~p'~Jitt :
ti :
J3J:Qr\.o{ :
[,->~ j : U~r
«u : J : 1-
,-U--}(}":.\opbr./-lA...
Abb. 24 : Isoli erung der Augenfarbstoffe von Dros ophila melanogaster_
Chemie in der Schule: www.chids.de
"" 40 -
Chemiluminesz enz und Biolumineszenz
Ein wei t verbreitetes Phänomen in der Tierw elt is t die Bioluminesz enz. Uns allen bekannt ist der als Glühwürmchen bezeichnete Leu chtkäfer , dessen Männchen in der Dämmerstunde periodi sch e Leuchtsignale für die Wei bch en und zur Revier abgr enzung gi bt.
Das sog. Meeresleuchten stammt von bi olumineszierenden Leuchtbakterien, die sich mass enhaft entwickelt
haben.
Vor allem in der Tiefs ee zeigen viele Organismen, au ch höh e r e Ti er e wie die Fische , Biol umine s z enz. Ein viel zit i er tes Beispiel i st der sog. Anglerfisch, der ein Leuchtorgan besit zt , welches er wie eine Angel vor seinem Kopf hängen läßt. In dies em Leuchtor gan
befinden si ch symbiontische Leuchtbakt erien . Mit dieser
"Laterne " lockt der Anglerfis ch Beuteti ere her an. Sinn und Zweck der Biolumineszenz ist vi e lfa ch un- bekannt, oft hat man nur va ge Ver mutun gen.
Doch eines ist sicher: Di e biochemis chen Leucht me chani smen sind so vie lgestaltig wie die Organismen selbst, die si e erfunden haben.
Allgemein is t die Ursache der Luminesz enz ni cht di e Anwesenheit eines Farbstoffe s, wa s verständlih wird, wenn man sich vor Augen füh rt , daß Flour eszen z bzw.
Phosphores zenz anregendes Licht , meist UV, benötigt, um in Erscheinung zu tret en .
Bei der Lumi n e s z en z entst eht du rch Oxidati on eines Au sgangs- stoffes eine energierei che, in s t abil e Zwi s chenstufe, die zer f ä l lt. Die result ier en den Reaktionsprodukt e ents t ehen
Licht emitt i ert. Dies es Licht ersch ei nt uns als Lumineszenz- Phänomen. Man kann also sa gen, daß bei der FI012res zen z
das Valen zelekt r on durch Absorpt ion von Lichtenergi e in den ange r egt en Zus tand gehoben wird. Be i der Lumineszen z wir d dies e Anregungsenergi e im Lauf e ein er chemi schen Reakt i on frei.
Di e Ch emil umi n es zenz stellt eine gut e Modellreaktion
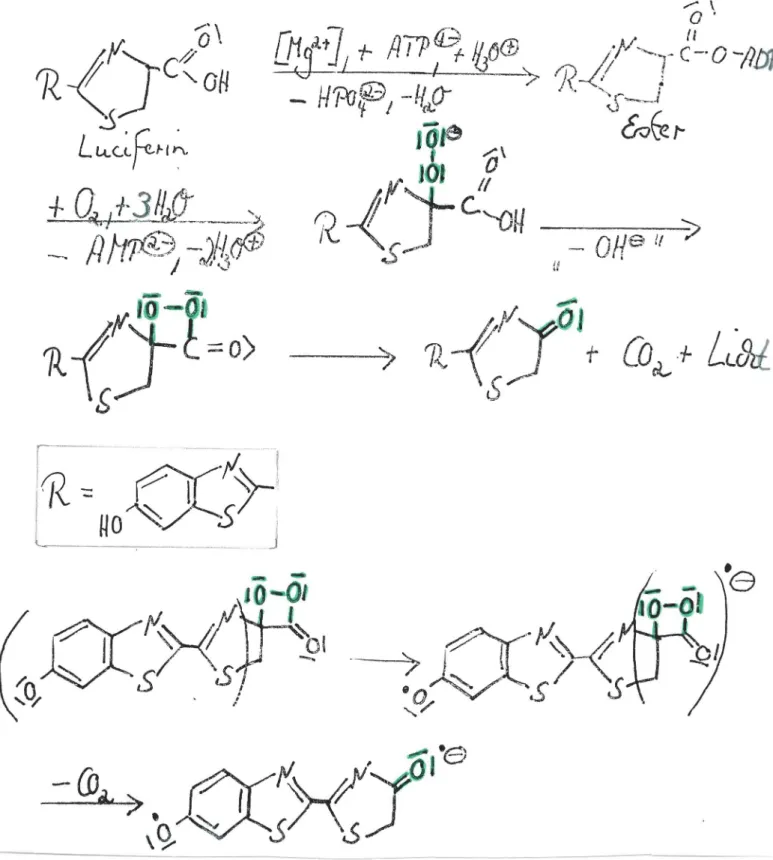
für di e Biolumineszenz dar , weil die rea ktiv e Zwis chen s tu f e wi e be i der Bi01umi neszenz ein Diox etan i s t, welches zer fällt und ein Reakt i onsprodukt mit ein er Ca r bonylf unkt ion hervor- bringt, welche s in einem angeregten Zustan d ent steht .
Im Versuch verwendet wi r d das Lucigenin, welches mit Hilfe von Wa sserstoffperoxid in alkal i scher Lösung zum Dioxetan oxidiert wird. Die s es Di oxetan ist in stabil und zerfällt in zwei Molekül e Methylacr idon. Die in einem angere gten Zu- st an d entstehenden Rea ktionspro dukte relax i e r en unter Aus- sendung von Licht .
Abb. 25 ver deu tlicht den Reakt i onsmechanismus . Gen au er heraus gezeichnet is t nochma l s das Ge schehen an der Pe roxo- brücke : Es er f olgt eine Ladungstrennung, wobei ein posi t iv gela denes und ein negativ geladenes Sauerstoffat om ent stehen. Unter Umklappen des Bi ndungspaares zwi sch en den beiden Mole- külhälf t en entsteh en zwei angeregte MoleküJ.e Methylacr idon. Man l öst 16.0 g Natri umhydroxid in 140 ml Wa s s er . Dieser Lösung setzt man 10 ml Wassers toff perox i d (30%ig) und 60 ml Ethanol zu. Da s obige Gemisch gi bt man langsam ein er 0,1 %i gen Lösung von Luc·genin in Was ser zu. Bei vollkommener Abdunkelung des Raumes er k ennt man eine milch ige gelb- wei ße Licht erschei- nung, die ei ni ge Zei t anhält .
(Zur DarsteJ. lung des Lucigeni ns s. J. für pr akt i sche Chemi e N.F. , Band 153, 1939; Karl Gl eu und Siegfried Nit zsche)
Chemie in der Schule: www.chids.de
- 42 -
-1.--
!
1
- - - )
I
I~
Im Gegensatz zur Chemilumineszenz handelt es sich bei der Biolumineszenz um eine Enzymr eakt i on.
Ausgangspr odukt ist das Luciferin , wel ches je na ch Organismus eine untersch iedlich e Gesta lt hat ~ Das Lucif erin wird am
Enzym unter Verbr auch von ATP in einen en ergi ere ichen Est er überführt, der dur ch Sauers tof f zum Dioxetan oxidi ert wir d. Dieses Di oxetan ist wi e derum in st a bil und zerfällt in eine Ca r bonylkompon ent e und Kohlendi oxi d. Die Carbony l komponente
Abb. 26 : Biolumin e s ze n z - Luciferi n-Lucif er a se- Sy stem beim Leu ch t käfer
Chemie in der Schule: www.chids.de
.~ 44 -
erläu t ert en Reakt i onsme chani s mu s, der in die s er For m nur für den Leuchtkäfer eindeuti g bewiesen ist.
Wie scho n erwähnt ,gi bt es eine Vielzahl von unt ersch ie dl i chen Luci fer in-Luci fera se-Syst emem.
Da die Biol uminesz enz nur zu bestimmten Ta geszei ten in Erscheinung tr itt und zudem oft als Mor s ecode ,stel lt
sich auch die Frage nach der Steuerung der Biolumineszenz und ihrem Zeitgeber . Nötig si n d di ese Einri chtungen, da
die Lumineszenz ein energetis ch kostbarer Luxus ist .